Модификация результатов биоинженерии костной ткани in vivo RGD пептидами, нанесенными на наноструктурные кальцийфосфатные покрытия
Автор: Хлусов И.А., Зайцев К.В., Дворниченко М.В., Больбасов Е.Н., Aрoнoв Д., Рoзенмaн Г.
Журнал: Гений ортопедии @geniy-ortopedii
Статья в выпуске: 4, 2009 года.
Бесплатный доступ
Одними из основных участников клеточной адгезии являются arginine-glycine-aspartic acids (RGD), распознающие последовательности в молекулах клеточной адгезии, являющиеся высокоафинными лигандами для интегриновых рецепторов на клетках, включая стволовые и родоначальные клетки костного мозга. В работе изучено регулирующее влияние RGD-пептидов на остеогенный потенциал различных видов наноструктурных кальцийфосфатных (КФ) поверхностей в тесте эктопического костеобразования (биореактор in vivo). RGD пептиды модулировали распределение, функциональную активность и дифференцировку стромальных и кроветворных клеток костного мозга. Тем не менее, они подавляют адгезию стволовых клеток костного мозга, ухудшают ремоделирование костной ткани. Это может ограничивать их перспективы для биоинженерии костной ткани на КФ покрытиях
Костный мозг, мыши, имплантаты, rgd-пептиды, гистогенез
Короткий адрес: https://sciup.org/142121247
IDR: 142121247 | УДК: 616.71-018.46:616-089.819.843:577.112:611.018:616-007.15
Текст научной статьи Модификация результатов биоинженерии костной ткани in vivo RGD пептидами, нанесенными на наноструктурные кальцийфосфатные покрытия
Экстрацеллюлярный матрикс (ЭЦМ) принимает активное участие в поддержании клеточного фенотипа, влияет на морфологические (форма, полярность) и функциональные свойства (адгезия, подвижность, пролиферация, дифференцировка) клеток. Одним из таргетных механизмов ЭЦМ являются arginine-glycine-aspartic acid (RGD) распознающие последовательности (мотивы) в молекулах клеточной адгезии (фибронектин, остеопонтин, I тип коллагена, ламинин, тромбоспондин и др.) [17]. Они являются высокоафинными лигандами для интегриновых рецепторов на клетках [12], включая эндотелио-циты, остеобласты [22], стромальные стволовые и родоначальные клетки [11].
В исследованиях in vitro установлено значение
RGD-трипептидов в инициации взаимодействия клеток с искусственными поверхностями [24]. Отмечается их позитивная [25] или негативная [15] биомиметическая роль в функционализации инертных материалов для жизнедеятельности остеобластов. В то же время представлено мало доказательств эффективности малых пептидов для стимуляции роста костной ткани in vivo [22]. Как правило, использовались титановые [13, 22] или полимерные имплантаты (полиметилметакрилат, полилактатгликолид) [24], покрытые RGD-пептидами, которые, тем не менее, показали неоднозначный остеогенный эффект в долгосрочных экспериментах на животных.
Другая стратегия улучшения остеоинтеграции изделий для ортопедии и стоматологии на протяжении последних 15-20 лет связана с макро- и микроструктурированием их поверхности и приданием биоактивных свойств за счет кальцийфосфатных покрытий [14], являющихся основной канвой в наших исследованиях [4, 7]. Одним из недостатков подобного подхода считается отсутствие биологической специфической (рецептор-опосредованной) связи имплантатов c клетками [22], хотя обнаружено взаимодействие гидроксиапатита (ГАП) с остеопонти-ном [18]. При этом, согласно мнению некоторых авторов [23], растворимые RGD-пептиды способны ингибировать адгезию остеобластов к поверхности ГАП, но не титана.
Нами показаны остеогенные свойства различных типов кальцийфосфатных (КФ) покрытий на титане в эксперименте [7] и клинике [6]. Целью данной работы было изучение модулирующего влияния RGD-пептидов на остеогенный потенциал различных видов КФ поверхностей в тесте эктопического костеобразования (биореактор in vivo).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Наноразмерные порошки синтетического ГАП Са10(РО4)6(ОН)2 для изготовления покрытий получали механохимическим методом [5]. Двусторонние наноструктурные КФ покрытия формировали в модифицированном варианте [8]. Титановые диски марки ВТ-6 (контроль) обрабатывали анодно-искровым способом в 10 % растворе фосфорной кислоты, содержащей СаС0 3 и взвесь наночастиц ГАП (20-40 нм) синтетического происхождения. Наноструктурное, элементное и фазовое состояния покрытий на имплантатах расшифрованы нами ранее [1].
Оценивалось состояние поверхности полученных КФ покрытий по значениям параметров вертикальных неровностей профиля с помощью измерительной системы Talysurf 5-120 (разрешающая способность 1 нм). Определялся общепринятый показатель Ra – средний результат шероховатости в пределах нескольких длин участков измерений. Шероховатость КФ поверхности от плотного (КФП) до рыхлого покрытия (КФР) варьировали посредством частоты импульсного тока в диапазоне 1-10 Гц и длительности импульсов от 20 до 200 мс.
Коммерчески чистый порошок RGD пептида (Bachem AG) наносили на оксидтитановую или КФ поверхность посредством термического напыления в вакууме (10-6 тор) при температуре 180 ºC. После осаждения пептидов на искусственные поверхности система постепенно охлаждалась до комнатной температуры. Отмечалась оптически гомогенная пленка RGD пептидов толщиной 1 мкм. Контроль толщины слоя в процессе напыления осуществлялся с помощью кварцевого резонансного измерителя толщины (SQM-160 MultiFilm Rate Thickness Monitor, Sigma).
В биологической части экспериментов 12 мышам-самцам линии Balb/c под эфирным наркозом подкожно вводили по 1 имплантату (диаметр 12 мм, толщина 1 мм) с нанесенным в асептических условиях столбиком сингенного костного мозга, взятого из бедренной кости.
Для адгезии клеток органную культуру костного мозга на подложке культивировали в течение 45 минут в культуральной среде, содержащей 95 % среды RPMI-1640 (ICN) и 5 % эмбриональ- ной телячьей сыворотки (ICN). Костный мозг служил источником мультипотентных мезенхимальных стромальных клеток (ММСК) и ростовых факторов. При раздельном подкожном введении мышам подложек или фрагментов костного мозга образования тканевых пластинок не наблюдалось.
Через 45 суток имплантаты извлекали, для определения площади тканевых пластинок применяли цифровые изображения, полученные при помощи фотоаппарата Olympus C-830L в отраженном свете с одинаковыми параметрами освещенности [3]. Для проведения гистологического анализа применяли стандартные методы световой микроскопии тонких (толщина 10 мкм) срезов. После декальцинации тканевых пластинок, выросших на имплантатах, осуществляли обычную окраску гематоксилином-эозином парафиновых срезов, выполненных на ротационном микротоме HM 325 (Zeiss) перпендикулярно поверхности дисков, фотографировали срезы на микроскопе Axioskop 40 (Zeiss) с цифровой фотонасадкой PowerShot A630 (Canon).
Посредством программы Photoshop 6.0 проводили количественную гистоморфометриче-скую оценку цифровых изображений площади тканевой пластинки, как описано ранее [10]. На цифровых изображениях поперечных сечений тканевых пластинок определяли площади (% и мм2) кости, как отражение функциональной активности остеобластов, костного мозга (функция кроветворного микроокружения) и костномозговых полостей (функция остеокластов) (рис. 1). Эффективность гистогенеза оценивали полуколичественным способом (в баллах или процентах) следующим образом: 0 – отсутствие тканевой пластинки; 0,25 – соединительная ткань (рис. 2); 0,5 – грубоволокнистая кость (рис. 3); 0,75 – грубоволокнистая кость с костным мозгом (рис. 4); 1 – пластинчатая кость с костным мозгом.
Статистическую обработку полученных данных осуществляли посредством t-критерия Стьюдента, корреляционного анализа по Спирмену (rS), регрессионного анализа с помощью программы Statistica for Windows Version 6,0.
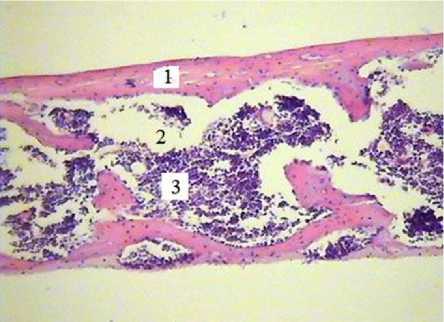
Рис. 1. Поперечный срез тканевой пластинки, выросшей на кальцийфосфатном покрытии в тесте эктопического гистогенеза. Определяются костная ткань (1) и костномозговые полости (2), заполненные костным мозгом (3). Окраска гематоксилином-эозином. Увеличение ×150
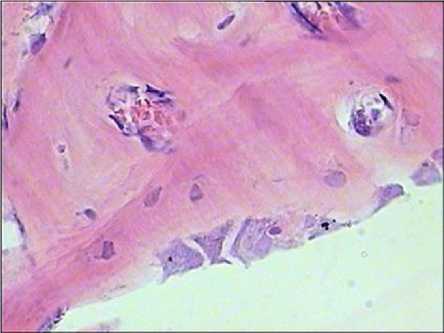
Рис. 3. Грубоволокнистая костная ткань в тканевых пластинках, выросших на кальцийфосфатном покрытии в тесте эктопического гистогенеза. Выявляются секретирующие остеобласты. Окраска гема-токсилином-эозином. Увеличение ×600
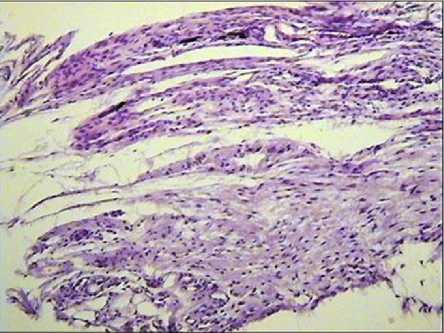
Рис. 2. Гистологический состав тканевой пластинки, выросшей на кальцийфосфатном покрытии в тесте эктопического гистогенеза. Определяются участки соединительной ткани. Окраска гематоксилином-эозином. Увеличение ×150
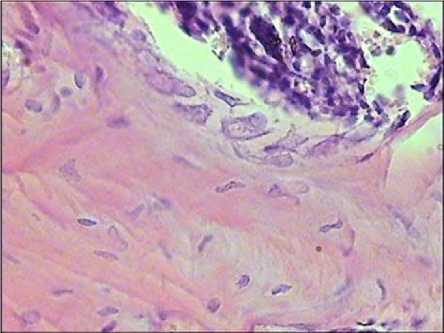
Рис. 4. Грубоволокнистая костная ткань с участками костного мозга в тканевых пластинках, выросших на кальцийфосфатном покрытии в тесте эктопического гистогенеза. Выявляются секретирующие остеобласты. Окраска гематоксилином-эозином. Увеличение ×600
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно полученным данным, на титановых дисках без КФ покрытия не наблюдается формирования костных пластинок из клеток костного мозга, что подтверждает ранние результаты теста “биореактор in vivo”, свидетельствующие об отсутствии у них остеоиндуцирующих свойств [7]. Нанесение слоя синтетических RGD пептидов на оксидтитановую поверхность не улучшает коренным образом адгезию и дифференцировку стволовых клеток (табл. 1), что подразумевает роль пептидов только как вероятных модификаторов уже известных ранее клеточных реакций на различные типы поверхностей (био-толерантных, биоинертных, биоактивных).
Как известно, эктопическое костеобразование позволяет зафиксировать результат интимных процессов адгезии и индукции остеогенно- го потенциала стромальных стволовых клеток на искусственных поверхностях [10] в сложных условиях гидродинамических и биомеханических нагрузок, характерных для системы in vivo. Исходя из этого факта, полученные результаты не противоречат сообщениям о слабой (статистически недостоверной) стимуляции остеогенеза и биомеханики вокруг костных имплантатов из титана с покрытием из RGD пептидов [13], особенно в долгосрочной перспективе [22]. Подобные данные предполагают аппозиционный рост со стороны регенерирующей кости, замедляющийся при длительном контакте с титановой поверхностью. Ухудшающаяся биомеханика системы кость/титановый имплантат показана нами ранее [3].
Таблица 1
Морфометрические данные поперечных срезов (толщина 10 мкм) тканевых пластинок, выросших на имплантатах с модифицированными и необработанными кальцийфосфатными покрытиями в тесте гетеротопического остеогенеза, X+m, P
|
Группа, число срезов, шероховатость |
S поперечной пластинки, мм |
S кости, % |
S кости, мм |
S костного мозга, % |
S костного 2 мозга, мм |
S костномозговых полостей, % |
S костномозговых полостей, мм2 |
|
Титан, Ra=0,53 мкм |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Титан+RGD |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
КФП n=19 Ra=l,43 мкм |
1,18±0,08 |
24,10±1,71 |
0,28±0,020 |
39,40±1,34 |
0,46±0,015 |
75,90±1,71 |
0,90±0,02 |
|
КФП+RGD, n=20 |
0,84±0,10 <0,013 |
38,20±2,29 <0,00002 |
0,32±0,019 |
38,70±2,32 >0,79 |
0,33±0,019 <0,00002 |
61,80±2,29 <0,00002 |
0,52±0,019 <10-6 |
|
КФР n=12 Ra=6,48 мкм |
0,82±0,06 |
54,51±5,73 |
0,45±0,04 |
22,08±3,85 |
0,18±0,03 |
45,49±5,73 |
0,37±0,05 |
|
КФР+RGD |
РНСТ |
- |
- |
- |
- |
- |
- |
|
КФП n=20 Ra=2,26 мкм |
1,48±0,21 |
44,80±2,10 |
0,66±0,03 |
30,30±2,33 |
0,45±0,034 |
55,50±2,22 |
0,82±0,033 |
|
КФП+RGD n=12 |
1,26±0,08 >0,43 |
30,70±4,12 <0,002 |
0,39±0,05 <0,0001 |
47,30±4,10 <0,00052 |
0,60±0,052 <0,05 |
69,40±4,15 <0,0029 |
0,87±0,052 |
|
КФР n=21 Ra=6,69 мкм |
4,73±0,28 |
27,60±1,38 |
1,31±0,065 |
43,00±1,91 |
2,03±0,09 |
72,70±1,32 |
3,42±0,062 |
|
КФР+RGD n=20 |
1,16±0,25 <10-6 |
67,70±5,97 <10-6 |
0,79±0,069<0, 00002 |
12,70±4,00 <10-6 |
0,15±0,046 <10-6 |
32,30±5,97 <10-6 |
0,37±0,069 <10 - 6 |
Примечание: n – число поперечных срезов пластинок; отмечены статистически значимые различия с соответствующим немодифици-рованным покрытием согласно t-критерию Стьюдента; КФП – кальцийфосфатное плотное покрытие; КФР – кальцийфосфатное рыхлое покрытие; РНСТ – рыхлая неоформленная соединительная ткань.
Вероятность формирования тканевой пластинки на КФ покрытиях составляла 100 %, площадь пластинок возрастала (по сравнению с начальной площадью костного мозга) в среднем на 68-109 % для КФП и 234-290 % – для КФР поверхностей. Применение для тканевой биоинженерии шероховатых КФР покрытий (Ra=6,48-6,69 мкм) увеличивало в 1,5-2 раза выход костной ткани (см. табл. 1), образованной остеобластами, в сравнении с более гладкими КФП поверхностями (Ra=1,43-2,26 мкм). Корреляционный анализ по Спирмену показал тесную связь (rS =0,9; p<0,038; n=5) средних показателей площади кости на поперечных срезах тканевых пластинок и шероховатости имплантатов. По-видимому, шероховатость КФ покрытий способствует прилипанию, кондукции и дифференцировке ММСК в остеогенном направлении (остеоиндукции).
Использованный нами метод гистоморфометрии поперечных срезов тканевых пластинок позволил определить взаимоотношения различных классов стволовых клеток в многоклеточной системе донора костного мозга и реципиента в процессе эктопического гистогенеза. Согласно исследованиям А.Я. Фриденштейна [9], в данной системе ММСК принадлежат донору, стволовые кроветворные клетки (СКК) хозяина заселяют готовые микротерритории, образованные элементами гемопоэзиндуцирующего микроокружения (ГИМ). К нему принадлежат различные типы клеток, например, остеобласты, адипоциты, эндотелиоциты, макрофаги, ретикулярные клетки, фибробласты [2, 26] и, по некоторым сообщениям, остеокласты [20].
Регрессионный анализ (рис. 5) показал для всех срезов прямую и обратную взаимосвязи относительной площади костномозговых полостей от площади костного мозга и кости соответственно. Корреляционный анализ средних значений (см. табл. 1) подтвердил существующие зависимости. Интерпретация методики позволяет заключить, что при формировании полноценной тканевой пластинки остеокласты находятся в реципрокных взаимоотношениях с остеобластами (rS = –1,0; n=7), что вполне логично, и способствуют расширению плацдарма кроветворения (rS =0,86; p<0,014; n=7). С другой стороны, остеобласты, синтезирующие костный матрикс, подавляют гемопоэз (rS = –0,86; p<0,014; n=7), возможно, посредством секреции протеинов, ингибирующих СКК [16].
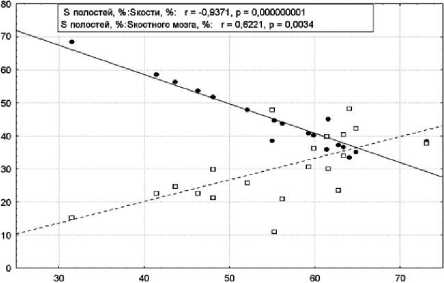
Рис. 5. Регрессионные зависимости относительных площадей костной ткани, костного мозга и костномозговых полостей в составе тканевых пластинок, выросших на кальцийфосфатных покрытиях в тесте эктопического гистогенеза. По оси абсцисс – площадь костномозговых полостей, %; по оси ординат – площади кости (сплошная линия) и костного мозга (пунктирная линия), %
Таким образом, остеокласты можно считать полноправными клетками ГИМ, ремоделирующими кость, создающими новые домены для заселения кроветворных клеток, что способствует формированию полноценной структурнофункциональной системы кость/костный мозг. При этом шероховатые КФ покрытия создают оптимальную 3D-топографию для гистогенеза многоклеточных систем.
Далее была предпринята попытка на молекулярном уровне улучшить результаты эктопического остеогенеза, эффективность которого составила 63-75 %, что соответствует ранее опубликованным результатам [7]. Модификация поверхностей тонкой пленкой RGD пептидов изменяла адгезию миелокариоцитов к поверхности незначительно. Площадь тканевых пластинок возрастала (по сравнению с начальной площадью костного мозга) в среднем на 79-129 % для КФП и 220-274 % – для КФР поверхностей. В то же время снижалась (на 28-75 %) средняя площадь поперечных сечений выросших тканевых пластинок независимо от типа КФ покрытия (табл. 1).
В совокупности получается ограничение количества прилипших ММСК при сохранении плацдарма адгезии к RGD-модифицированной поверхности. Максимальное уменьшение показателей было отмечено в случае шероховатой поверхности, в одном случае вместо системы кость/костный мозг формировалась рыхлая неоформленная соединительная ткань. Эффективность гистогенеза варьировала в пределах 075 %. Абсолютные показатели площадей демонстрировали неоднозначные результаты: подавление выхода костной ткани, костномозговых полостей и костного мозга (75 % случаев) или, напротив, стимуляцию гемопоэза (25 % случаев).
Одним из объяснений полученных негативных эффектов и дисперсии результатов может быть образование растворимых RGD пептидов при взаимодействии с тканевой жидкостью, которые способны блокировать интегриновые рецепторы и, таким образом, препятствовать адгезии, распространению [23] и созреванию остеобластов [15]. С другой стороны, RGD последовательности опосредуют функции нескольких интегринов [22], которые распределены на различных стволовых и родоначальных клетках. Далее одна и та же молекула адгезии (например, остеопонтин), содержащая RGD мотив [19], может способствовать проявлению функциональной активности нескольких клеток, в частности, миобластов [21], СКК и остеобластов [16]. В настоящее время суммарный эффект RGD пептидов в многоклеточной системе in vivo непредсказуем, что диктует необходимость дальнейшего изучения перспектив их приложения для биоинженерии костной ткани.
ВЫВОДЫ
-
1. RGD пептиды, нанесенные на КФ поверхность, модулируют функциональную активность и дифференцировку стромальных и кроветворных клеток костного мозга.
-
2. RGD пептиды в многоклеточной системе in vivo подавляют адгезию стволовых клеток
костного мозга, ухудшают ремоделирование костной ткани, прежде всего на шероховатых КФ покрытиях.
Исследование выполнено при частичной поддержке Российского фонда фундаментальных исследований (грант № 09-04-99105).


