Модулирование клинической эффективности рексетина при лечении депрессивных расстройств
Автор: Симуткин Г.Г., Кудякова Т.А., Счастный Е.Д., Потапкина Е.В., Горшкова Л.В., Рогозина Т.А.
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Психофармакотерапия
Статья в выпуске: 2 (36), 2005 года.
Бесплатный доступ
В результате исследования клинической эффективности рексетина и комбинированного применения рексетина с внутривенным введением глюкозы при терапии депрессивных расстройств у 18 пациентов показана высокая клиническая эффективность данного препарата. Гипотеза возможного влияния сочетанного использования рексетина и глюкозы при терапии депрессивных расстройств на повышение клинической эффективности СИОЗС за счет модулирования скорости синтеза серотонина не получила подтверждения. Исследование необходимо продолжить на более крупных выборках пациентов.
Короткий адрес: https://sciup.org/14295069
IDR: 14295069
Текст научной статьи Модулирование клинической эффективности рексетина при лечении депрессивных расстройств
Р е з ю м е : В результате исследования клинической эффективности рексетина и комбинированного применения рексетина с внутривенным введением глюкозы при терапии депрессивных расстройств у 18 пациентов показана высокая клиническая эффективность данного препарата. Гипотеза возможного влияния сочетанного использования рек-сетина и глюкозы при терапии депрессивных расстройств на повышение клинической эффективности СИОЗС за счет модулирования скорости синтеза серотонина не получила подтверждения. Исследование необходимо продолжить на более крупных выборках пациентов.
S u m m a r y : As a result of investigation of clinical efficacy of rexetin and combined application of rexetin with intravenous injection of glucose in therapy of depressive disorders in 18 patients a high clinical efficacy of this preparation has been shown. Hypothesis of possible influence of combined use of rexetin and glucose in therapy of depressive disorders on increase of clinical efficacy of SSRIs at the expense of modulation of speed of the synthesis of serotonin has not been confirmed. Investigation has to be continued on larger samples of patients.
В в е д е н и е . Признанным считается факт важного участия в патогенезе аффективных расстройств нарушений нейротрансмиттерного обмена в головном мозге. Наиболее частыми претендентами на роль важнейших моноаминов, обеспечивающих нормативный уровень настроения и целый ряд психофизиологических функций в современных исследованиях выступают серотонин, норадреналин и допамин (Berger M., Stieglitz R.D., 2000).
R.M. Hirschfeld (2000) отмечает, что моноаминовая гипотеза депрессии предполагает в качестве биологического или нейроанатомиче-ского основания для депрессии дефицит центральных норадренергических и/или серотонинергических систем, и что антидепрессанты восстанавливают нормальную функцию этих систем у депрессивных пациентов. Гипотеза была активно поддержана, однако она не обеспечивает полное объяснение действия антидепрессантов и патофизиологию депрессии. В последние годы моноаминовая гипотеза претерпела изменения и теперь предполагается, что при аффективных расстройствах (АР) существует изменение чувствительности рецепторов, и постепенный клинический ответ на применение антидепрессантов объясняется необходимостью адаптивных изменений в этих рецепторах.
Эффективность методов антидепрессивной терапии, обеспечивающих повышение серотонинергической трансдукции в головном мозге, подтверждает гипотезу о серотонинергической дисфункции в случае АР. В отношении АР, особенно с наличием сезонного паттерна течения, эффективно лечение предшественниками серотонина – триптофаном (Lam R.W. et al., 1997), СИОЗС (Partonen T., Lonnqvist J., 1996) и препаратами, индуцирующими выброс серотонина – d-fenfluramin (O’Rourke D., et al., 1989).
Обеспечение увеличения синтеза серотонина в головном мозге гипотетически может происходить по двум магистральным путям: количественное увеличение биохимического субстрата для более интенсивного синтеза серотонина или замедление скорости метаболизи-рования серотонина. Первый путь обеспечивается за счет увеличения уровня L-трипотофана – аминокислотного предшественника серотонина. Исследования, пытающиеся подтвердить возможность влияния уровня L-трипотофана на скорость синтеза серотонина, противоречивы. Работы, использующие процедуру триптофанового истощения, при которой осуществляется управление уровнем триптофана в крови (возможно, уровнем серотонина в мозге), показали, что антидепрессивное влияние части лечебных мероприятий (светотерапии) может быть полностью изменено, если уровень триптофана в крови быстро уменьшается (Neumeister A. et al., 1997). Позитрон-эмиссионная томография показала уменьшение синтеза серотонина в ответ на протокол истощения триптофана (Benkelfat C., 1995).
Ряд исследований доказали, что углеводы, поступающие с пищей, увеличивают синтез серотонина (Wurtman R.J., 1982). В случаях атипичных депрессивных признаков, когда в клинической картине наиболее часто представлены гиперсомния, гиперфагия и увеличение веса, примечательным клиническим признаком является «жажда» углеводов.
В литературе в качестве атипичных симптомов депрессии в настоящее время выделяют 8 признаков: социальный отход, увеличение веса, увеличение аппетита, увеличение количества потребляемой пищи, предпочтение углеводистой пище, гиперсомния, чувство усталости, обратный суточный ритм (Williams J. et al., 1991), что нашло отражение в появлении клинической шкалы, совмещающей 21 пункт шкалы Гамильтона и 8 пунктов по оценке атипичных признаков депрессии: SIGH-SAD (Williams J. et al., 1991). По данным S.M. Sotsky, S.J. Simmens (1999), учет таких клинических характеристик, как гиперсомния, гиперфагия или увеличение веса, важен при прогнозирова- нии низкого ответа на ТЦА (имипрамин). Для лечения атипичной депрессии могут с успехом применяться СИОЗС (Moller S.E., 1992).
S.E. Moller (1992) указывает, что в регулировании настроения и импульсивности поведения, моделировании пищевых паттернов в качественном и количественном отношении участвуют центральные серотонинергические пути, и что серотонин, вероятно, играет центральную роль в патофизиологии этих нарушений. Употребление углеводов увеличивает плазменное соотношение триптофана к другим нейтральным аминокислотам у человека и у животных, а также синтез серотонина в мозге крысы. Чрезмерное потребление углеводов пациентами с депрессивными расстройствами (ДР), и особенно с наличием атипичных признаков, отражает попытку самолечения, которая временно уменьшает вегетативные признаки атипичной депрессии через увеличенную центральную серотонинергическую деятельность. R.J. Wurt-man, J.J. Wurtman (1995) придерживаются мнения, что повышенное потребление углеводов при АР увеличивает синтез серотонина, при этом снижается потребление белка. Серотонин ответствен за начало сна, чувствительность к боли, регулирование давления крови, контролирование настроения. Поэтому люди, имеющие дисбаланс в серотонинергической системе, стремятся употреблять большее количество углеводов, что повышает вес тела.
На взаимосвязь АР и углеводного обмена указывают факты высокой встречаемости ДР при опухоли поджелудочной железы, сахарном диабете – СД (особенно II типа), способность антидепрессантов влиять на содержание сахара в крови (Mendlewicz J., 1991). По оценке P.J. Goodnick (1995), распространенность СД составляет 1-2 %, в 8,5-22,2 % случаев при этом обнаруживаются ДР. ТЦА могут даже повышать уровень сахара в крови, способствуют увеличению веса тела и усиливают тягу к углеводистой пище.
Многочисленные исследования показали высокую эффективность СИОЗС при терапии ДР (Мосолов С.Н., 1995). По современным данным 15-30 % депрессивных пациентов, получающих адекватную антидепрессивную терапию, не реагируют на нее заметным и/или динамичным снижением степени выраженности депрессии (Berger M., Stieglitz R.D., 2000).
Оригинальным подходом в решении проблемы повышения откликаемости депрессивных пациентов на антидепрессивное лечение было предложение P. Kielholz (1983) в случаях тяжелых и/или резистентных депрессий использовать сочетание внутривенного введения кломипрамина и мапротилина (обеспечивающих повышение серотонинергической и норадренергической нейротрансмиссии), а также 5 % раствора глюкозы и изотонического раствора. Включение в схему лечения раствора глюкозы может дать дополнительный стимул для активизации биохимической цепочки «триптофан-серотонин».
Рабочая гипотеза нашего исследования предполагала, что совместное использование СИОЗС и внутривенного введения глюкозы при лечении пациентов с ДР может обладать выраженным антидепрессивным эффектом. Подтверждением этой гипотезы послужили данные Т.А. Кудяковой (2004), согласно которым при использовании СИОЗС (флуоксетин, сертралин) в терапии ДР при объективизированном с помощью психометрических шкал снижении уровня депрессии (особенно в случае высокого удельного веса атипичных депрессивных симптомов) отмечается избирательное увеличение аппетита по отношению к углеводистой пище. Этот факт свидетельствует о необходимости компенсаторного повышения содержания сахара в крови при реализации антидепрессивного эффекта СИОЗС. В качестве базисного препарата использован рексетин (пароксетин) фирмы «Гедеон Рихтер» (Венгрия).
Цель: сравнительная оценка клинической эффективности рексетина и сочетания рексе-тина с внутривенным введением 40 % раствора глюкозы при терапии ДР.
Материалы и методы . Общая выборка больных составила 18 стационарных пациентов: 7 мужчин в возрасте 31,1±11,2 года (М+SD) и 11 женщин в возрасте 44,6±12,1 года (P=0,03). У 12 чел. (66,6 %) диагностирован депрессивный эпизод, у 6 (33,4 %) – рекуррентное депрессивное расстройство, текущий депрессивный эпизод. Тяжесть ДР в 16 случаях (88,9 %) оценена как умеренная с наличием соматических симптомов, в 1 – как умеренная без соматических симптомов (5,5 %) и еще в 1 – как легкая (5,5 %). Все пациенты, страдающие ДР, были распределены на две равноценные по количественному составу группы – опытную или основную (в терапии использовался рексе-тин в течение 4 недель в сочетании с курсом внутривенного введения 20 мл 40 % раствора глюкозы в течение 10 дней) и контрольную (в терапии использовался рексетин).
Рекситин назначался в утренние часы в дозе от 20 до 40 мг/сут. Доза рексетина в группе пациентов, получающих сочетанную терапию с глюкозой, составила 24,4±7,2 мг/сут, а в контрольной группе – 28,9±9,2 (P=0,27). В качестве методов объективизации клинической эффективности лечения использовались сокращенный вариант шкалы SIGH-SAD, включающий в себя стандартные 17 пунктов шкалы депрессии Гамильтона и 7 пунктов по оценке атипичных признаков депрессии; шкала глобальной клинической оценки (CGI); шкала оценки побочных явлений (UKU). Обследование проводилось в трех временных срезах: до начала лечения, спустя 2 и 4 недели после начала лечения. Выбор шкалы SIGH-SAD обусловлен тем, что имеющиеся шкальные оценки уровня депрессии не способны охватить атипичные признаки депрессии, связанные с повышенным потреблением сладкого, и особенно хорошо откликающиеся на ингибиторы МАО и СИОЗС (Quitkin F.M. et al., 1999).
Статистическая обработка данных проводилась на персональном компьютере с применением пакета стандартных прикладных программ Statistica for Windows (V. 6.0).
Р е з ул ь т а т ы . В основной группе суммарный балл по шкале SIGH-SAD к началу лечения составлял 29,9±2,4, на 14-й день – 18,7±1,9 и на 28-й день – 7,5±2,6 балла; в контрольной: 33,3±3,4; 15,1±2,2 и 5,9±1,4. Достоверных различий суммарных показателей по шкале SIGH-SAD в динамике лечения при межгрупповом сравнении не обнаружено (ANOVA, p>0,05). Особый интерес представляло рассмотрение клинического эффекта антидепрес-сивной терапии с учетом обратной динамики типичных и атипичных депрессивных симптомов по шкале SIGH-SAD.
По точкам контроля динамика суммарного балла для 17 типичных симптомов депрессии в основной группе составила 21,4+1,7; 13,1+1,4; 5,1+1,9 (p<0,05); в контрольной – 22,9+1,7; 11,1+1,8; 4,6+1,1 (p<0,05).
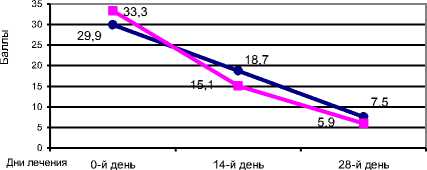
• рексетин+ глюкоза ■ рексетин
Рис. Динамика суммарного балла по шкале SIGH-SAD в основной и контрольной группах в ходе терапии
Достоверных отличий динамических показателей баллов типичных депрессивных симптомов по шкале SIGH-SAD при их межгрупповом сравнении не обнаружено (ANOVA, р>0,05). По точкам контроля динамика суммарного балла для 7 атипичных симптомов депрессии в основной группе составила 8,4+1,1; 5,6+0,6; 2,4+0,8; в контрольной – 10,1+1,9; 4,0+0,8; 1,3+0,3. Достоверных отличий динамических показателей баллов атипичных депрессивных симптомов по шкале SIGH-SAD при их межгрупповом сравнении не получено (ANOVA, р>0,05).
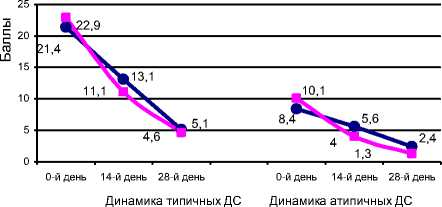
• рексетин+ глюкоза
—■— рексетин
Рис. Динамика суммарного балла типичных и атипичных депрессивных симптомов по шкале SIGH-SAD в основной и контрольной группах в ходе терапии.
Тяжесть заболевания по шкале CGI достоверно (p<0,001) редуцировалась с 4,3±0,3 до 2,4±0,4 балла к концу лечения для основной группы и с 4,1±0,1 до 2,2±0,2 – для контрольной. Межгрупповых различий в данных показателях не выявлено (ANOVA, p>0,05). Глобальная оценка динамики психического состояния по шкале CGI показала, что в основной группе к концу второй недели лечения средний балл составлял 2,1±0,2, в контрольной – 2,8±0,2, а через 4 недели лечения соответственно 1,6±0,2 и 1,1±0,1 балла (p>0,05).
Побочные эффекты от применения рексети-на или сочетанного использования рексетина и глюкозы отмечались в течение первой недели терапии. В случае сочетанного применения рексетина и глюкозы выраженность побочных эффектов была меньше, чем в контрольной группе (на 7-й день лечения – 0,2±0,1 и на 28-й день – 0,7±0,4; p>0,05). Среди незначительно выраженных и непродолжительных побочных эффектов в случае использования рексетина в терапии ДР отмечены снижение аппетита, дневная сонливость, тошнота, головная боль, тяжесть в области головы. Побочные эффекты практически полностью редуцировались к 7-му дню терапии без коррекции дозы рексетина.
О б с уж д е н и е. В ходе терапии ДР рек-сетин проявил себя как эффективный антидепрессант. Применение рексетина в сочетании с глюкозой позволило снизить суммарную дозу рексетина по сравнению с монотерапией данным препаратом. Обратная редукция депрессивной симптоматики (типичной и атипичной) в случае монотерапии рексетином и при сочетанном применении рексетина и глюкозы происходила в одинаковом темпе и в равной степени. Гипотеза возможного модулирующего влияния внутривенного введения глюкозы на клиническую эффективность СИОЗС рексетина не нашла полного подтверждения. Данное обстоятельство может быть связано с недостаточным по времени и дозе введением глюкозы, с малой выборкой пациентов, спорными диагностическими критериями атипичных депрессивных признаков, недоучетом объективной динамики показателей содержания сахара в крови у депрессивных пациентов, получающих СИОЗС.
З а кл ю ч е н и е . Полученные данные подтверждают необходимость дальнейших исследований в отношении путей возможной оптимизации клинической эффективности современных антидепрессантов при терапии депрессивных расстройств с учетом наших знаний о патогенезе аффективных нарушений.


