Молекулярно-генетические нарушения как критерии в дифференциальной диагностике редких опухолей почки
Автор: Аполихин О.И., Михайленко Д.С., Михальченко А.Е., Залетаев Д.В., Ефремов Г.Д., Сивков А.В.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Онкоурология
Статья в выпуске: 3, 2013 года.
Бесплатный доступ
Рак почки - гетерогенная группа опухолей, самой частой из которых является светлоклеточная карцинома, реже встречаются папиллярная и хромофобная карциномы. Патоморфологическое исследование сталкивается с трудностями в дифференциальной диагностике злокачественной хромофобной карциномы и доброкачественной онкоцитомы, а также между I и II типами папиллярной карциномы почки. Вместе с тем, точная верификация указанных типов опухолей необходима для адекватного прогноза заболевания и планирования лечения. В работе проведен поиск STR-маркеров и комплексный молекулярно-генетический анализ участков хромосом 1, 2, 6, 10, 13q, 17 и 21q в 4 хромофобных карциномах и 3 онкоцитомах, а также анализ мутаций гена МЕТ в 13 папиллярных карциномах для разработки критериев дифференциальной диагностики редких опухолей почки. Показано, что аллельный дисбаланс и/или микросателлитная нестабильность по 2 и более из 12 выбранных локусов встречаются во всех хромофобных карциномах и отсутствуют в онкоцитомах (р = 0.029). Разработку критерия дифференциальной диагностики хромофобной карциномы и онкоцитомы осуществляли методом классификационного анализа, основанном на модели логистической регрессии с регуляризацией. Точность критерия на обучающей выборке составила более 90%, что позволяет достоверно выявлять паттерн нарушений 10 STR-маркеров, характерный для хромофобной карциномы. Соматические мутации гена МЕТ, напротив, не могут служить диагностическим маркером папиллярного рака почки I типа вследствие низкой частоты встречаемости. Таким образом, предложен метод дифференциальной диагностики хромофобной карциномы и онкоцитомы почки с помощью молекулярно-генетического анализа первичной опухоли.
Рак почки, хромофобная и папиллярная карциномы, онкоцитома, аллельный дисбаланс, микросателлитная нестабильность, ген мет, точковые мутации
Короткий адрес: https://sciup.org/142187873
IDR: 142187873
Текст научной статьи Молекулярно-генетические нарушения как критерии в дифференциальной диагностике редких опухолей почки
121108, Россия, Москва, ул. Ивана Франко, д. 4, корп. 15, оф. 9 Тел.: +7 (495) 380-00-80; Факс: +7 (495) 780-31-11
PAJUNK
EpiSpin Lock - наборы для комбинированной спино-эпидуральной анестезии
Оригинальная игла SPROTTE® спинальных игл
Фрагментный анализ. Аллели STR-маркеров определяли методом фрагментного анализа 0,5-4 мкл ПЦР-продуктов с использованием стандарта молекулярной массы LIZ500 и полимера РОР4 на генетическом анализаторе ABI PRISM 3100 («Applied Biosystems», США) согласно руководствам фирмы-производителя.
Секвенирование ПЦР-продукта. ПЦР-продукт объемом 7 мкл обрабатывали смесью 5 ед. экзонуклеазы I из E.coli и 1 ед. щелочной фосфатазы, затем проводили секвенирование с помощью набора ABI PRISM® BigDye™ Terminator v.3.1 и генетического анализатора ABI PRISM 3100 по протоколам фирмы «Applied Biosystems». Идентификацию мутаций и полиморфизмов проводили с помощью интерактивной базы данных HGMD .
Статистическая обработка результатов. Для формирования критерия дифференциальной диагностики хромофобной карциномы и онкоцитомы использовали классификационный анализ с обучением, основанный на модели логистической регрессии с регуляризацией. Точный двусторонний критерий Фишера (программа GraphPad InStat v. 3.05.) использовали при сравнении частот аллельного дисбаланса и микросателлитной нестабильности в различных типах опухолей.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ доступной литературы показал, что критерии для дифференциальной диагностики хромофобной карциномы и онкоцитомы с помощью
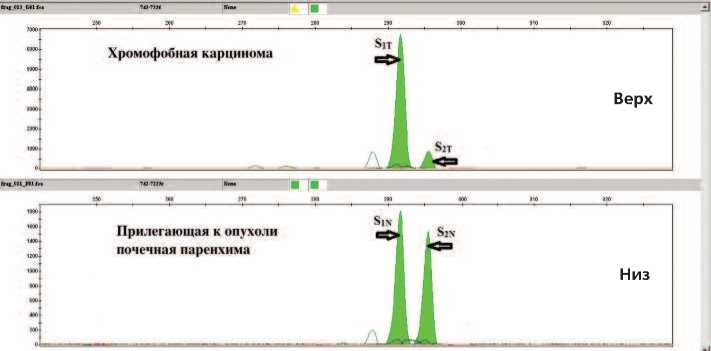
Рис. 1. Аллельный дисбаланс по локусу D13S1742 в хромофобной карциноме
микросателлитов целесообразно формировать на основе исследования хромосом 1q, 2, 6p, 10, 13q, 17p и 21q, показывающих наиболее выраженные различия по количеству копий между хромофобной карциномой и онкоцитомой [5-7]. Каждая из этих областей была проанализирована по 1-2 STR-маркерам. Основными критериями отбора, помимо локализации, были структура простого тандемного повтора (совершенный повтор с единицей 3-5 нуклеотидов) и наличие информации в базах данных о его полиморфизме.
Поиск подходящих локусов проводили с помощью интерактивной программы UCSC Genome Browser , в результате которого сформировали панель из 12 тетрануклеотидных STR-маркеров. Генотипирование проводили с помощью ПЦР, в которой один из праймеров в каждой паре был конъюгирован с флуоресцентным красителем, и последующего фрагментного анализа меченых ПЦР-продуктов на капиллярном генетическом анализаторе ABI3100 «Applied Biosystems» (США). Значение аллельного дисбаланса, где площади пиков опухолевого образца были нормализованы по сигналам этих же аллелей от нормальной ткани для корректировки эффекта преимущественной амплификации более короткого аллеля, вычисляли по формуле:
^1Т

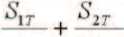
^1N ^ZN где:
AI –показатель аллельного дисбаланса, S1T и S2T – площади пиков от первого и второго аллелей в опухолевом образце, S1N и S2N – площади пиков от первого и второго аллелей в образце нормальной ткани (рис 1). Значение AI при этом могло изменяться в интервале [0;1], если AI находился в границах [0;0,3)U(0,7;1], то считали, что в образце опухолевой ткани присутствует аллельный дисбаланс. Хотя фирма “Applied Biosystems” предлагает проводить вычисления потери гетерозиготности (частный случай аллельного дисбаланса) по высотам пиков [13], ряд работ основаны на вычислении отношений площадей пиков как показателей, характеризующих количество ПЦР-продуктов, а не их концентрацию в зоне локального максимума при капиллярном электрофорезе [14, 15]. Эти подходом руководствуются и мы, анализируя площади пиков, соответствующих аллелям исследуемых STR-маркеров. Результаты генотипирования парных образцов (опухоль и прилегающая нормальная ткань от каждого из 4 пациентов с хромофобной карциномой и 3 пациентов с онкоцитомой) представлены в таблице 2. При генотипировании в образцах также выявляли микросателлитную нестабильность – аберрантные аллели STR-маркера в опухолевой ткани, которые отсутствуют в нормальной ткани и возникают вследствие ошибок репликации простых тандемных повторов при инактивированной системе репарации неспаренных оснований [16].
Показано, что аллельный дисбаланс и/или микросателлитная нестабильность по двум и более локусам из 10 встречаются во всех хромофобных карциномах, тогда как в онкоцитомах отсутствуют нарушения в тестируемых STR-маркерах (точный двусторонний критерий Фишера, р=0.029 при α=0.05). Далее аллельный дисбаланс интерпретировали как количественную переменную, преобразованную с помощью функции Y = I AI - 0,5 I в значение от 0 до 0,5. Образцам, в которых была выявлена только микросател-литная нестабильность, придавалось значение 0,5 для того, чтобы это нарушение можно было учитывать на- ряду с аллельным дисбалансом. Неинформативным случаям (гомозиготам) приписывали пограничное значение 0,2. Нарушения в хромосомах, анализируемых по двум STR-маркерам, коррелируют друг с другом (кроме неинформативных локусов). Поэтому для уменьшения эффекта переобучения из каждой анализируемой хромосомы был выбран локус с большим числом нарушений в образцах хромофобной карциномы, и была сформирована панель из 7 STR-маркеров: D1S2142, D2S1782, GAAT3A06, D10S2469, D13S634, D17S1298 и D21S11. Далее применяли метод классификационного анализа с обучением, основанный на модели логистической регрессии с регуляризацией. Решающее правило имеет следующий вид:
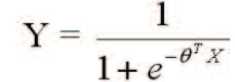
где:
Y = 1 для хромофобной карциномы и Y = 0 для онкоцитомы, X – вектор значений от 0 до 0,5, в которые был преобразован AI, θ – вектор с оптимизированными параметрами при X. Для оптимизации параметров использовался алгоритм градиентного спуска с функцией:
Таблица 2. Аллельный дисбаланс и микросателлитная нестабильность в хромофобной карциноме и онкоцитоме почки
|
^TR-мдпі/рп |
Хромофобные карциномы |
Онкоцитомы |
|||||
|
STR-маркер |
5006 |
13579 |
7226 |
10763 |
5858 |
14912 |
22058 |
|
D1S3465 |
MSI |
NI |
AI |
N |
NI |
NI |
N |
|
D1S2142 |
MSI |
N |
AI |
MSI |
N |
N |
N |
|
D2S1782 |
N |
NI |
AI |
N |
NI |
N |
N |
|
D2S1336 |
NI |
NI |
NI |
NI |
NI |
NI |
NI |
|
GAAT3A06 |
MSI |
N |
NI |
N |
N |
N |
N |
|
D10S2469 |
AI, MSI |
N |
AI |
N |
N |
N |
N |
|
D10S1216 |
NI |
NI |
NI |
NI |
NI |
NI |
NI |
|
D13S634 |
MSI |
AI, MSI |
AI |
N |
N |
N |
N |
|
D13S742 |
AI |
N |
AI |
N |
N |
N |
NI |
|
D17S1298 |
MSI |
N |
AI |
N |
NI |
NI |
N |
|
D21S11 |
AI, MSI |
MSI |
AI |
AI |
N |
N |
N |
|
D21S1411 |
AI, MSI |
N |
AI |
N |
N |
N |
N |
Примечание: сверху указаны номера блоков с материалом опухолей, курсивом выделены неинформативные STR-маркеры, полужирным шрифтом – минимальный набор локусов для алгоритма дифференциальной диагностики; NI (non-informative) – неинформативные случаи, AI (allelic imbalance) – аллельный дисбаланс, MSI (microsatellite instability) – микросателлитная нестабильность.
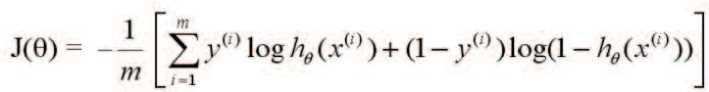
где m – число пациентов в обучающей выборке; y(i) – тип опухоли для пациента i (1 в случае хромофобной карциномы и 0 - онкоцитомы); hθ(x(i)) – предсказанное значение типа опухоли (от 0 до 1) для пациента i по его переменным x. Точность при сформированной обучающей выборке составила 92%. В результате был сформирован алгоритм, который использует в качестве входных данных матрицу значений аллельного дисбаланса и микросателлит-ной нестабильности для панели STR-маркеров, затем осуществляет подгонку введенных данных к логистической кривой и на выходе дает ряд значений вектора θ, однозначно задающих логистическую функцию для вероятностной дифференциальной диагностики хромофобной карциномы и онкоцитомы. Однако 7 STR-маркеров представляют собой необходимый и достаточный набор локусов для обучающей выборки, тогда как целесообразно в дальнейшем апробировать этот алгоритм на тестовой выборке большего объема, при этом включая в анализ все локусы, показавшие аллельный дисба- ланс и/или микросателлитную нестабильность при высокой гетерозиготности, т.е. 10 STR-маркеров из 12 первоначально выбранных для настоящего исследования (табл. 2). В нашей работе доброкачественные опухоли – онкоцитомы – не показали наличие аберраций по тестируемым локусам, как и образцы нормальной почечной паренхимы. Это отчасти не согласуется с данными высокоразрешающих методов анализа хромосомных аберраций на микрочипах, хотя подтверждается методами молекулярной цитогенетики (FISH на интерфазных и мета-фазных хромосомах) [7, 17]. Вместе с тем, имеются данные о том, что некоторые онкоцитомы имеют потерю гетерозиготности или амплификацию по хромосомам 1, Х и Y, а также транслокации с вовлечением хромосом 6, 9 и 11 [18]. Возможно, целенаправленное тестирование этих нарушений позволит сформировать паттерн аберраций, который позволит дифференцировать онкоцитому не только от хромофобной карциномы, но и от других типов опухолей почки.
В настоящей работе проведены ПЦР и последующее секвенирование экзонов 15-21 гена МЕТ, кодирующих тирозинкиназный домен рецептора HGF, с целью определения мутаций, которые характерны для папиллярной карциномы почки I типа. В одном образце опухоли смешанного строения (I/II типов) выявлена соматическая мутация c.3743A→G, приводящая к замене аминокислоты p.Y1248C и охарактеризованная в базе данных HGMD как активирующая миссенс-мутация при наследственной папиллярной карциноме I типа (rs121913246). Другие обнаруженные однонуклеотидные замены представляли собой известные синонимичные SNP в 20 и 21 экзонах: c.3912С→Т (rs41736), c.4026C→T (rs201519623), c.4071G→A (rs2023748) и c.4146G→A (rs41737). Таким образом, мутации МЕТ редко встречаются в спорадических папиллярных карциномах и не могут быть использованы в качестве маркера дифференциальной диагностики, даже если со временем будут накоплены данные, подтверждающие их □
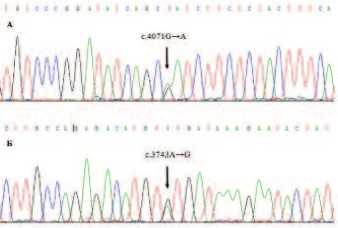
Рис. 2. Секвенирование однонуклеотидных замен МЕТ в папиллярной карциноме Обозначения: стрелками указаны позиции однонуклеотидных замен, А – полиморфизм c.4071G→A, Б – миссенс-мутация c.3743A→G (p.Y1248C).
специфичность для папиллярного РП I типа. Приблизительная оценка частоты мутаций на уровне 8% (1/13) в нашей работе близка к данным других авторов, обнаружившим мутации МЕТ в 12% папиллярных карцином почки [12]. Ранее показано, что определенный тип опухоли, развивающейся при моно-генном наследственном онкологическом синдроме и имеющей герминальные мутации в соответствующем гене-кандидате, часто не имеет или характеризуется низкой частотой аналогичных соматических мутаций в идентичных спорадических новообразованиях. В нарушении экспрессии МЕТ и/или связанного с ним сигнального пути могут играть роль другие механизмы (регуляция на уровне транскрипции или трансляции, эпигенетические факторы, отношение скоростей синтеза и деградации белка и т.п.). Несмотря на низкую частоту соматических мутаций, гиперэкспрессию МЕТ наблюдают в 90% папиллярных карцином почки [19]. Похожая ситуация встречается и в регуляции экспрессии других онкогенов, например, активация HRAS в результате соматических мутаций показана в 10% случаев рака мочевого пузыря, однако гиперэкспрессия белка HRAS происходит значительно чаще, что свидетельствует о наличии других механизмов активации гена [2]. Относительно редко наблюдают иную картину, как, например, в случае светлоклеточной карциномы почки: герминальные точковые мутации VHL являются причиной синдрома Хиппеля-Лин-дау (наследственный светлоклеточный РП), соматические точковые мутации VHL встречаются в 50-70% спорадических светлоклеточных карцином почки и специфичны для этого типа РП [20].
ЗАКЛЮЧЕНИЕ
Патоморфологическое исследование зачастую сталкивается с трудностями в определении хромофобной карциномы и онкоцитомы почки, так как эти опухоли имеют общее происхождение и сходство на гистологическом уровне. Однако хромофобная карцинома – злокачественная, а онкоцитома – доброкачественная опухоль, что обуславливает различный прогноз заболевания. Нами проведен поиск STR-маркеров и комплексный молекулярно-генетический анализ аллельного дисбаланса участков хромосом 1, 2, 6, 10, 13q, 17 и 21q в 4 хромофобных карциномах и 3 онкоцитомах. Показано, что аллельный дисбаланс и/или микросателлитная нестабильность по 2 и более из 12 выбранных локусов встречаются во всех хромофобных карциномах, тогда как в онкоцитомах отсутствуют нарушения в тестируемых STR-маркерах (р = 0.029 при α = 0.05). Разработку критерия дифференциальной диагностики хромофобной карциномы и онкоцитомы осуществляли методом классификационного анализа с обучением, основанном на модели логистической регрессии с регуляризацией. Точность критерия при сформированной обучающей выборке составила более 90%, что позволяет достоверно выявлять паттерн нарушений, характерный для хромофобной карциномы. Соматические мутации гена МЕТ, напротив, не могут служить диагностическим маркером папиллярного рака почки I типа вследствие низкой частоты встречаемости. Таким образом, предложена система из 10 STR-маркеров для дифференциальной диагностики хромофобной карциномы и онкоцитомы почки с помощью молекулярно-генетического анализа образцов первичной опухоли.
Исследование выполнено при частичной финансовой поддержке РФФИ в рамках научного проекта № 12-04-31005 мол_а. □
Резюме:
Список литературы Молекулярно-генетические нарушения как критерии в дифференциальной диагностике редких опухолей почки
- Cheng L, Zhang S, MacLennan GT, Lopez-Beltran A, Montironi R. Molecular and cytogenetic insights into the pathogenesis, classification, differential diagnosis, and prognosis of renal epithelial neoplasms//Hum Pathol. 2009. Vol. 40, N 1. P. 10-29.
- Yusenko MV. Molecular pathology of renal oncocytoma: a review//Int J Urol. 2010. Vol. 17. P. 602-614.
- Yusenko MV. Molecular pathology of chromophobe renal cell carcinoma: a review//Int J Urol. 2010. Vol. 17. P. 592-601.
- Системы генетических и эпигенетических маркеров в диагностике онкологических заболеваний. [Под ред. Пальцева М.А., Залетаева Д.В.]. М.: Медицина. 2009. 384 с.
- Nagy A, Buzogany I, Kovacs G. Microsatellite allelotyping differentiates chromophobe renal cell carcinomas from renal oncocytomas and identifies new genetic changes//Histopathol. 2004. Vol. 44. P. 542-546.
- Tan MH, Wong CF, Tan HL, Yang XJ, Ditlev J, Matsuda D, Khoo SK, Sugimura J, Fujioka T, Furge KA, Kort E, Giraud S, Ferlicot S, Vielh P, Amsellem-Ouazana D, Debre B, Flam T, Thiounn N, Zerbib M, Benoit G, Droupy S, Molinie V, Vieillefond A, Tan PH, Richard S, Teh BT. Genomic expression and single-nucleotide polymorphism profiling discriminates chromophobe renal cell carcinoma and oncocytoma//BMC Cancer. 2010. Vol. 10. P. 196.
- Yusenko MV, Kuiper RP, Boethe T, Ljungberg B, van Kessel AG, Kovacs G. High-resolution DNA copy number and gene expression analyses distinguish chromophobe renal cell carcinomas and oncocytomas//BMC Cancer. 2009. Vol. 9. P. 152.
- Tickoo SK, Reuter VE. Differential diagnosis of renal tumors with papillary architecture//Adv Anat Pathol. 2011. Vol. 18. P. 120-132.
- Lee JH, Choi JW, Kim YS. The value of histologic subtyping on outcomes of clear cell and papillary renal cell carcinomas: a meta-analysis//Urol. 2010. Vol. 76. P. 889-894.
- Клинические рекомендации Европейской ассоциации урологов. Онкоурологические заболевания. [пер. Российского общества онкоурологов]. М.: «АБВ-пресс», 2009.
- Schmidt LS., Nickerson ML, Angeloni D, Glenn GM, Walther MM, Albert PS, Warren MB, Choyke PL, Torres-Cabala CA, Merino MJ, Brunet J, Berez V, Borras J, Sesia G, Middelton L, Phillips JL, Stolle C, Zbar B, Pautler SE, Linehan WM. Early onset hereditary papillary renal carcinoma: germline missense mutations in the tyrosine kinase domain of the MET proto-oncogene//J Urol. 2004. Vol. 172. P. 1265-1261.
- Salvi A, Marchina E, Benetti A, Grigolato P, De Petro G, Barlati S. Germline and somatic c-met mutations in multifocal/bilateral and sporadic papillary renal carcinomas of selected patients//Int J Oncol. 2008. Vol. 33. P. 271-276.
- Relative fluorescent quantitation on capillary electrophoresis systems: screening for loss of heterozygosity in tumor samples on the Applied Biosystems 3130 series genetic analyzers with GeneMapper® Software v3.7. Applied Biosystems.© -2004.
- Pinheiro RF, Serio FM, Silva MR, Briones MR, Chauffaille ML. Association of loss of heterozygosity with cytogenetic abnormalities in acute myeloid leukemia and myelodisplastic syndrome//Braz J Med Biol Res. 2008. Vol. 41. P. 610-614.
- Zaky AH, Watari J, Tanabe H, Sato R, Moriiche K, Tanaka A, Maemoto A, Fujiya M, Ashida T, Kohgo Y. Clinicopathological implications of genetic instability in intestinal-type gastric cancer and intestinal metaplasia as a precancerous lesion//Am J Clin Pathol. 2008. Vol. 129. P. 613-621.
- Altavilla G, Fassan M, Busatto G, Orsolan M, Giacomelli L. Microsatellite instability and hMLH1 and hMSH2 expression in renal tumors//Oncol Rep. 2010. Vol. 24. P. 927-932.
- Brunelli M, Delahunt B, Gobbo S, Tardanico R, Eccher A, Bersani S, Cossu-Rocca P, Parolini C, Balzarini P, Menestrina F, Cheng L, Eble JN, Martignoni G. Diagnostic usefulness of fluorescent cytogenetics in differentiating chromophobe renal cell carcinoma from renal oncocytoma//Am J Clin Pathol. 2010. Vol. 133. P. 116-126.
- Hudako R, May M, Aviv H. A new translocation between chromosomes 6 and 9 helps to establish diagnosis of renal oncocytoma//Ann Diagn Pathol. 2011. Vol. 15. P. 278-281.
- Choi JS, Kim MK, Seo JW, Choi YL, Kim DH, Chun YK, Ko YH. MET expression in sporadic renal cell carcinomas//J Korean Med Sci. 2006. Vol. 21. P. 672-677.
- Nickerson ML, Jaeger E, Shi Y, Durocher JA, Mahurkar S, Zaridze D, Matveev V, Janout V, Kollarova H, Bencko V, Navratilova M, Szeszenia-Dabrowska N, Mates D, Mukeria A, Holcatova I, Schmidt LS, Toro JR, Karami S, Hung R, Gerard GF, Linehan WM, Merino M, Zbar B, Boffetta P, Brennan P, Rothman N, Chow WH, Waldman FM, Moore LE. Improved identification of von Hippel-Lindau gene alterations in clear cell renal tumors//Clin. Cancer Res. 2008. Vol. 14. P. 4726-4734.


