Молекулярно-генетический анализ генов GJB2, SLC26A4 и SLC26A5 у больных с наследственными нарушениями слуха из Республики Башкортостан
Автор: Лобов Семен Леонидович, Джемилева Лиля Усеиновна, Хуснутдинова Эльза Камилевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Генетика
Статья в выпуске: 5-3 т.13, 2011 года.
Бесплатный доступ
Рассмотрен анализ генов GJB2, SLC26A4 и SLC26A5 у больных с наследственными нарушениями слуха, проведён сравнительный анализ распространения данных мутаций в разных странах мира.
Глухота, внутреннее ухо, гены
Короткий адрес: https://sciup.org/148205563
IDR: 148205563 | УДК: 575.176,
Текст научной статьи Молекулярно-генетический анализ генов GJB2, SLC26A4 и SLC26A5 у больных с наследственными нарушениями слуха из Республики Башкортостан
Человеческое ухо способно воспринимать звуки от 20-20000 Гц и может различать разницу всего лишь на 0,2-0,5% [4, 6]. Такая чувствительность и точность, наблюдающаяся и у других млекопитающих, происходит от сложного взаимодействия кохлеарных волосковых клеток и текториальной мембраны в пределах кортиева органа. При нарушении этого взаимодействия наступает глухо-та/тугоухость.
Последние исследования показали, что более 75% детской глухоты генетического происхождения [1]. Около четверти генетических форм син-дромальные (глухота является частью генетического синдрома). Наиболее частая форма наследственной глухоты – несиндромальная сенсоневральная тугоухость/глухота (НСНТ). В разных странах мира из 1000 новорожденных 1 ребенок рождается глухим, и глухота в основном прелингвальная [22]. По статистическим данным ВОЗ, в мире насчитывается около 300 млн человек, страдающих нарушением слуха различной этиологии (III-IV степени тугоухости). В РФ этот показатель превышает 13 млн человек, из которых более 1 млн. – это дети в возрасте до 18 лет.
На сегодняшний день определены более 80 локусов для несиндромальных форм потери слуха. Наиболее значимыми среди всех идентифицированных генов, вовлеченных в функционирование системы звуковосприятия, являются гены белков-коннексинов 26 ( GJB2 ), 30 ( GJB6 ) и 31 ( GJB3 ), мутации в которых, по данным разных авторов, являются причинами 50-80% случаев развития несин-дромальных и некоторых синдромальных форм глухоты/тугоухости [5, 27] и около 10-12% всех случаев потери слуха обусловлены повреждением генов белков SLC26A4 (пендрина) и SLC26A5 (престина) [11, 26].
Ген SLC26A4 (7q31) состоит из 21 экзона и кодирует белок пендрин, который является переносчиком I-, Cl- и CO 3 2- ионов [9,23]. Повреждение пендри-на приводит к развитию синдрома Пендреда (1/7500, ответственен за 5-10% всех врожденных
форм тугоухости) либо к неполному развитию костного и перепончатого лабиринтов улитки – «дисплазия Мондини» (расширение вестибулярного водопровода) [10]. На сегодняшний день известно около 100 мутаций в гене SLC26A4. Спектр и частота отдельных мутаций гена обладают этнической специфичностью. p.Thr416Pro и c.1001+1G>A – две наиболее частых мутации у пациентов из Северной Европы. У больных из Китая мутация c.919-2A>G выявляется на 57,63% хромосом пациентов с синдромом Пендреда и дисплазией Мондини. У больных из Японии преобладающей являются мутация p.His723Arg, которая обнаруживаются у 53% пациентов с синдромом Пендреда и дисплазией Мондини. Мутации p.His723Arg и c.919-2A>G также являются преобладающими у больных из Кореи, которые обнаруживаются у 45,5% пациентов с синдромом Пендреда и дисплазией Мондини [25].
Ген SLC26A5 (7q22.1), состоящий из 21 экзона, имеющий 4 сплайсинговые изоформы, высокогомологичен членам семейства сульфатных и анионных переносчиков, кодирует белок престин, который, приблизительно, на 40% гомологичен пендри-ну, но имеет несколько другие свойства [38]. Считается, что престин является двигательным белком наружных волосковых клеток. Мажорной мутацией в гене SLC26A5 для большинства пациентов из Европы является мутация g.-53-2A>G, выявляемая у 3% больных с нарушениями слуха.
Несмотря на актуальную медико-социальную значимость проблемы, данные о спектре мутаций в генах GJB2, SLC26A4 и SLC26A5 у больных с потерей слуха из различных этнических групп Республики Башкортостан (РБ) до сих пор не были получены. Цель нашего исследования – изучение спектра мутаций в генах GJB2, SLC26A4 и SLC26A5 у индивидов с нормальным слухом и у пациентов с тугоухостью/глухотой из различных этнических групп, проживающих на территории РБ.
МАТЕРИАЛ И МЕТОДЫ
Материалом для исследования послужили 246 образцов ДНК больных с диагнозом «наследственная несиндромальная тугоухость/глухота». По сте- пени потери слуха у пробандов семьи распределились следующим образом: I степень тугоухости была зарегистрирована в 4 семьях, II степень тугоухости – в 17 семьях, III степень тугоухости – в 31 семье, IV степень тугоухости – в 62 семьях, и глухота - в 132 семьях. Этнический состав обследованных молекулярно-генетическими методами семей был следующим: русские – 98 семей, татары – 58 семей, башкиры – 37 семей, мари – 5 семей, украинцы – 3 семьи, армяне – 3 семьи, метисы – 42 семьи.
Диагноз глухоты или тугоухости устанавливался в соответствии с современными диагностическими критериями, предлагаемыми Институтом глухоты и коммуникативных расстройств (г. Омаха, США) и рекомендованных в 2003 г. Европейской рабочей группой по наследственным нарушениям слуха GENDEAF [20,31,32]. Наследственный характер глухоты в семьях устанавливали на основании генеалогических данных и ретроспективного анализа анамнеза больных с целью исключения возможного влияния факторов внешней среды (инфекции, травмы слухового аппарата) во время пренатального и постнатального развития.
Образцы крови были взяты с информированного письменного согласия пациентов и их родителей. ДНК выделяли из 10 мл периферической крови методом фенол-хлороформной экстракции. Поиск мутаций в генах GJB2, SLC26A4 и SLC26A5 осуществляли с помощью ПЦР с последующим ПДРФ-анализом и анализа конформационного полимор-
272 П.Н.
112 П.Н.
91 П.Н.
69 л.н.
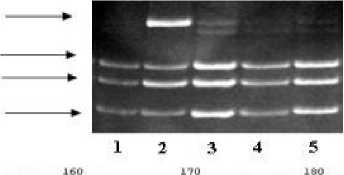
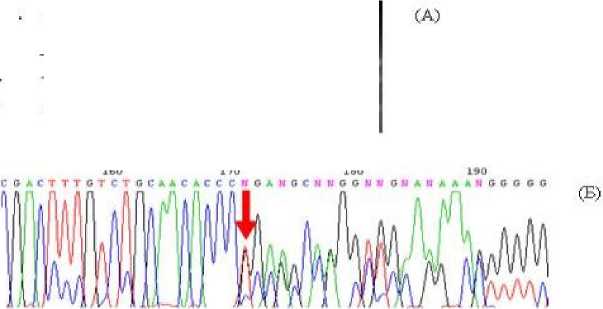
Рис. 1. Идентификация мутации с.167delT в гетерозиготном состоянии в гене GJB2 с помощью ПДРФ-анализа (Pst1) (А) и ресеквенирования 2 экзона гена GJB2 (Б) . Дорожки: 1, 3-5: образцы с генотипом norm/norm., 2 – образец с генотипом с.167delT/N.
Мутация с.167delT в гене GJB2 была идентифицирована у пробандов из 8 семей с НСНТ. В 4 семьях (2 метисных тат/рус, 1 русской и одной татарской) с.167delT выявлена в гетерозиготном состоянии, в 3 семьях (2 русских и 1 татарской) данная делеция была выявлена в компаунд-гетерозиготном состоянии с мутацией с.35delG. И в 1 татарской семье (Б) у пробанда с глухотой мутация с.167delT в гене GJB2 выявлена в сочетании с мутацией q.919-2A>G, расположенной в 7 интроне в сайте сплайсинга 8 экзона в гене SLC26A4 .
физма однонитевой ДНК (SSCP-анализ). Окрашивание конформеров проводили 0,1%-ным раствором AgNO3. Определение последовательности ДНК в образцах с аномальной электрофоретической подвижностью при SSCP-анализе проводили мощью автоматического секвенирования PRISM 310, ABI3100, Applied Biosystoms).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Мутация 167delT в гене GJB2 впервые с по-(АВ1
была
идентифицирована в 1998 г. у больных наследственной формой потери слуха в нескольких семьях евреев Ашкенази [21]. Далее различными исследователями были показаны достаточно высокие частоты этой мутации и в других популяциях Европы, Средиземноморья, Ближнего Востока, Северной Америки и Евразии [3, 21]. Всё вышеперечисленное послужило основанием для поиска с.167delT в выборке больных из РБ. При делеции с.167delT происходит потеря тимина в 167 положении, что приводит к сдвигу рамки считывания и образованию преждевременного стоп-кодона. Для детекции мутации с.167delT был подобран метод идентификации с помощью ПЦР с последующим ПДРФ– анализом. При иcпользовании данного метода теряется один из двух сайтов рестрикции для эндонуклеазы Pst1 (рис. 1), что позволяет выявлять гомозиготных и гетерозиготных носителей этой де-леции. Наличие мутации в образцах подтверждалось последующим ресеквенированием образцов.
Родословная пробанда представлена на рис. 2. У пробанда данной семьи четверо детей, которые также глухие, родители пробанда слышащие. К сожалению, образцы ДНК детей, жены и родителей пробанда оказались недоступны для исследования (родители пробанда, а также его жена и дети отказались проходить медико-генетическое консультирование по религиозным причинам).
Подобное сочетание мутаций g.-3179G>A и с.35delG в гене GJB2 и g.2-2A>G в гене SLC26A4 обнаружено в 2 эстонских семьях с нарушением слуха [34]. Также в литературе описаны случаи со- четания мутаций в гене GJB2 с протяженными де-лециями в гене GJB6 - del(GJB6-D13S1830) и del(GJB6-D13S1854): с.167 delT/del(GJB6-D13S1830) и с.35delG/del(GJB6-D13S1830) у итальянцев [28].
Частота мутации с.167delT в выборке больных из РБ составляет 2%. Во всех обследованных семьях наблюдается аутосомно-рецессивный тип наследования потери слуха, что согласуется с данными по частоте и этнической специфичности с.167delT [3, 21].
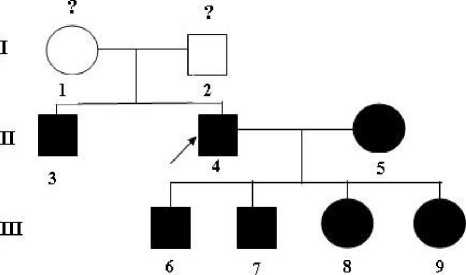
Рис. 2. Фрагмент родословной семьи Б. II-3 пробанд -глухой, генотип с.167delT (ген GJB2)/ c.919-2A>G (ген SLC26A4 ). Родители пробанда (мать I-1 и отец I-2) имеют нормальный слух.
Впервые трансверсия в 101 положении гена GJB2 описана в 1997 г. как доминантная мутация, вызывающая потерю слуха [16]. Замена тимина на цитозин в 101 положении приводит к замене полярной аминокислоты метионин на гетероциклическую – триптофан в 34 положении трансмембранного домена – Тм-1 белка коннексина 26. Далее в 1998 году c.101T>C была обнаружена в гетерозиготном состоянии в выборке 192 индивидов с нормальным слухом [15]. Однако несколькими иссле- дователями при изучении экспрессии коннексина 26 с заменой метионина на триптофан в 34 положении был подтвержден доминантно негативный эффект мутации c.101T>C in vitro [2, 8, 12, 36]. Таким образом, функциональная значимость данной замены на сегодняшний день спорна: ряд исследователей считает, что c.101T>C полиморфный вариант [17,33], а другие придерживаются мнения, что c.101T>C - мутация с аутосомно-рецессивным типом наследования [2, 8, 18].
Мутация c.101T>C выявлена у пациентов с НСНТ из Австралии (около 1%) [7], Австрии (0,98%) [14], Финляндии (3,8%) [19], Венгрии (0,28%) [35], Польше (7,3%) [37], Испании (0,01%) [29], Швейцарии (около 1%) [13], в США (1,5%) [24], Франции 2,3% [30].
Мутация c.101T>C выявлена в трех семьях с НСНТ из РБ. У одного индивида из выборки больных, башкира по этнической принадлежности, идентифицирована замена c.101T>C в гомозиготном состоянии (рис. 3Б), у второго пациента, метиса (русский/татарин), в компаунд гетерозиготном состоянии с полиморфным вариантом с.79A>G (рис. 3А) в гене GJB2 и у третьего пациента русской этнической принадлежности в сочетании с мутацией q.-53-2A>G в гене SLC26A5 . У всех трех пациентов наблюдалась III степень тугоухости. Это не противоречит литературными данными, что мутация q.-53-2A>G идентифицирована у пациента, русского по этнической принадлежности, т.к. трансверсия q.-53-2A>G в гене SLC26A5 встречается, в основном, в популяциях Европы и частота гетерозиготного носительства данной мутации у европейцев около 4%. В Эстонии мутация q.-53-2A>G выявлена с частотой 2,1% среди пациентов с НСНТ [34]. Частота мутации c.101T>C составила 1% у пациентов из РБ.
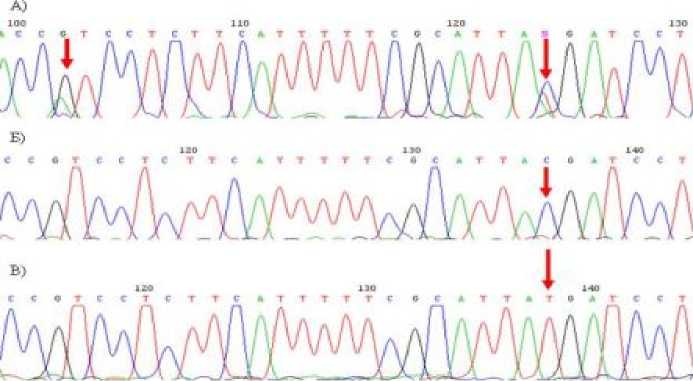
Рис. 3. Последовательность участка 2 экзона гена GJB2, содержащего мутацию c.101T>C в компаунд гетерозиготном состоянии с полиморфным вариантом с.79A>G (А); мутация c.101T>C в гомозиготном состоянии (Б) и нормальная последовательность гена GJB2 (В).
В заключение можно отметить, что хотя в этиологии и патогенезе заболевания остается много неясных аспектов, на сегодня известно, что примерно половина всех случаев врожденной глухоты имеет наследственное происхождение. Большинство случаев генетически детерминированной потери слуха наследуется по аутосомно-рецессивному типу.
Однако выраженная клиническая и генетическая гетерогенность заболевания, а также большая ассортативность браков между глухими и слабослышащими зачастую не позволяет точно выяснить механизм наследования дефекта звуковосприя-тия, а также приводит к повышению случаев болезни среди потомков пробанда.
Большинство детей с врожденными дефектами слуха имеют слышащих родителей, между тем отсутствие сведений о родственниках, имеющих нарушения звуковосприятия, не исключает возможность генетической природы заболевания. Как следствие, правильное консультирование семей таких пациентов практически невозможно без применения ДНК-диагностики.
Список литературы Молекулярно-генетический анализ генов GJB2, SLC26A4 и SLC26A5 у больных с наследственными нарушениями слуха из Республики Башкортостан
- Albert S., Blons H., Jonard L. et. al. SLC26A4 gene is frequently involved in nonsyndromic hearing impairment with enlarged vestibular aqueduct in Caucasian populations//Eur. J. Hum. Genet. 2006. № 14. P. 773-779.
- Bicego M., Beltramello M., Melchionda S. et. al. Pathogenetic role of the deafness-related M34T mutation of Cx26//Hum. Mol. Genet. 2006. V. 15. № 17. P. 2569-2587.
- Bors A., Andrikovics H., Kalmar L. et al. Frequencies of two common mutations (c.35delG and c.167delT) of the connexin 26 gene in different populations of Hungary//Intern. J. Mol. Med. 2004. № 14. P. 1105-1108.
- Conne B.W. Sensory Transduction//Medical Physiology: A Cellular and Molecular Approach. Philadelphia, 2002. P. 325-358.
- Connexin-Deafness Homepage, http://davinci.crg.es/deafness/
- Dallos P. The active cochlea//J. Neurosci. 1992. V. 12. P. 4575-4585.
- Dahl H.H., Tobin S.E., Poulakis Z. et al. The contribution of GJB2 mutations to slight or mild hearing loss in Australian elementary school children//J. Med. Genet. 2006. V. 43 (11). P. 850-855.
- D'Andrea P., Veronesi V., Bicego M. Hearing loss: frequency and functional studies of the most common connexin26 alleles//Biochem Biophys Res. Comm. 2002. V. 296 (3). P. 685-691.
- Eisen M.D., Ryugo D.K. Hearing molecules: contributions from genetic deafness//Cell. Mol. Life Sci. 2007. № 64. P. 566-580.
- Everett L.A., Glaser B. et al. Pendred syndrome is caused dy mutations in a putative sulphate transporter gene (PDS)//Nat. Genet. 1997. V. 17. P. 411-422.
- Fraser G.R. Association of congenital deafness with goitre (Pendred’s syndrome): a study of 207 families//Ann. Hum. Genet. 1965. V. 28. P. 201-249.
- Griffith A.J., Chowdhry A.A., Kurima K. et al. Autosomal recessive nonsyndromic neurosensory deafness at DFNB1 not associated with the compound-heterozygous GJB2 (connexin 26) genotype M34T/167delT//Am. J. Hum. Genet. 2000. V. 67. P. 745-749.
- Gürtler N., Kim Y., Mhatre A. et al. GJB2 mutations in the Swiss hearing impaired//Ear Hear. 2003. V. 24 (5). P. 440-447.
- Janecke A.R., Hirst-Stadlmann A., Günther B. et al. Progressive hearing loss, and recurrent sudden sensorineural hearing loss associated with GJB2 mutations-phenotypic spectrum and frequencies of GJB2 mutations in Austria//Hum. Genet. 2002. V. 111 (2). P. 145-53.
- Kelley P.M., Harris D.J., Comer B.C. et al. Novel mutations in the connexin 26 gene (GJB2) that cause autosomal recessive (DFNB1) hearing loss//Am. J. Hum. Genet. 1998. V. 62. P. 792-799.
- Kelsell D.P., Dunlop J., Stevens H.P. et al. Connexin 26 gene mutations in hereditary non-syndromic sensorineural deafness//Nature. 1997. V. 387. P. 80-83.
- Kelsell D.P., Wilgoss A.L., Richard G. et al. Connexin mutations associated with palmoplantar keratoderma and profound deafness in a single family//Eur. J. Hum.Genet. 2000. V. 8 (6). P. 469-72.
- Kenna M.A., Feldman H.A., Neault M.W. et al. Audiologic phenotype and progression in GJB2 (Connexin 26) hearing loss//Arch. Otolaryngol Head Neck Surg. 2010. V. 136 (1). P. 81-87.
- Löppönen T., Väisänen M.L., Luotonen M. et al. Connexin 26 mutations and nonsyndromic hearing impairment in northern Finland//Laryngoscope. 2003. V. 113 (10). P. 1758-1763.
- Mazzoli M., Van Camp G., Newton V. et al. Recommendations for the description of genetic and audiological data for families with nonsyndromic hereditary hearing impairment//Composed by the GENDEAF study group on genotype phenotype correlations. 2003. P. 1-3.
- Morell R.J., Kim H.J., Hood L.J. Mutations in the connexin 26 gene (GJB2) among Ashkenazi Jews with nonsyndromic recessive deafness//N. Engl. J. Med. 1998. V. 339 (21). P. 1500-1505.
- Morton N.E., Ann N.Y. Genetic epidemiology of hearing impairment//Acad. Sci. 1991. № 630. P. 16-31.
- Nance W.E. The genetic of deafness//MRDD Res. Rev. 2003. V. 9. P. 109-119.
- Pandya A., Arnos K.S., Xia X.J. et al. Frequency and distribution of GJB2 (connexin 26) and GJB6 (connexin 30) mutations in a large North American repository of deaf probands//Genet. Med. 2003. V. 5 (4). P. 295-303.
- Park H.J., Lee S.J., Jin H.S. et al. Genetic basis of hearing loss associated with enlarged vestibular aqueducts in Koreans//Clin. Genet. 2004. V. 67. P. 160-165.
- Park H.J., Shaukat S., Liu X.Z. et al. Origins and frequencies of SLC26A4 (PDS) mutations in east and south Asians: global implications for the epidemiology of deafness//J. Med. Genet. 2003. V. 40. P. 242-248.
- Petersen M.B., Willems P.J. Non-syndromic, autosomal-recessive deafness//Clin. Genet. 2006. № 69. P. 371-392.
- Primignani P., Trotta L., Castorina P. et al. Analysis of the GJB2 and GJB6 genes in Italian patients with nonsyndromic hearing loss: frequencies, novel mutations, genotypes, and degree of hearing loss//Genet. Test Mol. Biomarkers. 2009. V. 13 (2). P. 209-217.
- Rabionet R., Gasparini P., Estivill X. Molecular genetics of hearing impairment due to mutations in gap junction genes encoding beta connexins//Hum. Mutat. 2000. V. 16. P. 190-202.
- Roux A.F., Pallares-Ruiz N., Vielle A. et al. Molecular epidemiology of DFNB1 deafness in France//BMC Med. Genet. 2004. V. 5. P. 1-10.
- Smith S.D., W.J. Kimberling, Schaefer G.B. et al. Medical genetic evaluation for the etiology of hearing loss in children//J. Commun. Disord. 1998. V. 31. P. 371-388.
- Stephens D. Audiological terms//Definitions, protocols & guidelines in genetic hearing impairment. Whurr publishers, 2001.
- Tan, W., Zhang Y., Chang Q. et al. Connexin29 is highly expressed in cochlear Schwann cells, and it is required for the normal development and function of the auditory nerve of mice//J. Neurosci. 2006. V. 26. P. 1991-1999.
- Teek R., Oitmaa Eneli E., Kruustuk K. et al. Splice variant IVS2-2A>G in the SLC26A5 (Prestin) gene in five Estonian families with hearing loss//Intern. J. Pediatric Otorhinolaryngology. 2009. № 73. P. 103-107.
- Tóth T., Kupka S., Haack B. et al. GJB2 mutations in patients with non-syndromic hearing loss from Northeastern Hungary//Hum. Mutat. 2004. V. 23 (6). P. 631-632.
- White T.W., Deans M.R., Kelsell D.P. et al. Connexin mutations in deafness//Nature. 1998. V. 394. P. 630-631.
- Wiszniewski W., Sobieszczanska-Radoszewska L., Nowakowska-Szyrwinska E. et al. High frequency of GJB2 gene mutations in Polish patients with prelingual nonsyndromic deafness//Genet. Test. 2001. V. 5 (2). P. 147-148.
- Zheng J., Shen W., He D.Z.Z et al. Prestin is the motor protein of cochlear outer hair cells//Nature. 2000. V. 405. P. 149-155.


