Молекулярное маркирование образцов гороха овощного
Автор: Анохина В.С., Саук И.Б., Романчук И.Ю., Жардецкий С.С., Дронов С.М., Чайковский А.И.
Журнал: Овощи России @vegetables
Рубрика: Теория и практика селекции и семеноводства сельскохозяйственных культур
Статья в выпуске: 3 (24), 2014 года.
Бесплатный доступ
В работе представлены результаты исследований гибридного материала гороха овощного на наличие в их геномах участков ДНК, комплементарных ряду праймеров, связанных с биохимическими характеристиками и устойчивостью к настоящей мучнистой росе.
Гибрид, молекулярный маркер, устойчивость к мучнистой росе, горох овощной
Короткий адрес: https://sciup.org/14025096
IDR: 14025096 | УДК: 635.656:577.21
Текст научной статьи Молекулярное маркирование образцов гороха овощного
С
Введение овременные молекулярно-генетические методы позволяют разрабатывать новые стратегии маркер-селекции сельскохозяйственных культур. Использование молекулярных маркеров по хозяйственно ценным признакам актуально для выведения и оценки последующей перспективности селекционных форм у ряда культивируемых растений. Эти подходы имеют большое значение для паспортизации сортов и гибридов, оценки чистоты сортового посевного материала, а также для установления родственных связей между ними и построения древа филогенетического родства разных форм и видов. Использование молекулярных маркеров в селекции на устойчивость к заболеваниям позволит проводить оценку селекционного материала на разных этапах развития растений и выбраковать неустойчивые генотипы, а, следовательно, сократить объем работ по созданию инфекционного фона и проводить дальнейшую работу по оценке уровня устойчивости у растений.
В работах сотрудников разных научных учреждений России [1] на примере гороха и других культур доказана важность молекулярного маркирования генетических ресурсов и селекционных образцов для их идентифика- ции и эффективности использования. Исторически для характеристики образцов коллекций генбанков использовали морфофизиологические признаки растений, реже биохимические маркеры. Однако за последние несколько десятилетий ex situ коллекции чрезвычайно увеличились в объёмах как результат попыток мирового сообщества сохранить и расширить растительные генетические ресурсы. В связи с этим становится всё сложнее пользоваться традиционными методами оценки в генбанках сохраняемого разнообразия. В настоящее время FAO разработала набор рекомендаций по эффективному управлению национальными генбанками. При этом подчёркивается, что современное состояние ген-банков не является удовлетворительным. Так, свыше 65% мировых коллекций нуждаются в возобновлении всхожести и получении семян свежих репродукций, и многие национальные программы, направленные на поддержание генбанков, переживают значительные трудности, что связано с дороговизной и трудоёмкостью поддержания коллекций, а это в свою очередь приводит к обеднению их, и часто значительному. Предложенное Frankel [2] создание так называемых core-коллекций для эффективного сохранения и использования генетических ресурсов также требует предварительной оценки всего разнообразия основной коллекции [3].
Решение проблем на современном этапе видится в использовании молекулярных методов ДНК-анализа коллекций, что и предлагает ФАО в качестве базовой характеристики генетического разнообразия, представленного в генбанках. При этом подчёркивается, что конечный результат полностью оправдывает и, главное, окупает затраты на проведение молекулярных исследований. В дополнение к традиционным способам характеристики молекулярное генотипирование позволяет охарактеризовать образцы коллекций на уровне первичных последовательностей ДНК на любой стадии развития растения. Молекулярный анализ генетического разнообразия внутри образца и между образцами коллекций позволяет одновременно решать целый ряд актуальных задач для правильной организации и характеристики генетических коллекций:
-
• идентификация дублетных образцов;
-
• верификация таксономического статуса образцов;
-
• создание core-коллекций;
-
• создание генбанка ДНК;
-
• молекулярная паспортизация образцов (прежде всего, сортов).
При этом следует учитывать, что не всегда уровень морфологического полиморфизма коррелирует с генетическим, и, следовательно, молекулярная оценка коллекций может помочь идентифицировать новые потенциальные источники генетического разнообразия, в том числе и полезного для селекции [4].
В основу молекулярной характеристики образцов коллекций был положен метод комплексного геномного анализа, подразумевающий использование различных методов молекулярного маркирования (AFLP, RAPD,
-
1. Образцы гороха овощного, использованные в эксперименте
№ образца МР
Наименование образца
Родители, t xu
1
05-07-9-3
Ramzes x Альдерман
2
05-07-21-1
Ramzes x Альдерман
3
05-07-27-4
Ramzes x Альдерман
4
06-07-2-5
Альдерман x Helmo
5
06-07-17-2
Альдерман x Helmo
6
06-07-17-3
Альдерман x Helmo
7
06-07-20-3
Альдерман x Helmo
8
12-07-3-1
Альдерман x Betafortuna
9
07-07-3-3
Альдерман x Betafortuna
10
07-07-4-2
Альдерман x Betafortuna
11
07-07-4-3
Альдерман x Betafortuna
12
07-07-24-2
Альдерман x Betafortuna
13
08-07-2-1
Альдерман x Ramzes
14
08-07-2-2
Альдерман x Ramzes
15
08-07-18-2
Альдерман x Ramzes
16
08-07-18-3
Альдерман x Ramzes
17
08-07-22-1
Альдерман x Ramzes
18
08-07-29-2
Альдерман x Ramzes
19
09-07-1-2
Betafortuna x Helmo
20
09-07-1-4
Betafortuna x Helmo
21
09-07-2-2
Betafortuna x Helmo
22
16-07-4-7
Betafortuna x Альдерман
23
16-07-6-8
Betafortuna x Альдерман
24
16-07-4-4
Betafortuna x Альдерман
25
17-07-4-5
Betafortuna x Ramzes
26
Ramzes
27
Альдерман
28
Betafortuna
29
Helmo
ISSR, анализ семейств генов, анализ нуклеотидного полиморфизма отдельных генов и некодирующих последовательностей, как ядерного генома, так и пластидной ДНК). Подход позволяет максимально полно описать генетическое разнообразие уникальных, функционально значимых областей генома, а также повторяющихся или эволюционно нейтральных локусов.
Установлено существенное различие по полиморфизму изученных форм между данными морфофизиологического анализа и молекулярно-генетического тестирования при молекулярном тестировании коллекций.
Молекулярно-генетическое изучение структуры популяции сои [5] выявило зависимость генетического разнообразия от эколого-фитоценотических условий произрастания и антропогенного воздействия. Исследования сотрудников МГУ убедительно доказали существенное уточнение таксономического положения и полиморфизма рода Pisum и др. на основе молекулярногенетического тестирования образцов гороха и других культур по структуре ДНК [6].
С использованием молекулярно-генетических, молекулярно-биохимических и молекулярно-генетических маркеров проведена паспортизация генетического разнообразия разных видов льна [7] , гороха [8], пшеницы
[9-11] и других культур [12,13], что актуально для селекционных программ и познания процессов генетической дивергенции и родства изучаемых форм растений, а также для создания коллекций и изучения генетического разнообразия в целях селекции [14].
Целью наших исследований было изучение образцов гороха овощного гибридного происхождения на наличие участков ДНК комплементарных праймерам, сцепленным со следующими признаками: синтез протеина транспорта сахарозы SUT 1, рибосомального протеина L24A, вицилина, металлотионин, ингибитора трипсина и устойчивостью к настоящей мучнистой росе (ген er 1).
Материалы и методы
В работе по маркированию использовали 29 образцов гороха овощного (табл.1). Среди них 25 линий из гибридов поздних поколений и 4 родительские формы.
ДНК выделяли из листьев растений до цветения. Листья высушивали в термостате при Т=37°С, примерно двое суток. Навеску листового материала 0,2 г растирали в ступке с добавлением небольшого количества Al2O3. Выделение и очистку ДНК исследуемых образцов проводили по методике фирмы Fermentas, набором Genomic DNA Purification Kit, разработанным этой же

1ХТАЕ, 7V£m, 45mln
2. Праймеры, использованные в опытах
|
Название праймера |
Сцепленный с праймером признак |
Источник |
|
P 248 |
протеин транспорта сахарозы SUT 1 |
Zhukov, V.A. [15] |
|
BC 210 |
устойчивость к настоящей мучнистой росе (ген er 1) |
Tonguc M [16] |
|
Rph 24 A |
рибосомальный протеин L24 A |
Zhukov, V.A[15] |
|
VicJ |
вицилин |
Zhukov, V.A[15] |
|
TI 1 |
ингибитор трипсина |
Zhukov, V.A[15] |
|
Met 2 |
металлотионин |
Zhukov, V.A[15] |
фирмой. Концентрацию полученного раствора ДНК определяли методом спектрофотометрии на приборе CARY 50 SCAN (Varian, Австралия). Для проведения ПЦР использовали амплификатор Thermo Hybaid Rx2 (Великобритания).
Условия амплификации были следующими:
-
I. 94°С – 5 мин;
-
II. 94°С – 45 сек, Х°С – 30 сек,72°С – 1 мин
-
III. 94°С – 30 сек, Х°С – 30 сек ,72°С – 1 мин
-
IV. 72°С – 5 мин
-
3. Результаты маркирования образцов гороха овощного
Образец
P 248
BC 210
Праймеры
Rph 24 A VicJ
TI 1
Met 2
Ramzes x Альдерман, линия 1
+
+
+
+
+
+
Ramzes x Альдерман, линия 2
+
+
+
+
-
+
Ramzes x Альдерман, линия 3
+
+
+
+
+
+
Альдерман x Helmo, линия 1
+
+
-
+
+
+
Альдерман x Helmo, линия 2
+
+
+
+
+
+
Альдерман x Helmo, линия 3
+
+
+
+
+
+
Альдерман x Helmo, линия 4
+
+
+
+
+
+
Альдерман x Betafortuna, линия 1
+
+
-
+
+
+
Альдерман x Betafortuna, линия 2
+
+
-
+
+
+
Альдерман x Betafortuna, линия 3
+
+
+
+
+
+
Альдерман x Betafortuna, линия 4
+
+
+
+
+
+
Альдерман x Betafortuna, линия 5
+
-
+
+
+
+
Альдерман x Ramzes, линия 1
+
+
+
+
+
+
Альдерман x Ramzes, линия 2
+
+
+
+
+
+
Альдерман x Ramzes, линия 3
+
-
+
+
+
+
Альдерман x Ramzes, линия 4
+
+
+
+
+
+
Альдерман x Ramzes, линия 5
+
+
+
+
+
+
Альдерман x Ramzes, линия 6
+
+
-
+
+
+
Betafortuna x Helmo, линия 1
+
+
-
+
+
+
Betafortuna x Helmo, линия 2
+
+
+
+
+
+
Betafortuna x Helmo, линия 3
+
+
+
+
+
+
Betafortuna x Альдерман, линия 1
+
+
+
+
+
+
Betafortuna x Альдерман, линия 2
+
+
+
+
+
+
Betafortuna x Альдерман, линия 3
+
-
+
+
+
+
Betafortuna x Ramzes
+
+
-
+
+
+
Ramzes
+
-
+
+
+
+
Альдерман
+
+
-
+
+
+
Betafortuna
+
+
+
+
+
+
Helmo
+
+
+
+
+
+
GeneRuler™ DNA Ladder Mix
O’GeneRuler™ DNA Ladder Mix, ready-to-use

bf) ng/0.5 pg
10000 MQQ 6000 5000 4)00 3500 3000 2500 2000 1500 1200 1000
900 800 TOT
600 500 4)0
300 200
18.0
18.0
18.0
18.0
18.0
18.0
60.0
16.0
16.0
16.0
16.0
60.0
17.0
17.0
17.0
17.0
60.0
20.0
20.0
20.0
20.0
3.6
3.6
3.6
3.6
3.6
12.0
3.2
3.2
3.2
3.2
12.0
3.4
3.4
3.4
3.4
12.0
4.0
4.0
4.0
4.0
0.5 рдОэпн, 8 cm kngth gel,
1XTAE,7V/cm, 45 mln
Температуру отжига праймеров определяли с помощью программы «олигокалькулятор» . ПЦР амплификация и разделение продуктов ПЦР в полиакриламидном геле проведены согласно методике [15].
Продукты ПЦР разделяли методом электрофореза в 1,5% агарозном геле с буфером TАE в присутствии бромистого
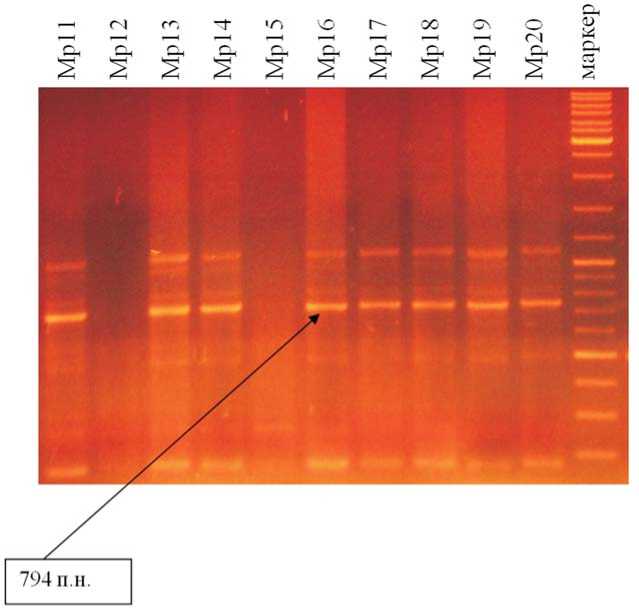
Рис. Электрофореграмма продуктов амплификации фрагментов ДНК с праймером BC210 опытных образцов гороха овощного (устойчивость к настоящей мучнистой росе)
МР11 - Альдерман х Betafortuna, л 4
МР12- Альдерман х Betafortuna, л 5
МР 13 -Альдерман х Ramzes, л 1 .
МР 14 -Альдерман х Ramzes, л 2
МР 17- Альдерман х Ramzes, л 5 .
МР 18 - Альдерман х Ramzes, л 6
МР 19- Betafortuna х Helmo, л 1
МР 20 - Betafortuna х Helmo, л 2
МР 15 -Альдерман х Ramzes, л 3 .
МР 16- Альдерман х Ramzes, л 4 .
этидия и визуализировали на UV-трансиллюминаторе. На форез наносили одинаковый объем ПЦР-продуктов в 10 мкл. В качестве маркера длины фрагментов использовали DNA Ladder, Mix MassRuler TM.
В опытах по маркированию гороха овощного использовали следующие праймеры (табл.2).
Результаты и их обсуждение
Выбор этих праймеров обоснован как данными литературы, так и важностью маркируемых признаков, характеризующих биохимические особенности культуры и устойчивость к настоящей мучнистой росе.
Гибриды гороха овощного и их исходные родительские формы проанализированы на наличие в их геномах участков ДНК, комплементарных праймерам P 248, BC 210, Rph 24 A, VicJ, TI 1, Met 2. Результаты проведенных исследований представлены в таблице 3.
Выявлены сходства генотипов изученных форм гороха овощного по праймерам P 248 (синтез протеина транспорта сахарозы), VicJ (синтез вицилина), Met 2 (синтез металло- тионина). Разница между изученными образцами установлена по праймерам BC 210, TI 1 и Rph 24 A.
Интересные данные получены по признаку устойчивости к настоящей мучнистой росе. Три родительские формы (Альдерман, Betafortuna и Helmo) содержали ген устойчивости er 1. У линий комбинаций скрещивания Альдерман x Betafortuna, линия 5, Альдерман x Ramzes, линия 3; Betafortuna x Альдерман, линия 3 – не выявлено данного гена, Учитывая рецессивную природу искомого гена, при гибридизации отдельных форм происходит рекомбинация геномов, приводящая к восстановлению признака неустойчивости к мучнистой росе. Возможно, это является как результатом неаллельного взаимодействия, так и подтверждением полигенной природы изучаемого признака. Проведенное маркирование позволило нам среди изученных форм выделить образцы, имеющие в своем геноме рецессивный ген устойчивости к настоящей мучнистой росе.
При маркировании образцов гороха овощного по праймеру TI 1 (наличие ингибиторов трипсина) выделен образец Ramzes x Альдерман, линия 2, у которого отмечено отсутствие искомого фрагмента ДНК комплементарного изучаемому праймеру, что позволяет нам утверждать об отсутствии у этого образца гена синтеза ингибиторов трипсина. Сложности в генанализе представляет проявление у гибридов в сравнении с исходными родительскими формами признака синтеза рибосомального протеина L24 A, ген которого не обнаружен как у одной из родительских форм (Альдерман), так и у гибридов, полученных с другими формами (Betafortuna x Helmo, Betafortuna x Ramzes).
Полученные результаты молекулярного маркирования могут быть и следствием гетерозиготности исходных компонентов скрещивания, что требует дополнительной проверки.
Список литературы Молекулярное маркирование образцов гороха овощного
- Молекулярное маркирование видового разнообразия генетических ресурсов растений коллекции ГНУ ГНЦ РФ ВИР/Рыжова Н.Н. и др.//Доклады II Вавиловской Международной конференции «Генетические ресурсы культурных растений в XXI веке: Состояние, проблемы, перспективы», 26-30 ноября 2007. -СПб.: ВИР, 2009. -С. 160-171.
- Frankel, О.Н. Genetic perspectives of germplasm conservation/Genetic Manipulation: Impact on Man and Society. Cambridge University Press, Cambridge, 1984. -P.161-170.
- Barneby R. C. A new species of Lathyrus (Fabaceae) from the Death Valley region of California, Nevada//Aliso. 1971,-V. 7.-P.361-364.
- De Vicente C., Metz T., Alercia A. Descriptors for Genetic markers Technologies. International plant Genetic Resources Institute, Rome Italy, 2004. -30 p.
- Тихонов А.В., Дорохов Д.Б. Сравнительное молекулярно-генетическое исследование структуры естественных и антропогенных популяций дикой сои (Glycine Soja Sieb. Et Zucc.) на юге Приморского края как элемент программы сохранения in situ родичей культурных растений//Материала Международной конференции «Генетические ресурсы культурных растений: Проблемы эволюции и систематики культурных растений», 9-11 декабря 2009 г. СПб.: ВИР, 2009,-С. 131-134.
- Синюшин А.А., Демиденко Н.В. Таксономическое положение Vavilovia Formosa (Stev.)Fed.no данным морфологических и молекулярных исследований//Материала Международной конференции «Генетические ресурсы культурных растений: Проблемы эволюции и систематики культурных растений», 9-11 декабря 2009г. СПб.: ВИР, 2009. -С. 212-214.
- Зеленин А.В. Исследования геномов сельскохозяйственных растений и их дикорастущих сородичей с помощью молекулярно-хромосомных маркеров с целью характеристики и обогащения генофондов важнейших культур//Динамика генофондов растений, животных и человека. М.: ИОГен РАН, 2005.-С.81-82.
- Гостимский С.А. и др. Исследования генома культурных растений и их сородичей применительно к генетической теории селекции: анализ молекулярногенетического полиморфизма генома гороха и идентификация новых генов, кодирующих хозяйственно ценные признаки//Динамика генофондов. М.: ФИАН, 2007. -С. 110
- Кудрявцев А.М. и др. Исследования генома культурных растений и их сородичей применительно к генетической теории селекции: изучение полиморфизма стародавних сортов твердой пшеницы Болгарии//Динамика генофондов. М.: ФИАН,2007. -С. 130-131.
- Одинцова Т.И. идр. Исследования генома культурных растений и их сородичей применительно к генетической теории селекции: исследования спектров дефензинов у устойчивых и восприимчивых к фитопатогенам видов пшеницы//Динамика генофондов. М.: ФИАН, 2007. -С. 139-141.
- Першина Л.А и др. Использование молекулярногенетических подходов и методов хромосомной инженерии для изучения и увеличения генетического разнообразия мягкой пшеницы//Динамика генофондов. М.: ФИАН, 2007. -С. 147-149.
- Гришаева Т.М., Додашев С.Я., Богданов Ю.Ф. Изучение генетических и молекулярных аспектов мейоза как основы для реализации изменчивости и сохранения стабильности генома: сравнительное исседование in sili-со мейоз-специфичных когезинов Rec8n их соматических ортологов Rad21 у таксономически далёких организмов//Динамика генофондов. М.: ФИАН, 2007,-С. 111-112.
- Евдокимова Л.И., Ратькин А.В. Исследования генома культурных растений и их сородичей применительно к генетической теории селекции: динамика флавонолрасщепляющей активности бесклеточных экстрактов у мутантов мака (Papaver somniferum L.)//Динамика генофондов. М.: ФИАН, 2007,-С. 115-116.
- Шумный В.К. и др. Генетическое разнообразие растений для создания уникальных коллекций и их использования для разработки новых методов селекции//Динамика генофондов. М.: ФИАН,2007. -С. 168-170
- Gene-based markers of pea linkage group V for mapping genes related to symbioses/Zhukov, V.A. et.al.//Pisum Genetics. -2007. -V.39. -P. 19-25.
- Tongue M., Weeden N.T. Identification and mapping of molecular markers to er 1 Gene in Pea//Plant Molecular Biology & Biotechnology. -2010.-V.1. -P.1 -5.


