Молекулярные маркеры системы гемостаза после эндопротезирования крупных суставов на фоне антитромботической профилактики низкомолекулярным гепарином
Автор: Антропова Ирина Петровна, Осипенко Артур Васильевич, Рейно Елена Викторовна, Бабушкин Василий Николаевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2010 года.
Бесплатный доступ
Проведено изучение показателей гемостаза у 83 пациентов, перенесших эндопротезирование крупных суставов. Было показано, что использование молекулярных маркеров позволяет выявить предоперационную дисфункцию коагуляции и фибринолиза, исследовать динамику фазовых изменений гиперкоагуляционного синдрома, проследить интенсивность и вариабельность тромбинемии на фоне стандартной антитромботической профилактики эноксапарином.
Гемостаз, эндопротезирование, эноксапарин
Короткий адрес: https://sciup.org/142121326
IDR: 142121326
Текст научной статьи Молекулярные маркеры системы гемостаза после эндопротезирования крупных суставов на фоне антитромботической профилактики низкомолекулярным гепарином
Операции по эндопротезированию крупных суставов, несмотря на совершенствование хирургической техники, анестезиологического пособия и внедрения в практику современных антикоагулянтных препаратов, сопровождаются повышенным риском развития тромбозов глубоких вен и тромбоэмболии легочной артерии [8, 10]. Основное значение для возникновения тромба, его размеров и физических свойств, наряду с повреждением сосудистой стенки и нарушением кровотока, имеют сдвиги в системе гемостаза [9].
Поэтому необходимы надежные критерии комплексной оценки системы гемокоагуляции, в первую очередь плазменного гемостаза, состояние которого определяется сбалансированным функционированием свертывающего, противосвертывающего и фибринолитического звеньев [5].
Учитывая важность дисфункции коагуляционного звена в процессе формирования венозных тромбов, адекватная антикоагулянтная терапия является приоритетным направлением в предупреждении развития тромбоэмболических осложнений у хирургических больных [6, 14]. В настоящее время использование антикоагулянт- ных препаратов, в частности низкомолекулярных гепаринов (НМГ), специфически действующих на систему гемостаза, основано на принадлежности хирургических пациентов к той или иной группе риска без учета выраженности гемокоагуляционных нарушений [7, 10]. Это делает актуальным изучение вариабельности проявлений и эффективности коррекции гиперкоагуляционного синдрома на фоне стандартного действия НМГ.
Использование современных лабораторных технологий позволяет дополнить базовые тесты высокоспецифичными и чувствительными методами, которые не только определяют индивидуальные компоненты гемостаза, но и оценивают степень активации системы.
Превращение протромбина в активный тромбин является ключевым событием в процессе свертывания крови. Тромбин взаимодействует с различными компонентами коагуляционного каскада и ингибируется антитромбином, в результате чего образуется неактивный комплекс (ТАТ), который удаляется из циркуляции в течение нескольких минут. Повышение концентрации ТАТ в плазме свидетельствует об усилении образования тромбина и наличии гиперкоагуляции непосредственно в момент взятия крови на исследование [4, 11].
Повышенное формирование фибринмономерных комплексов (РФМК) свидетельствует о стадии образования растворимого фибрина. Увеличение в крови Д-димера (Д-д) отражает интенсивность образования и лизиса нерастворимого фибрина и характеризует активность свертывающей и фибринолитической систем. Систему физиологических антикоагулянтов оценивают по активности ее основных компонентов – антитромбина и протеина С [3]. Использование молекулярных маркеров сущест- венно расширяет возможности изучения механизмов гемокоагуляционных нарушений, их диагностики и определения степени медикаментозной коррекции.
Вместе с этим, динамика взаимодействия основных звеньев системы плазменного гемостаза при эндопротезировании крупных суставов остается недостаточно исследованной, что и обусловило проведение данной работы, целью которой стал анализ динамики молекулярных маркеров системы гемостаза и оценка их информативности у пациентов, перенесших эндопротезирование крупных суставов, на фоне анти-тромботической профилактики НМГ.
МАТЕРИАЛ И МЕТОДЫ
В работу было включено 83 пациента (35 мужчин и 48 женщин) в возрасте от 33 до 72 лет, перенесших неосложненные операции первичного эндопротезирования тазобедренного или коленного сустава.
Критерии исключения составили: наличие в анамнезе патологии системы гемостаза, неконтролируемого артериального давления, почечной, печеночной недостаточности, онкологических, наркологических заболеваний, сахарного диабета, ревматоидного артрита, количество тромбоцитов менее 100×109 , противопоказания к антикоагулянтной терапии.
Антитромботическую медикаментозную профилактику проводили НМГ-эноксапарином. Первая инъекция за 12 часов до операции, при планировании общей анестезии вводили 40 мг препарата, при планировании комбинированной спинально-эпидуральной анестезии 20 мг. Вторая инъекция – через 12 часов после операции, впоследствии эноксапарин вводили 1 раз в сутки в дозе 40 мг в течение 14-20 дней.
Отбор проб для анализов проводили до операции, через 30 минут после ее окончания и на 1-е, 3-и, 7-е, 14-е, 20-23-и сутки после эндопротезирования.
Определение комплексов ТАТ проводили с помощью иммуноферментного анализа (ИФА) [11, 12] наборами Enzygnost TAT фирмы Dade
Behring на иммуноферментном анализаторе Stat Fax-2100 (США). Д-димер также определяли с помощью ИФА наборами Asserachrom D-dimer фирмы Roche [13]. Активность образования растворимого фибрина оценивали ортофенантролиновым методом наборами фирмы Технология–Стандарт [3]. Для оценки системы фибринолиза проводили определение времени XIIa-зависимого эуглобулинового лизиса наборами фирмы Технология–Стандарт [3]. Определение фибриногена проводили по Клауссу с помощью наборов Multifibren фирмы Dade Behring на коа-гулометре CA-50 (Sysmex, Япония). Активности антитромбина и плазминогена определяли хромогенным методом наборами фирмы Технология-Стандарт [3] на биохимическом анализаторе Stat Fax-3300 (США). Общие клоттинговые тесты (АЧТВ, тромбиновое время, протромбиновое время) выполняли реактивами фирмы Dade Behring на коагулометре CA-50 (Sysmex, Япония). В качестве контролей использовались Standart Human Plasma, Control Plasma N и Control Plasma P фирмы Dade Behring.
Статистический анализ проводили с использованием t-критерия Стьюдента. Проверялись условия нормальности распределения по критерию Колмогорова-Смирнова и равенство дисперсий по критерию Фишера.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исследования, проведенные до операции, показали, что результаты клоттинговых тестов – АЧТВ, ПВ, ТВ не выходили за пределы физиологической нормы. Однако повышенное формирование комплексов ТАТ и Д-Д свидетельствовало об усилении образования тромбина и продуктов деградации нерастворимого фибрина у 43,8 % и 46,0 % обследованных пациентов соответственно. Это указывает на активацию и коагуляционного, и фибринолитического звеньев системы гемостаза у значительной части обследованных уже в предоперационном периоде, что является фактором повышенного риска интра- и послеоперационного развития как тромботических, так и геморрагических осложнений.
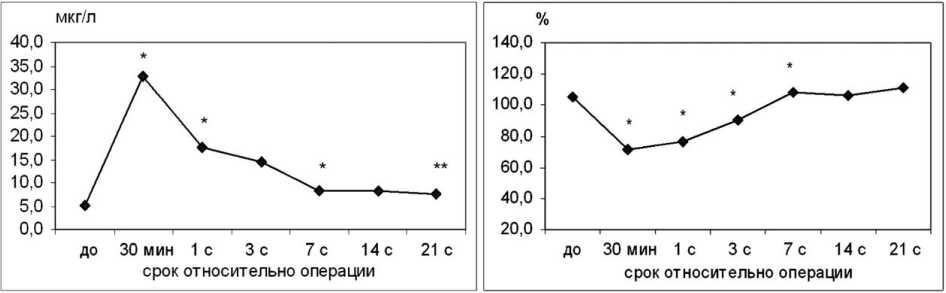
Интраоперационное массивное выделение тканевого фактора приводило к значительному усилению активности свертывающей системы, что выражалось в увеличении формирования комплексов ТАТ (рис. 1, а). Непосредственно по окончании эндопротезирования уровень тромбина в целом по группе увеличивался в 6,4 раза, несмотря на предоперационное введение НМГ, действие которого направлено на ингибирование формирования тромбина и снижение активности коагуляции [2]. Анализ вариабельности показал, что 29,8 % пациентов имели 4-кратное превышение нормы, 31,9 % 5-7 кратное, 38,3 % более чем 7-кратное. Высокая активность свертывания приводила к снижению на 35 % уровня антитромбина, одного из основных ингибиторов коагуляционного процесса (рис. 1, б).
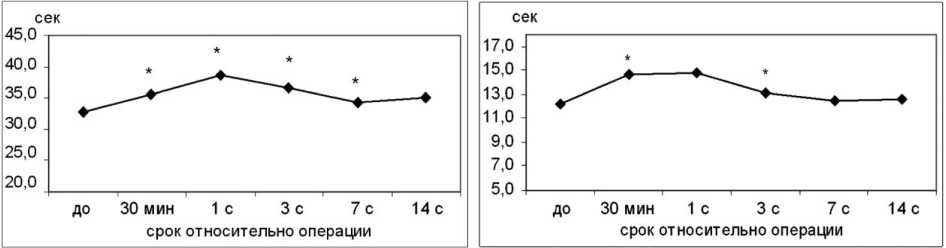
Глобальные тесты показали существенное снижение факторов свертывания, что свидетельствовало об их активном потреблении и выражалось в увеличении АЧТВ (рис. 2, а) и ПВ (рис. 2, б).
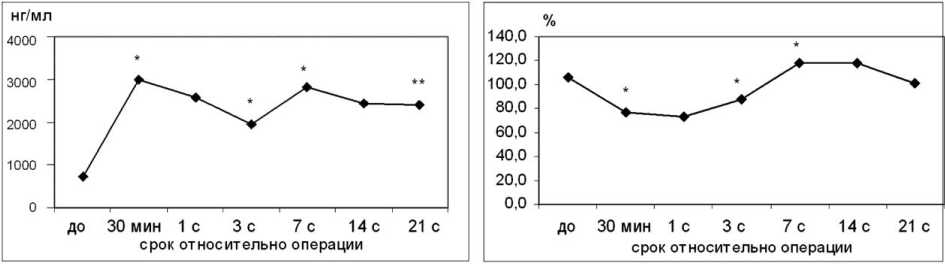
Интраоперационное усиление гемокоагуляционной активности приводило к компенсаторному усилению фибринолиза, о чем свидетельствовало практически пятикратное увеличение концентрации продуктов плазминовой деградации фибрина (рис. 3, а) и снижение на 29 % уровня плазминогена (рис. 3, б).
Полученные данные указывают на высокую активность всех звеньев плазменного гемостаза непосредственно после эндопротезирования крупных суставов и повышенный риск нарушения равновесия в их функционировании, что может приводить к развитию тромботических осложнений при существенном сдвиге в сторону свертывания и к кровоточивости в случае сдвига в сторону фибринолиза [9].
Через сутки после операции активность про- цессов свертывания существенно понижается, о чем свидетельствует уменьшение концентрации комплекса ТАТ (рис. 1, а). Вместе с тем, с 1-х суток увеличивается уровень белка острой фазы воспаления фибриногена (рис. 4, а). К 3-м суткам концентрация фибриногена достигает максимума и сохраняется на высоком уровне до 7-х суток. Это существенно усиливает протромбо-тический статус, так как происходит увеличение концентрации субстрата фибринообразования и повышается вязкость плазмы, тем самым ухудшаются реологические свойства крови.
Положительным фактором снижения тромбогенного риска является восстановление к 5-м суткам уровня физиологического антикоагулянта антитромбина (рис. 1, б).
С первых суток послеоперационного периода в формировании тромбогенного статуса усиливается вклад фибринолитического звена плазменного гемостаза с одновременным снижением геморрагического риска. После выраженной интраоперационной активации фибринолиза происходит его депрессия, что является физиологическим механизмом, направленным на сокращение кровопотери и следствием понижения активности плазминогена. О торможении фибринолиза свидетельствует снижение формирования Д-д (рис. 3, а) и увеличение времени эуглобулинового лизиса (рис. 4, б).
а
б
Рис. 1. Динамика ТАТ (а) и антитромбина (б) после эндопротезирования крупных суставов: * р<0,05 – различия достоверны по сравнению с предыдущим сроком, ** р<0,05 различия достоверны по сравнению с исходными данными
б
Рис. 2. Динамика АЧТВ (а) и ПВ (б) после эндопротезирования крупных суставов:* р<0,05 – различия достоверны по сравнению с предыдущим сроком, ** р<0,05 различия достоверны по сравнению с исходными данными
б
Рис 3. Динамика Д-д (а) и плазминогена (б) после эндопротезирования крупных суставов: * - р<0,05 - различия достоверны по сравнению с предыдущим сроком, ** - р<0,05 - различия достоверны по сравнению с исходными данными
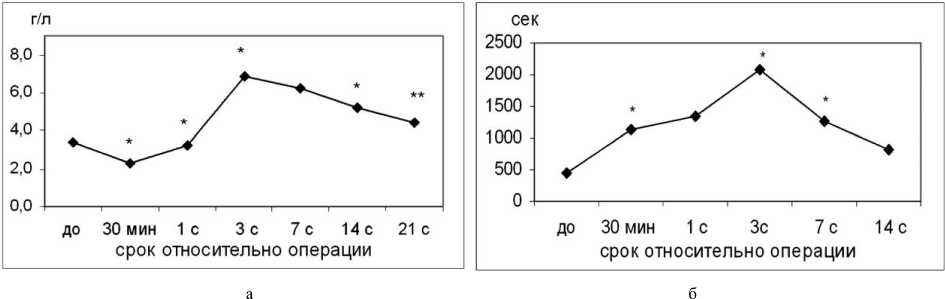
Рис. 4. Динамика фибриногена (а) и ХИа-зависимого фибринолиза (б) после эндопротезирования крупных суставов: * -р<0,05 - различия достоверны по сравнению с предыдущим сроком, ** - р<0,05 - различия достоверны по сравнению с исходными данными
На 7-е сутки содержание плазминогена не только восстанавливалось, но и превышало до-операционные значения (рис. 3, б). Это приводило к усилению репарационного фибринолиза и выражалось в повторном увеличении продукции Д-д (рис. 3, а), снижении времени эуглобулинового лизиса (рис. 4, б), что положительно влияло на уменьшение тромбогенного риска. Через неделю после операции тромбинемия существенно понижалась (рис. 1, а).
На 14-е сутки повышенная концентрация острофазного фибриногена (рис. 4, а) имела существенный сдвиг к нормализации. Таким образом, уменьшался тромбогенный риск, связанный с плазменным звеном гемостаза в целом по группе. Однако анализ индивидуальной вариабельности концентрации комплекса ТАТ через 14 суток после операции показал, что формирование тромбина снижалось до нормального уровня только у 16,4 % обследованных. Умеренная активация тромбинообразования (превышение нормы в 2 раза) выявлена у 58 % пациентов, 3-4 кратное превышение нормы сохранилось в 21,8 % случаев, более чем 5-кратное - у 3,6 % обследованных. Это свидетельствует о том, что более четверти пациентов на 14 -е сутки после эндопротезирования крупных суставов и по окончании срока, который отводится в большинстве рекомендаций для антитромботической профилактики [1, 10], сохраняют выраженный гиперкоагуляционный статус и нуждаются в пролонгировании антикоагулянтной терапии.
В целом по группе повышенное образование тромбина сохранялось до конца исследования, оставался повышенным и уровень фибриногена, что свидетельствует о сохранении гиперкоагуляционного состояния до трех недель после операции эндопротезирования.
ВЫВОДЫ
Таким образом, использование молекулярных маркеров позволило:
-
• выявить у пациентов с дегенеративнодистрофическими заболеваниями суставов предоперационную дисфункцию плазменного гемостаза, которая проявлялась в повышенной активности процессов свертывания и фибринолиза;
исследовать динамику фазовых изменений гиперкоагуляционного синдрома и вклад в его развитие различных звеньев плазменного гемостаза: значительную активацию свертывания, снижение антикоагуляционного потенциала и торможение фибринолиза после эндопротезирования крупных суставов;
проследить интенсивность тромбинемии, которая имела максимальную выраженность непосредственно после оперативного вмешательства и сохранялась до 14 суток у 83,6 % об- следованных после тотальной артропластики крупных суставов при использовании стандартной дозы НМГ.


