Молекулярные участники рецепторного пути регуляции апоптоза в опухолевых и нормальных лимфоцитах в условиях ингибирования белка теплового шока 90 in vitro
Автор: Рязанцева Н.В., Кайгородова Е.В., Новицкий В.В., Белкина М.В., Марошкина А.Н., Клименченко М.В., Таширева Л.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 (44), 2011 года.
Бесплатный доступ
Проведено исследование программированной гибели лимфоцитов, полученных у здоровых доноров, и опухолевых кле- ток линии Jurkat в условиях культивирования с селективным ингибитором Hsp90 (Heat shock protein - Hsp) 17-AAG. Оценку реализации апоптоза проводили методом флуоресцентной микроскопии с использованием FITC-меченного аннексина V и пропидий иодида. Активность каспазы-8 определяли спектрофотометрическим методом. Установлено, что ингибирование Hsp90 приводит к активации каспазы-8, увеличению числа клеток, презентрирующих TNFR1, что облегчает запуск програм- мированной гибели опухолевых клеток линии Jurkat.
Короткий адрес: https://sciup.org/14055897
IDR: 14055897 | УДК: (612.112.94+616.155.32)-091.818-092.4
Текст научной статьи Молекулярные участники рецепторного пути регуляции апоптоза в опухолевых и нормальных лимфоцитах в условиях ингибирования белка теплового шока 90 in vitro
Идентификация молекулярных механизмов эндогенной и экзогенной регуляции апоптоза, уравновешивающего эффекты клеточной пролиферации, элиминации поврежденных, функционально неполноценных и опухолевых клеток, является актуальным направлением фундаментальных исследований. Механизмы, участвующие в запуске и реализации апоптоза, весьма разнообразны [1, 4]. Известно, что после индукции апоптоза дальнейшая судьба клетки – гибель или выживание – зависит от наличия или активации многочисленных модуляторов программированной клеточной гибели. К числу последних относятся белки теплового шока (Heat shock proteins – Hsps). Данные протеины принимают участие в формировании трехмерной конформации вновь синтезированных полипептидов; поддержании функциональной активности внутриклеточных белков и элиминации поврежденных белковых молекул, а также в осуществлении транспорта через клеточные мембраны, процессах ассоциации-диссоциации внутриклеточных надмолекулярных комплексов, защите белков от агрегации [8]. Роль Hsps в апоптозе неоднозначна: в одних случаях они обеспечивают выживание клетки, а в других – способствуют ее гибели [4, 5].
Одним из представителей семейства белков теплового шока является Hsp90. Известно, что белок теплового шока 90 обладает преимущественно антиапоптотическим эффектом и имеет большое значение в регуляции рецепторного и митохондриального путей апоптоза [9, 11]. Рецептор-опосредованный путь апоптоза может запускаться при связывании специфических лигандов c рецепторами семейства фактора некроза опухоли (TNF), расположенными на плазматической мембране [13]. Презентация рецепторов на плазматической мембране осуществляется при помощи молекулярных шаперонов, к группе которых относится белок теплового шока Hsp90 [10]. Также показано, что Hsp90 и Hsp70 регулируют функции комплекса IKK (IκB (inhibitors of NF-κB) kinase), являющегося основным активатором NF-kappaB. Белки теплового шока приводят к диссоциации комплекса IKK, что подавляет NF-kappaB-опосредованную трансдукцию сигнала [12]. Повышенная экспрессия Hsp90 может рассматриваться среди причин устойчивости трансформированных клеток к апоптогенным сигналам [6, 7]. Наряду с этим остаётся нерешённым вопрос о молекулярных механизмах участия вышеуказанного шаперона в регуляции апоптоза опухолевых и нормальных клеток.
В связи с этим целью настоящей работы явилась оценка экспрессии молекулярных участников рецепторного пути апоптоза (TNFR1,TNFα, sTNFR1, каспаза-8) в опухолевых и нормальных лимфоцитах при ингбировании белка теплового шока 90 in vitro.
Материалы и методы
В качестве материала исследования были использованы опухолевая клеточная линия Jurkat (Т-лимфобластного лейкоза человека), полученная из Российской коллекции клеточных культур Института цитологии РАН (г. Санкт-Петербург), и мононуклеарные лейкоциты, выделенные из крови относительно здоровых доноров (11 мужчин и 16 женщин в возрасте от 18 до 45 лет).
Культивирование опухолевых клеток линии Jurkat проводили суспензионным методом в полной питательной среде, содержащей 90 % RPMI-1640 («Вектор-Бест», Россия), 10 % эмбриональной телячьей сыворотки («Invitrogen», США), инактивированной при 56°С в течение 30 мин, 0,3 мг/мл L-глутамина («Вектор-Бест», Россия) и 100 мкг/мл гентамицина («INS», США) при температуре 37°С и в 5 % атмосфере СО2. Клетки поддерживали в логарифмической фазе роста и пересаживали через 3 сут. Ингибирование белка теплового шока Hsp90 в клетках осуществляли с помощью добавления в культуральную среду 17-аллиламино-17-деметоксигелданамицин (17-AAG) («Sigma Aldrich», США) в концентрации 5,0 мкМ.
Выделение мононуклеарных лейкоцитов проводили методом градиентного центрифугирования в стерильных условиях из венозной гепаринизированной крови на градиенте плотности (ρ=1,077 г/см3) Ficoll-Paque (‹‹Pharmacia››, Швеция) в соотношении 1:2. Оценку апоптоза проводили методом флуоресцентной микроскопии на микроскопе «Axiostar plus» («Carl Zeiss», Германия) с использованием FITC-меченного аннексина V и пропидий иодида («Abcam», Великобритания) согласно инструкции фирмы-производителя.
Уровень фосфорилированной и нефосфо-рилированной формы Hsp90 в опухолевых и нормальных лимфоцитах определяли методом вестерн-иммуноблоттинга, используя первичные моноклональные антитела к белкам Hsp90-фосфо-S226 и Hsp90 («Abcam», Великобритания) и вторичные антитела, конъюгированные с HRP. Детекцию результатов осуществляли с помощью хемилюминесцентного субстрата Novex («Invitrogen», США) на рентгеновской пленке («Kodak X-ray film», США). Вывод о содержании исследуемого белка в клетке делали по изменению отношения величины сигнала метки искомого белка к величине сигнала с фермента глицеральдегид-3-фосфатдегидрогеназы, используя программное обеспечение TotalLab. Результаты выражали в условных единицах.
Количество TNFR1-презентирующих клеток
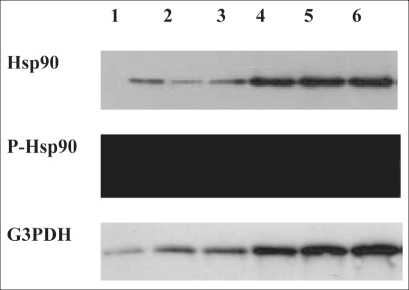
Рис. 1. Вестерн-блоттинг белка теплового шока Hsp90 в опухолевых и нормальных лимфоцитах. Примечание: 1–3 – лизаты мононуклеарных лейкоцитов здоровых доноров; 4–6 – лизаты опухолевых клеток линии Jurkat;
G3PDF-глицеральдегид – 3 – фосфатдегидрогеназа определяли методом проточной цитофлуори-метрии с помощью набора моноклональных антител к человеческому антигену CD120 («Invitrogen», США) на цитофлуориметре FACS-Canto II («Becton Dickinson», США). Результаты выражали в % от общего числа клеток.
Уровнь sTNF-R и TNFα в супернатантах опухолевых клеток Jurkat оценивали методом иммуноферментного анализа по протоколу фирмы-производителя («Bender MedSystem», Австрия). Измерения проводили при 450 нм на микропланшетном фотометре Multiscan EX («Thermo Labsystem», Финляндия). Количество sTNF-R и TNFα в супернатантах опухолевых клеток линии Jurkat определяли по калибровочной кривой и выражали в нг/мл.
Активность каспазы-8 определяли с помощью спектрофотометрического метода согласно инструкции фирмы-производителя («Abcam», Великобритания). Анализ основан на спектрофотометрической детекции хромофора р-nitroanilide (p-NA), который отщепляется под действием каспазы-8 из субстрата IETD-pNA. Эмиссию света pNA измеряли при длине волны 400 и 405 нм. Результаты выражали в коэффициентах активности каспазы-8, соответственно, показывающих соотношение прироста оптической плотности pNA опытных и контрольных образцов с учетом содержания белка в пробе. Концентрацию белка в пробе определяли методом Бретфорда.
Полученные данные обрабатывали методами вариационной статистики. Проверку нормальности распределения количественных показателей проводили с использованием критерия Шапиро-Вилка. Достоверность различий оценивали с помощью непараметрического критерия Манна–Уитни (для выборок, подчиняющихся ненормальному закону распределения) и двухвыборочного критерия Стьюдента (для выборок, подчиняющихся нормальному закону распределения). Данные представлены в виде медианы (Ме), верхнего и нижнего квартилей (Q1-Q3). Статистически значимыми различия считались при р<0,05.
Результаты и обсуждение
На первом этапе работы с помощью вестерн-блоттинга было оценено внутриклеточное содержание фосфорилированной и нефосфори-лированной формы Hsp90 в опухолевых и нормальных лимфоцитах. Результаты исследования показали повышенное количество фосфорилированной (активной) формы Hsp90 в опухолевых клетках линии Jurkat (7,01 (6,18-7,91) усл.ед.) по сравнению с мононуклеарными лейкоцитами, полученными из крови относительно здоровых доноров, где данная форма белка теплового шока 90 практически не обнаруживалась. Уровень нефосфорилированной формы Hsp90 в клетках Jurkat и мононуклеарных лейкоцитах не различался (5,83(5,62-6,16) усл. ед. и 4,67(4,426,86) усл.ед. соответственно) (рис. 1).
Известно, что опухолевые клетки в процессе канцерогенеза вырабатывают собственные защитные белки, вследствие чего они значительно отличаются от нормальных клеток организма, в том числе и по способности вступать в апоптоз. Одним из важнейших антагонистов проапоптоз-ных молекул в процессе программированной клеточной смерти является белок теплового шока Hsp90 [1, 4, 5].
В этой связи на втором этапе исследования нами была проведена оценка количества апоп-тотически измененных клеток линии Jurkat и мононуклеарных лейкоцитов в условиях их культивирования со специфическим ингибитором Hsp90 17-AAG в концентрации 5мкМ. При исследовании апоптоза в интактных опухолевых клетках линии Jurkat было обнаружено, что число апоптотически измененных клеток составляет 4,99 (1,78–6,38) %. Добавление в
Таблица
Изменения молекулярных показателей рецепторного пути апоптоза опухолевых клеток линии Jurkat при действии ингибитора Hsp90 in vitro Mе (Q1-Q3)
|
Показатели |
Интактная культура Jurkat |
Культивирование опухолевых клеток линии Jurkat с 5мкМ 17-AAG |
|
TNF-R1, % |
3,80 (1,80–7,20) |
21,90 (20,30–27,250) р<0,05 |
|
sTNF-R, нг/мл |
1,715 (1,655–1,880) |
1,685 (1,670–1,745) р>0,05 |
|
TNFα, нг/мл |
0,058 (0,024–0,069) |
0,040 (0,031–0,053) р>0,05 |
|
Активность каспазы-8, усл. ед. |
0,53 (0,46–0,58) |
1,00 (0,98–1,30) р<0,05 |
Примечание: р– статистическая значимость различий по сравнению с аналогичным показателем в интактной культуре.
среду культивирования 5мкМ ингибитора 17-AAG приводило к увеличению числа клеток в апоптозе до 25,96 (18,62–30,78) % (р1<0,05) по сравнению с интактной культурой. Повышение экспрессии белка теплового шока Hsp90 подавляет программированную клеточную смерть, так как данный шаперон регулирует активность многих транскрипционных факторов, способствующих выживанию клеток [9]. Действие ингибитора Hsp90 сопровождается проведением «смертельных» сигналов внутрь клетки и повышением активности эффекторных каспаз, что неизбежно приводит к увеличению уровня клеток, вступивших в апоптоз [1]. Именно эта способность Hsp90 положена в основу разработки противоопухолевых лекарств на основе ингибиторов Hsps [3]. Анализ содержания апоптотически измененных клеток в культуре мононуклеарных лейкоцитов у здоровых доноров не выявил достоверных различий между интактной культурой и при добавлении ингибитора Hsp90 in vitro – 19,13 (13,84–22,10) % и 22,44 (20,93–23,59) % соответственно.
На третьем этапе исследования для оценки молекулярных механизмов рецепторного пути регуляции апоптоза клеток в условиях действия ингибитора Hsp90 in vitro были оценены TNFR1,TNFα, sTNFR1 и каспаза-8 (таблица). Было показано, что добавление в культуру опухолевых клеток линии Jurkat селективного ингибитора 17-AAG в концентрации 5мкМ увеличивало в 7 раз количество клеток, презентирующих на своей поверхности TNF-R1, по сравнению с интактной культурой. Однако содержание TNFα и sTNF-R в культуральной среде не изменялось.
Одним из главных молекулярных участников рецептор-опосредованного пути апоптоза является каспаза-8 [2]. Было установлено, что при действии ингибитора Hsp90 17-AAG активность каспазы-8 в опухолевых клетках линии Jurkat повышается (р<0,05). Исходя из полученных данных, можно заключить, что белок Hsp90 влияет на активацию инициаторной каспазы-8. Нами высказано предположение, что Hsp90 регулирует рецепторный путь реализации апоптоза не только через RIP, Akt, NF-κB [4], но и напрямую, ингибируя превращение прокаспазы-8 в активную форму.
Таким образом, в опухолевых клетках линии Jurkat, в отличие от мононуклеарных лейкоцитов, полученных у здоровых доноров, повышено содержание фосфорилированной формы белка Hsр90, играющей в опухолевых клетках антиапоптотическую роль. Действие специфического ингибитора Hsр90 17-AAG на культуру клеток линии Jurkat приводило к возрастанию активности каспазы-8, увеличению количества TNF-R1- презентирующих клеток. В связи с этим с практической точки зрения возможность влиять на противоапоптотическую роль Hsp90 в опухолевых клетках с помощью его ингибиторов, например 17-AAG, представляет большой интерес для разработки новых подходов в тар-гетной терапии онкологических заболеваний.
Работа выполнена в рамках Федеральной целевой программы «Научные и научнопедагогические кадры инновационной России»
на 2009–2013 г. (ГК П1203; ГК 02.740.11.0311), поддержана грантами Carl Zeiss, РФФИ (№ 0904-99025) и Совета по грантам при Президенте РФ (ГК№ 02.120.11.3842-МД, МК-480.2011.7).


