Мониторинг динамики активности злокачественного роста методом структурного анализа неклеточной ткани
Автор: Шабалин В.Н., Шатохина С.Н., Дедова М.Г.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 3, 2021 года.
Бесплатный доступ
Исследован состав биокристаллических структур (анизоморфонов) сыворотки крови больных раком гортани, которые формируются при переходе сыворотки крови в твердую фазу в процессе ее краевой дегидратации. Выявленные анизоморфоны представляют собой три вида маркерных структур: маркер активного роста злокачественной опухоли - агрегация макросферолита и зернистого микросферолита с одинаковой степенью анизотропии; маркер дегенеративно-дистрофического процесса - агрегация макросферолита с низкой степенью анизотропии и микросферолита с высокой степенью анизотропии; маркер прогрессии злокачественного роста - волнистый микросферолит вне агрегации. Цель - выявить диагностические маркеры активности злокачественного процесса в структурах твердой фазы сыворотки крови больных раком гортани и оценить их значение для выбора эффективного вида лечения. Материалы и методы. В качестве основного метода исследования использован метод краевой дегидратации сыворотки крови, являющийся разделом диагностической технологии «Литос-система» (Разрешение ФС № 155 от 2009 г. на применение в клинической практике). Результаты. Показано, что фаза развития рака гортани (активный рост или дегенеративно-дистрофический процесс) служит важным критерием выбора вида лечения: в фазу дегенеративнодистрофического процесса опухоли наиболее благоприятный эффект дает хирургическое лечение, а в период активной фазы злокачественного роста - лучевая терапия.
Рак гортани, сыворотка крови, краевая дегидратация биологических жидкостей, маркеры фазы активности опухолевого роста
Короткий адрес: https://sciup.org/14121670
IDR: 14121670 | УДК: 616-006.04 | DOI: 10.34014/2227-1848-2021-3-89-96
Текст научной статьи Мониторинг динамики активности злокачественного роста методом структурного анализа неклеточной ткани
Введение. Рак гортани является наиболее частым видом злокачественных опухолей лор-органов [1]. Ежегодно в России первичный рак гортани устанавливают у 6–7 тыс. пациентов [2]. В последние годы разработаны новые подходы к лечению и реабилитации больных раком гортани, как консервативные, так и хирургические. Однако вопрос о выборе метода лечения остается дискутабельным [3]. Успех лечения онкологических больных во многом зависит от стадии выявления опухоли [4]. В связи с тем что в 30-35 % случаев заболевание протекает бессимптомно, диагностика злокачественного роста запаздывает [5, 6]. В то же время опухолевый процесс имеет фазовое течение: активная фаза сменяется фазой покоя. Фаза активности опухолевого роста имеет принципиальное значение для выбора вида лечения. На сегодняшний день не существует общепризнанного молекулярного маркера, позволяющего с высокой долей вероятности прогнозировать инвазию и метастазирование опухоли у больных раком гортани [7].
Разработанная нами новая технология диагностики различных видов патологических процессов, в т.ч. и злокачественного роста, базирующаяся на морфологических признаках структур неклеточных тканей организма -биологических жидкостей, открывает значительные перспективы. При исследовании структур сыворотки крови больных с различной локализацией опухолей (т.е. с помощью нового вида жидкостной биопсии) нами были открыты морфологические маркеры доброкачественной и злокачественной неоплазии [8], показано соотношение процессов пролифера- ции и дегенерации в течении злокачественного роста [9].
Цель исследования. Выявить диагностические маркеры активности злокачественного процесса в структурах твердой фазы сыворотки крови больных раком гортани и оценить их значение для выбора эффективного вида лечения.
Материалы и методы. Под наблюдением находились 64 больных раком гортани в возрасте от 47 до 83 лет, среди них было 59 мужчин и 5 женщин. По данным гистологического заключения у всех больных диагностирован плоскоклеточный рак. По стадиям заболевания: Т1N0М0 – 4 чел., Т2N0M0 – 19, Т3N0M0 – 32, Т3N2М0 – 5, Т4N0М0 – 4.
В качестве основного метода исследования использован метод краевой дегидратации сыворотки крови, являющийся разделом диагностической технологии «Литос-система» (разрешение ФС на применение новой медицинской технологии № 2009/155 от 15 июня
2009 г.). Взятие крови у пациента проводили натощак из локтевой вены в объеме 2 мл. Кровь собирали в сухую пробирку (без стабилизатора), после свертывания центрифугировали при 3000 об/мин в течение 10 мин. Полученная сыворотка крови являлась основным объектом исследования. Полуавтоматической пипеткой-дозатором наносили каплю сыворотки крови (0,02 мл) в аналитическую ячейку тест-карты ТК4 (рис. 1), накрывали покровным стеклом. Далее тест-карты выдерживали в течение 7 сут при температуре 20–25 °С и относительной влажности 55–60 %. При этом в процессе медленного перехода в твердую фазу в сыворотке крови формировались отдельные биокристаллы (морфоны). Морфоны могли иметь изо- или анизотропную структуру. В настоящей работе нас интересовали только анизоморфоны. Их исследование проводили с помощью микроскопа DM2500 фирмы Leica в поляризованном свете при увеличении ×100, ×200, ×400, ×800.
Рис. 1. Тест-карта (ТК4) диагностического набора «Литос-система»
Fig. 1. Test card (TC4), "Litos-system" diagnostic kit
Исследование анизоморфонов сыворотки крови больных раком гортани проводили периодически на протяжении всего периода наблюдения: при поступлении пациента в стационар, в процессе лучевой терапии – после доз 46 и 70 Гр, при хирургическом вмешательстве – до и в послеоперационном периоде, да- лее при амбулаторном наблюдении – через каждые 1–2 мес. на протяжении двух лет.
Статистическую обработку полученных данных проводили при помощи программы Statistica for windows v.8.0. Для концевых точек (0 и 100 %) применялся t-критерий Стьюдента с поправкой на концевые точки. Для вы- явления зависимости эффективности лечения от исходного состояния опухолевой ткани (активный рост или дегенеративно-дистрофическое состояние) использовался корреляционный анализ Пирсена (r).
Результаты и обсуждение. При поступлении в стационар анизоморфоны сыворотки крови больных раком гортани были представлены двумя видами: маркером злокачественного роста (МЗР) и маркером дегенеративнодистрофического процесса (МДД) [10].
МЗР представлял собой агрегацию базисного сферолита, в центре которого располагался микросферолит с зернистой структурой (рис. 2а). Данная агрегация имела равномерную степень выраженности анизотропии. МДД также был представлен агрегацией базисного сферолита с зернистым микросферолитом. Однако отличие этой агрегации от МЗР состояло в более низкой степени анизотропии базисного сферолита при резко выраженной анизотропии встроенного в него микросферолита, который имел вид ярко светящегося «глазка» (рис. 2б).
При первичном исследовании 64 больных раком гортани МЗР был выявлен у 36 (56 %), а МДД – у 28 (44 %) чел. На основании клинико-лабораторных показателей 23 больным было проведено хирургическое лечение, а 41 больной получил курс лучевой терапии по радикальной программе. В ходе дальнейших исследований в сыворотке крови наблюдаемых больных была отмечена смена видов ани-зоморфонов на этапах лечения и в процессе последующего амбулаторного наблюдения.
Сопоставление клинических данных и результатов морфологических исследований показало, что эффективность определенного вида лечения зависела от стадии развития опухолевого процесса, которая устанавливалась по онкомаркерам: МЗР и МДД (табл. 1).

а
Рис. 2. Анизоморфоны сыворотки крови:
а) маркер злокачественного роста; б) маркер дегенеративно-дистрофического процесса.
Ув. ×200. Микроскопия в поляризованном свете

б
-
Fig. 2. Blood serum anisomorphone:
-
a) malignant growth marker; b) marker degenerative-dystrophic process marker.
Zoom×200. Polarized light microscopy
Данные табл. 1 показывают значительные различия результатов хирургического лечения и лучевой терапии в зависимости от вида онкомаркеров в сыворотке крови больных раком гортани. Так, из 23 пациентов, которым было проведено хирургическое лечение, 14 пациентов имели МЗР. Из них 9 чел. после операции оставались живыми в течение двух лет наблюдения, а 5 погибли (трое – через 2 мес. после операции, 2 – через 4 и 6 мес.). Больные, в сыворотке крови которых выявлялся МДД (9 пациентов), оставались в живых в течение всего срока наблюдения.
Таблица 1
Table 1
Результаты лечения больных раком гортани в зависимости от вида структурных онкомаркеров в сыворотке крови
Treatment outcomes of laryngeal cancer patients depending on structural tumor markers in blood serum
|
Результат лечения Treatment outcomes |
Хирургическое лечение Surgical treatment (n=23) |
Лучевая терапия Radiotherapy (n=41) |
||
|
МЗР Malignant growth marker (n=14) |
МДД Degenerative-dystrophic process marker (n=9) |
МЗР Malignant growth marker (n=22) |
МДД Degenerative-dystrophic process marker (n=19) |
|
|
Положительный Positive |
9 |
9 |
22 |
8 |
|
Летальный исход Mortality |
5 |
0 |
0 |
11 |
В группе больных, получивших курс радикальной лучевой терапии (41 чел.), у 22 пациентов до начала лечения в сыворотке крови был выявлен МЗР. После проведенной лучевой терапии все они оставались в живых в течение всего срока наблюдения. У 19 пациентов до начала лечения был выявлен МДД. Здесь наблюдался значительно худший результат лечения: только 8 больных оставались живыми на конец срока наблюдения, а остальные 11 погибли: 7 – через 1–2 мес., 4 – через 5–7 мес. после проведенного курса лечения.
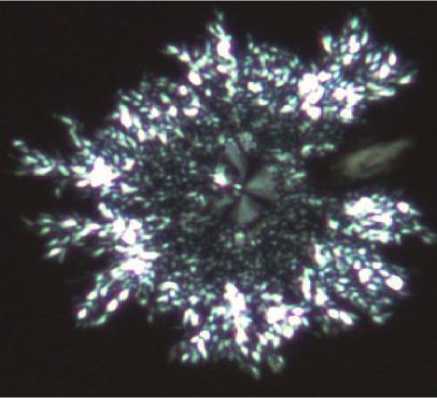
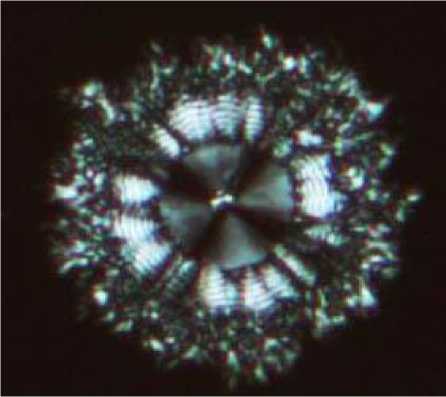
При исследовании морфологической картины сыворотки крови 11 больных раком гортани после курса лучевой терапии с последующим летальным исходом у всех были выявлены особые, не обнаруживаемые до лечения маркеры в виде волнистых микросферолитов (ВМС). Они располагались изолированно, т.е. не были встроены в базисные сферолиты, а вместо зернистости (рис. 3а) в них определялись волнообразные структуры (рис. 3б). Следует отметить, что у двух пациентов данный маркер обнаруживался одновременно с выявлением клинических признаков прогрессии злокачественного роста, а у девяти – на два месяца раньше их клинической манифестации. Появление ВМС в сыворотке крови больных после курса лучевой терапии указывает на продолженный рост опухоли. То есть используемая доза лучевого воздействия на опухолевую клетку, находящуюся в фазе покоя
(МДД) и имеющую резистентность к любым внешним воздействиям, оказывает не угнетающий, а стимулирующий эффект. Это вызывает мутацию исходного пула клеток с последующим возникновением более злокачественного клона. Структура ВМС формируется специфическими белковыми молекулами, которые вырабатываются клетками нового злокачественного клона. Наши исследования показали, что появление ВМС указывает на неблагоприятное течение онкологического процесса (р=0,043).
При сопоставлении результатов лечения больных с наличием МЗР выявлено, что эффективность лучевой терапии по сравнению с хирургическим лечением достоверно выше (р=0,02).
При сравнении результатов лечения больных с МДД установлена обратная зависимость: эффективность лучевой терапии оказалась достоверно ниже, чем при хирургическом лечении (р=0,01).
При помощи корреляционного анализа Пирсена в группах хирургического лечения выявлена прямая умеренная зависимость между фазой процесса в опухоли (злокачественный рост или дегенеративно-дистрофический процесс) и эффективностью лечения (r=0,447; р=0,013). В группе лучевой терапии установлена прямая зависимость между активностью опухоли и эффективностью лечения (r=0,247; р<0,05).
а
Рис. 3. Анизоморфоны сыворотки крови: а) зернистый микросферолит; б) волнистый микросферолит. Ув. ×800. Микроскопия в поляризованном свете
б
Fig. 3. Blood serum anisomorphone:
-
a) granular microspherolite; b) wavy microspherolite. Zoom×800. Polarized light microscopy
Таким образом, среди анизоморфонов сыворотки крови больных раком гортани выявлены три вида маркерных структур: маркер активного роста злокачественной опухоли (патологическая агрегация базисного сферолита и зернистого микросферолита с одинаковой степенью анизотропии); маркер дегенеративно-дистрофического процесса (аналогичная агрегация, но с низкой степенью анизотропии базисного сферолита при высокой анизотропии встроенного микросферолита); маркер прогрессии злокачественного роста (волнистый микросферолит вне агрегации).
Полученные результаты показывают, что состояние активности опухоли (активный рост или дегенеративно-дистрофический процесс) служит важным критерием выбора вида лечения: в фазу дегенеративно-дистрофического процесса рака гортани наиболее благоприятный эффект достигается при хирургическом лечении, а в период активной фазы зло- качественного роста – при помощи лучевой терапии.
Выводы:
-
1. Морфологическое исследование сыворотки крови больных раком гортани методом краевой дегидратации позволяет выявить специфические маркеры злокачественного роста, указывающие на фазу его активности.
-
2. При наличии в сыворотке крови больных раком гортани маркера дегенеративнодистрофического состояния опухоли показано хирургическое лечение, а выявление маркера активности злокачественного роста указывает на необходимость применения лучевой терапии.
-
3. Выявление в сыворотке крови больного раком гортани в процессе лучевой терапии маркерной структуры в виде волнистого микросферолита указывает на отрицательный результат лечения – продолженный рост опухоли.
Список литературы Мониторинг динамики активности злокачественного роста методом структурного анализа неклеточной ткани
- Раджабова З.А., Котов М.А., Эберт М.А., Митрофанов А.С., Раджабова М.А., Левченко Е.В. Распространенный рак гортани: обзор литературы. Сибирский онкологический журнал. 2019; 18 (5): 97-107. =-5-97-107. DOI: 10.21294/1814-4861-2019-18
- Каприн А.Д., Старинский В.В., Петрова Г.В., ред. Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М.; 2019. 250.
- Кожанов А.Л. Современные аспекты лечения и реабилитации больных при раке гортани. Опухоли головы и шеи. 2016; 6 (2): 17-26.
- Edge S.B., Bynd D.R., Compton C. C., Fritz A.L., Trolti A. Laryngs AJCC Cancer Staging Mfnual. 7th ed. New York: Springer; 2010: 57-62.
- Медведева А.А., Чернов В.И., Зельчан Р.В., Синилкин И.Г., Фролова И.Г., Чижевская С.Ю., Чойнзонов Е.Л., Черемисина О.В., Гольдберг А.В. Радионуклидные методы исследования в диагностике рака гортани и гортаноглотки. Сибирский онкологический журнал. 2017; 16 (6): 57-66.
- Paget-Boilly S., Cyr D., Luce D. Ocupational expozures and cancer of the larings-systematic review and meta analysis. J. Occup. Environ. Med. 2012; 54 (I): 71-84.
- Немцова М.В., Кушлинский Н.Е. Молекулярно-биологические маркеры в практической онкологии. Лабораторная служба. 2014; 3 (1): 14-22.
- Шатохина С.Н., Шабалин В.Н. Атлас структур неклеточных тканей человека в норме и патологии (в 3 томах). Т. II. Морфологические структуры сыворотки крови. М.; 2013. 238.
- Шатохина С.Н., Шабалин В.Н. Маркеры злокачественного роста в морфологической картине биологических жидкостей человека. Вестник онкологии. 2010; 3 (56): 293-300.
- Шабалин В.Н., Шатохина С.Н. Функциональная морфология неклеточных тканей человека. М.: РАН; 2019. 360.


