Морфо-функциональные механизмы ускорения восстановительных процессов в тканях после травматических повреждений в спорте
Автор: Вирник В.Л., Алексанянц Г.Д.
Журнал: Физическая культура, спорт - наука и практика @fizicheskaya-kultura-sport
Рубрика: Из портфеля редакции
Статья в выпуске: 3, 2022 года.
Бесплатный доступ
Актуальность. Экстремальные физические нагрузки в современном спорте сопровождаются ростом случаев спортивного травматизма. Для действующего спортсмена это означает вынужденный выход из тренировочного цикла, срыв графика соревнований, углубление общего стресса с высоким риском истощения адаптационных ресурсов резервов организма. Это привело к поиску новых технологий, радикального сокращения сроков лечения и реабилитации после травматических повреждений в спорте. Цель исследования - осветить историю фундаментальных исследований, нацеленных на практическое решение актуальных проблем спортивного травматизма и разработку на их основе методов ускорения восстановительных процессов в тканях после травматических повреждений в спорте. Материал и методы. Аналитический обзор целевых литературных источников библиотечного фонда Российского национального исследовательского медицинского университета им. Н.И. Пирогова (РНИМУ, Москва), фондов научной библиотеки eLIBRARY.RU и Российской научной электронной библиотеки CYBERLeninka.RU и пр. с глубиной обзора 26 лет (1995-2021). Результаты. Фундаментальные исследования крови и тонких механизмов кроветворения привели к открытию функциональной полимодальности тромбоцитов. Доказано, что они принимают непосредственное участие не только в механизме тромбоцитарного и коагуляционного гемостаза, но и в инициации и ускорении процессов репаративной регенерации в месте повреждения. Эти достижения стали возможны благодаря открытию в «альфа-гранулах» тромбоцитов биологически активных гликопротеинов, получивших общее название «факторов роста тромбоцитов» (PDGF). Проведенные исследования помогли обосновать, разработать и внедрить в практику спортивной медицины относительно простые методы сокращения сроков лечения. При ряде травм, осложненных переломами трубчатых костей, удалось добиться двукратного сокращения сроков лечения и реабилитации с оптимальным функциональным исходом. Заключение. Достижения фундаментальных наук открывают возможности широкого внедрения технологии PRP-терапии® в практику спортивной медицины и реабилитации. Большинство спортивных травм не имеют противопоказаний к методу PRP-терапии®, особенно, если они реализуются в условиях стационара. При легких травмах PRP-терапия® может успешно применяться врачами команд при соблюдении необходимых медико-санитарных стандартов непосредственно в период тренировок и соревнований.
Спортивные травмы, лечение, функциональная полимодальность тромбоцитов, факторы роста тромбоцитов, ускорение регенерации тканей, сокращение сроков реабилитации
Короткий адрес: https://sciup.org/142236561
IDR: 142236561 | УДК: 796.01:61 | DOI: 10.53742/1999-6799/3_2022_97_104
Текст научной статьи Морфо-функциональные механизмы ускорения восстановительных процессов в тканях после травматических повреждений в спорте
В соответствии с современными представлениями кровь является одной из самых уникальных тканей внутренней среды, которая на протяжении всей жизни обеспечивает организм транспортными, защитными и регуляторными функциями. Особый интерес вызывает вопрос происхождения и развития форменных элементов красной и белой крови. Согласно унитарной (монистической) теории кроветворения А.А. Максимова [4] все формы клеток крови происходят от одной стволовой полипотентной клетки, дающей начало всем ее росткам. Эти клетки обладают невысоким потенциалом пролиферативной активности и в течение жизни человека совершают не более 100 митозов. Происходящие от стволовой клетки дифференцирующиеся полустволовые клетки дают начало разновидностям колониеобразующих клеток (KOE), каждая из которых, в свою очередь, дает последовательность созревающих клеток определенного типа, так называемый диф-фероны. Одним из них является дифферон КОЕ-МегЭ, дающий начало эритроцитарной и тромбоцитарной ветвям кроветворения. Тромбоцитарная ветвь кроветворения проходит последовательные стадии созревания от мегакариобласта до промегакариоцита и далее от мегакариоцита I, II и III стадий зрелости до зрелого тромбоцита. Мегакариоцит III стадии зрелости является материнской клеткой дефинитивных, высокодифференцированных клеток крови – зрелых тромбоцитов. Один зрелый мегакариоцит может создать до 800 зрелых тромбоцитов. Они покидают красный костный мозг и попадают в общий кровоток как самостоятельный форменный элемент крови. Общим свойством клеток дифферона КОЕ-МегЭ является то, что их дефинитивные формы (эритроциты и тромбоциты) являются безъядерными клеточными формами и поэтому не способны к размножению и имеют весьма ограниченный срок жизни. Например, эритроцит проходит свой полный жизненный цикл в среднем за 100120 дней, а тромбоцит работает не более 10 дней. Если бимодальная функция эритроцитов хорошо изучена как встречный аэрогематический и гистогематический газообмен молекулярного кислорода и углекислого газа, то функции тромбоцитов оказались существенно более разнообразными и многочисленными. Участие тромбоцитов в гемостазе известно со времен Giulio Bizzozero[14]. Новейшие открытия непосредственного участия тромбоцитов в активации и управлении процессами гистогенеза, дифференцировки и регенерации клеток привлекло пристальное внимание современных морфологов, физиологов, молекуляр- ных биологов, клиницистов и специалистов в области спортивной медицины [1-5,11,15]. В настоящее время известно, что функциональная полимодальность зрелых тромбоцитов обусловлена генетическим кодом мегакариоцитов, уникальным способом размножения тромбоцитов и особенностями их структурно-функциональной организации.
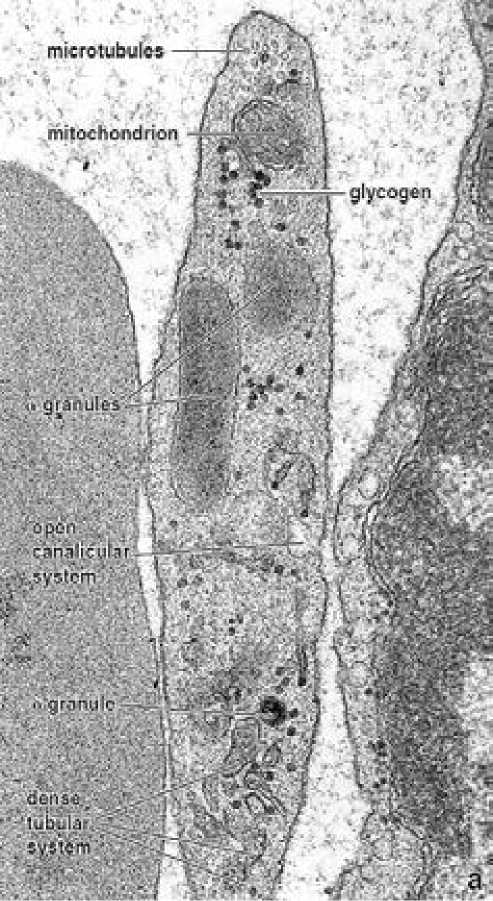
Рисунок 1. Неактивный тромбоцит (х 30.000) дисковидной формы в центре между эритроцитом слева и эндотелиоцитом сосуда справа [13, с.288]
В зоне органелл неактивного дисковидного тромбоцита находятся митохондрии, открытая канальцевая система (OCS), глыбки гликогена и характерные гранулы «α-альфа», «δ-сигма» и «γ-гамма» типов. Гранулы «α-альфа» типа самые крупные и многочисленные. Они содержат важнейшие факторы свертывания крови: фибриноген, плазминоген, активатор плазминогена, тромбокиназу и пр.. Установлено также, что в гранулах«α-альфа» типа содержаться так называемые тромбоцитарные факторы роста (PDGF – (англ. Platelet-Derived Growth Factor).
Это биологически активные димерные гликопротеины, которые синтезируются и накапливаются в шероховатом эндоплазматическом ретикулуме гигантских полиплоидных мегакариоцитов и к моменту отрыва от них молодых тромбоцитов оказываются заключенными в их альфа гранулах. В одном тромбоците может содержаться до 1000 молекул PDGF. С помощью рецепторного тиразиназного механизма PDGF способны активировать пролиферативную фазу реактивного воспаления в зоне повреждения. Димерные гликопротеины PDGF в гранулах «α-альфа» типа обладают уникальной плюрипотентной биологической активностью, которая может проявится только внеклеточно после активации и дегрануляции тромбоцитов, например, в случае травмы сосудистой стенки, в присутствии тромбина, фактора Виллебранда или ионов кальция. Пока PDGF находятся внутри неактивных тромбоцитов, они не доступны для окружающих клеток и биологически инертны. Как митогены они стимулируют митотическое деление и размножение клеток мезенхимального происхождения, содержащих на своей поверхности специфические рецепторы к PDGF. К таким клеткам относятся фибробласты, остеобласты, гладкомышечные клетки, эндоте-лиоциты сосудов и клетки нейроглии. PDGF работают как хемоаттрактанты. В очаге воспаления они ускоряют синтез коллагена и основного матрикса фибробластами соединительной ткани. PDGF также являются факторами выживания клеток. При активации и дегрануляции тромбоцитов PDGF массировано поступают в очаг патологического процесса, где работают через α и β рецепторы в качестве свои активных центров. У эмбрионов PDGF координируют процессы эмбрио- и фетоге-неза, предупреждают развитие врожденных аномалий и пороков. У взрослых тромбоцитарные факторы роста стимулируют заживление ран, управляют тонусом регуляторных сосудов в системе гемомикроциркуляции, регулируют водно-электролитый и кислотно-основной баланс интерстициальной жидкости в механизме образования лимфы и микролимфоциркуляции. В настоящее время кроме факторов роста тромбоцитов, PDGF, открыты факторы роста эндотелия сосудов,VEGF (Vascular endothelial growth factor), фактор роста фибробластов, FGF (Fidroblast Growth Factor), эпидермальный фактор роста, EGF (Epidermal Growth Factor), трансформирующий ростовой фактор бета, TGF-b (Transformative Growth Factor-b), инсулиноподобный фактор роста, IGF (Insulin-like Growth Factor),
При одновременном воздействии на ткани нескольких факторов роста, например PDGF и EGF, наблюдается аддитивный репаративный эффект. В зоне травмы, кровотечения и тромбообразования «факторы роста» выходят на поверхность гликокаликса тромбоцитов в результате ретракции и пространственной реорганизации цитоскелета. Реактивный процесс на поверхности фибриновых нитей превращает поверхность тромба в реакционную зону – стартовую площадку регенерации [21].
Физиологическая активность факторов роста изучена достаточно хорошо. Например, фактор роста фибробластов (FGF)–стимулирует пролиферацию и дифференцировку фибробластов в тканях различной специализации. Доказано участие фактора роста тромбоцитов (PDGF) в активации заживления ран различной природы и локализации. Эпидермальный фактор роста (EGF) стимулирует пролиферацию и дифференцировку клеток пограничных тканей. Фактор роста эндотелия сосудов (VEGF) участвует в эмбриональном неоваскулогенезе, в постнатальном неоангиогенезе и в механизме роста новых капилляров в скелетной мускулатуре в состоянии рабочей гипертрофии.
В цитоплазме тромбоцитов гранулы «δ-сигма» содержат биологически активные молекулы АТФ, АДФ, серотонин, гистамин, тромбоксан А2, тромбокиназу. Они тонко регулируют процессы гемостаза и реактивного воспаления в зоне травмы. Серотонин оказывает мощное сосудосуживающее действие, уменьшая кровоток и кровопотерю в месте повреждения. Тромбаксан, АДФ и АТФ ускоряют агрегацию тромбоцитов, ретракцию и фиксацию гемостатической пробки. Гистамин как медиатор воспаления создает воспалительный барьер, отграничивающий зону повреждения от окружающих здоровых тканей [13].
Гранулы «γ-гамма» являются лизосомами и содержат гидролитические ферменты. После восстановления целостности эндотелиальной выстилки и стенки сосуда в целом гидролазы лизосом обеспечивают резорбцию фибриновой пробки – фибринолиз. В плазме крови тромбоциты и биологически активные биополимеры распределены достаточно равномерно. Это обеспечивает равнодоступность всех элементов сосудистой системы к гемостазу при кровотечениях различной природы и локализации [8].
Способность тромбоцитарных факторов роста стимулировать и ускорять регенерацию поврежденных тканей побудила ученых разработать технологии ускорения репаративно-восстановительных процессов. Известны такие технологии как PRP-терапии® (plateletrich plasma – обогащенная тромбоцитами плазма) [1] и Плазмолифтинг™ [2, 3]. Обе технологии применяют для использования тромбоцитарных факторов роста с целью сокращения сроков лечения и реабилитации.
Различия удельного веса и плотности форменных элементов крови позволяют разделить их на фракции за счет разной скорости осаждения (седиментации) под действием сил гравитации. В клинической практике этот феномен используется для определения скорости оседания эритроцитов (СОЭ). Самые тяжелые форменные элементы крови, эритроциты, располагаются внизу, на дне пробирки, над ними располагается фракция лейкоцитов, а еще выше – фракция тромбоцитов. Четвертую, самую легкую фракцию, составляют растворенные в сыворотке крови плазменные белки. Таким образом, искомая фракция тромбоцитов располагается на дне фракции плазмы. В норме содержание тромбоцитов в крови у взрослых от 180 до 320 тыс. в 1 мм3, у новорожденных – от 200 до 400 тыс. в 1 мм3. В случае принудительного обогащения фракции тром-
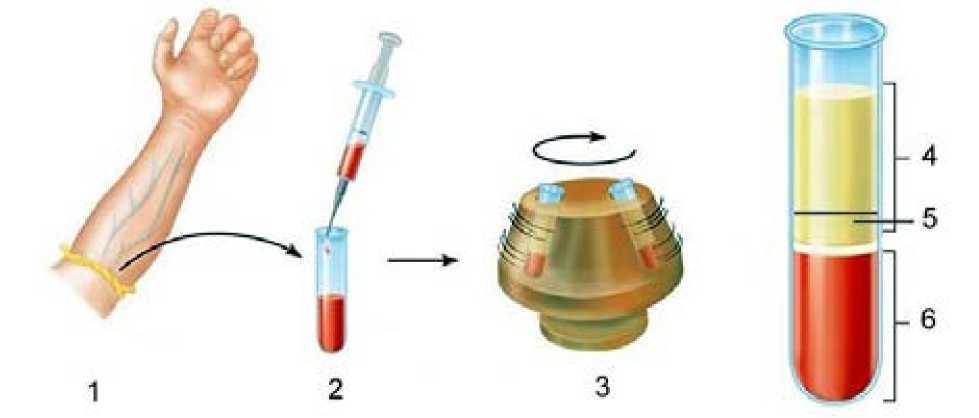
Рисунок 2. 1, 2 – забор венозной крови в стерильную вакуумированную пробирку, 3 – центрифугирование крови при 3000 об/мин в течение 5 минут, 4 – фракция плазмы бедная тромбоцитами (PPP), 5 – фракция плазмы, богатая тромбоцитами (PRP), фракция эритроцитов и лейкоцитов под сепарационным гелем.
боцитов с помощью центрифугирования их содержание у взрослых примерно в 4 раза выше нормы и достигает 1000-1200 в 1 мм3.
Для получения обогащенной тромбоцитами плазмы применяется технология Plasmolifting™ [ 3 ] см. рисунок 2.
На первом этапе проводится забор 8 мл венозной крови из локтевой вены и помещается в пробирку. Пробирка изготовлена из борсиликатного стекла, содержит гепаринат натрия в качестве антикоагулянта и специальный сепарационный гель для разделения форменных элементов крови от плазмы с тромбоцитами. Пробирка с кровью герметично закрыта пробкой из геморепеллентного (отталкивающего кровь) полимера.
На втором этапе пробирка с кровью помещается в лабораторную центрифугу и центрифугируется при 3000 об/мин в течение 5 минут.
На третьем этапе визуально оценивается результат седиментации элементов крови в центробежном поле. В норме эритроциты и лейкоциты располагаются на дне пробирки под разделительным гелем, а плазма и тромбоциты – над ним. Самый нижний слой плазмы высотою примерно 2-3 мм над сепарационным гелем – это фракция плазмы, обогащенная тромбоцитами (plateletrichplasma – PRP). Выше нее располагается фракция, обедненная тромбоцитами (platelet-poorplasma–PPP). Рисунок 2.
На четвертом этапе фракции тромбоцитов извлекают из пробирки двумя способами. В первом случае одноразовым стерильным шприцем с удлиненной иглою извлекается только обогащенная тромбоцитами фракция (PRP) объемом до 0,5-0,7 мл. Во втором случае извлекаются обе фракции, т.е. вся отцентрифугированная плазма с тромбоцитами, объемом около 4,0 мл. Выбор вида фракции плазмы для лечения определяются врачом. Например, для введения в периартикулярные ткани, сумки или в полость коленного сустава исполь- зуется максимальный объем биологически активной плазмы. В других случаях, когда требуется сфокусировать лечебный эффект в сравнительно небольшом тканевом объеме, например в точке энтезопатии ахиллова сухожилия, используется только обогащенная PRP-фракция плазмы объемом до 0,7 мл. [11,12]. В дермато-косметологии при проведении процедур омоложения кожи лица и декольте методом плазмолифтинга, как правило, используют обе фракции плазмы с фактором роста фибробластов. Они стимулируют пролиферацию фибробластов, ускоряют синтез и секрецию в субэпидермальный слой молодого коллагена и гиалуроновой кислоты с эффектом гидратации увядающей кожи.
Процедуры плазмолифтинга проводятся в специально подготовленных медицинских помещениях по стандартам процедурного или хирургического кабинетов. Плазмолифтинг могут проводить врачи разных специальностей в зависимости от области ее применения. В настоящее время технология плазмолифтинга успешно применяется во многих отраслях современной медицины. В 90е годы она впервые начала применяться в челюстно-лицевой и пластической хирурги. В трансплантологии PRP-терапия широко применяется при ауто– и ксенотрансплантации костей, где доказано существенное ускорение процессов приживления донорских тканей и имплантов. Для правильного понимания особенностей технологии PRP-терапии™, изучения ее норм, правил и стандартов необходимо пройти профильное обучение и специализацию [3].
В 2009 году в журнале Американской академии ортопедической хирургии были приведены первые результаты успешного применения плазмолифтинга для лечения последствий широкого спектра спортивных травм. Получены феноменальные результаты по ускорению возвращения травмированных спортсменов к активной состязательной деятельности. Исследования
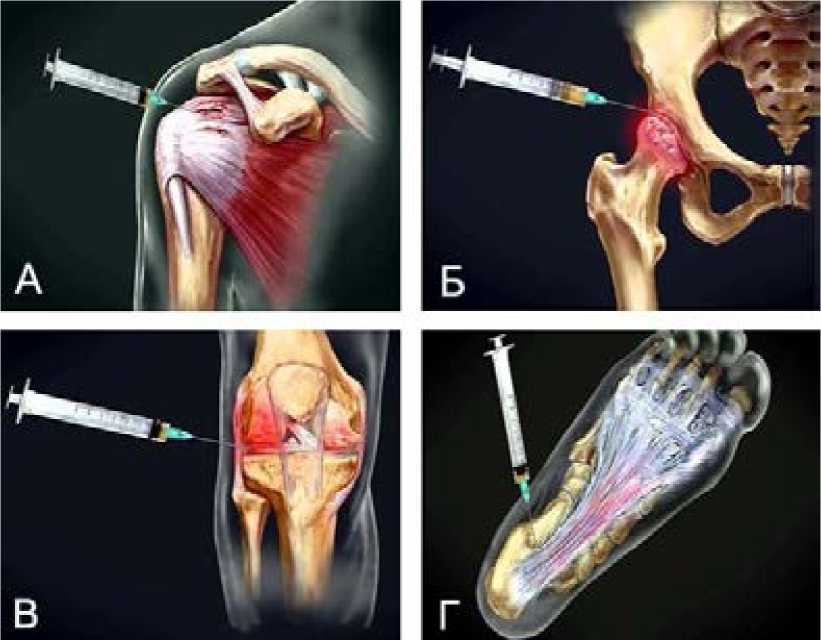
Рисунок 3. Примеры применения технологии PRP-терапии.
А – Плечелопаточный периартрит; cубакромиальный синдром; тендинит сухожилия длинной головки двуглавой мышцы плеча; синдром ротаторной манжеты плеча; субпекторальный бурсит; лигаментит [18]; Б – Артрозо-артрит тазобедренного сустава [19]; В – Гонит с частичными разрывами латеральной обходной связки и латерального мениска в белой зоне [17]; Г – Травматическое растяжение длинной подошвенной связки; пяточная шпора; артрозо-артрит сустава Шопара [20].
по изучения влияния PRP-терапии® на заживление мягких тканей и аутотрасплантатов показало сокращения сроков приживления кожного аутотрансплантата примерно в 3 раза [6,7].
Высокие темпы регенерации создают благоприятные условия для заживления раны первичным натяжением с ускоренной эпителизацией и образованием мягкого соединительнотканного рубца [8,9]. В травматологической практике доказано двух–трехкратное ускорение формирования костной мозоли и заживление закрытых переломов трубчатых костей после введения в область оперативного вмешательства аутологичной плазмы, обогащенной тромбоцитами. Обогащенная ьромбоцитами плазма вводилась трижды с интервалом 7 дней [15].
Заключение. Технологии PRP-терапии® и Plasmolifting™ находят все более широкое применение в практике спортивной медицины. Применение аутологичной плазмы, обогащенной тромбоцитами, существенно снижает интенсивность воспалительного процесса, купирует болевой синдром и ускоряет восстановление костной, хрящевой и мышечной тканей. Особенно ценным представляется то обстоятельство, что для реализации технологии PRP-терапии и сокращения сроков лечения требуется минимальное коли- чество вполне доступных медикаментов и стандартная лабораторная центрифуга. Многочисленные виды спортивных травм и повреждений являются прямым показанием для ее практического применения спортивными врачами непосредственно в командах, во время тренировочного и состязательного процессов. Таким образом, как в эксперименте, так и на практике доказано, что применение аутологичной плазмы крови, обогащенной тромбоцитами, существенно ускоряет регенерацию поврежденных тканей и кратно сокращает продолжительность посттравматического восстановления. Для действующих спортсменов технология PRP-терапии снижает риски срыва графиков тренировок и состязательной деятельности, уменьшает вероятность развития детренированности и снижения спортивной конкурентоспособности. В связи с этим, представляет большую актуальность внедрение в практику реабилитации технологий PRP-терапии и Plasmolifting™, которые позволят заменить без потери качества лечения инвазивные (хирургические) технологии лечения на не инвазивные (консервативные), радикально ускорить развитие восстановительных процессов в тканях после травматических повреждений и в конечном итоге существенно сократить сроки лечения и реабилитации спортсменов.
Список литературы Морфо-функциональные механизмы ускорения восстановительных процессов в тканях после травматических повреждений в спорте
- Анитуа Э. Плазма, богатая факторами роста: предварительные результаты использования при подготовке будущих мест для имплантатов. Оральные челюст-но-лицевые имплантаты Int J. 1999 г.; 14: 529-535.
- Ахмеров Р.Р. // Регенеративная медицина на основе аутологичной плазмы. Технология PlasmoliftingTM / Р. Р. Ахмеров. - М.: Литтерра, 2014. - с. 144.
- Ахмеров Р.Р. // Академия регенеративной медицины Dr.Renat Akhmerov®, Интернет источник: https:// plasmolifting.online/
- Воробьев А.И., Схема кроветворения / А.И. Воробьев, Н.И. Дризе, И.Л. Чертков // Проблемы гематологии. -1995. - Т. 1, №1. - С. -14.
- Карлсон Н.Е., Роуч Р.Б., мл. // Богатая тромбоцитами плазма: клиническое применение в стоматологии. J Am Dent Assoc (1939) 2002; 133: 1383-1386.
- Петрунгаро П.С. Использование богатой тромбоцитами плазмы для ускорения созревания мягких тканей в эстетической хирургии пародонта. CompendContinEducDent. 2001г.; 22:729-732. 734736.
- Уитмен Д.Х., Берри Р.Л., Грин Д.М. // Тромбоцитарный гель: аутологичная альтернатива фибриновому клею для применения в оральной и челюстно-лицевой хирургии. J Oral Maxillofac Surg. 1997 год; 55: 1294-1299.
- Эль-Шаркави Х., Кантарчи А., Дэди Дж., Хастюрк Х., Лю Х., Альшахат М. и др. // Богатая тромбоцитами плазма: факторы роста, про- и противовоспалительные свойства. J Paradontol. 2007 г.; 78: 661-669.
- Andia I, Sanchez M, Maffulli // Tendon healing and platelet-rich plasma therapies. / N.Expert Opin Biol Ther. 2010 0ct;10(10):1415-26
- BrewerDB. MaxSchultze. G. Bizzozero (1882) andthediscoveryoftheplatelet // BritishJournal of Hae-matology . - 2006. - Vol. 133. - P. 251-258.
- Grambart S.T., «Sport medicine and platelet-rich plasma: nonsurgical therapy». Clinics in Podiatric Medicine and Surgery, 2015, 32(1): С. 99-107.
- Paoloni J, De Vos RJ, Hamilton B, Murrell GA, Orchard J.Clin // Platelet-rich plasma treatment for ligament and tendon injuries.J Sport Med. 2011 Jan;21(1):37-45.
- Ross M.H, Pawlina W., Histology Text and Atlas With Correlated Cell and Molecular Biology. 2011, 6th ed., p.996.
- Vigliani,R. Giulio Bizzozero: Remenbrance 100 years after his death // Pathologica: journal. - 2002. - August (vol. 94, no. 4). - P. 206-215.
- Weibrich G, Kleis WK, Kunz-Kostomanolakis M, Loos AH, Wagner W. Корреляция концентрации тромбоцитов в богатой тромбоцитами плазме с методом выделения, возрастом, полом и количеством тромбоцитов донора. Имплантаты. IntJ. 2001 г.; 16: 693-699.
- Интернет источник: https://prpmed.de/de/
- Интернет источник: https://sporttravma.org/assets/ img/demis/prp/p1.jpg
- Интернет источник: https://sporttravma.org/assets/ img/demis/prp/p2.jpg
- Интернет источник: https://sporttravma.org/assets/ img/demis/prp/p3.jpg
- Интернет источник: https://sporttravma.org/assets/ img/demis/prp/p4.jpg
- Barman A., Mukherjee S., Sinha K., Sahoo J., Wiswanath A. // The benefit of platelet-rich plasma injection over institution-based physical therapy program in adhesive capsulitis patients with diabetes mellitus: prospective observational cohort study. / National Library of Medicine. 2021 Dec; 24(4):215-223.


