Морфофизиологические и биохимические показатели каллусов у сортообразцов озимой тритикале (x Triticosecale wittmack) при засолении
Автор: Лагметова Н.А., Алиева З.М., Куркиев К.У., Гаджимагомедова М.Х.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Улучшение сортов растений
Статья в выпуске: 3 т.59, 2024 года.
Бесплатный доступ
Исследования солеустойчивости тритикале (× Triticosecale Wittmack) и выявление оптимальных в этом отношении сортообразцов актуальны в связи с широким распространением засоленных почв в районах выращивания этой культуры. Среди способов оценки солеустойчивости привлекают внимание биотехнологические методы, однако для тритикале они практически не разработаны, а сортовая специфика ее реакции на засоление в условиях in vitro недостаточно изучена. В представленной работе впервые выявлена зависимость активности каллусообразования, прироста сырой и сухой биомассы, динамики накопления в тканях пролина и интенсивности перекисного окисления липидов (ПОЛ) от концентрации соли NaCl (0,5, 0,75 и 1 %) в питательной среде, а также сортовая специфика изменения этих показателей в условиях засоления у образцов озимой тритикале. Целью работы было изучение влияния разной степени хлоридного засоления на морфофизиологические и биохимические изменения каллусов пяти сортообразцов озимой тритикале. В качестве материала для исследований использовали зрелые зародыши зерновок сортообразцов озимой тритикале Triskell, Сотник, ПРАГ530л-1934, Timbo и Алмаз из коллекции Дагестанской опытной станции - филиала ФИЦ Всероссийского института генетических ресурсов растений им. Н.И. Вавилова. Для введения в культуру in vitro зерновки последовательно стерилизовали в течение 30 с в 96 % этаноле и 20 мин - в коммерческом препарате Белизна, затем 3 раза по 5 мин промывали стерильной дистиллированной водой. Выделенные из поверхностно простерилизованных зерновок зародыши помещали на питательную среду срезом вниз для формирования каллуса. В работе использовали четыре варианта питательной среды Мурасиге-Скуга (МС), которая различалась по концентрации NaCl: МС с добавлением 2,5 мг/л 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) и 0,5 мг/л 6-бензиламинопурина (БАП) (контрольный вариант, МС1); МС + 2,4-Д + БАП + 0,5 % NaCl (МС2); МС + 2,4-Д + БАП + 0,75 % NaCl (МС3); МС + 2,4-Д + БАП + 1 % NaCl (МС4). Продолжительность культивирования зрелых зародышей на питательных средах составляла 30 сут. Все варианты культивировали в климатической камере (MLR-352H, «Sanyo», Япония) в условиях 16-часового фотопериода при 24±1 °С, освещенности 3000 лк и влажности 80 %. Определяли размер каллусов, прирост сырой и сухой биомассы, накопление свободного пролина, интенсивность процессов перекисного окисления липидов. По результатам опытов наибольшую чувствительность к засолению in vitro проявили сортообразцы Timbo и Алмаз, у которых каллусогенез наблюдался только на среде с низкой концентрацией NaCl (0,5 %). Сортообразцы Сотник и ПРАГ530л-1934 выдерживали средний уровень засоления (0,75 % NaCl). Устойчивым оказался образец Triskell, у которого каллусообразование было также отмечено в варианте наиболее интенсивного засоления (1 % NaCl). Введение в среду хлорида натрия в концентрации 0,75 % приводило к снижению размера каллуса у сортообразцов Triskell, Сотник и ПРАГ530л-1934 соответственно в 1,8; 1,9 и 2,0 раза относительно контроля (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Triticosecale wittmack, каллусы, тритикале, солеустойчивость, хлоридное засоление, культуры in vitro
Короткий адрес: https://sciup.org/142242459
IDR: 142242459 | УДК: 633.1:58.04:58.085 | DOI: 10.15389/agrobiology.2024.3.525rus
Текст научной статьи Морфофизиологические и биохимические показатели каллусов у сортообразцов озимой тритикале (x Triticosecale wittmack) при засолении
Тритикале (½ Triticosecale Wittmack) — зерновая культура, гибрид пшеницы (Triticum) и ржи (Secale), сочетающая такие ценные признаки, как высокая продуктивность, кормовая питательность, сбалансированность зерна по составу минеральных веществ (1, 2). Культура проявляет устойчивость к некоторым болезням и вредителям мягкой пшеницы, в том числе ржавчине, септориозу, стеблевой и твердой головне, мучнистой росе (3, 4). Эти ценные свойства имеют важное значение для ее использования в сельскохозяйственном производстве. Актуальным представляется исследование солеустойчивости тритикале, которая в целом изучена недостаточно (5, 6). Работы в этом направлении, а также выявление устойчивых образцов особенно важны в связи с распространением засоленных почв в районах возделывания тритикале, в частности в Дагестане (7).
Среди методов изучения и диагностики устойчивости растений к стрессовым воздействиям все больше внимания привлекают биотехнологические (8-10). Изолированные клетки и ткани широко применяются для изучения и диагностики устойчивости растений к пониженным температурам (11), избытку алюминия (12), засухе (13, 14), засолению (15-17), загрязнению тяжелым металлам (18, 19), биотическим (20-22) и многим другим факторам. Это удобная и перспективная модельная система для анализа механизмов формирования и возможностей повышения стрессоустойчивости (23-25). Привлекает внимание сравнительный анализ влияния стрессоров, в том числе тяжелых металлов (20) и засоления (8), in vitro и in vivo.
Применение культур изолированных клеток при анализе солеустой-чивости позволяет выявлять молекулярные механизмы и физиолого-биохимические основы изучаемых процессов (26-28). Исследования солеустойчи-вости in vitro направлены на отбор устойчивых видов и сортов (29), разработку методов диагностики и схем клеточной селекции (30, 31), сопоставление с интактными растениями (32).
Важным представляется накопление экспериментальных данных in vitro с целью отбора сортов зерновых культур, устойчивых к засолению (33, 34). Однако для тритикале сведения о сортовой специфике каллусообразо-вания в условиях солевого стресса, ростовых особенностях каллусных культур и изменениях их биохимических параметров практически отсутствуют. Информация о маркерах окислительного стресса (содержание малонового диальдегида — МДА, активность пероксидазы и каталазы) в условиях засоления относится к интактным растениям тритикале (5, 6), а вопросы, связанные с анализом физиолого-биохимических изменений в культивируемых in vitro тканях тритикале, остаются слабо изученными.
Пролин — наиболее известный осмолит, который накапливается в растениях при действии абиотических факторов (35, 36). Повышенное накопление пролина может служить индикатором стресса, а степень и кратность его повышения при стрессе — основным критерием солеустойчивости генотипов и показателем их адаптивности к стрессовому воздействию (3739). Распространенным и удобным методом оценки интенсивности окислительного стресса у растений и структурной целостности мембран служит измерение количества МДА — продукта перекисного окисления липидов в реакции с тиобарбитуровой кислотой. В последнее время появляется все больше данных, показывающих, что увеличение интенсивности перекисного окисления липидов (ПОЛ) при стрессе становится не только следствием нарушения перекисного гомеостаза, но и представляет собой важный компонент адаптационного процесса (40-42).
В представленной работе впервые выявлена зависимость активности каллусообразования, прироста сырой и сухой биомассы, динамики накопле- ния в тканях пролина и интенсивности ПОЛ от концентрации соли NaCl (0,5; 0,75 и 1 %) в питательной среде, а также сортовая специфика изменения этих показателей в условиях засоления у образцов озимой тритикале.
Целью работы было изучение влияния разной степени хлоридного засоления на морфофизиологические и биохимические изменения каллусов пяти сортообразцов озимой тритикале.
Методика. Опыты проводили в 2014-2016 годах в Дагестанском государственном университете. В качестве материала для исследований использовали зрелые зародыши зерновок сортообразцов озимой тритикале Triskell, Сотник, ПРАГ530л-1934, Timbo и Алмаз из коллекции Дагестанской опытной станции — филиала ФИЦ Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова.
Для введения в культуру in vitro зерновки последовательно стерилизовали в течение 30 с в 96 % в этаноле и 20 мин — в коммерческом препарате Белизна (АО «Каустик», Россия), затем 3 раза по 5 мин промывали стерильной дистиллированной водой. Выделенные из поверхностно простерилизованных зерновок зародыши помещали на питательную среду срезом вниз для формирования каллуса. Питательные среды стерилизовали в автоклаве (2540 EKA, «Tuttnauer», Израиль) при 121 ° С в течение 20 мин и разливали по чашкам Петри, предварительно простерилизован-ным сухим жаром. В работе использовали четыре варианта питательной среды Мурасиге-Скуга (МС), которые различались по концентрации NaCl: МС с добавлением 2,5 мг/л 2,4-дихлорфеноксиуксусной кислоты (2,4Д) и 0,5 мг/л 6-бензиламинопурина (БАП) (контрольный вариант, МС1); МС + 2,4-Д + БАП + 0,5 % NaCl (МС2); МС + 2,4-Д + БАП + 0,75 % NaCl (МС3); МС + 2,4-Д + БАП + 1 % NaCl (МС4).
Продолжительность культивирования зрелых зародышей на питательных средах составляла 30 сут. Объем выборки — 25 зародышей каждого сорта в 3-кратной повторности для каждого варианта. Зародыши во всех вариантах культивировали в климатической камере (MLR-352H, «Sanyo», Япония) в условиях 16-часового фотопериода при 24±1 ° С, освещенности 3000 лк и влажности 80 %.
Определяли размер каллусов, прирост сырой и сухой биомассы, накопление свободного пролина (43), интенсивность процессов перекисного окисления липидов (44). Размер каллуса (длина) измеряли с помощью линейки. Свежую и сухую биомассу оценивали гравиметрическим методом с помощью аналитических весов (ВСЛ-60/0,1А, «Невские весы», Россия). Сухую массу определяли после фиксации материала при 105 ° С в течение 3 ч и при доведении до постоянной массы.
Количество свободного пролина определяли по методу L.S. Bates с соавт. (43). Навеску массой 100 мг растирали в 5 мл дистиллированной воды (2 мл + 2 мл + 1 мл). Содержимое пробирки кипятили в течение 1015 мин и охлаждали на ледяной бане, затем центрифугировали 20 мин при 6 тыс. об/мин (центрифуга ОПН-8, ОАО «ТНК «Дастан», Киргизия). Из образовавшейся вытяжки брали по 2 мл экстракта и переносили в чистые пробирки. К 2 мл экстракта добавляли 2 мл нингидринового реактива (1,25 г нингидрина + 20 мл 6 М Н3PO4 + 30 мл ледяной уксусной кислоты) и 2 мл ледяной уксусной кислоты. Пробирки с полученным раствором тщательно перемешивали и инкубировали в течение 60 мин на кипящей водяной бане, после чего охлаждали на ледяной бане. В контрольном образце вместо экстракта добавляли 2 мл дистиллированной воды. Оптическую плотность окрашенных растворов измеряли при X = 520 нм (спектрофотометр ПЭ-5400УФ, ООО «ЭКРОСХИМ», Россия). Содержание пролина рассчитывали по калибровочной кривой.
Интенсивность перекисного окисления липидов в каллусах сортооб-разцов тритикале определяли по накоплению в тканях продукта окисления липидов (МДА) по цветной реакции с тиобарбитуровой кислотой (ТБК) (44) при высокой температуре и кислом значении рН, что приводит к образованию окрашенного триметинового комплекса, содержащего одну молекулу МДА и две молекулы ТБК (44). Оптическую плотность растворов измеряли на спектрофотометре при λ = 540 нм. Содержание МДА рассчитывали по формуле: С = OD ½ V/ ε ½ L ½ 1000 ½ P, где С — концентрация МДА, мкМ; OD — оптическая плотность при λ = 540 нм; ε — коэффициент молярной экстинкции МДА (155 мМ - 1•см - 1); L — длина пути светового пучка в кювете с раствором (1 см); V — объем среды для растирания навески, мл; P — навеска растительного материала, г.
Эксперименты проводили в 3 биологических повторностях. Для оценки содержания свободного пролина и ПОЛ в каждом варианте для анализа использовали по 3 пробы в 4 аналитических повторностях.
Данные обрабатывали в программе Microsoft Excel 2007. Рассчитывали средние значения изучаемых параметров ( М ), стандартные отклонения среднего (±SD) и стандартные ошибки средних значений (±SEM). Для сравнения независимых выборок использовали параметрический t -критерий Стьюдента. Различия между вариантами считали статистически значимыми при р < 0,05.
Результаты. В таблицах 1-3 указано число полученных каллусов.
На питательной среде МС + 2,4-Д + БАП с низким содержанием соли (0,5 % NaCl, МС2) между сортообразцами тритикале уже наблюдались различия в размерах каллуса: минимальное уменьшение размера относительно контроля отмечали у образца Triskell (в 1,1 раза, р < 0,05), наибольшее — у Timbo (в 1,7 раза, р < 0,05).
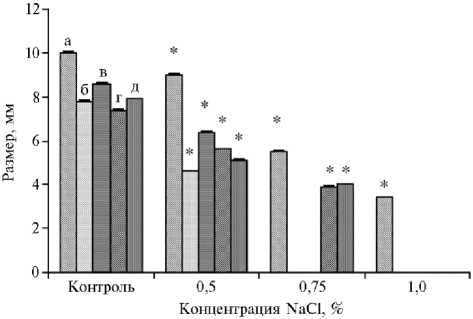
Рис. 1. Размер каллусов у сортообразцов озимой тритикале ( х Triticosecale Wittmack) (коллекция Дагестанской опытной станции — филиала ФИЦ Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова) в зависимости от концентрации NaCl в питательной среде: а — Triskell, б — Timbo, в — Алмаз, г — Сотник, д — ПРАГ530л-1934 (измерения проводили в 3 биологических повторностях, фактический размер выборок см. в таблице 1, M ±SEM).
* Различия с контролем статистически значимы при р < 0,05.
Добавление в среду хлорида натрия в концентрации 0,75 % (МС3) приводило к снижению размера каллуса у сортообразцов Triskell, Сотник и ПРАГ530л-1934 соответственно в 1,8; 1,9 и 2,0 раза относительно контроля (р < 0,05), у сортообразцов Timbo и Алмаз каллусогенез полностью подавлялся (рис. 1). На питательной среде МС4 с 1 % NaCl каллус формиро- вался только у образца Triskell, при этом размер каллуса снижался в 2,9 раза (р < 0,05) (см. рис. 1).
1. Общее число полученных каллусов при определении их размера и биомассы у сортообразцов озимой тритикале ( х Triticosecale Wittmack) (коллекция Дагестанской опытной станции — филиала ФИЦ Всероссийский институт генетических ресурсов растений им. Н.И. Вавилов) в зависимости от концентрации NaCl в питательной среде (3 биологические повторности)
|
Образец |
Контроль 0,5 % 0,75 % 1 % |
|
Triskell Timbo Алмаз ПРАГ530л-1934 Сотник |
73 66 56 13 66 54 0 0 67 56 0 0 70 62 51 0 71 64 49 0 |
В варианте более слабого засоления МС2 наименьшее снижение сырой биомассы каллуса происходило у образцов Triskell (в 1,6 раза относительно контроля, р < 0,05) и Алмаз (в 1,7 раза, р < 0,05), наибольшее — у Timbo (в 3,0 раза, р < 0,05). На питательной среде МС3 у образцов Алмаз и Timbo процесс каллусообразования полностью подавлялся. У сортообразцов Triskell, ПРАГ530л-1934 и Сотник сырая биомасса снижалась относительно контроля соответственно в 2,1; 2,5 и 2,5 раза (р < 0,05) (рис. 2). В варианте МС4 у устойчивого образца Triskell сырая биомасса составила 31 % относительно контроля (р < 0,05). У остальных сортообразцов в этом варианте каллусообразования не отмечали.
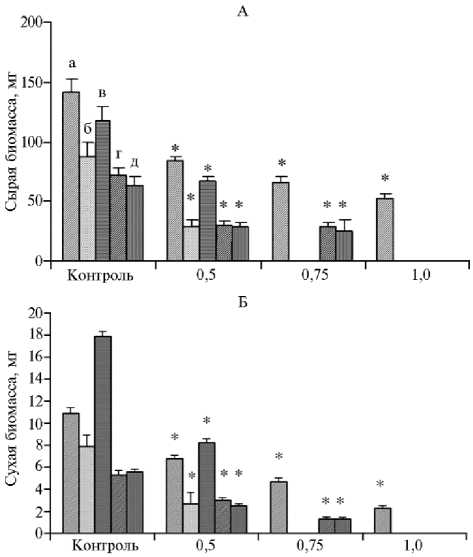
Концентрация NaCl. %
Рис. 2. Сырая (А) и сухая (Б) биомасса каллусов у сортообразцов озимой тритикале ( х Triticosecale Wittmack) из коллекции Дагестанской опытной станции — филиала ФИЦ Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова в зависимости от концентрации в питательной среде NaCl: а — Triskell, б — Timbo, в — Алмаз, г — Сотник, д — ПРАГ530л-1934 (измерения проводили в 3 биологических повторностях, фактический размер выборок см. в таблице 1, M ±SEM).
*Различия с контролем статистически значимы при р < 0,05.
По накоплению сухой биомассы в варианте МС2 высокие показатели имели образцы Triskell и Сотник (62 и 57 % по отношению к контролю, р < 0,05). На питательной среде МС3 наибольшую сухую биомассу каллусов отмечали у Triskell (43 %), наименьшую — у образцов ПРАГ530л-1934 (23 %) и Сотник (25 %). У сортообразцов Алмаз и Timbo в этих условиях каллусо-образования не наблюдали. При добавлении в питательную среду NaCl в самой высокой концентрации (МС4) у образца Triskell сухая биомасса составила 21 % относительно контроля (р < 0,05), тогда как у остальных сорто-образцов процесс каллусообразования полностью подавлялся. Это свидетельствует о большей устойчивости образца Triskell (см. рис. 2).
В работах других авторов сообщалось о снижении каллусогенеза на среде с добавлением NaCl у гибридных линий пшеницы, выведенных в условиях Северо-Казахстанской области. Существенное (почти 10-кратное) ингибирование каллусообразования было отмечено на среде с 50 мМ (0,29 %) NaCl (34). Культивирование зародышей пшеницы на питательной среде МС с добавлением соли NaCl (100 мМ, 0,6 %) приводило к снижению массы каллуса по сравнению с контрольным вариантом (31). С увеличением концентрации NaCl на среде МС до 1,5 % отмечалось снижение ростовых показателей и биомассы у каллусов пшеницы (32). Разрабатывая схему клеточной селекции для сортов твердой и мягкой пшеницы, исследователи показали, что засоление в варианте 0,4 % NaCl оптимально для мягкой селекции, а сублетальная концентрация соли 1 % (в наших опытах ей соответствовал вариант МС4), которая приводит к многократному снижению частоты регенерации растений из каллусных культур, — для жесткой (33, 45).
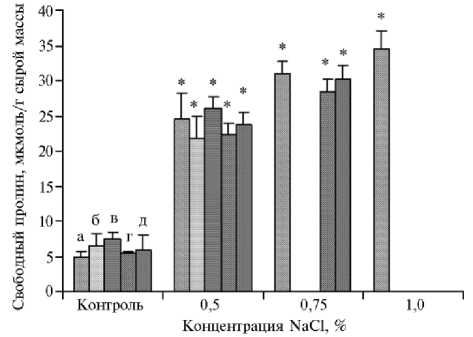
Рис. 3. Содержание свободного пролина в каллусах у сортообразцов озимой тритикале ( х Triticosecale Wittmack) (коллекция Дагестанской опытной станции — филиала ФИЦ Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова) в зависимости от концентрации в питательной среде NaCl: а — Triskell, б — Timbo, в — Алмаз, г — Сотник, д — ПРАГ530л-1934 (измерения проводили в 3 биологических и 4 аналитических повторностях, фактический размер выборок см. в таблице 2, M ±SEM).
* Различия с контролем статистически значимы при р < 0,05.
На 30-е сут мы определяли содержание пролина в каллусах, подвергнутых солевому стрессу (рис. 3). Установлено, что сортообразцы озимой тритикале различались по этому показателю уже в контрольном варианте: наибольшее содержание пролина отмечали у чувствительных образцов Timbo (6,5 мкмоль/г сырой массы) и Алмаз (7,4 мкмоль/г), наименьшее — у устойчивых Triskell (5 мкмоль/г), Сотник (5,5 мкмоль/г) и ПРАГ530л-1934 (5,9 мкмоль/г). На питательной среде с NaCl каллусы устойчивых по биометрическим показателям сортообразцов выделялись морфогенной структурой и были способны к побегообразованию и высокому накоплению пролина (см. рис. 3).
2. Общее число полученных каллусов при определении содержания свободного пролина у сортообразцов озимой тритикале ( х Triticosecale Wittmack) (коллекция Дагестанской опытной станции — филиала ФИЦ Всероссийский институт генетических ресурсов растений им. Н.И. Вавилов) в зависимости от концентрации NaCl в питательной среде (3 биологические повторности)
|
Образец |
Контроль |
0,5 % |
0,75 % |
1 % |
|
Triskell |
70 |
68 |
55 |
15 |
|
Timbo |
64 |
54 |
0 |
0 |
|
Алмаз |
67 |
52 |
0 |
0 |
|
ПРАГ530л-1934 |
71 |
63 |
48 |
0 |
|
Сотник |
69 |
58 |
49 |
0 |
При введении NaCl в среду у каллусов чувствительных образцов наблюдалось потемнение и отмирание участков тканей. У наиболее чувствительного сортообразца Timbo это проявлялось уже на питательной среде МС2, у других (Сотник, ПРАГ530л-1934) — на МС4 (см. рис. 3). В варианте МС1 количество пролина у чувствительных образцов Timbo и Алмаз составило 6,5 и 7,4 мкмоль/г сырой массы. Добавление NaCl в питательную среду в концентрации 0,5 % (МС2) повышало содержание пролина в каллусах у сортообразцов Timbo и Алмаз соответственно в 3,3 и 3,5 раза (р < 0,05) относительно контроля. В варианте МС3 у этих образцов процесс каллусообразования не наблюдался. У устойчивого образца Triskell при всех изученных концентрациях было зафиксировано высокое содержание пролина: при добавлении в среду NaCl в концентрациях 0,5; 0,75 и 1 % оно повышалось соответственно в 4,9; 6,2 и 6,9 раза (р < 0,05) (см. рис. 3).
Большинство исследователей отмечают, что в каллусах зерновых культур при засолении наблюдается изменение содержания пролина. Действие абиотических стрессов на сельскохозяйственные растения приводит к высокому накоплению пролина, что коррелирует с их стрессоустойчиво-стью (46). У сортов Durakli и Careioglu ( Triticum dicoccum Schrank ex Schubl.) в каллусах содержание пролина повышалось при концентрациях NaCl 50 мМ, 100 мМ и 250 мМ. При увеличении концентрации NaCl до 250 мМ (1,5 %) устойчивый сорт Careioglu характеризовался высоким содержанием пролина, чувствительный сорт Durakli — низким (47). Солевой стресс вызывал накопление пролина в каллусах у устойчивых сортов ячменя (48).
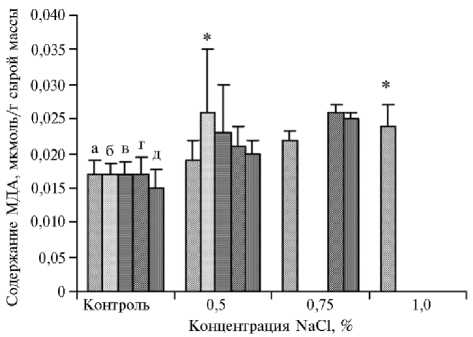
Рис. 4. Содержание малонового диальдегида в каллусах у сортообразцов озимой тритикале ( х Triticosecale Wittmack) (коллекция Дагестанской опытной станции — филиала ФИЦ Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова) в зависимости от концентрации в питательной среде NaCl: а — Triskell, б — Timbo, в — Алмаз, г — Сотник, д —
ПРАГ530л-1934 (измерения проводили в 3 биологических и 4 аналитических повторностях, фактический размер выборок см. в таблице 3, M ±SEM).
-
* Различия с контролем статистически значимы при р < 0,05.
-
3. Общее число полученных каллусов при определении содержания малонового диальдегида у сортообразцов озимой тритикале ( х Triticosecale Wittmack) (коллекция Дагестанской опытной станции — филиала ФИЦ Всероссийский институт генетических ресурсов растений им. Н.И. Вавилов) в зависимости от концентрации NaCl в питательной среде (3 биологические повторности)
Образец
Контроль
0,5 %
0,75 %
1 %
Triskell
71
68
56
12
Timbo
67
53
0
0
Алмаз
67
50
0
0
ПРАГ530л-1934
73
65
51
0
Сотник
70
62
53
0
Интенсивность ПОЛ, которую оценивают по содержанию МДА, часто рассматривается как показатель наличия или отсутствия стрессовой реакции в растениях (40). В нашем опыте в каллусах сортообразцов озимой тритикале, подвергнутых воздействию NaCl, содержание МДА было выше, чем в контрольном варианте. У устойчивых образцов тритикале в условиях засоления количество МДА в каллусах уменьшалось, у чувствительных — увеличивалось (рис. 4).
На питательной среде МС2 у чувствительных сортообразцов Алмаз и Timbo содержание МДА повышалось соответственно в 1,4 и 1,5 раза (р < 0,05) относительно контроля (0,017 мкмоль/г сырой массы). У устойчивого образца Triskell накапливалось меньше всего МДА: в варианте МС2 его содержание повышалось в 1,1 раза (р < 0,05) (до 0,019 мкмоль/г), на питательной среде МС3 — в 1,3 раза (р < 0,05) (до 0,022 мкмоль/г). При добавлении в среду 1 % NaCl (МС4) количество МДА увеличивалось в 1,4 раза (р < 0,05) (до 0,024 мкмоль/г) (см. рис. 4). При введении в питательную среду NaCl в концентрации 0,5 % у образца Сотник количество МДА возрастало в 1,2 раза (р < 0,05) (до 0,021 мкмоль/г сырой массы), в варианте МС3 — в 1,5 раза (р < 0,05) (до 0,026 мкмоль/г).
В каллусах устойчивых сортообразцов озимой тритикале в условиях засоления содержание МДА было низким, что может свидетельствовать о меньшей степени повреждения клеточных мембран (32).
Сортовая специфика накопления продуктов ПОЛ в условиях засоления отмечена и в других работах. Например, при добавлении в питательную среду 100 мМ NaCl (0,6 %) интенсивность ПОЛ у кунжута коррелировала с относительной сортовой толерантностью (36). У сортов T. dicoccum Durakli и Careioglu в условиях солевого стресса (0,3 и 0,9 % NaCl) количество МДА увеличивалось по сравнению с контролем, в меньшей степени — у устойчивого сорта Careioglu (47). При введении в среду Мурасиге-Скуга NaCl в концентрации 100 мМ (0,6 %) у сортов томата в каллусах повышалось содержание МДА: устойчивый сорт PS-10 характеризовался низким накоплением МДА (увеличение количества в 1,78 раза по сравнению с контролем, р < 0,05), чувствительный сорт Roma — высоким (увеличение в 2,16 раза, р < 0,05) (49).
Таким образом, наши эксперименты показали влияние NaCl на ростовые и биохимические показатели каллусов у пяти сортообразцов озимой тритикале из коллекции Дагестанской опытной станции (филиал ФИЦ Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова). Выраженное уменьшение размера и биомассы каллусов в условиях стресса наблюдалось у образцов Timbo и Алмаз (соответственно 4,6 и 6,4 мм, 29,0 и 67,5 мг, р < 0,05). При добавлении в среду 0,75 % NaCl формирование каллуса у них было полностью подавлено. На питательной среде с высоким содержанием соли (1 % NaCl) каллусообразование происходило только у устойчивого сортообразца Triskell, а у чувствительного сортообразца Timbo каллус формировался только на питательной среде с добавлением 0,5 % NaCl. В условиях засоления образцы озимой тритикале, проявившие устойчивость при оценке ростовых показателей каллусов (Triskell, Сотник и ПРАГ530л-1934), характеризовались высоким накоплением в каллусах пролина (соответственно 30,9; 28,4 и 30,2 мкмоль/г, р < 0,05) и низким содержанием малонового диальдегида (0,022; 0,026 и 0,025 мкмоль/г, р < 0,05). Полученные данные могут быть использованы при изучении механизмов устойчивости тритикале и других злаковых культур к засолению в условиях in vitro, в селекционной работе при отборе устойчивых образцов, а также при подборе сортов для выращивания на засоленных почвах. Сорта с высокими показателями можно рекомендовать для возделывания на засоленных территориях Дагестана и других регионов России.
Список литературы Морфофизиологические и биохимические показатели каллусов у сортообразцов озимой тритикале (x Triticosecale wittmack) при засолении
- Шулындин А.Ф. Тритикале — новая зерновая и кормовая культура. Киев, 1981.
- Куркиев К.У., Муслимов М.Г., Мирзабекова М.С., Алиева З.М., Арнаутова Г.И., Магара-мов Б.Г., Исмаилов А.Б., Гасанова В.З. Влияние различных условий выращивания на проявление морфологических признаков колоса у гексаплоидной тритикале. Юг России: экология, развитие, 2016, 11(2): 160-169 (doi: 10.18470/1992-1098-2016-2-160-169).
- Skovmand B., Fox P.N., Villareal R.L. Triticale in commercial agriculture: progress and promise. Advances in Agronomy, 1984, 37: 1-45 (doi: 10.1016/S0065-2113(08)60450-2).
- Колесников Л.Е., Власова Э.А., Фунтикова Е.Ю., Колесникова Ю.Р. Устойчивость тритикале к основным возбудителям болезней, распространенным в северо-западном регионе Российской Федерации. Сельскохозяйственная биология, 2013, 3: 110-116 (doi: 10.15389/agrobiology.2013.3.110rus).
- Евграшкина Т.Н., Иванищев В.В., Бойкова О.И., Жуков Н.Н. Индукция окислительного стресса карбонатным засолением в проростках тритикале. Российская сельскохозяйственная наука, 2020, 1: 11-14 (doi: 10.31857/S2500-2627-2020-1-11-14).
- Хабиева Н.А., Алиева З.М., Куркиев К.У. Влияние хлорида натрия на рост проростков и содержание пролина и натрия у сортообразцов озимого тритикале. Агрохимия, 2020, 2: 84-91 (doi: 10.31857/S0002188120020064).
- Залибеков З.Г. Почвы Дагестана. М., 2010.
- Arzani A. Improving salinity tolerance in crop plant: a biotechnological view. In Vitro Cellular & Developmental Biology — Plant, 2008, 44: 373-383 (doi: 10.1007/s11627-008-9157-7).
- Pérez-Clemente R., Gómez-Cadenas A. In vitro tissue culture, a tool for the study and breeding of plants subjected to abiotic stress conditions. In: Recent advances in plant in vitro culture /A. Leva, L.M.R. Rinaldi (eds.). InTech, 2012, 5: 91-108 (doi: 10.5772/50671).
- Wijerathna-Yapa A., Hiti-Bandaralage J. Tissue culture — a sustainable approach to explore plant stresses. Life, 2023, 13(3): 780 (doi: 10.3390/life13030780).
- Роик Н.В., Бех Н.С., Коцар М.А., Бойко И.И. Оценка и отбор холодостойких форм сахарной свеклы с использованием культуры in vitro. Сахарная свекла, 2016, 9: 11-13.
- Солодкая Л.А., Лапотышкина Л.И., Агафодорова М.Н. Особенности кислотовыносливо-сти различных неустойчивых к ионам алюминия образцов клевера лугового в культуре in vitro. Кормопроизводство, 2021, 1: 26-29.
- Малюкова Л.С., Нечаева Т.Л., Зубова М.Ю., Гвасалия М.В., Конинская Н.Г., Загоскина Н.В. Физиолого-биохимические характеристики микропобегов чая (Сamellia sinensis L.) в условиях in vitro: норма, осмотический стресс, влияние кальция. Сельскохозяйственная биология, 2020, 55(5): 970-980 (doi: 10.15389/agrobiology.2020.5.970rus).
- Matheka J.M., Magiri E., Rasha A.O., Machuka J. In vitro selection and characterization of drought tolerant somaclones of tropical maize (Zea mays L.). Biotechnology, 2008, 7(4): 641-650 (doi: 10.3923/biotech.2008.641.650).
- Almansouri M., Kinet J.-M., Lutts S. Effect of salt and osmotic stress on germination in durum wheat (Triticum durum Desf.). Plant and Soil, 2001, 6(1): 243-254 (doi: 10.1023/A:1010378409663).
- Elwan M.W.M. Explant type, regeneration stage and pre-conditioning affect in vitro salinity tol-erance in sweet pepper (Capsicum annuum cv. California wonder). African Crop Science Conference Proceeding, 2007, 8: 1951-1956.
- Zair I., Chlyah A., Sabounji K., Tittahsen M., Chlyah H. Salt tolerance improvement in some wheat cultivars after application of in vitro selection pressure. Plant Cell, Tissue and Organ Culture, 2003, 73(3): 237-244 (doi: 10.1023/A:1023014328638).
- Гладков Е.А. Оценка токсичности тяжелых металлов для каллусных клеток и целых рас-тений. Сообщение 1. Биотехнология, 2006, 3: 79-82.
- Михайлова И.Д., Лукаткин А.С. Влияние различных концентраций ионов тяжелых метал-лов на каллусогенез и генерацию супероксидного анион-радикала в каллусах огурца и редиса. Известия высших учебных заведений, 2022, 2: 3-11 (doi: 10.21685/2307-9150-2022-2-1).
- Zair I., Chlyah A., Sabounji K., Tittahsen M., Chlyah H. Salt tolerance improvement in some wheat cultivars after application of in vitro selection pressure. Plant Cell, Tissue and Organ Culture, 2003, 73(3): 237-244 (doi: 10.1023/A:1023014328638).
- Koç E., Karayigit B. Plant secondary metabolites in stress tolerance. In: Climate-resilient agri-culture, vol. 1 /M. Hasanuzzaman (ed.). Springer, Cham, 2023: 379-433 (doi: 10.1007/978-3-031-37424-1_19).
- Зайцева С.М., Калашникова Е.А., Нгуен Тхань Хай, Киракосян Р.Н. Участие полифено-лов в формировании фунгицидной активности и устойчивости каллусных культур Helian-thus annuus L. к экзометаболитам гриба Sclerotinia sclerotiorum L. Химия растительного сырья, 2023, 2: 289-299 (doi: 10.14258/jcprm.20230211025).
- Rai M.K., Kalia R.K., Singh R., Gangola M.P., Dhawan A.К. Developing stress tolerant plants through in vitro selection — an overview of the recent progress. Environmental and Experimental Botany, 2011, 71(1): 89-98 (doi: 10.1016/j.envexpbot.2010.10.021).
- Kruglova N.N., Zinatullina A.E. In vitro culture of autonomous embryos as a model system for the study of plant stress tolerance to abiotic factors (on the example of cereals). Biology Bulletin Reviews, 2022, 12: 201-211 (doi: 10.1134/S2079086422020050).
- Álvarez S.P., Ardisana E.F.H., Leal R.P. Plant biotechnology for agricultural sustainability. In: Resources use efficiency in agriculture /S. Kumar, R.S. Meena, M.K. Jhariya (eds.). Springer, Singapore, 2020: 389-425 (doi: 10.1007/978-981-15-6953-1_12).
- El-Mahdy M.T., Youssef M., Elazab D.S. In vitro screening for salinity tolerance in pomegranate (Punica granatum L.) by morphological and molecular characterization. Acta Physiol. Plant., 2022, 44: 27 (doi: 10.1007/s11738-022-03361-2).
- Acemi A., Duman Y., Karakuş Y.Y., Kömpe Y.Ö., Özen F. Analysis of plant growth and bio-chemical parameters in Amsonia orientalis after in vitro salt stress. Horticulture, Environment, and Biotechnology, 2017, 58: 231-239 (doi: 10.1007/s13580-017-0215-0).
- Krasensky J., Jonak C. Drought, salt, and temperature stress-induced metabolic rearrangements and regulatory networks. Journal of Experimental Botany, 2012, 63(4): 1593-1608 (doi: 10.1093/jxb/err460).
- Hannachi S., Werbrouck S., Bahrini I., Abdelgadir A., Siddiqui H.A., Van Labeke M.C. Obtain-ing salt stress-tolerant eggplant somaclonal variants from in vitro selection. Plants, 2021, 10(11): 2539 (doi: 10.3390/plants10112539).
- Queiros F., Fidalgo F., Santos I., Salema R. In vitro selection of salt tolerant cell lines in Solanum tuberosum L. Biologia Plantarum, 2007, 51(4): 728-734 (doi: 10.1007/s10535-007-0149-y).
- Ayed-Slama O., Ayed S., Slim-Amara H. Selection of tolerant lines to salinity derived from durum wheat (Triticum durum Desf.) in vitro culture. Agricultural Sciences, 2015, 6(7): 699-706 (doi: 10.4236/as.2015.67067).
- Терлецкая Н.В. Неспецифические реакции зерновых злаков на абиотические стрессы in vivo и in vitro. Алматы, 2012.
- Никитина Е.Д., Хлебова Л.П., Ерещенко О.В. Разработка отдельных элементов тех-нологии клеточной селекции яровой пшеницы на устойчивость к абиотическим стрес-сам. Известия Алтайского государственного университета, 2014, 3-2(83): 50-54 (doi: 10.14258/izvasu(2014)3.2-09).
- Гаджимурадова А.М., Савин Т.В., Федоренко Е.Н, Швидченко В.К., Киргизова И.В. Се-лекция гибридных линий пшеницы (Triticum aestivum) на устойчивость к хлоридному за-солению в культуре in vitro. Вестник науки Казахского агротехнического университета им. С. Сейфуллина, 2022, 3-2(114): 4-16 (doi: 10.51452/kazatu.2022.3(114).1175).
- Dashek W.V., Erickson S.S. Isolation, assay, biosynthesis, metabolism, uptake and translocation, and function of proline in plant cells and tissues. The Botanical Review, 1981, 47(3): 349-385 (doi: 10.1007/BF02860578).
- Koca H., Bor M., Ozdemir F., Turkan I. The effect of salt stress on lipid peroxidation, antioxi-dative enzymes and proline content of sesame cultivars. Environmental and Experimental Botany, 2007, 60(3): 344-351 (doi: 10.1016/j.envexpbot.2006.12.005).
- Theriappan P., Aditya K.G., Dhasaratham P. Accumulation of proline under salinity and heavy metal stress in Cauliflower seedlings. Journal of Applied Sciences and Environmental Management, 2011, 15(2): 251-255 (doi: 10.4314/jasem.v15i2.68497).
- Kavi Kashor P.B., Sreenivasulu N. Is proline accumulation per se correlated with stress tolerance or is proline homeostasis a more critical issue? Plant, Cell & Environment, 2013, 37(2): 300-311 (doi: 10.1111/pce.12157).
- Szabados L., Savoure A. Proline: a multifunctional amino acid. Trends in Plant Science, 2010, 15(2): 89-97 (doi: 10.1016/j.tplants.2009.11.009).
- Urbinati G., Nota P., Frattarelli A., Di Cori P., Lucioli S., Forni C., Caboni E. Morpho-physi-ological and antioxidant response to NaCl-induced stress in in vitro shoots of pomegranate (Punica granatum L.). Acta Physiol. Plant., 2018, 40: 151 (doi: 10.1007/s11738-018-2726-4).
- Хабиева Н.А. Рост и интенсивность перекисного окисления липидов у проростков озимой тритикале (Triticosecale) при засолении среды. Вестник Дагестанского государственного университета, 2016, 31(1): 114-118.
- Абилова Г.А. Роль салициловой кислоты в преадаптации растений пшеницы к окислительному стрессу. Вестник Дагестанского государственного университета, 2022, 37(3): 93-99.
- Bates L.S., Waldren R.P., Teare I.D. Rapid determination of free proline for water stress studies. Plant and Soil, 1973, 39(1): 205-207 (doi: 10.1007/BF00018060).
- Мерзляк М.Н., Погосян С.И., Юфарова С.Г. Использование -тиобарбитуровой кислоты при исследовании перекисного окисления липидов в тканях растений. Научные доклады высшей школы. Биологические науки, 1978, 9: 86-94.
- Haque M.S., Hasanuzzaman M., Rahman M.T., Islam N., Begum S.N., Yasmin S. Hydroponic and in vitro screening of wheat varieties for salt-tolerance. Plant Sci. Today, 2022, 9(4): 844–854 (doi: 10.14719/pst.1686).
- Mansour M.M.F., Salama K.H.A. Proline and abiotic stresses: responses and adaptation. In: Plant ecophysiology and adaptation under climate change: Mechanisms and perspectives II /M. Hasanuz-zaman (ed.). Springer, Singapore, 2020: 357-397 (doi: 10.1007/978-981-15-2172-0_12).
- Ilhan D., Yazicilar B., Geyik M.S., Actici O., Bezirganoglu I. In vitro studies of salt tolerance at the physiological and molecular levels in two cultivars of Emmer Wheat (Triticum dicoccum Schrank ex Schübl). Journal of Soil Science and Plant Nutrition, 2024 (doi: 10.1007/s42729-024-01678-0).
- Widodo, Patterson J.H., Newbigin E., Tester M., Bacic A., Roessner U. Metabolic responses to salt stress of barley (Hordeum vulgare L.) cultivars, Sahara and Clipper, which differ in salinity tolerance. Journal of Experimental Botany, 2009, 60(14): 4089-4103 (doi: 10.1093/jxb/erp243).
- Aazami M.A., Rasouli F., Ebrahimzaden A. Oxidative damage, antioxidant mechanism and gene expression in tomato responding to salinity stress under in vitro conditions and application of iron and zinc oxide nanoparticles on callus induction and plant regeneration. BMC Plant Biology, 2021, 21: 597 (doi: 10.1186/s12870-021-03379-7).


