Морфофункциональные особенности макулярной зоны у пациентов с диабетическим макулярным отеком на фоне лечения имплантатом дексаметазона в авитреальных глазах
Автор: Аржуханов Д.Д., Петрачков Д.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Офтальмология
Статья в выпуске: 3 т.17, 2021 года.
Бесплатный доступ
Цель: оценить динамику изменения морфофункциональных показателей макулярной зоны пациентов с диабетическим макулярным отеком (ДМО) на фоне интравитреального введения имплантата дексаметазона (ИВВ-ИД) при авитрии и нативном стекловидном теле (НСТ). Материал и методы. Обследованы 60 больных (60 глаз), разделенных на две группы, с диагнозом «диабетическая ретинопатия», ДМО. I группа — пациенты с НСТ, II группа — с авитрией. Пациентам проводилась оценка максимальной корригируемой остроты зрения (МКОЗ), оптическая когерентная томография (ОКТ), ОКТ с функцией ангиографии и микропериметрия до, через 1, 3 и 6 месяцев после ИВВ-ИД. Результаты. В обеих группах наблюдались повышение средней МКОЗ после ИВВ-ИД до 3 месяцев мониторинга (p<0,01); экспоненциальное уменьшение центральной толщины сетчатки с 1‑го по 3‑й месяцы (p<0,01) и увеличение — на 6‑й месяц (p<0,05); рост показателей общей сосудистой плотности в течение 6 месяцев мониторинга (p<0,05); средняя светочувствительность (СЧ) повышалась в I группе до 3 месяцев и вернулась к исходным параметрам к 6‑му месяцу (p<0,05); во II группе — до 6‑го месяца (p<0,05); параметр К (количество точек со СЧ ниже 24 дБ) уменьшался в I группе до 3 месяцев (p<0,05) и возвращался к исходным параметрам к 6‑му месяцу; во II группе — в течение всего периода наблюдения (p<0,01). Заключение. ИВВ-ИД при ДМО позволяет достоверно улучшить морфофункциональные показатели макулярной зоны в глазах и с авитрией, и с НСТ. При этом максимальный эффект препарата отмечался на 3‑й месяц мониторинга.
Диабетическая ретинопатия, диабетический макулярный отек, оптическая когерентная томография, имплантат дексаметазона.
Короткий адрес: https://sciup.org/149138129
IDR: 149138129 | УДК: 617.736
Текст научной статьи Морфофункциональные особенности макулярной зоны у пациентов с диабетическим макулярным отеком на фоне лечения имплантатом дексаметазона в авитреальных глазах
1Введение. Диабетический макулярный отек остается одной из главных причин снижения зрения у пациентов, страдающих сахарным диабетом, по данным многочисленных клинических исследований. Так, частота возникновения ДМО при длительности сахарного диабета более 15 лет составляет 20% [1,2].
Золотым стандартом лечения ДМО является ин-травитреальное введение (ИВВ) препаратов, ингибирующих сосудистый эндотелиальный фактор роста (от англ. vascular endothelial growth factor, VEGF). Однако в ряде случаев отмечается сниженный ответ на проводимую терапию [3, 4]. Одним из факторов, влияющих на данную резистентность, является наличие тракционного компонента. Присутствие тангенциальных или переднезадних тракций в сочетании с классическим патогенезом ДМО, обусловленным дисфункцией гематоретинального барьера, ишемией на фоне гипергликемии и последующим нарушением эндотелиальной целостности сосудов, формируют смешанную клиническую картину, осложняющую определение наилучшей тактики лечения для практикующего врача [5].
Рядом работ была показана целесообразность проведения витрэктомии с пилингом внутренней пограничной мембраны в качестве первого этапа лечения тракционного ДМО. Однако, несмотря на проведенную хирургию, возможно рецидивирование отека. Следующий этап подразумевает использование ИВВ анти-VEGF препаратов или глюкокортикостероидов (ГКС). Примером ГКС, разрешенного в Российской Федерации, является Озурдекс (биодеградируемый имплантат дексаметазона 0,7 мг, Allergan Inc., Irvine CA) [6].
Продолжаются обсуждения наиболее предпочтительной тактики лечения ДМО, при этом стероидная терапия в настоящее время не относится к терапии первой линии вследствие описанных рисков возникновения таких побочных явлений, как офтальмогипертензия и усиление катарактоге-неза. В то же время, по мнению ряда авторов, ГКС могут рассматриваться как стартовая терапия ДМО в авитреальных глазах с артифакией, а также в случаях, когда анти-VEGF терапия противопоказана ввиду отягощенного сердечно-сосудистого анамнеза [7–10]. Немаловажным является и добровольное следование пациента предписанному ему режиму лечения или приверженность лечению, определяемая как комплаенс (от англ. compliance — согласие, соответствие, т. е. действие в соответствии с запросом или указанием). Первичная антиангиогенная терапия включает пять ежемесячных ИВВ-инъекций, с необходимостью ежемесячного мониторинга, что приводит к снижению комплаенса [11]. Данного рода недостаток может быть минимизирован посредством использования имплантата дексаметазона за счет более длительного действия препарата.
Анализ имеющейся литературы выявил недостаток публикаций, касающихся алгоритмов назначения повторного ИВВ ГКС, а именно в режиме pro re nata при использовании имплантата дексаметазона в качестве первичной терапии и последующих реинъекций [12].
Цель — оценить динамику изменения морфофункциональных показателей макулярной зоны пациентов с ДМО на фоне ИВВ-ИД при авитрии и НСТ.
Материал и методы. Проведено обследование 60 пациентов (60 глаз), разделенных на две группы, которым ранее был поставлен диагноз ДМО. Первая группа включала пациентов с нативным стекловидным телом, вторая — с авитрией. Критерием исключения из исследования являлись пролиферативные изменения глазного дна с целью дифференциальной диагностики диабетического и тракционного отеков. Во всех авитреальных глазах в ходе витреоретинальной хирургии выполнен пилинг внутренней пограничной мембраны. В настоящем исследовании оценивались как функциональные, так и морфометрические показатели макулярной зоны. К функциональным показателям относились максимальная корригируемая острота зрения, оцениваемая по таблицам ETDRS, средняя пороговая величина стимула (average threshold, Av. Tr.) и параметр К ( K -value), определяемый как количество точек со светочувствительностью ниже 24 дБ (уровень ниже 24 дБ является пороговым и не встречается в норме) по данным микропериметрии [13]. Морфометрические показатели регистрировались при ОКТ и включали центральную толщину сетчатки (central retinal thickness, CRT), объем сетчатки в зоне фовеа (foveal volume, FV), общий объем сетчатки в макулярной зоне (retinal volume, RV). Помимо этого, по данным ОКТ с функцией ангиографии (ОКТА) фиксировались такие показатели, как сосудистая плотность (СП) поверхностного (superficial capillary plexus, SCP) и глубокого (deep capillary plexus, DCP) капиллярных сплетений. Анализировались общая СП макулярной зоны (SCP-T и DCP-T).
Динамический мониторинг резорбции отека проводился через 1, 3 и 6 месяцев после интра-витреального введения имплантата дексаметазона (ИВВ-ИД).
Статистическая обработка данных проводилась в пакете программ IBM SPSS Statistics v. 21 (Statistical Package for the Social Science). Характер распределения выборок определялся при помощи критерия Колмогорова — Смирнова. Распределение нормальное. Данные представлены в формате M ±σ, где M — среднее значение, σ — среднеквадратическое отклонение. Для сравнения показателей выборок применяли непараметрические методы: U -критерий Манна — Уитни (для независимых выборок). Во всех случаях различия считали значимыми при достижении уровня значимости р меньше 0,05.
Результаты. Полученные в ходе исследования данные I и II групп представлены в табл. 1 и 2 в виде средних показателей и стандартных отклонений. Уровень достоверности изменений параметров через 1, 3 и 6 месяцев оценивался в сравнении с первоначальными данными до ИВВ-ИД.
Исходя из данных табл. 1 и 2 построены графики динамики изменения используемых при диагностике параметров за рассматриваемый период (рис. 1–3).
Средние показатели МКОЗ обеих групп увеличивались на 1-й и 3-й месяцы после ИВВ-ИД ( p <0,01). Изменения МКОЗ на 6-й месяц после проведенного лечения не превышали 5 букв ETDRS и не были статистически значимыми.
Средние показатели CRT, FV и RV обеих групп экспоненциально уменьшались с 1-го по 3-й месяцы после ИВВ-ИД ( p <0,01). К 6-му месяцу отмечалось статистически значимое увеличение описанных параметров ( p <0,05).
По данным МП, средняя пороговая величина стимула увеличивалась в I группе до 3 месяцев (p<0,05) и возвращалась к исходным параметрам к 6-му месяцу; во II группе — повышение СЧ наблюдалось до 6-го месяца включительно (p<0,05). Параметр К уменьшался в I группе до 3 месяцев (p<0,05) и возвращался к исходным параметрам к 6-му месяцу; во II группе — уменьшение отмечалось в течение всего периода наблюдения (p<0,01). При оценке межгрупповых различий методом Манна — Уитни выявлено, что статистически значимыми были изменения параметра K (p=0,02).
Анализ данных ОКТА показал достоверный прогрессирующий рост показателей общей СП SCP и DCP обеих групп в течение 6 месяцев мониторинга ( p <0,05).
Исходя из представленных выше графиков и данных, несмотря на незначительную разницу течения ДМО, в постинъекционный период по данным остроты зрения и ОКТ обеих групп отмечена более стабильная, наиболее предсказуемая и прогностически благоприятная динамика функционального ответа на лечение ИВВ-ИД в группе с авитрией по данным МП и ОКТА за период 6 месяцев.
Обсуждение. В настоящее время обсуждаемым продолжает оставаться вопрос первичного назначения ИВВ-ИД в глазах с ДМО. Воспаление — один
Результаты данных для I группы с нативным стекловидным телом
Таблица 1
|
Параметр |
До инъекции |
1 месяц |
3 месяца |
6 месяцев |
|||||||
|
M |
σ |
M |
σ |
p |
M |
σ |
p |
M |
σ |
p |
|
|
МКОЗ |
53,5 |
13,2 |
66,1 |
9,2 |
0,001 |
67,0 |
8,5 |
64,8 |
11,3 |
0,002 |
|
|
CRT |
536,7 |
176,0 |
346,1 |
92,3 |
0,021 |
308,4 |
62,6 |
0,0001 |
379,5 |
137,0 |
0,032 |
|
FV |
0,42 |
0,14 |
0,27 |
0,07 |
0,017 |
0,24 |
0,05 |
0,3 |
0,11 |
0,039 |
|
|
RV |
11,9 |
2,1 |
10,2 |
1,2 |
0,002 |
9,8 |
0,8 |
10,4 |
1,57 |
0,005 |
|
|
Av. Tr. |
19,6 |
4,1 |
21,2 |
3,6 |
0,01 |
21,3 |
3,1 |
0,01 |
20,5 |
3,5 |
0,069 |
|
Пар. К |
27,2 |
7,1 |
22,3 |
9,6 |
0,011 |
22,6 |
9,5 |
0,011 |
24,9 |
9,3 |
0,327 |
|
SCP-T |
34,5 |
3,7 |
36,6 |
2,8 |
0,032 |
37,2 |
2,0 |
0,021 |
35,8 |
3,6 |
0,002 |
|
DCP-T |
34,5 |
3,0 |
35,7 |
4,0 |
0,039 |
37,0 |
2,3 |
0,0001 |
36,3 |
2,6 |
0,008 |
П р и м еч а н и е : CRT — центральная толщина сетчатки; FV — объем сетчатки в зоне фовеа; RV — общий объем сетчатки в макулярной зоне; Av. Tr. — Average Threshold, средняя пороговая светочувствительность; пар. К — параметр К ; SCP-Т — общая СП SCP; DCP-Т — общая СП DCP.
Результаты данных для II группы с авитрией
Таблица 2
|
Параметр |
До инъекции |
1 месяц |
3 месяца |
6 месяцев |
|||||||
|
M |
σ |
M |
σ |
p |
M |
σ |
p |
M |
σ |
p |
|
|
МКОЗ |
53,1 |
10,4 |
65,5 |
7,9 |
0,001 |
68,4 |
9,3 |
69 |
10,3 |
||
|
CRT |
466,7 |
84,8 |
342,9 |
83,9 |
0,002 |
316,2 |
63,2 |
0,0001 |
342,3 |
87,7 |
0,0001 |
|
FV |
0,37 |
0,07 |
0,27 |
0,07 |
0,001 |
0,25 |
0,05 |
0,27 |
0,07 |
||
|
RV |
11,4 |
1,9 |
9,9 |
1,36 |
0,002 |
9,7 |
1,4 |
9,9 |
1,6 |
||
|
Av. Tr. |
20,8 |
3,3 |
21,3 |
3,7 |
0,104 |
21,6 |
3,9 |
0,024 |
22,2 |
3,9 |
0,001 |
|
Пар. К |
21,2 |
9,2 |
19,4 |
9,6 |
0,289 |
16,9 |
9,6 |
0,001 |
15,6 |
9,8 |
0,0001 |
|
SCP-T |
34,5 |
3,1 |
35,3 |
2,8 |
0,104 |
35,3 |
2,7 |
0,028 |
35,9 |
2,6 |
0,003 |
|
DCP-T |
32,9 |
2,9 |
35,2 |
2,9 |
0,016 |
35,1 |
2,6 |
0,001 |
36,4 |
2,9 |
0,0001 |
П р и м еч а н и е : CRT — центральная толщина сетчатки; FV — объем сетчатки в зоне фовеа; RV — общий объем сетчатки в макулярной зоне; Av. Tr. — Average Threshold, средняя пороговая светочувствительность; пар. К — параметр К ; SCP-Т — общая СП SCP; DCP-Т — общая СП DCP.
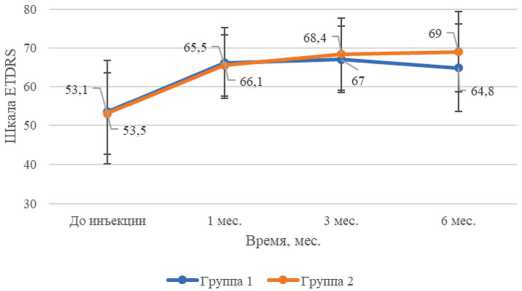
Рис. 1. Динамика средних величин и стандартных отклонений остроты зрения обеих групп
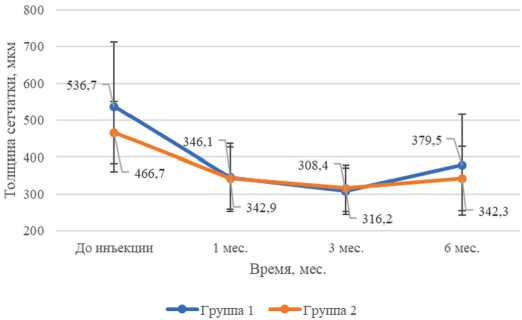
Рис. 2. Динамика средних величин и стандартных отклонений центральной толщины сетчатки по оптической когерентной томографии обеих групп, мкм
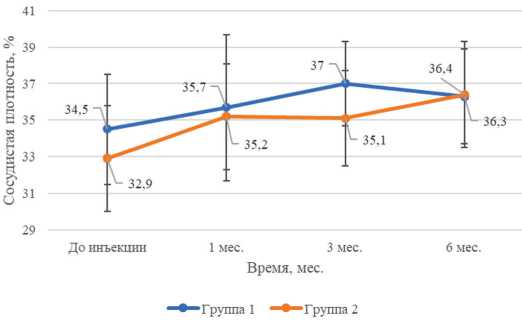
Рис. 3. Динамика средних величин и стандартных отклонений общей сосудистой плотности глубокого капиллярного сплетения по оптической когерентной томографии с функцией ангиографии обеих групп, % из ключевых патогенетических механизмов развития ДМО, поскольку, помимо выработки VEGF, также наблюдается высокая концентрация провос-палительных факторов, таких как интерлейкин 8, моноцитарный хемотаксический белок 1, молекулы клеточной адгезии 1 в витреальной полости, что обосновывает целесообразность применения ГКС [14]. В связи с этим обусловливается необходимость определения дифференциальных отличий течения ДМО на фоне применения имплантата дексаметазона в глазах с различным статусом стекловидного тела [15]. По нашим данным, при оценке показателей остроты зрения и центральной толщины сетчатки не было выявлено значимых различий между группами, что согласуется с данными литературы [16]. Однако при анализе функционального ответа на лечение имплантатом дексаметазона был выявлен более длительный положительный эффект в группе с авитрией, что может рассматриваться как предиктор раннего рецидивирования ДМО. Причиной данных положительных результатов может являться уменьшение общей концентрации провоспалитель-ных факторов в витреальной полости вследствие отсутствия стекловидного тела.
Заключение. Стероидная терапия ИВВ-ИД в лечении ДМО позволяет достоверно улучшить морфометрические и функциональные параметры в глазах и с нативным стекловидным телом, и с авитрией, такие как центральная толщина сетчатки ( p <0,01), фо-веальный ( p <0,01) и макулярный объемы ( p <0,01), средняя пороговая величина стимула ( p <0,05), параметр K ( p <0,05) и показатель общей сосудистой плотности ( p <0,05). При этом максимальный эффект препарата отмечался на 3-й месяц мониторинга.
Список литературы Морфофункциональные особенности макулярной зоны у пациентов с диабетическим макулярным отеком на фоне лечения имплантатом дексаметазона в авитреальных глазах
- Klein R, Klein BE, Moss SE, et al. Wisconsin epidemiologic study of diabetic retinopathy. IV. Diabetic macular edema. Ophthalmology 1984; 91 (12): 1464–74.
- Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study report number 1. Early Treatment Diabetic Retinopathy Study research group. Arch Ophthalmol 1985; 103 (12): 1796–806.
- Korobelnik JF, Do DV, Schmidt-Erfurth U. Intravitreal aflibercept for diabetic macular edema. Ophthalmology 2014; 121 (11): 2247–54. DOI: https://doi.org / 10.1016 / j.ophtha. 2014.05.006.
- Brown DM, Nguyen QD, Marcus DM, et al. Long-term outcomes of ranibizumab therapy for diabetic macular edema. The 36‑month results from two phase III trials: RISE and RIDE. Ophthalmology 2013; 120 (10): 2013–22. DOI: https:// doi.org / 10.1016 / j.ophtha.2013.02.034.
- Romano MR, Allegrini D, Guardia CD. Vitreous and intraretinal macular changes in diabetic macular edema with and without tractional components. Graefes Arch Clin Exp Ophthalmol 2019; 257 (1): 1–8. DOI: https://doi.org / 10.1007 / s00417‑018‑41 73‑8.
- Petrachkov DV, Budzinskaya MV, Arzhukhanov DD. The role of peeling of the inner bordering membrane of the retina in the treatment of diabetic macular edema. The Russian Annals of Ophthalmology / Vestnik Oftalmologii 2020; 136 (4): 359–66. Russian (Петрачков Д. В., Будзинская М. В., Аржуханов Д. Д. Роль пилинга внутренней пограничной мембраны сетчатки в лечении диабетического макулярного отека. Вестник офтальмологии 2020; 136 (4): 359–66).
- Malclès A, Dot C, Voirin N, et al. Real-life study in diabetic macular edema treated with dexamethasone implant: the Reldex study. Retina 2017; 37 (4): 753–60.
- American Society of Retina Specialists. FDA approves revised indication for Ozurdex for diabetic macular edema. URL: https://www.asrs.org / clinical / clinical-updates / 368 / fdaapproves-revised-indication-for-ozurdex-for-diabetic-macularedema (24 Nov 2018).
- Callanan D, Loewenstein A, Patel S, et al. A multicenter, 12‑month randomized study comparing dexamethasone intravitreal implant with ranibizumab in patients with diabetic macular edema. Graefes Arch Clin Exp Ophthalmol 2017; (255): 463–73.
- Diabetic Retinopathy Clinical Research Network, Scott IU, Edwards AR, Beck RW, et al. A phase II randomized clinical trial of intravitreal bevacizumab for diabetic macular edema. Ophthalmology 2007; 114 (10): 1860–7.
- Bobykin EV. Influence of the compliance level on the effectiveness of antiangiogenic therapy for neovascular age-related macular degeneration. The Russian Annals of Ophthalmology / Vestnik Oftalmologii 2014; 130 (4): 88–96. Russian (Бобыкин Е. В. Влияние уровня комплаенса на эффективность антиангиогенной терапии неоваскулярной формы возрастной макулярной дегенерации. Вестник офтальмологии 2014; 130 (4): 88–96).
- Bilgic A, Sudhalkar A, Kodjikian L. Pro Re Nata dexamethasone implant for treatment-naive phakic eyes with diabetic macular edema: a prospective study. Ophthalmol Retina 2019; 3 (11): 929–37. DOI: https://doi.org / 10.1016 / j.oret.2019.05.027.
- Vingrys AJ, King-Smith PE. A quantitative scoring technique for panel tests of color vision. Invest Ophthalmol Vis Sci 1988; 29 (1): 50–63.
- Romero-Aroca P, Baget-Bernaldiz M, Pareja-Rios A, et al. Diabetic macular edema pathophysiology: vasogenic versus Inflammatory. J Diabetes Res 2016; 2016: 2156273. DOI: 10.1155 / 2016 / 2156273.
- Calvo P, Abadia B, Ferreras A, et al. Diabetic macular edema: options for adjunct therapy. Drugs 2015; 75 (13): 1461–9.
- Medeiros MD, Alkabes M, Navarro R, et al. Dexamethasone intravitreal implant in vitrectomized versus nonvitrectomized eyes for treatment of patients with persistent diabetic macular edema. J Ocul Pharmacol Ther 2014; (30): 709–16.


