Морфогенез кожного регенерата и локальные факторы его регуляции
Автор: Шидин В.А., Аптекарь И.А., Ахматов А.В., Леднева Д.С., Марков А.А., Матвиенко В.В., Матусевич С.Л., Нургалиева А.Р., Соловьв Г.С., Соловьва О.Г., Спирина Ю.С., Стеблюк А.Н.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 4, 2023 года.
Бесплатный доступ
Восстановление кожи и ее дериватов после повреждения может завершиться по одному из двух вариантов: кожному (реституция) или дермальному (субституция). При этом механизмов заживления существует три: первичным натяжением, вторичным натяжением и заживление под струпом. Активность репарации коррелирует с действием факторов среды, стимуляторов, соблюдением хроновектора вовлечения в регенерат клеток производных всех дифферонов, участников гистои органогенезов в зоне поражения. Цель работы выявить значение клеток-промоторов, температурного фактора и геля «Эйковит» на этапах заживления термического ожога, контактного дерматита и раневого дефекта кожа. Обозначить этап трансформации провизорного регенерата в дефинитивное состояние.
Кожа, эксперимент, мыши-самцы, полнослойная рана, термический ожог, контактный дерматит, регенерация
Короткий адрес: https://sciup.org/14129331
IDR: 14129331 | УДК: 576.2 | DOI: 10.34014/2227-1848-2023-4-153-168
Текст научной статьи Морфогенез кожного регенерата и локальные факторы его регуляции
Введение. Известные способы ускорения заживления ран, ожогов, травм направлены на стимуляцию биологических потенций клеток, участвующих в репарации. Состояние раневого дефекта на различных стадиях восстановления нарушенной структуры зависит от активности регуляторных факторов локального и дистантного характера действия, способа обработки и клинического ведения раневого дефекта [1-5].
Расшифровка процессов репарации зачастую проводится с позиции эстафетности этапов воспаления и связанных с ними миграционных перемещений клеток, производных эпителиальных, нейральных, мезенхимальных дифферонов, мезенхимально-эпителиаль- ных либо эпителиально-мезенхимальных переходов.
На сегодняшний день регенеративной медициной накоплен значительный опыт применения различных раневых повязок, имеется большой объем информации о технических характеристиках используемых для этих повязок материалов, различных эффектах заживления в зависимости от действующего начала лечебного компонента [6–11].
В настоящее время в экспериментах по изучению активности регенераторных процессов уделяется внимание состоянию симбиотических отношений про- и эукариотов и использованию ген-компонентов, обладающих индуктивным влиянием на клеточные компартменты регенерата [12, 13]. Недостаточно изученным остается феномен эстафетной трансформации провизорного морфологического субстрата в дефинитивное состояние [14]. Перспектива внедрения математического моделирования морфогенеза несомненна [15–18].
Структура регенерата может зависеть от присутствия в его составе клеток-промоторов, выполняющих роль индукторов и контролеров трансформации клеточных коопераций в эпителиальном и мезенхимальном компонентах [19].
Цель исследования. Выявить значение клеток-промоторов, температурного фактора и геля «Эйковит» на этапах заживления раневого дефекта кожи, термического ожога и контактного дерматита. Обозначить этап трансформации провизорного регенерата в дефинитивное состояние.
Материалы и методы. Репаративную регенерацию кожи изучали на моделях травматического повреждения кожи спины аутбред-ных мышей-самцов массой 25±5 г. Экспериментальные животные (126 особей) были распределены на 4 группы: «Полнослойная кожная рана», «Термическое повреждение», «Контактный дерматит», «Контроль».
Термический ожог формировали аппаратом «Терцик» RS232S (Россия) с выносным металлическим модулем площадью 1 см2. Экспозиция составляла 3 мин при температуре 80 оС, что соответствовало ожогу II степени.
Контактный дерматит моделировали втиранием в кожу мышей 0,5 % спиртово-аце-тонового раствора 2,4-динитрохлорбензола (2,4-ДНХБ, «Ленреактив», Россия) по 5 мин 1 раз в сутки в течение 5 дней. При термическом повреждении и контактном дерматите использовали два варианта: с внешним стимулом в виде геля «Эйковит» и без него. Гель «Эйковит» – это продукт из жира сиговых рыб Салехардского рыбоконсервного комбината, содержит комплекс полиненасыщенных жирных кислот (ТУ 9158-001-3445816695).
Кожную рану формировали в соответствии с моделью плоскостной асептической кожной раны по Турищеву. Под эфирным наркозом в стерильных условиях вырезали лоскут кожи по пластиковому трафарету овальной формы с отверстием 3×4 мм. С помощью пинцета вытягивали кожу через трафарет на 2 мм кнаружи и отрезали ножницами. Подкожная мышца при этом не затрагивается, получается полнослойный лоскут и открытая рана площадью 60–70 мм2.
Контракцию краев и динамику заживления выявляли измерением площади раневого дефекта. Скорость контракции определяли по формуле V=(Sn-S/Sn)×100 %, где Sn – площадь при предыдущем измерении, S – площадь при последующем измерении.
Использовали два режима теплового воздействия: «холод» (температура +8 оС) и «тепло» (+42 оС). Температурный режим в «Контроле» соответствовал нормальной температуре тела экспериментального животного (+33 оС). Время воздействия температурного фактора – 30 с, режим воздействия – 1 раз в сутки начиная с первого дня заживления кожной раны и до 30-х сут.
Регенераты забирали в пределах здоровых тканей после декапитации животного под глубоким эфирным наркозом на 3, 7, 10, 14, 20, 30-е сут эксперимента, фиксировали в 10 % нейтральном формалине, заливали в парафин. Срезы окрашивали гематоксилином Майера и эозином [20]. Животных содержали в стандартных условиях вивария с учетом действующего законодательства РФ и положений Хельсинкской декларации об этических принципах медицинских исследований, утверж- денной Всемирной медицинской ассоциацией в 1964 г. Имеется разрешение ЛЭК Тюменского ГМУ на проведение экспериментов (протокол № 14 от 07.06.2018).
Иммуногистохимическим методом выявляли антигены Ki-67, CD1-альфа, CD3, CD31. Реактивы применяли согласно рекомендациям фирмы-производителя (Thermo Fisher Scientific, MA, США). Результаты оценивали методом полуколичественного анализа визуально в баллах с учетом интенсивности окраски и процента окрашенных клеток. Ki-67-позитив-ную реакцию использовали для выявления индекса пролиферации: I=(n+/N)×100 %, где n+ – число окрашенных ядер, N – общее число ядер в исследуемом массиве в 20–30 полях зрения микроскопа при об. 100, ок. 10 в базальном и шиповатом слоях эпидермиса, формирующихся сальных железах, волосяных фолликулах и сосочковом слое дермы.
Гистопрепараты изучали с помощью медицинского микровизора mVizo-101 («ЛОМО», Россия), микроскопа MEIJI-4200 (MEIJI Techno, Япония) и цифровой камеры Canon EOS 5D (Япония). Изображения переносили на персональный компьютер, проводили морфометрический анализ, используя пакет UTHSCHA Image Tools для среды Windows. Статистический анализ осуществляли с помощью IBM StatSoft Statistics (США). В нормально распределенных выборках использовали Т-критерий Стьюдента.
Результаты и обсуждение. Анализ фактического материала проведен с позиций органотипической детерминированности тканей [21], принципа провизорности и морфогенетических корреляций в регенерирующем участке пораженного органа. Классическое представление о воспалительных разрастаниях эпителиев [22] было дополнено привлечением понятий о дивергенции, хроновекторе конвергенции клеток, производных дифферонов различного генеза на этапах регенерации, выявлении критических стадий становления эпидермального и мезенхимального компонентов регенерата, значимости клеток-промоторов морфогенеза и адаптивной реакции регене- рата на действие факторов экосреды слабой интенсивности.
Разрастания эпителия были представлены выстилающим и погружным вариантами, инфильтративного роста не наблюдалось.
Первые трое суток опыта сопровождались формированием эпителиальных наплывающих пластов из краевых дефектов и в сохранившихся островках кожи между пораженным и интактным участками. В парабазаль-ных слоях сохранившегося эпидермиса выявлялись нарушения воспалительного характера в виде вакуолизации, спонгиоза, акантоза, отмечалась гиперемия сосочкового слоя дермы. К концу третьих суток определялся пограничный лейкоцитарный вал между гиподермой и сетчатым слоем дермы.
При термическом ожоге и контактном дерматите оформлялся надэпидермальный детрит, состоявший из отслоившихся ороговевших слоев эпидермиса, участков корней и стержней волос, сгустков фибрина и компонентов сальных желёз – происходило оформление струпа (рис. 1).
Воспалительная реакция дермального слоя сопровождалась альтеративными и регенеративными проявлениями, трансформацией в продуктивную стадию. Граница отторжения эпидермиса формировалась за счет воспалительного экссудата, локализовалась в зоне зернистого слоя. В состав детрита вовлекались компоненты волосяных воронок внутреннего корневого эпителиального влагалища, секрет сальных желез. В волосяных фолликулах истончались эпителиальные оболочки корня, снижалась секреторная активность себоцитов, уменьшался диаметр луковицы. В перифокальной зоне корней выявлялись локальные очаги отека, изоляции сумки волоса от прилежащей соединительной ткани.
Седьмые сутки опыта характеризовались проявлениями органотипической дифференцировки и образованием эпителиальных тяжей погружного роста. В составе эпидермального пласта при применении геля «Эйковит» выявлялись CD1-альфа-позитивные клетки и эпидермально-пролиферативные единицы (рис. 2).
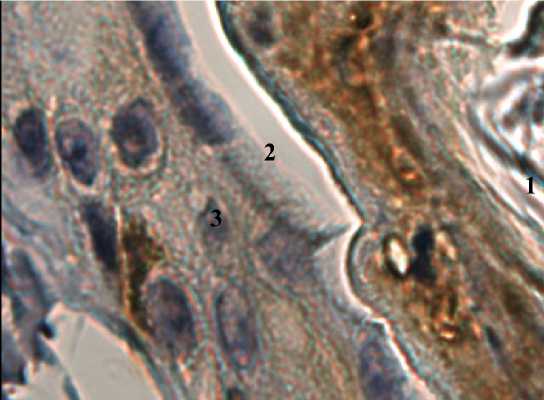
Рис. 1. Контактный дерматит, 3-и сут опыта. Формирование детрита (1), зона отторжения.
Воспалительный экссудат (2), витальные слои эпидермиса (3). Фиксация 10 % нейтральным формалином. Визуализация при помощи пероксидазы. Содержание Ki-67-позитивных клеток. 100×10
Fig. 1. Contact dermatitis. Experiment, Day 3. Detritus formation (1), rejection zone.
Inflammatory exudate (2), vital layers of the epidermis (3). Fixation: 10 % neutral formalin.
Visualization with peroxidase. Ki-67 positive cells. 100×10
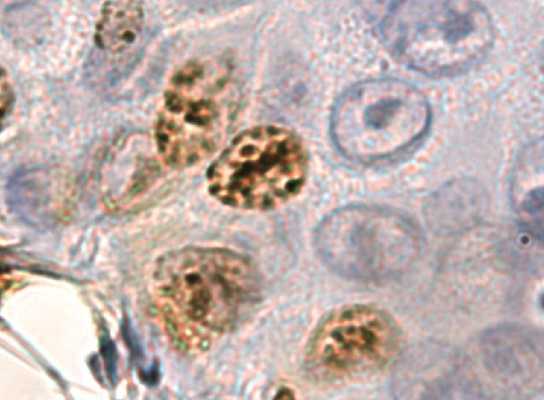
Рис. 2. Контактный дерматит, 7-е сут опыта. CD1-альфа-позитивные клетки в составе регенерата. Формирование эпидермальных пролиферативных единиц. Фиксация 10 % нейтральным формалином.
Визуализация при помощи пероксидазы. 100×10
Fig. 2. Contact dermatitis. Experiment, Day 7. CD1-alpha positive cells in regenerate. Formation of epidermal proliferative units. Fixation: 10 % neutral formalin. Visualization with peroxidase. 100×10
Выявление в составе эпидермального пласта CD3-клеток свидетельствовало о вступлении регенерата в стадию органотипической дифференцировки и полидифферонного состояния. Кожный вариант регенерации сопровождался поддержанием в составе эпителиальных компонентов высокого содержания
CD1-альфа и CD3 на всех последующих стадиях регенерации (табл. 1, 2).
Содержание Ki-67-позитивных клеток в эпидермальном пласте регенерата при воздействии температурного фактора представлено на рис. 3.
Таблица 1
Table 1
Содержание CD1-альфа / CD3-позитивных клеток в эпидермальном пласте регенерата, % (M±m)
CD1-alpha / CD3-positive cells in the epidermal layer of regenerate, % (M±m)
|
Сутки опыта Day of experiment |
«Контактный дерматит» Contact dermatitis |
«Термический ожог» Thermal burn |
||
|
Без «Эйковита», Without Eikovit n=18 |
С «Эйковитом», With Eikovit n=18 |
Без «Эйковита», Without Eikovit n=18 |
С «Эйковитом», With Eikovit n=18 |
|
|
3-и Day 3 |
0 |
0 |
0 |
0 |
|
7-е Day 7 |
9,1±0,4 / 0,0 |
6,2±0,3 / 3,8±0,2 |
9,5±0,4 / 0 |
5,3±0,5 / 4,1±0,3 |
|
10-е Day 10 |
12,3±0,5 / 2,1±0,2 |
10,2±0,4 / 6,2±0,3* |
10,3±0,5 / 4,3±0,2 |
8,4±0,1 / 9,2±0,3* |
|
14-е Day 14 |
14,2±0,6 / 10,3±0,4 |
12,1±0,4 / 9,4±0,5 |
14,3±0,5 / 9,6±0,4 |
12,1±0,4 / 15,1±0,5* |
|
20-е Day 20 |
12,3±1,1 / 16,4±0,4 |
10,2±0,3 / 17,3±0,6 |
15,4±0,4 / 15,2±0,3 |
12,4±0,5 / 19,2±0,7 |
|
30-е Day 30 |
11,6±0,4 / 19,1±0,3 |
11,7±0,3 / 18,6±0,4 |
12,4±0,4 / 18,3±0,6 |
12,7±0,6 / 20,2±0,4 |
Примечания: 1. * – статистически значимые отличия при сравнении с соответствующей группой, в которой не использовался «Эйковит», при p<0,046 (выполнена поправка Бонферрони в связи с попарным множественным сравнением).
-
2. Содержание CD1-альфа в коже интактного животного составляло 9,4±0,3.
-
2. The number of CD1-alpha cells in the skin of intact animals was 9.4±0.3.
Содержание CD3-позитивных клеток в сосочковом слое регенерата
Note: 1. * – the differences are statistically significant when compared with the corresponding group without Eikovit (p<0.046) (Bonferroni correction).
Таблица 2
Table 2
CD3-positive cells in the papillary layer of regenerate
|
Сутки опыта Day of experiment |
«Контактный дерматит» Contact dermatitis |
«Термический ожог» Thermal burn |
||
|
Без «Эйковита», Without Eikovit n=18 |
С «Эйковитом», With Eikovit n=18 |
Без «Эйковита», Without Eikovit n=18 |
С «Эйковитом», With Eikovit n=18 |
|
|
3-и Day 3 |
0 |
0 |
0 |
6,1±0, |
|
7-е Day 7 |
21,2±0,6 |
40,3±1,2* |
26,3±0,7 |
41,4±1,1* |
|
10-е Day 10 |
23,3±0,7 |
40,2±2,1* |
29,4±0,8 |
43,4±0,9* |
|
14-е Day 14 |
27,4±0,6 |
42,1±1,1* |
33,4±1,2 |
45,1±1,1* |
|
Сутки опыта Day of experiment |
«Контактный дерматит» Contact dermatitis |
«Термический ожог» Thermal burn |
||
|
Без «Эйковита», Without Eikovit n=18 |
С «Эйковитом», With Eikovit n=18 |
Без «Эйковита», Without Eikovit n=18 |
С «Эйковитом», With Eikovit n=18 |
|
|
20-е Day 20 |
28,1±0,4 |
41,1±0,6* |
35,7±1,1 |
45,2±1,3* |
|
30-е Day 30 |
31,2±0,6 |
44,4±0,8* |
36,2±0,8 |
48,3±0,9* |
Примечания: 1. * – статистически значимые отличия при сравнении с соответствующей группой, в которой не использовался «Эйковит», при p<0,034 (выполнена поправка Бонферрони в связи с попарным множественным сравнением).
-
2. Содержание CD3-позитивных клеток в коже интактного животного составляло 36,7±0,4.
-
2. The number of CD3-positive cells in the skin of intact animals was 36.7±0.4.
Note: 1. * – the differences are statistically significant when compared with the corresponding group without Eikovit (p<0.034) (Bonferroni correction).
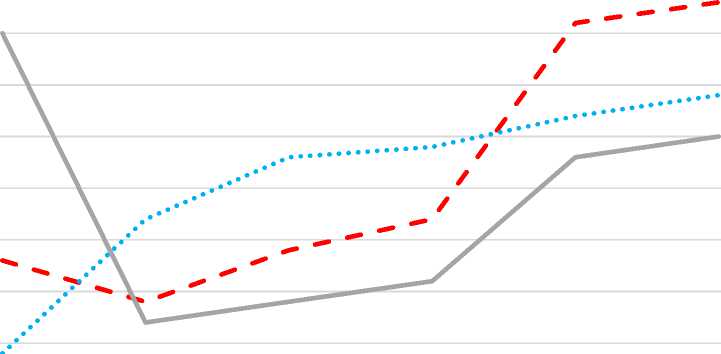
3 суток – Day 3 7 суток – Day 7 10 суток – Day 10 14 суток – Day 14 20 суток – Day 20 30 суток – Day 30
Тепло – Heat
Холод – Cold ^^^^^^^в Контроль - Control
Рис. 3. Содержание Ki-67-позитивных клеток в эпидермальном пласте регенерата при воздействии температурного фактора малой интенсивности
Fig. 3. The number of Ki-67 positive cells in the epidermal layer of regenerate under various temperatures
Согласно сведениям литературы у мышей экспрессия генов приводит к генерации белков в течение 20 мин [23–25]. Посттрансляционные модификации белка могут быть обратимы. Процессы расщепления и деградации
белка необратимы. Это важно учитывать при анализе состояния биологии клетки. Во многих типах клеток эффекторное действие стимуляторов характеризуется пульсирующей формой с периодом смены в несколько минут,
что может отразиться на финальном этапе транскрипционно-ретрансляционного конвейера [26].
Длительная стимуляция слабой интенсивности на уровне субстратов межуточного обмена может привести к адаптации либо к ответу слабой интенсивности, не исключается также колебательный ответ, т.е. индуцированная колебательная активность. К сожалению, выявление динамических процессов в многоклеточном организме ограничено из-за технологических условий на механическом уровне. Поэтому использование различных модельных систем, позволяющих приблизиться к расшифровке сигнальных активностей клеток, оправдано и широко используется при изучении процессов цито-, гисто- и эмбриогенезов [27, 28].
Внутриклеточные сигнальные каскады включают ферментативные реакции, посттрансляционные модификации, протеолитические деформации и осуществляются стремительно – в течение секунды-минуты [27, 28].
Чаще всего такие процессы приводят к активации факторов транскрипции, которые перемещаются в ядро и вызывают экспрессию генов. Передача сигналов часто пульсирует в течение нескольких минут из-за периодичности динамики фосфорилирования-дефосфорилирования. В клетках кожи мыши период импульса варьирует от 30 мин до 1,5 ч. Пульсирующая активность коррелирует с уровнем пролиферации клеток кожи [27, 28].
Во всех сериях реализовался генетически закрепленный механизм репаративной регенерации, прохождение провизорной и дефинитивной стадии тканево- и органотипической дифференцировки. Показателем прогрессивных восстановительных процессов стало наблюдение за уровнем пролиферативной активности клеток в эпидермальном компоненте регенерата (рис. 4).
Основанием для оценки состояния пролиферации послужила визуализация топики Ki-67 (рис. 5).
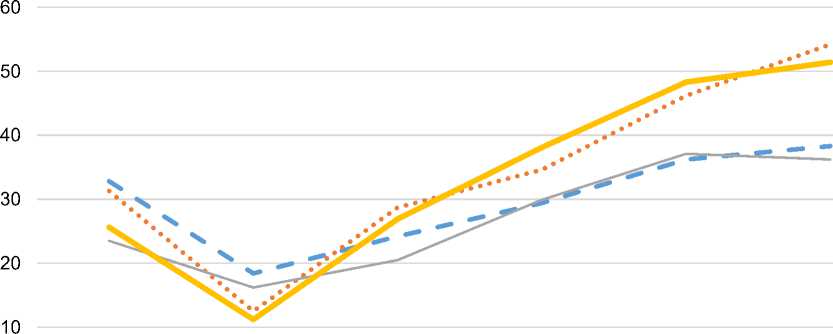
3 суток – Day 3 7 суток – Day 7 10 суток – Day 10 14 суток – Day 14 20 суток – Day 20 30 суток – Day 30
Химический ожог без Эйковита – Chemical burn without Eikovit
Химический ожог с Эйковитом – Chemical burn with Eikovit
Термический ожог без Эйковита – Thermal burn without Eikovit
^^^^Термический ожог с Эйковитом – Thermal burn with Eikovit
Рис. 4. Демонстрация уровня пролиферативной активности клеток во всех сериях опыта (по уровню белка Ki-67) в эпидермальном пласте кожного регенерата при химическом и термическом факторах поражения
Fig. 4. The level of proliferative cell activity at all stages of the experiments (Ki-67 protein level) in the epidermal layer of the skin regenerate under chemical and thermal burns
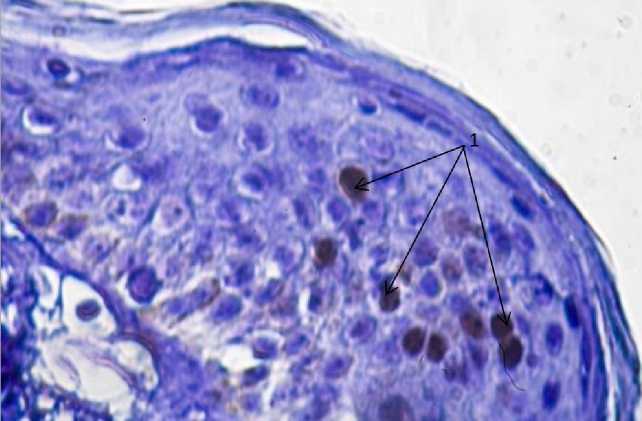
Рис. 5. Термический ожог кожи, 20-е сут опыта, использование геля «Эйковит». Ki67-позитивные клетки в составе регенерирующего эпидермиса (1).
Фиксация 10 % нейтральным формалином.
Визуализация при помощи пероксидазы. Окраска гематоксилином Майера. 90×7
Fig. 5. Thermal burn. Experiment, Day 20. “Eykovit” gel. Ki67 positive cells in regenerating epidermis (1). Fixation: 10 % neutral formalin. Visualization with peroxidase. Mayer's hematoxylin staining. 90×7
Стадия 7–10-х сут характеризовалась качественными преобразованиями регенерата, трансформацией из провизорного в дефинитивное состояние.
Выявление в составе эпидермального пласта CD31-позитивных клеток стало морфологическим показателем заживления дефекта по дермальному типу и формирования рубца. Реализация биологических компетенций клеток в сериях с применением геля «Эйковит» осуществлялась раньше, чему способствовала активизация липофильного варианта трансмембранного поступления в клетки полиненасы-щенных жирных кислот, содержащихся в препарате. Эти кислоты, включаясь в систему межуточного обмена, ингибируют фосфолипазы, встраиваются в билипидный слой мембран, участвуют в регенерации биомембран, выполняя роль липидных сшивок, инициируют прерывание свободнорадикального окисления.
Органогенез сальных желёз осуществлялся в виде двух хроноэтапов, первый из которых (10–14 сут) сопровождался формированием свободно открывающихся на поверхность восстановленного эпидермиса желёз. Выделенное кожное сало санировало регене-
рирующую поверхность, обеспечивало эластичность и предотвращало формирование трещин. Второй этап формирования сальных желёз совпал по времени с формированием зачатков волос и начался после 20 сут регенерации.
К 14-м сут эпидермальный пласт находился в состоянии тканево-типической дифференцировки, ороговевшие кератиноциты были представлены отдельными участками и не формировали непрерывного защитного слоя. Зачатки сальных желёз в опытах с применением геля «Эйковит» вступали в стадию железистой дифференцировки: в них образовались секреторные отделы и выводные протоки.
К 20-м сут эпидермальный пласт характеризовался наличием камбиальных и дифференцированных слоёв. При контактном дерматите хроновектор процесса репарации запаздывал по сравнению с термическим ожогом и кожной раной, отсутствовали зачатки дериватов, заживление дефекта происходило по дермальному типу.
К 30-м сут обеспечивалась реституция поражённого участка кожи в зоне раневого дефекта и после термического ожога. Следует отметить, что активность процессов репара-
тивной регенерации кожи и её дериватов контролировалась состоянием локальных регуляторных факторов. Одним из объективных показателей морфогенеза кожного регенерата являлся хроновектор конвергенции и плотность иммунокомпетентных клеток в составе эпителиального и мезенхимального компонентов на стадиях регенерации. Хроновектор
вовлечения в состав эпидермального компонента клеток CD1-альфа и CD3 декларировал стартовое состояние кожного типа регенерации и реституции пораженного участка. Выявление в составе эпидермального пласта регенерата CD31-позитивных клеток может рассматриваться как предиктор субституции (рис. 6).
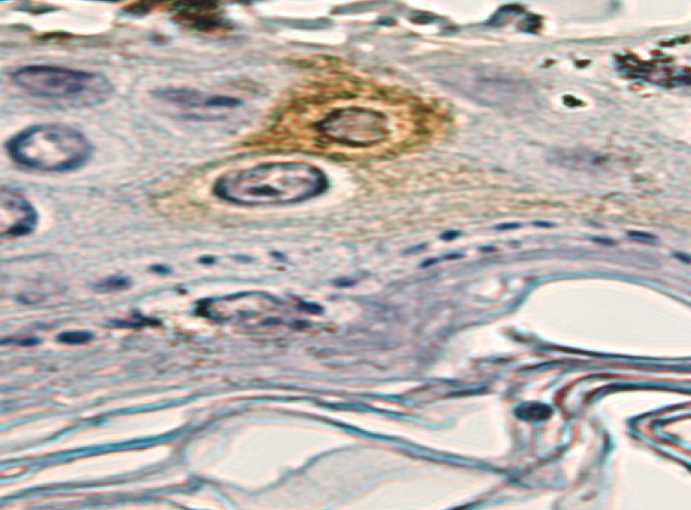
Рис. 6. Содержание CD31-позитивных клеток в эпителиальном компоненте формирующегося кожного регенерата
Fig. 6. CD31-positive cells in the epithelium component of skin regenerate
Выводы:
-
1. Хроновектор конвергенции иммунокомпетентных клеток при заживлении дефектов кожи является критерием реституции эпидермального и соединительнотканного компонентов регенерата и дериватов кожи – сальных желёз и волос. Соблюдение отмеченного хроновектора обеспечивает становление провизорного регенерата и его дальнейшую трансформацию в дефинитивное состояние.
-
2. Одним из итогов десинхроноза конвергенции может быть заживление по дермальному варианту и субституция.
-
3. Полемика по поводу провизорного / дефинитивного состояния кожного регенерата продолжает страницу обсуждения «об интерференции детерминаций» и «презумпции про-визорности» [14, 29].
Работа выполнена при финансовой поддержке Совета по грантам Президента Российской Федерации в рамках гранта Президента РФ для государственной поддержки молодых российских ученых (номер контракта МК-2804.2022.3).
Список литературы Морфогенез кожного регенерата и локальные факторы его регуляции
- АлексееваН.Т., НикитюкД.Б., Клочкова С.В. Аналитическая морфология репаративной регенерации в коже под действием различных региональных факторов. Журнал анатомии и гистопатологии. 2015; 4 (1): 26-38.
- Безносик В.Н., Безносик Р.В., Стадников А.А., Шевлюк Н.Н. О влиянии окситоцина на репаратив-ные гистогенезы в периодонте и слизистой оболочке воздухоносных путей (экспериментальное исследование). Журнал анатомии и гистопатологии. 2019; 8 (3): 18-25.
- Abdo J., Ortman H. Biologic and synthetic cellular and/or tissue-based products and smart wound dressings. Surgical Clinics of North America. 2020; 100 (4): 741-756.
- Pandey A., Sharma N.K., Dhiman N.K. Comparative evaluation of buccal pad of fat with and without bovine collagen membrane in the management of oral submucous fibrosis: A prospective clinical study. National journal of maxillofascial surgery. 2020; 11: 57-63.
- Sonnen K.F., Janda C.Y. Signaling dynamics in embryonic development. Biochem J. 2021; 478 (23): 4045-4070.
- Русакова С.Э., Бирина В.В., Камардин Е.В. Мезенхима, эпителии и «эпителиально-мезенхимальные переходы». В кн.: Вопросы морфологии XXI века. Вып. 5. Санкт-Петербург: ДЕАН; 2018: 40-46.
- Koniaeva A.D., Badaraev A.D., Bolbasov E.N., Stankevich K.S., Tverdokhlebov S.I., Koniaeva A.D., Krikova S.A., Varakuta E. Y., Shesterikov E. V., Nemoykina A.L., Bouznik V.M., Zhukov Y.M., Mishin I.P. Piezoelectric polymer membranes with thin antibacterial coating for the regeneration of oral. Applied Surface Science. 2020; 504: 144068.
- Koniaeva A.D., Varakuta E.Yu., Leiman A.E., Bolbasov E.N., Stankevich K.S. Changes in the cellular composition of the inflammatory infiltrate and connective tissue of the oral mucosa in rats during wound healing using a protective piezoelectric coating. Clinical and Experimental Morphology. 2022; 1 (11): 50-61.
- Lee K., Kim E.H., Shin D., Roh J.L. Accelerated oral wound healing using a pre-vascularized mucosal cell sheet. Scintific reports. 2017; 7 (1): 10677.
- Xu X., Cui N., Wang E. Application of an acellular dermal matrix to a rabbit model of oral mucosal defects. Experimental and therapeutic medicine. 2018; 15 (3): 2450-2456.
- Шевлюк Н.Н., Гатиатуллин И.З., Стадников А.А. Особенности репаративных гистогенезов при использовании биопластических материалов. Журнал анатомии и гистопатологии. 2020; 9 (1): 86-93.
- Билялов А.И., Абызов М.С., Титова А. Комбинированное применение плазмидного препарата pCMV-VEGFA и аутодермопластики для стимуляции заживления кожных дефектов в эксперименте. Гены и клетки. 2018; 13 (1): 90-94.
- Деев Р.В., Бозо И.Я., Мавликеев М.О. Индукция репаративного рабдомиогистогенеза ген-активированным гидрогелем на основе гиалуроновой кислоты в эксперименте. В кн.: Вопросы морфологии XXI века. Вып. 6. Санкт-Петербург: ДЕАН; 2021: 94-98.
- Соловьев Г. С., Янин В.Л., Пантелеев С.М., Баженов Д.В., Вихарева Л.В., Шидин В.А., Молокова О.А., Соловьева О.Г., Маргарян А.В., Иванов И.В., Иванова Е.В., Истомина О.Ф., Морозова Е.В., Мкртычева К.К., Мухамедьяров Д.А., Гарчук И.В., Вотинцев А.А., Хадиева Е.Д., Алексеева Ю.В., Сазонова Н.А., Анищенко О.А., Карпова Я.А., Соловьев В.Г., Аптекарь И.А., Бондаренко О.М., Шидин А.В., Спирина Ю.С., Гузенкова Д.В. Дивергентная теория эволюционирования тканей академика Н.Г. Хлопина и дивергенция органогенеза при формировании провизорных структур. В кн.: Вопросы морфологии XXI века. Вып. 6. Санкт-Петербург: ДЕАН; 2021: 53-64.
- СавостьяновГ.А. Пути построения трехмерной гистологии. В кн.: Вопросы морфологии XXI века. Вып. 6. Санкт-Петербург: ДЕАН; 2021: 53-61.
- Сергеев Т.Н., Новожилов К.А., Николенко В.Н. Математическая модель сопряжения клеточных механизмов нейровоспаления и нейродегенерации. Медицинская наука и образование Урала. 2022; 23 (1 (109)): 145-148.
- Шестакова В.Г., Банин В.В., Баженов Д.В. Морфометрия и математическое моделирование регенераторного процесса полнослойной раны кожи при стимулированном ангиогенезе. Медицинская наука и образование Урала. 2022; 23 (1 (109)): 200-203.
- Kartasalo K., Latonen L., Vihinen J., Visakorpi T., Nykter M., Ruusuvuori P. Comparative analysis of tissue reconstruction algorithms for 3D histology. Bioinformatics. 2018; 34 (17): 3013-3021.
- Бычков В.Г., Вихарева Л.В., Зуевский В.П. Методология выявления инициаторных и промоторных факторов в процессе онкогенеза при суперинвазионном описторхозе. Медицинская наука и образование Урала. 2022; 23 (1 (109)): 47-50.
- Семченко В.В., Барашкова С.А., Ноздрин В.Н., Артемьев В.Н. Гистологическая техника: учебное пособие. 3-е изд., доп. и перераб. Омск; Орёл: Омская областная типография; 2006. 290.
- Гаршин В.Г. Воспалительные разрастания эпителия, их биологическое значение и отношение к проблеме рака. Москва; 1939. 140.
- Дунаев П.В. Органоспецифическая детерминация и дифференцировка генетически родственных тканей в онтогенезе и регуляция тканевых процессов. Закономерности морфогенеза и регуляции тканевых процессов в нормальных, экспериментальных и патологических условиях: материалы Всероссийской научной конференции анатомов, гистологов и эмбриологов. Тюмень: Вектор-Бук; 1998: 5-6.
- Harima Y., Takashima Y., Ueda Y., Ohtsuka T., KageyamaR. Accelerating the tempo of the segmentation clock by reducing the number of introns in the Hes7 gene. Cell Rep. 2013; 3 (1): 1-7.
- Shamir M., Bar-On Y., Phillips R., Milo R. SnapShot: Timescales in Cell Biology. Cell. 2016; 164 (6): 1302-1302.
- Matsuda M., Hayashi H., Garcia-Ojalvo J., Yoshioka-Kobayashi K., Kageyama R., Yamanaka Y., Ikeya M., Toguchida J., Alev C., EbisuyaM. Species-specific segmentation clock periods are due to differential biochemical reaction speeds. Science. 2020; 369 (6510): 1450-1455.
- Albeck J.G., Mills G.B., Brugge J.S. Frequency-modulated pulses of ERK activity transmit quantitative proliferation signals. Mol Cell. 2013; 49 (2): 249-261.
- Nelson D.E., Ihekwaba A.E., Elliott M., Johnson J.R., Gibney C.A., Foreman B.E., Nelson G., See V., Horton C.A., Spiller D.G., Edwards S.W., McDowell H.P., Unitt J.F., Sullivan E., Grimley R., Benson N., Broomhead D., Kell D.B., White M.R. Oscillations in NF-kappaB signaling control the dynamics of gene expression. Science. 2004; 306 (5696): 704-708.
- Tsiairis C., Großhans H. Gene expression oscillations in C. elegans underlie a new developmental clock. Curr Top Dev Biol. 2021; 144: 19-43.
- Соловьев Г.С., Янин В.Л., Бажанов А.Н. Проявление интерференции детерминаций в механизмах эмбрио-, гисто- и органогенезов. Клеточная трансплантология и тканевая инженерия. 2010: 34.


