Морфологическая картина эстрального цикла в условиях резерпиновой модели депрессии у крыс
Автор: Беляков Владимир Иванович, Антипов Евгений Валерьевич
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.25, 2017 года.
Бесплатный доступ
В исследовании на крысах при оценке морфологической картины влагалищных мазков и кальпоцитографических индексов изучено влияние резерпиновой модели депрессии на протекание эстральных циклов. Установлено, что действие резерпина в депрессогенной дозе вызывает пролонгирование фазы диэструса, снижение представленности в эструсе чешуйчатых клеток, а также уменьшение значения кариопикнотического индекса. В работе делается заключение о том, что истощение резерпином запасов медиаторов - катехоламинов нарушает механизмы нейроэндокринного контроля репродуктивной функции и приводит к развитию гипоэстрогенного состояния.
Эстральный цикл, эструс, резерпин, депрессия, крысы
Короткий адрес: https://sciup.org/143177160
IDR: 143177160 | DOI: 10.20340/mv-mn.17(25).01.06
Текст научной статьи Морфологическая картина эстрального цикла в условиях резерпиновой модели депрессии у крыс
Введение. Одной из самых распространенных психических дисфункций является депрессия. По данным Всемирной организации здравоохранения около 30 % пациентов, обращающихся к врачам различного профиля, страдают депрессией [1]. При этом прогнозируется рост частоты депрессивных расстройств в ближайшем будущем, и они могут опередить такие распространенные заболевания, как сердечно-сосудистые и онкологические. Возникновение данной патологии сопровождается нарушениями не только в сфере высших мозговых функций (мышления, обучения, внимания, памяти и др.), но и в протекании соматических и вегетативных процессов [2, 3]. Большую озабоченность вызывают постоянно накапливающиеся факты о выраженном неблагоприятном влиянии депрессии на состояние репродуктивной функции у женщин. Известно, что женщины имеют вдвое более высокий риск заболевания депрессией по сравнению с мужчинами уже с подросткового возраста [4]. Женский организм отличается наличием репродуктивной функции, обусловленной циклическим высвобождением половых гормонов и обладающей высокой чувствительностью к действию различного рода повреждающих факторов. Имеются данные о взаимовлиянии психоэмоционального статуса и протекания репродуктивных процессов. В частности, показана связь гормональных перестроек в пубертатный, климактерический, родовой и послеродовый периоды, а также фаз менструального цикла (предменструальный период) с формированием и течением депрессивных расстройств. С другой стороны, возникновение депрессии отражается на состоянии репродуктивных процессов. Так, у девочек с проявлениями депрессивных симптомов менструация устанавливается в более поздние сроки (15–17 лет) и с самого начала может быть нерегулярной. При тяжелой форме депрессии может возникать ановуляторный синдром [4, 6].
К настоящему времени установлена важная роль катехоламинов (норадреналина, дофамина) в контроле эмоционального статуса и функционирования гипоталамических структур, связанных с выработкой половых нейрогормонов. Показано, что снижение функциональной активности норадрено- и дофаминергической нейромедиаторных систем проявляется в нарушениях эмоционального баланса вплоть до возникновения депрессивной симптоматики, а также в функциональном сбое механизмов регуляции нейрогормональной системы «гипоталамус–аденогипофиз–яичники» [7-13]. В этой связи востребованными являются исследования, связанные с моделированием и комплексным изучением влияния сниженного уровня активности катехоламинергических систем (характерного нейрохимического маркера депрессии) на состояние половой функции.
Адекватной экспериментальной моделью при изучении данного вопроса является эстральный цикл у самок крыс, отражающий морфологические изменения клеток слизистой влагалища в связи с циклическими гормональными изменениями. В исследованиях установлена высокая степень аллометричности функционирования репродуктивной сферы самок крыс и женского организма. Так, при сопоставлении пульсаций уровня гонадотропинов в течение всего цикла у женщин и эстрального цикла у крыс выявлена их идентичность. Высокая аллометричность половой сферы у женщин и у крыс подтверждается не только схожестью нормального функционирования гормональных механизмов контроля репродукции, формирования бесплодия, но и аналогичностью процессов инволюции половой функции [14, 15].
Цель исследования – провести комплексный анализ изменений картины влагалищных мазков и расчетных индексов кальпоцитограммы у крыс в условиях истощения катехоламинергических систем в резерпиновой модели депрессии.
Материал и методы исследования. Дизайн исследования планировался в соответствии с требованиями ГОСТ 53434-2009 «Принципы надлежащей лабораторной практики (GLP)», Правил лабораторной практики и директив Европейской Конвенции по защите позвоночных животных. Протокол исследования утвержден на заседании комиссии по биоэтике Самарского университета. Эксперименты проводились на базе лаборатории кафедры физиологии человека и животных Самарского университета в летний период на 36 крысах-самках линии Wistar в возрасте 2,5-3 месяцев, массой 200-220 граммов. Животные содержались в стандартных условиях вивария (режим освещения – 12:12; температура в помещении – 18-20 Сº; влажность воздуха – 60-70%). Крысы находились в металлических клетках по 6 особей. Кормление крыс осуществлялось в свободном режиме смесью для грызунов, вода подавалась ad libitum при помощи автоматических поилок. В эксперимент отбирались самки, имевшие регулярный эстральный цикл продолжительностью 4-5 дней и характерную картину влагалищных мазков на каждой стадии цикла. Фазы эстрального цикла (диэструс, проэструс, эструс) определяли с использованием бинокулярного микроскопа Levenhuk 625 (увеличение 200) по соотношению основных типов клеток в мазке: лейкоцитов, промежуточных эпителиальных клеток (созревающих крупных клеток округлой или овальной формы с относительно небольшим, концентрически расположенным ядром), парабазальных клеток (относительно мелких клеток с крупным ядром) и чешуек (самых крупных клеточных образований неправильной формы с различной степенью выраженности кариопикноза). Кроме того, оценивалась представленность в мазках слизи и клеточных конгломератов (относительно плотных скоплений клеток за счет слизи). Для компьютерной визуализации изображения морфологической картины влагалищных мазков использовалась цифровая насадка на микроскоп (Levenhuk С 510 NG 5 M USB 2.0). Окраска мазков осуществлялась 0,5 % раствором метиленового синего.
Структура мазков исследовалась на протяжении трех недель ежедневно в утреннее и вечернее время. Для построения кальпоцитограммы в каждом мазке подсчитывалось 100 эпителиальных клеток. По соотношению различных типов клеток в мазке определялись: кариопикнотический индекс (процентное отношение числа клеток с пикнотическими ядрами к общему количеству клеток в мазке) и индекс промежуточных клеток (процентное отношение числа промежуточных клеток к общему числу клеток). Оценка морфологической картины влагалищных мазков и кальпоцитографических индексов позволяла косвенно судить о гормональном профиле [15].
Для моделирования депрессивного состояния крысам опытной группы (n=18) однократно, внутрибрюшинно в объеме 1 мл вводился раствор резерпина (4 мг/кг). Резерпин в данных условиях истощает запасы медиаторов-катехоламинов и обладает выраженной депрессогенной активностью [16]. С целью подтверждения формирования депрессивного состояния у крыс использовался классический тест на потребление сахарозы и поведенческая установка «Открытое поле» (НПК «Открытая Наука», Россия). В тесте потребления раствора сахарозы каждую крысу на 30 минут помещали в клетку, оснащенную двумя автоматическими поилками (с 20 %-м раствором сахарозы и с водой). Регистрировалось количество потребленной жидкости в каждой из поилок как разница между массой (в граммах) поилки до и после теста, а также число подходов к поилкам и процентный показатель предпочтения потребления раствора сахарозы по сравнению с водой. Отсутствие у крыс предпочтения потребления раствора сахарозы по сравнению с водой рассматривалось как агедония и показатель депрессивного состояния животных. В тесте «Открытое поле» оценивалась горизонтальная двигательная активность (по числу пересеченных секторов), вертикальная двигательная активность (по количеству вставаний на задние лапы) и исследовательская активность (по числу обследований отверстий площадки теста). Для оптимизации процедуры оценки поведенческого статуса использовалась программа RealTimer (версия 1.15). Дефицит различных вариантов двигательной активности в сочетании с низким уровнем исследовательского поведения интерпретировался как показатель депрессивного состояния [17]. Крысам контрольной группы (n=18) по аналогичной схеме вводился физиологический раствор. Полученные данные статистически и графически обрабатывались с помощью программы SigmaStat с использованием t-теста Стьюдента. Значения считались статистически значимыми при p<0,05. Результаты исследования представлены как среднее значение ± стандартная ошибка среднего.
Результаты исследования и обсуждение . В ходе проведенного исследования были установлены закономерности протекания эстрального цикла у крыс в зависимости от их психофизиологического состояния. Отобранные в эксперимент крысы имели регулярные эстральные циклы с характерной клеточной картиной влагалищного мазка на каждой стадии цикла. Всего за трехнедельный период наблюдения определялось в среднем 4,6±0,3 сменявших друг друга эстральных циклов при средней продолжительности одного цикла около 100 часов. Полученные данные хорошо согласуются с известными представлениями о том, что у молодых самок крыс в летний период продолжительность одного эстрального цикла составляет 4-5 дней [15]. На протяжении всего периода наблюдения фиксировалась типичная смена морфологического состава влагалищных мазков, определяемая особенностями гормонального профиля организма в зависимости от стадии цикла. Следует отметить, что в силу относительно короткого времени протекания эстрального цикла и динамичного перехода одной основной стадии в другую в части наблюдений регистрировались переходные стадии цикла.
На стадии покоя (диэструса), продолжавшейся около 48 часов, наблюдалось значительное количество лейкоцитов при практически полном отсутствии клеток эпителия. В переходную стадию от диэструса к проэструсу наряду с лейкоцитами регистрировалось появление промежуточных эпителиальных клеток с относительно мелким ядром. В отдельных случаях обнаруживались мелкие эпителиальные клетки округлой или овальной формы с хорошо оформленным ядром, занимающим значительный объем клетки. Подобная картина указывает на появление в мазках парабазальных клеток. Стадия проэструса характеризовалась увеличением в мазках числа промежуточных эпителиальных клеток крупного размера с мелкими, центрально расположенными ядрами. В некоторых мазках диагностировались поверхностные клетки с пикнотическими ядрами, а также отдельные чешуйчатые клетки. На стадии эструса обнаруживалось значительное число чешуйчатых клеток неправильной формы при практически полном отсутствии лейкоцитов. В цитологической картине метаэструса обнаруживалось скопление слизи и разнообразные типы клеток: чешуйчатые, эпителиальные клетки с мелким, плохо оформленным ядром, а также лейкоциты. Эпителиальные клетки имели загнутые края («ладьевидные клетки») и окрашивались красителем менее интенсивно, чем в другие стадии цикла. Встречались крупные конгломераты из сильно деформированных клеток с пикнотическими ядрами. Фон таких мазков оценивался как «грязный». Переход от метаэструса к диэструсу определялся по появлению в мазках отдельных эпителильных клеток с достаточно крупным ядром и возрастанию представленности лейкоцитов. При этом число чешуйчатых и поверхностных клеток с пикнотическими ядрами сокращалось, клеточные конгломераты практически не обнаруживались.
Таблица 1
Особенности изменений индекса промежуточных клеток (%) на различных стадиях эстрального цикла
|
Стадии эстрального цикла |
Контрольная группа |
Группа с резерпиновой моделью депрессии |
|
Диэструс |
68±5,9 |
69,3±7,1 |
|
Проэструс |
59,0±4,8 |
65,2±4,7 |
|
Эструс |
9,4±1,2 |
21,0±2,6* |
Примечание: * - статистически значимое отличие между группами крыс при р<0,05
Таблица 2
Особенности изменений кариопикнотического индекса (%) на различных стадиях эстрального цикла
|
Стадии эстрального цикла |
Контрольная группа |
Группа с резерпиновой моделью депрессии |
|
Диэструс |
30,0±4,4 |
28,4±4,5 |
|
Проэструс |
41,7±5,2 |
57,8±7,1* |
|
Эструс |
90,6±10,2 |
70,3±9,2* |
Примечание: обозначения те же, что в таблице 1
Кариопикнотический индекс, отражающий степень эстрогенной активности, напротив, имел выраженную положительную динамику в цикле смены стадий цикла «диэструс–проэструс–эструс» (табл. 2). На стадии эструса регистрировалось увеличение данного индекса в среднем на 200 % (р<0,001) в сравнении со стадией покоя, что косвенно свидетельствует о должном уровне функционирования гипоталамо-гипофизарно-гонадальной системе и нормальной продукции эстрогенов.
Описанные выше изменения морфологии влагалищных мазков связаны с особенностями функционирования гипоталамо-гипофизарно-гонадальной системы, определяющей циклический характер продукции половых гормонов. Пусковым механизмом для данной системы является открытый в 1991 году гипоталамический пептидный фактор -кисспептин. Выработка кисспептина начинается с момента наступления полового созревания нейронами аркуатного и антеровентрального перивентрикулярного ядер гипоталамуса [18-20]. Данный нейропептид осуществляет контроль над выработкой гормонов гипоталамуса, аденогипофиза и половых желез, непосредственно регулирующих репродуктивную сферу организма. У большинства самок млекопитающих, в т.ч. у крыс, циклические изменения в продукции эстрогенов и прогестинов проявляются в виде эстральных циклов, отличающихся определенным морфологическим и функциональным состоянием слизистой влагалища. Стадия проэструса характеризуется максимальной секрецией эстрогенов созревающими фолликулами яичника, а морфологически выражена в виде гипертрофии и гиперплазии эпителиальных клеток слизистой влагалища и последующим отторжением клеток, секретирующих слизь. Окончание эстрогенной стимуляции клеток влагалища происходит в стадию эструса. В это время стимулированные высоким уровнем эстрогенов эпителиальные клетки слизистой влагалища расслаиваются и формируют слой чешуек. Дальнейшее снижение концентрации эстрогенов приводит к развитию следующей стадии - метаэструсу, который сопровождается некротическими процессами и отторжением клеток базального слоя слизистой. По времени данная стадия совпадает с образованием желтых тел и секрецией ими прогестинов, являющихся функциональными антагонистами эстрогенов в отношении влияния на клетки влагалищного эпителия. Стадия диэструса («покоя») отличается заторможенностью пролиферативных процессов и продукцией эпителиальными клетками слизи. Физиологически диэструс обеспечен низким уровнем эстрогенов [15]. Функционирование механизмов, контролирующих работу гипоталамо-гипофизарно-гонадальной оси и смену стадий эстрального цикла, испытывает влияние со стороны факторов различной этиологии. Не последнюю роль при этом играет общий психоэмоциональный фон организма. Клинические наблюдения свидетельствуют о тесной связи нарушений в эмоциональной сфере и риском развития репродуктивной патологии [5, 7, 8].
Во второй серии экспериментов изучены особенности морфологической картины влагалищных мазков в условиях резерпиновой модели депрессии. Формирование депрессивного поведения фиксировалось в тесте «Потребления сахарозы». Установлено, что однократное введение резерпина в депрессогенной дозе обеспечивало снижение числа подходов животных к поилкам с растром сахарозы в сочетании с уменьшением количества потребляемого сладкого раствора. Кроме того, тестирование животных в «Открытом поле» показало сниженный уровень двигательной и исследовательской активности, что является классическим маркером депрессивного состояния [17].
Формирование депрессивного статуса оказало в целом негативное влияние на протекание эстральных циклов крыс, о чем свидетельствовало нарушение установившегося физиологического соотношения между различными популяциями клеток во влагалищных мазках, а также определенные перестройки расчетных индексов кальпоцитограммы. Отмечалось пролонгирование по времени характерных признаков диэструса (преобладание в структуре мазков лейкоцитов), которое обеспечивало затягивание наступления следующих стадий цикла в среднем на 24 часа. При этом слабо проявлялись отличительные морфологические особенности влагалищных мазков на стадии эструса. В эту стадию в мазках регистрировалось относительно большее число промежуточных клеток с достаточно хорошо структурированным ядерным аппаратом в сочетании с низкой представленностью чешуйчатых клеток. На рис. 1 и рис. 2 продемонстрированы отличительные особенности морфологии влагалищных мазков на стадии эструса в контрольной группе и при моделировании депрессивного состояния.
Индекс промежуточных клеток не претерпевал на протяжении эстрального цикла существенных изменений, характерных для нормального протекания репродуктивных процессов. Так, если для контрольных особей на долю промежуточных клеток на эстральной стадии приходилось 9,4±1,2 % от числа всех клеток в мазках, то для «депрессивных» особей - 21,0±2,6 %. Таким образом, в случае развития депрессивного статуса число поверхностных клеток в активную стадию цикла было повышенным на 55,2 % по сравнению с контрольной группой. О затухании митотических процессов, нарушении нормальных структурно-функциональных преобразований слизистой влагалища при моделировании депрессии свидетельствует недостаточная степень кариопикнотических изменений. В случае контрольных особей кариопикнотический индекс на стадиях проэструса и эструса в среднем составлял 41,7±5,2 % и 90,6±10,2 %, соответственно. В условиях депрессивного состояния данный индекс на стадиях проэструса и эструса находился на уровне 57,8±7,1 % и 70,3±9,2 %, соответственно. Описанная картина влагалищных мазков и расчетных кальпоцитографических индексов является отличительным признаком гипоэстрогенного состояния и указывает на вероятную «поломку» сложноорганизованного нейрогормонального механизма регуляции эстральных циклов в условиях депрессивного фенотипа.
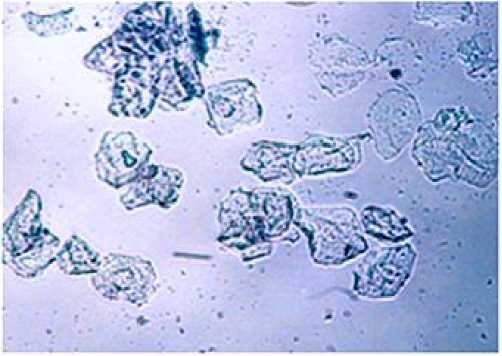
Рис. 1. Влагалищный мазок на стадии эструса в физиологических условиях. Окраска метиленовым синим. Ув. 200.
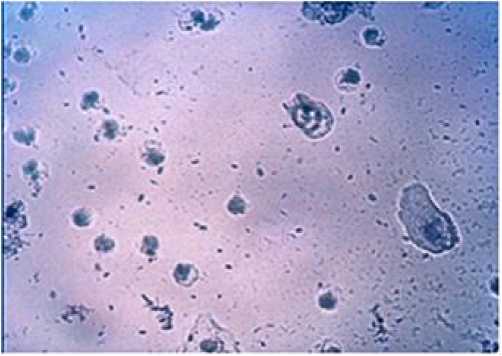
Рис. 2. Влагалищный мазок на стадии эструса в условиях резерпиновой модели депрессии. Окраска метиленовым синим. Ув. 200.
Как известно, поддержание должного эмоционального баланса выстраивается за счет функционирования эмоциогенных структур головного мозга и активности, определенных нейротрансмиттерных систем. В частности, ключевая роль в поддержании положительного эмоционального статуса принадлежит моноаминоергическим нейромедиаторным системам: дофамин-, норадреналин- и серотонинергической [11-13]. Высокая плотность моноаминоергических терминалей в гипоталамических областях, связанных с экскрецией кисспептина и гонадолиберина, позволяет предполагать модулирующую роль медиаторов-моноаминов в контроле функционирования системы «гипоталамус-аденогипофиз-гонады». Данные иммуногистохимических исследований свидетельствуют о сосуществовании гонадолиберинергических нейронов c нервными терминалями, содержащими 5-ОТ и ферменты метаболизма катехоламинов (дофамин-в-гидроксилазу и тирозингидроксилазу) [21]. Имеются данные о наличии синаптических связей между дофамин-, норадреналин- и серотонинергическими нейронами с гонадолибернергическими нейронами преоптической зоны гипоталамуса [22-25]. На уровне срединного возвышения гипоталамуса показано аксо-аксональное взаимодействие между дофамин- и гонадолиберинергическими нейронами [7].
Расположенные в перивентрикулярных ядрах гипоталамуса нейроны, синтезирующие дофамин, формируют инсертогипоталамическую дофаминергическую систему, имеющую проекции в преоптическую зону и срединное возвышение гипоталамуса. Передача дофаминергических влияний на срединное возвышение гипоталамуса осуществляется также с участием нейронов аркуатных ядер, входящих в состав тубероинфундибулярной дофаминергической системы. Источником норадренергических проекций в преоптическую зону и срединное возвышение гипоталамуса является голубое пятно. Данные литературы указывают на то, что влияния вышеописанных медиаторных систем на синтез и секрецию половых нейрогормонов гипоталамуса являются неоднозначными. Сложность изучения данного вопроса определяется также тем, что активность самих моноаминоергических медиаций зависит от концентрации в крови половых гормонов. Установлено активирующее действие норадреналина через альфа-адренорецепторы на продукцию гонадолиберина [26]. Предполагается, что повышенный уровень эстрогенов на стадии проэструса обеспечивает возбуждение норадренергических нейронов, которые, в свою очередь, посылают стимулирующие влияния к гонадолиберинергическим нейронам гипоталамуса [27]. Имеются данные о включении норадреналина посредством бета-адренорецепторов в регуляцию выработки гонадилиберина по тормозному типу [7]. В отношении модулирующей роли 29
дофамина показано, что инсертогипоталамическая дофаминергическая система связана с активацией, а тубероинфундибулярная - с торможением деятельности гонадолиберинергических нейронов [28]. Имеются данные о динамике уровня медиаторов-моноаминов в областях гипоталамуса, непосредственно связанных с синтезом и выделением половых нейрогормонов, на протяжении фаз эстрального цикла. В частности, установлено повышение уровня норадреналина в преоптической зоне и срединном возвышении гипоталамуса на стадии проэструса. Пиковое значение концентрации данного нейромедиатора совпадало или несколько предшествовало началу преовуляторных пиков гонадолиберина и лютеинизирующего гормона [29]. В отношении дофамина и серотонина таких однозначных корреляций не обнаружено [30]. С учетом приведенных данных о значении медиаторов-катехоламинов в обеспечении нормального функционирования нейрогормональных механизмов, регулирующих репродуктивные процессы, можно говорить о том, что «сбои» в деятельности норадрен- и дофаминергической систем выполняют роль дестабилизирующего фактора и могут вызывать различного рода репродуктивные дисфункции.
Заключение. На основании результатов проведенного исследования допустимо считать, что морфологические изменения влагалищного эпителия на протяжении фаз эстрального цикла у крыс находятся в определенной зависимости от эмоционального статуса и уровня функциональной активности катехоламинергических нейромедиаторных систем. Резерпиновая модель депрессии, истощающая запасы катехоламинов, нарушает протекание нормальных циклических преобразований клеток влагалищного эпителия, что является, по всей видимости, результатом развития гипоэстрогенного состояния.
Список литературы Морфологическая картина эстрального цикла в условиях резерпиновой модели депрессии у крыс
- Депрессия. Информационный бюллетень ВОЗ № 369. 2016.
- Вассерман Л.И., Ананьева Н.А., Вассерман Е.Л., Иванов М.В., Мазо Г.Э., Незнанов Н.Г., Горелик А.Л., Ежова Р.В., Ершов Б.Б., Сорокина А.В., Янушко М.Г. Нейрокогнитивный дефицит и депрессивные расстройства: структурно -функциональный подход в сравнительных многомерных исследованиях. Обозрение психиатрии и медицинской психологии им. В.М. Бехтерева. 2013; 4: 58 -67.
- Silverstein B., Edwards T., Gamma A. The role played by depression associated with somatic symptomatology in accounting for the gender difference in the prevalence of depression. Soc. Psychiatry Psychiatr. Epidemiol. 2013; 48 (2): 257 -63.
- Тювина Н.А. Депрессии у женщин. Москва: Издательство «Сервье»; 2006. 32 с.
- Алексеев Б.Е., Белоус И.М. Сексуальные дисфункции у женщин с психогенными депрессиями. Обозрение психиатрии и медицинской психологии. 2013; 1: 22 -24.
- Тювина Н.А., Балабанова В.В., Воронина Е.О. Гендерные особенности депрессивных расстройств у женщин. Неврология, нейропсихиатрия, психосоматика. 2015; 7 (2): 75 -79.
- Бабичев В.Н. Нейроэндокринная регуляция репродуктивной системы. Пущино: ОНТИ ПНЦ РАН; 1995. 227 с.
- Перехов А.Я. Депрессия и сексуальные расстройства у женщин в естественной и хирургической менопаузе. ОРЖИН. Акушерство. Гинекология. Репродукция. 2009; 4: 6 -9.
- URL: http://cyberleninka.rU/article/n/depressiya
- Арутюнян А.В., Керкешко Г.О., Степанов М.Г. и др. Роль биогенных аминов в гипоталамической регуляции репродуктивной функции. Журнал акушерства и женских болезней. 2004; LIII (1): 98 -106.
- Саркисова К.Ю. Депрессивноподобные изменения в поведении и экспрессии гена c-fos в дофаминергических структурах мозга у крыс линии WAG/RIJ. Журн. высшей нерв. деят. 2002; 52 (6): 733 -742.
- Узбеков М.Г., Максимова Н.М. Моноамино -гормональные связи в патогенезе тревожной депрессии. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2015; 115 (1): 52 -55.
- Grace А.А. Dysregulation of the dopamine system in the pathophysiology of schizophrenia and depression. Nat. Rev. Neurosci. 2016; 17 (8): 524 -32.
- Montoya A., Bruins R., Katzman M.A., Blier P. The noradrenergic paradox: implications in the management of depression and anxiety. Neuropsychiatr. Dis. Treat. 2016; 12: 541 -557.
- Wise P.M., Kashon M.L., Krajnak K.M. Aging of the female reproductive system: a window into brain aging. Recent Prog. Horm. Res. 1997; 52: 279 -303.
- Cora M.C., Kooistra L., Travlos G. Vaginal Cytology of the Laboratory Rat and Mouse: Review and Criteria for the Staging of the Estrous Cycle Using Stained Vaginal Smears. Toxicol. Pathol. 2015; 43 (6): 776 -93.
- Blasco-Serra A., Escrihuela-Vidal F., Gonzalez-Soler E.M., Martrnz-Expösito F., Blasco-Ausina M.C., Marfnez-Bellver S., Cervera -Ferri A., Teruel-Mart'i V., Valverde-Navarro A.A. Depressive -like symptoms in a reserpine -induced model of fibromyalgia in rats. Physiol. Behav. 2015; 1 (151): 456 -462.
- Балакирева Г.А., Кузнецов И.Э., Шипшина М.С., Кузнецов К.И. Выявление признаков депрессии, основанных на анализе поведения животных. Педагогика, психология и медико-биологические проблемы физического воспитания и спорта. 2007; 5: 192 -194.
- Clarkson J., dAnglemont de Tassigny X., Moreno A.S., Colledge W.H., Herbison A.E. Kisspeptin -GPR54 signaling is essential for preovulatory gonadotropin -releasing hormone neuron activation and the luteinizing hormone surge. J. Neurosci. 2008; 28 (35): 8691 -8697.
- Зарубина Е.Г., Лысова А.Н., Беляков В.И. Влияние kiss -пептина на эстральный цикл крыс. Морфологические ведомости. 2014; 2: 34 -40.
- Babiker A., Al Shaikh A. The role of kisspeptin signalling in control of reproduction in genetically similar species. Sudan. J. Paediatr. 2016; 16 (1): 9 -16.
- Hoffman G.E. Organization of LHRH cells: differential opposition of neurotensin, substance P and catecholamine axons. Peptides. 1985; 6: 439 -451.
- Chen W.P., Witkin J.W., Silverman A.J. Gonadotropin releasing hormone (GnRH) neurons are directly innervated by catecholamine terminals. Synapse. 1989; 3 (3): 288 -290.
- Horvath T.L., Naftolin F., Leranth C. Luteinizing hormone -releasing hormone and gamma-aminobutyric acid neurons in the medial preoptic area are synaptic targets of dopamine axons originating in anterior periventricular areas. J. Neuroendocrinol. 1993; 5 (1): 71 -79.
- Kiss J., Halasz B. Demonstration of serotoninergic axons termination on luteinizing hormone -releasing hormone neurones in the preoptic area of the rat using a combination of immunocytochemistry and high resolution autoradiography. Neurosci. 1985; 14: 69 -78.
- Leranth C., MacLusky N.J., Shanabrough M., Naftolin F. Catecholaminergic innervations of hormone -releasing hormone and glutamic acid decarboxylase immunopositive neurons in the rat medial preoptic area. An electron -microscopic double immunostaining and generation study. Neuroendocrinology. 1988; 48 (6): 591 -602.
- Науменко Е.В., Осадчук А.В., Серова Л.И., Шишкина Т.Г. Генетико-физиологические механизмы регуляции функции семенников. Новосибирск: Наука, 1983; 202 с.
- Herbison A.E. Noradrenergic regulation of cyclic GnRH secretion. Rev. Reprod. 1997; 2 (1): 1 -6.
- Gunnet J.W., Lookingland K.J., Moor K.E. Effects of gonadal steroids on tuberoinfundibular and tuberohypophyseal dopaminergic neural activity in male and femal rats. Proc. Soc. Biol. Med. 1986; 183 (1): 48 -53.
- Mohankumar P.S., Thyagarajan S., Quadri S.K. Cyclic and age -related changes in norepinephrine concentrations in the medial preoptic area and arcuate nucleus. Brain Res. Bull. 1995; 38 (6): 561 -564.
- Kordon C., Drouva S.V., de la Escalera G.M., Weiner R.I. Role of classic and peptide neuromediators in the neuroendocrine regulation luteinizing hormone and prolactine/In: The physiology of reproduction. Raven Press Ltd, New York. 1994: 1621 -1681.


