Морфологическая картина костной ткани при имплантации дисперсного биокомпозита на основе волластонита
Автор: Афонин И.С., Апанасевич В.И., Зиновьев С.В., Папынов Е.К., Евдокимов И.О., Шичалин О.О., Усов В.В., Костив Е.П., Плехова Н.Г.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 4, 2023 года.
Бесплатный доступ
Цель исследования изучить структуру костной ткани, окружающей зуб в норме, после его удаления и при размещении графта на основе волластонита, допированного гидроксиапатитом, в альвеоле нижней челюсти подопытного животного (кролик).
Дисперсный волластонит, биокомпозит, аугментация альвеол
Короткий адрес: https://sciup.org/14129330
IDR: 14129330 | УДК: 616.314.17-089.844:615.462:611.716.1-018.4 | DOI: 10.34014/2227-1848-2023-4-144-152
Текст научной статьи Морфологическая картина костной ткани при имплантации дисперсного биокомпозита на основе волластонита
Введение. Репаративная регенерация костной ткани представляет собой сложноорганизованный процесс [1]. Вопрос о понимании закономерностей процессов регенерации костной ткани в присутствии остеопластических материалов на данный момент имеет очень большое значение, так как при потере зубов наблюдается агрессивная атрофия альвеолярных отростков [1, 2]. Для решения данной проблемы используются различные остеопластические материалы с выраженными биоактивными свойствами [3, 4]. Так, могут быть использованы порошок аутокости и ксе-нотрансплантанты, взятые от крупного рога- того скота и свиньи [5, 6], а также синтетические материалы: биостекло [7], биополимеры [8], карбонат и сульфат кальция, трикальцийфосфат и гидроксиапатит [9].
К одному из таких материалов может относиться биокомпозит на основе волластонита [10]. Первые сообщения об успешном использовании волластонита относятся к концу XX – началу XXI в. [11, 12]. Его допируют синтетическим гидроксиапатитом, который при взаимодействии с окружающими костными тканями способен активно выделять ионы Ca2+ и SiO32-, что улучшает биоактивные свойства волластонита, используемого для за- мещения дефектов костной ткани [13, 14]. При комбинации методов темплатного золь-гель-синтеза и искрового плазменного спекания возможен синтез дисперсного остеопластического материала с хорошими механическими характеристиками и высокой биосовместимостью [15–17].
Как правило, материалы, используемые для увеличения объема костной ткани альвеолярного отростка, помещаются в области дефекта костной ткани в ходе оперативного вмешательства: либо при расщеплении альвеолярного отростка [18], либо при направленной костной регенерации [19]. Однако имеются сообщения о возможности размещения имплантируемого материала непосредственно в альвеолах удаленных зубов с целью предотвращения развития дегенеративных изменений [20].
Цель исследования. Изучить структуру костной ткани, окружающей зуб в норме, после его удаления и при размещении графта на основе волластонита, допированного гидроксиапатитом, в альвеоле нижней челюсти подопытного животного (кролик).
Материалы и методы. Для подтверждения наличия биоактивных свойств у графта на основе волластонита, допированного гидроксиапатитом, были использованы 9 выращенных в условиях животноводческой фермы самок кроликов породы новозеландский белый. Возраст каждого животного составлял 1 год, масса варьировала от 1,7 до 3 кг. Подопытные были разбиты на 3 группы по 3 животных в каждой: группа 1 – контрольная, без оперативного вмешательства; группа 2 – удаление зуба 3.1 без последующей аугментации; группа 3 – удаление зуба 3.1 с последующей аугментацией графтом на основе волластонита с гидроксиапатитом. Под медикаментозным комбинированным наркозом (2 % ксилозин (5 мг/кг), 5 % раствор гидрохлорида кетамина (30 мг/кг) и 2 % раствор лидокаина (0,3 мг/кг)) проводилась синдесмотомия (удаление круговой связки зуба) с последующей экстракцией резцов 3.1. В течение двух минут осуществлялся кюретаж альвеол удаленных зубов. Затем альвеолы животных в экспериментальной группе аугментировались графтом (порош- ком) на основе волластонита, допированного гидроксиапатитом. Фракция графта составляла от 0,1 до 0,05 мм, объём – 1,5 см3. Далее операционная рана ушивалась наглухо узловыми нерассасывающимися швами («Вик-рилл», США). Операционная рана в течение недели обрабатывалась 0,9 % раствором хлористого натрия. На 10-е сут швы снимались.
Эвтаназия животных проводилась через 60 дней путем внутримышечного введения 2 % ксилозина и 5 % кетамина с последующим введением 1 % пропафола (5 мг/кг) и 19,1 % хлористого калия (1 мг/кг). Все манипуляции с подопытными животными осуществлялись в соответствии с принципами Хельсинкской декларации о гуманном обращении с животными. Проведение исследований одобрено этическим комитетом ФГБОУ ВО ТГМУ Минздрава России (протокол № 3 от 16 ноября 2020 г.). В качестве материала для гистологического исследования был выбран фрагмент нижней челюсти. После изъятия фрагменты фиксировались в формалине и декальцинировались в растворе «СофтиДек» («БиоВитрум», Россия). Из декальцинированного биоматериала изготавливались парафиновые блоки и делались срезы толщиной 16– 20 мкм, которые окрашивались гематоксилином Эрлиха, эозином и по методу Маллори, после чего просматривались с помощью микроскопа CX41, оснащенного цифровой камерой U-TV0.35XC-2 (Olympus, Япония), при увеличениях ×100 и ×200. Измерения проводились в 10 точках у трех животных в каждой группе (рис. 1). Морфометрическая обработка полученных изображений в 10 полях зрения осуществлялась с помощью программы CellSens (Olympus, Япония).
Статистическая обработка полученных данных производилась с помощью t-критерия Стьюдента и непараметрического критерия Манна – Уитни. Нормальность распределения проверялась с использованием критерия Шапиро – Уилка.
Результаты и обсуждение. Исследованию подвергался альвеолярный отросток нижней челюсти: в проекции зубов 3.1 (группа 1), в области удаленных зубов (группа 2) и после аугментации (группа 3).
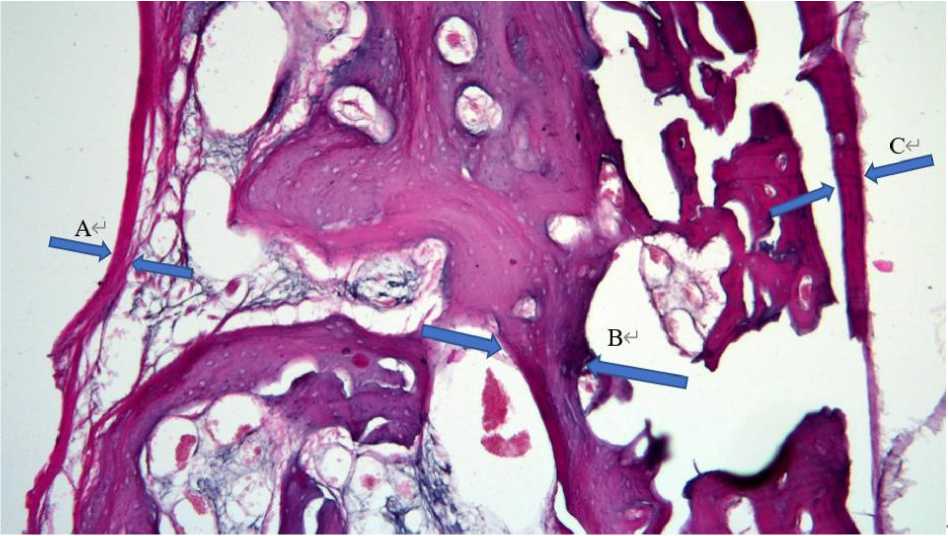
Рис. 1. Схема измерения компонентов компактной кости стенки альвеол зубов-резцов после экстракции зуба: А – внутренняя кортикальная пластинка стенки альвеол зубов, В – балки компактной кости, С – наружная кортикальная пластинка.
Окраска гематоксилином Эрлиха, эозином. Ув. ×100
Fig. 1 . Components of the compact bone in the alveolar wall of incisors after tooth extraction: A – internal cortical plate in the dental alveolar wall, B – compact bone beams, C – external cortical plate.
Ehrlich’s hematoxylin and eosin staining (magnification, ×100)
В качестве препаратов для гистологии были использованы фрагменты переднего отдела нижней челюсти, куда был имплантирован биокомпозит.
Экстракция зубов приводит к резорбции внутренней кортикальной пластинки альвеолярного отростка нижней челюсти, что нашло выражение в уменьшении показателей её толщины (рис. 1). Восстановление толщины кортикальной пластинки происходило в группе 3 после аугментации графтом на основе волластонита с гидроксиапатитом. Отмечалось утолщение периоста и пародонта. Видны новооб-разующиеся кровеносные сосуды различного калибра.
Следует сделать вывод о том, что при введении в альвеолы удаленных зубов биокомпозита прорастание кровеносных сосудов
и соединительной ткани в имплант происходит без истончения и рассасывания костных балок и трабекул компактной кости.
В табл. 1 приведены морфометрические показатели костной ткани животных исследуемых групп.
Внешний диаметр остеона на щечной и язычной поверхностях нижней челюсти, толщина кортикальной пластинки и периоста на поверхности зубной лунки при имплантации увеличились по сравнению с контролем.
Как следует из табл. 1, ширина внутренней и наружной кортикальных пластинок и толщина костных балок компактной кости альвеолярного отростка нижней челюсти кости в группе 3 были достоверно больше, чем в группе 2, но не имели значимых различий по сравнению с группой 1.
Таблица 1
Table 1
Морфометрическая характеристика костной ткани альвеолярного отростка нижней челюсти
Таким образом, после экстракции зубов происходит резорбция внутренней кортикальной пластинки и уменьшение толщины костных балок компактной кости альвеолярного отростка нижней челюсти, если не проводится аугментация альвеолы зуба графтом на основе волластонита, допированного гидроксиапатитом. Аналогичный результат стимуляции репарации костной ткани был получен при использовании каркасов из волластонита с трикальцийфосфатом [20] и пористой биокерамикой из β-трикальциевого фосфата [21]. Как показали исследования, пористость имплантируемых изделий оказывала значительное влияние на скорость интеграции имплантируемых веществ. В этом плане используемый в данном исследовании графт на основе волластонита с гидроксиапатитом при аугмента-
ции альвеолярного отростка имеет явные преимущества за счет дисперсности своей структуры.
Заключение. В ходе проведения исследования было показано, что графт на основе волластонита с гидроксиапатитом активно препятствует дегенерации внутренней и наружной кортикальных пластинок альвеолярного отростка нижней челюсти. Немаловажным компонентом, обеспечивающим прочность костной ткани нижней челюсти, является сохранение толщины костных балок, что также обеспечивается аугментацией графтом на основе волластонита, допированного гидроксиапатитом. Таким образом, данный материал можно рассматривать в качестве перспективного для сохранения объема костной ткани при утрате зубов.
Morphometric characteristics of the bone tissue in the alveolar process of the lower jaw
|
Показатель Parameter |
Группа 1 (контроль) Group 1 (control) (n=3) |
Группа 2 (удаление зуба) Group 2 (tooth extraction) (n=3) |
Группа 3 (удаление + аугментация) Group 3 (extraction + augmentation) (n=3) |
|
Ширина внутренней кортикальной пластинки, мкм Thickness of the inner cortical plate, μm |
65,6±3,4 |
30,9±3,4** |
50,9±3,5** |
|
Ширина наружной кортикальной пластинки, мкм Thickness of the outer cortical plate, μm |
237,6±1,8 |
219,4±4,8* |
231,8±2,6* |
|
Толщина костных балок, мкм Thickness of bone beams, μm |
52,1±3,9 |
30,6±3,7* |
68,5±6,5* |
Примечание . Различия между показателями достоверны: * – р<0,05, ** – р<0,001.
Note . The differences are significant: *– p<0.05, ** – p<0.001.
Исследование выполнено при финансовой поддержке Российского научного фонда (проект № 18-73-10107).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Разработка концепции и дизайна: Афонин И.С.
Анализ и интерпретация данных: Афонин И.С., Апанасевич В.И., Евдокимов И.О., Шичалин О.О., Плехова Н.Г.
Обоснование рукописи или проверка критически важного интеллектуального содержания:
Зиновьев С.В., Апанасевич В.И., Усов В.В.
Окончательное утверждение для публикации рукописи: Апанасевич В.И., Зиновьев С.В., Папынов Е.К., Костив Е.П.
Список литературы Морфологическая картина костной ткани при имплантации дисперсного биокомпозита на основе волластонита
- Boersema G.S., Grotenhuis N., Bayon Y., Lange J.F., Bastiaansen-Jenniskens Y.M. The Effect of Biomaterials Used for Tissue Regeneration Purposes on Polarization of Macrophages. BioResearch Open Access. 2016; 5 (1): 6-14. DOI: 10.1089/biores.2015.0041.
- Kuc J., Sierpinska T., GoiqbiewskaM. Alveolar ridge atrophy related to facial morphology in edentulous patients. Clinical Interventions in Aging. 2017; 12 (1): 1481-1494. DOI: 10.2147/CIA.S140791.
- Tarasenko S.V., Ershova A.M. Synthetic osteoplastic materials for alveolar bone augmentation before dental implantation. Stomatologiia. 2017; 96 (2): 70-74. DOI: 10.17116/stomat201796270-74.
- AraujoM.G., Lindhe J. Dimensional ridge alterations following tooth extraction. An experimental study in the dog. Journal of clinical periodontology. 2005; 32 (2): 212-218. DOI: 10.1111/j.1600-051X.2005.00642.x.
- Todorovic L., Bogdanovic D., Obradovic O. Involution of the mandibular alveolar process and dental branches of the inferior dental artery. Bulletin du Groupement international pour la recherche scientifique en stomatologie & odontology. 1982; 25 (1): 65-71.
- Ananyan S.G., Gunko M.V., Zakaryan A.V., Gvetadze S.R. Surgical aspects of alveolar bone augmentation. Stomatologiia. 2015; 94 (2): 47-52. DOI: 10.17116/stomat201594247-52.
- Shao H., Sun M., Zhang F. Custom Repair of Mandibular Bone Defects with 3D Printed Bioceramic Scaffolds. Journal of Dental Research. 2018; 97 (1): 68-76. DOI: 10.1177/0022034517734846.
- Iaquinta M.R., Mazzoni E., Manfrini M. Innovative biomaterials for bone regrowth. International Journal of Molecular Sciences. 2019; 20 (3): 1-17. DOI: 10.3390/ijms20030618.
- Anghelescu V.M., Neculae I., Dinca O. Inflammatory-driven angiogenesis in bone augmentation with bovine hydroxyapatite, B-tricalcium phosphate, and bioglasses: A comparative study. Journal of Immunology Research. 2018; 2018 (9): 1-8. DOI: 10.1155/2018/9349207.
- Saghiri M.A., Asatourian A., Garcia-Godoy F., Sheibani N. The role of angiogenesis in implant dentistry part II: The effect of bone-grafting and barrier membrane materials on angiogenesis. Medicina Oral, Patologia Oral, Cirugia Bucal. 2016; 21 (4): e526-e537. DOI: 10.4317/medoral.21200.
- Zenebe C.G. A Review on the Role of Wollastonite Biomaterial in Bone Tissue Engineering. BioMed Research International. 2022; 13 (1): 4996530. DOI: 10.1155/2022/4996530.
- Ge R., Xun C., Yang J., Jia W., Li Y. In vivo therapeutic effect of wollastonite and hydroxyapatite on bone defect. Biomedical Materials. 2019; 14 (6): 065013. DOI: 10.1088/1748-605X/ab4238.
- Epple M., Chernousova S. Bioactive bone substitution materials. Advanced Biomaterials and Devices in Medicine. 2014; 1 (1): 74-86. DOI: 10.24411/2409-2568-2014-00008.
- Himansu S.N., Thomas V., Nukavarapu S.P. Biomaterials 2021: Future of biomaterials. Current Opinion in Biomedical Engineering. 2021; 18 (1): 100304. DOI: 10.1016/j.cobme.2021.100304.
- Xu J.L., Khor K.A. Chemical analysis of silica doped hydroxyapatite biomaterials consolidated by a spark plasma sintering method. Journal of Inorganic Biochemistry. 2007; 101 (2): 187-195. DOI: 10.1016/ j.jinorgbio.2006.09.030.
- Cheah C. W., Al-Namnam N.M., Lau M.N. Synthetic Material for Bone, Periodontal, and Dental Tissue Regeneration: Where Are We Now, and Where Are We Heading Next? Materials. 2021; 14 (20): 6123. DOI: 10.3390/ma14206123.
- Jahan K., Tabrizian M. Composite biopolymers for bone regeneration enhancement in bony defects. Biomaterials Science. 2016; 4 (1): 25-39. DOI: 10.1039/c5bm00163c.
- Smeets R., Matthies L., Windisch P. Horizontal augmentation techniques in the mandible: a systematic review. International Journal of Implant Dentistry. 2022; 8 (1): 23. DOI: 10.1186/s40729-022-00421-7.
- Tolstunov L., Hamrick J.F.E., Broumand V. Bone Augmentation Techniques for Horizontal and Vertical Alveolar Ridge Deficiency in Oral Implantology. Oral and maxillofacial surgery clinics of North America. 2019; 31 (2): 163-191. DOI: 10.1016/j.coms.2019.01.005.
- Barbosa W.T., de Almeida K.V., de Lima G.G. Synthesis and in vivo evaluation of a scaffold containing wollastonite/ß-TCP for bone repair in a rabbit tibial defect model. Journal of biomedical materials research. Part B. Applied biomaterials. 2020; 108 (3): 1107-1116. DOI: 10.1002/jbm.b.34462.
- Xu S., Lin K., Wang Z. Reconstruction of calvarial defect of rabbits using porous calcium silicate bioactive ceramics. Biomaterials. 2008; 29 (17): 2588-2596. DOI: 10.1016/j.biomaterials.2008.03.013.


