Морфологические и перфузионные предикторы отдаленных церебральных нарушений у кардиохирургических пациентов
Автор: Портнов Ю.М., Семенов С.Е., Сырова И.Д., Сигитов И.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.34, 2019 года.
Бесплатный доступ
Цель: оценить морфологическое состояние головного мозга и мозгового кровообращения у пациентов, направленных на операцию коронарного шунтирования, для выявления предикторов отдаленных послеоперационных церебральных осложнений.Материал и методы. В исследование включены 33 пациента мужского пола, разделенные на две группы по наличию либо отсутствию отдаленных неврологических осложнений через 5 лет после операции. Всем пациентам выполнялась нативная компьютерная томография головного мозга и перфузионная компьютерная томография до операции. Нативная компьютерная томография повторялась через 5 лет после операции.Результаты. Показатели перфузии во всех зонах измерения у пациентов двух групп значимо не различались. Статистически значимых различий ширины III желудочка и вентрикуло-краниального индекса (ВКИ) между группами выявлено не было. У пациентов двух групп перед операцией значимо различалась только встречаемость лейкоареоза: перивентрикулярный лейкоареоз чаще определялся у пациентов 2-й группы (в 78% случаев), чем у пациентов 1-й группы (в 31% случаев), p=0,0455.Обсуждение. Размеры полостной системы мозга и предоперационное состояние микроциркуляторного кровотока не являются предикторами отдаленных послеоперационных неврологических нарушений. Однако через 5 лет после операции у пациентов 2-й группы выявлялись клинико-лучевые признаки перенесенных ишемических изменений, чего не отмечено у пациентов 1-й группы, то есть можно сделать вывод, что лейкоареоз является неблагоприятным прогностическим показателем послеоперационных цереброваскулярных нарушений в отдаленном периоде.Заключение. Достаточным предоперационным обследованием состояния головного мозга при направлении пациента на кардиохирургическую операцию можно считать выполнение рутинных компьютерной (КТ) или магнитно-резонансной томографии (МРТ) для выявления морфологических проявлений церебральной микроангиопатии в виде феномена лейкоареоза. Данных пациентов следует относить к группе риска, использовать необходимый комплекс мероприятий по профилактике отдаленных церебральных осложнений.
Лейкоареоз, мультиспиральная компьютерная томография, перфузионная компьютерная томография, послеоперационные неврологические нарушения, кардиохирургические операции
Короткий адрес: https://sciup.org/149125284
IDR: 149125284 | УДК: 616.12-089-06: | DOI: 10.29001/2073-8552-2019-34-1-92-97
Текст научной статьи Морфологические и перфузионные предикторы отдаленных церебральных нарушений у кардиохирургических пациентов
Трудно переоценить значение кардиохирургических операций для пациентов с кардиоваскулярными заболеваниями. Нередко это единственный способ спасти пациенту жизнь. Но, помимо объективных плюсов кардиохирургии, нельзя забывать и о вероятных последствиях данного вида хирургического вмешательства. Список их широк и включает множество патологических состояний: от снижения когнитивного статуса до ишемического инсульта. Зная риски развития отдаленных осложнений, уже на предоперационном периоде можно сформировать комплекс профилактических мероприятий, направленных на снижение послеоперационной смертности и инвалидизации. Для выявления предикторов отдаленных неврологических нарушений мы использовали нативную муль-тиспиральную компьютерную томографию (МСКТ) головного мозга и перфузионную компьютерную томографию (ПКТ).
Как правило, у пациентов соответствующей возрастной категории нередко выявляются атрофические изменения вещества мозга, чему соответствует расширение полостной системы мозга и проявления церебральной микроангиопатии в виде феномена лейкоареоза. Лейкоареоз — это нейровизуализационный симптом в виде обычно симметричных двусторонних диффузных изменений белого вещества головного мозга с понижением плотности на КТ-изображениях или изменением сигнала на МР-изображениях [1–4]. По локализации лейкоареоз делится на перивентрикулярный и субкортикальный: перивентрикуляр-ный лейкоареоз представлен в виде изменений по периметру боковых желудочков, субкортикальный лейкоареоз имеет вид рассеянных очагов или очагов сливного характера. Иногда лей-коареоз выглядит единой крупной зоной поражения.
Для количественной оценки степени выраженности используют шкалу Fazekas: 0 — отсутствуют изменения белого вещества, 1 — имеются точечные поражения белого вещества, 2 — имеются изменения сливного характера, 3 — имеются обширные сливные изменения белого вещества мозга. Существует модифицированная версия данной шкалы с учетом возраста [5]. Как правило, лейкоареоз является следствием поражения мелких сосудов, среди значимых факторов риска развития лейкоареоза выделяют кардиоваскулярные и цереброваскулярные болезни, которые превалируют у возрастных пациентов [6].
Несмотря на прилагаемые усилия, патогенез лейкоареоза остается не до конца изученным. Среди гипотез выделяются две — это ишемия и нарушение гематоэнцефалического барьера. Объединяющей эти две гипотезы является дисфункция эндотелия, которой на данный момент уделяется повышенное внимание. Также важную роль занимает генетическая предрасположенность к развитию сосудистых изменений [7, 8].
Морфологически изменения весьма гетерогенны, можно выделить следующие изменения: демиелинизация, глиоз, расширение периваскулярных пространств, внутриклеточный и внеклеточный отек, инфаркты вещества мозга. Перивентри-кулярные изменения с ровными контурами чаще связывают с проникновением спинномозговой жидкости в прилегающее вещество мозга и формированием участка глиоза. Неровные контуры могут быть связаны с инфарктами, обширной демиелинизацией и утратой аксонов. Субкортикальные изменения чаще обусловлены глиозом, лакунарными инфарктами, расширением периваскулярных пространств [9]. Среди наиболее значимых факторов риска развития лейкоареоза чаще всего описываются возраст и артериальная гипертензия. Несмотря на нередкую бессимптомность лейкоареоза, его все чаще связывают с такими состояниями, как депрессия, деменция, инсульт, послеоперационные осложнения [10, 11]. Обзор исследований подтверждает наши выводы о статистически значимой зависимости наличия лейкоареоза и развития послеоперационных осложнений [12, 13].
Цель: оценка предоперационного морфологического состояния головного мозга и мозгового кровообращения у пациентов, направленных на операцию коронарного шунтирования в условиях искусственного кровообращения (ИК), для выявления предикторов отдаленных церебральных осложнений.
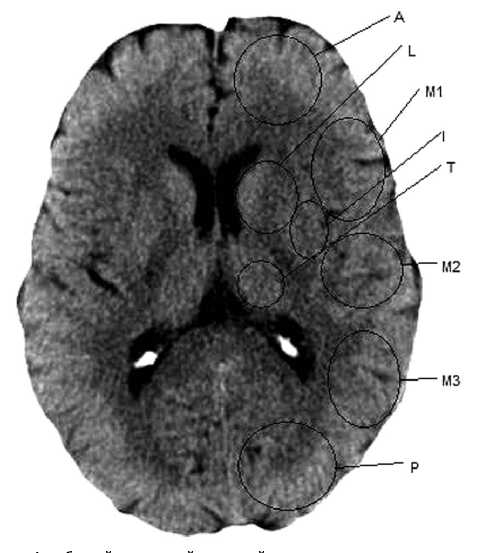
A — бассейн передней мозговой артерии
P — бассейн задней мозговой артерии
M1 — задние отделы нижней лобной извилины
M2 — задние отделы верхней височной извилины
M3 — задний стык
I — островок
T — таламус
L — лентикулярные ядра
Рис. 1. Зоны измерения показателей перфузии
Fig. 1. Areas of perfusion measurements
Материал и методы
Когорта пациентов представляла собой 33 человек мужского пола, (средний возраст — 57±5 лет). Все пациенты предоставили информированное согласие на участие в исследовании. В исследование включались пациенты кардиохирургического профиля, направленные на операцию коронарного шунтирования. Исключались из исследования пациенты, имеющие каротидные стенозы более 50%, тяжелые формы нарушения ритма сердца, хроническую сердечную недостаточность (ХСН) IIБ стадии и более, сахарный диабет, хроническую обструктивную болезнь легких (ХОБЛ), онкопатологию, нейротравму, любые эпизоды нарушения мозгового кровообращения, проявления деменции, по данным шкалы MMSE (Mini-mental State Examination) менее 24 баллов.
На этапе предоперационной подготовки (за 3–5 суток) пациентам предлагалось пройти короткий опросник MMSE для исключения деменции, осуществлялся стандартизированный неврологический осмотр.
За 3 суток до операции проводилось нативное сканирование и ПКТ головного мозга на мультиспиральном (64 среза) компьютерном томографе Somatom Sensation (Siemens, Германия) с внутривенным болюсным введением (8 мл/с) рентгеноконтрастного препарата (неионный рентгеноконтрастный препарат с низкой осмолярностью и содержанием йода 350 мг/мл) в кубитальную вену (табл. 1).
Оценку показателей перфузии [14] проводили с помощью приложения Neuro PCT, входящего в пакет программного обеспечения независимой рабочей станции Leonardo (Siemens, Германия). При проведении исследований каких-либо осложнений отмечено не было.
Определяли следующие параметры церебральной перфузии:
-
• церебральный кровоток (CBF), мл/100 г/мин;
-
• церебральный объем крови (CBV), мл/100 г;
-
• время до достижения максимальной (пиковой) концентрации контрастного вещества (TTP), с. Выбранные показатели измерялись в симметричных корковых и субкортикальных зонах, представленных на рисунке 1.
На нативных изображениях оценивали ширину III желудочка, вентрикуло-краниальный индекс (ВКИ) Evans 1, наличие лейкоареоза. Все пациенты оперировались в условиях общей анестезии, включая вводный наркоз, искусственную вентиляцию легких и нормотермию. ИК проводилось с использованием ламинарного режима, среднее время ИК и время
Таблица 1. Параметры сканирования при ПКТ
Table 1. Perfusion computed tomography scan options
Пациенты были разделены на 2 группы. Критерием формирования групп было возникновение или отсутствие отдаленных неврологических изменений, проявляющихся ишемическим инсультом, деменцией, наличием зон трансформации вещества головного мозга по данным нативной МСКТ. Пациенты 1-й группы ( n =19) не имели осложнений. У пациентов 2-й группы ( n =14) выявлялись клинические и лучевые признаки вышеуказанных осложнений.
Статистическая обработка производилась с использованием статистического пакета Statistica 6.0 (StatSoft, Tulsa, OK, USA) с вычислением средних значений и стандартных отклонений. Качественные показатели анализировались с помощью критерия χ2 Пирсона с поправкой Йетса. Для проверки нулевой гипотезы использовался U-критерий Манна — Уитни.
Результаты
Показатели перфузии во всех зонах измерения у пациентов двух групп значимо не различались, зон значимой гипо- и гиперперфузии выявить не удалось (табл. 2).
При анализе нативных изображений МСКТ головного мозга статистически значимых различий ширины III желудочка (6,1±1,2 и 7,6±1,4 мм) и ВКИ 1 (29,0±1,3 и 30,0±1,2) между пациентами 1 и 2-й групп выявлено не было (табл. 3).
В предоперационный период у пациентов 2-й группы статистически значимо чаще определялся перивентрикулярный лейкоареоз (в 78% случаев), тогда как у пациентов 1-й группы перивентрикулярный лейкоареоз регистрировался заметно реже (в 31% случаев) (рис. 2). Различия между группами значимы ( p =0,0455). Через 5 лет после операции у пациентов
2-й группы выявлялись клинико-лучевые признаки перенесенных ишемических изменений, чего не определялось у пациентов 1-й группы.
Обсуждение
По результатам проведенного исследования можно сделать вывод о том, что статистически значимым неблагоприятным предиктором церебральных осложнений коронарного шунтирования в условиях ИК в отдаленный период является наличие феномена лейкоареоза перед операцией. Обычно лейкоареоз фигурирует как один из морфологических призна-
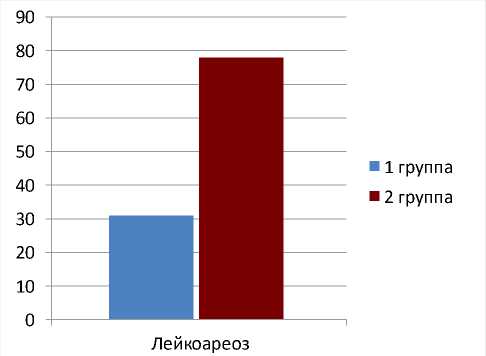
Рис. 2. Соотношение встречаемости лейкоареоза до операции у пациентов двух групп, p=0,0455
Fig. 2. The ratio of the occurrence of leukoaraiosis before surgery in patients of two groups at p=0.0455
Таблица 2. Результаты ПКТ головного мозга у пациентов двух групп
Table 2. The results of brain perfusion computed tomography in patients of two groups
|
Зоны |
CBF ЛП |
CBV ЛП |
TTP ЛП |
CBF ПП |
CBV ПП |
TTP ПП |
CBF ЛП |
CBV ЛП |
TTP ЛП |
CBF ПП |
CBV ПП |
TTP ПП |
|
А |
45,7±9,0 |
2,7±0,4 |
9,5±1,2 |
44,8±7,6 |
2,7±0,3 |
9,9±1,2 |
47,2±8,5 |
2,9±0,4 |
11,5±2,2 |
44,4±13,0 |
2,9±0,4 |
11,7±2,3 |
|
M1 |
60,6±15 |
3,5±0,8 |
8,8±1,4 |
58,3±16 |
3,2±0,4 |
9±1,4 |
54,7±7,3 |
3,3±0,59 |
10,1±2 |
52,6±8,2 |
3,2±0,5 |
11±2,1 |
|
M2 |
63,7±12 |
3,6±0,5 |
8,9±1,3 |
61,6±12 |
3,5±0,4 |
9,1±1,3 |
62,2±9,2 |
3,7±0,38 |
10,7±1,9 |
56,5±8,7 |
3,6± 0,7 |
11,1±2 |
|
M3 |
50,5±13 |
2,9±0,5 |
9,6±1,2 |
51±13 |
2,9±0,4 |
10,1±1,3 |
50,4±7,2 |
2,9±0,4 |
11,8±2,4 |
51,1±7,6 |
3±0,5 |
12± 2,3 |
|
P |
49,7±10 |
3±0,4 |
10,3±1,3 |
52,8±12,0 |
3±0,4 |
10,3±1,4 |
53,2±7,6 |
3,1±0,3 |
12,2±2,1 |
54,4±5,5 |
3,3± 0,3 |
12±2 |
|
L |
62,5±7,0 |
3,5±0,3 |
8,8±1,4 |
59,2±7,2 |
3,4±0,2 |
8,9±1,3 |
59,3±7,7 |
3,5± 0,31 |
10,8±2,1 |
60,8±6,7 |
3,5± 0,3 |
11,1±2,1 |
|
I |
61,9±13 |
3,5±0,6 |
8,8±1,2 |
63,4±12,0 |
3,6±0,5 |
8,9±1,2 |
56,7±6,6 |
3,4± 0,3 |
10,9±2 |
57,7±8,7 |
3,5± 0,5 |
10,8±2,1 |
|
T |
62,5±7 |
3,4±0,4 |
9,2±1,6 |
63,4±11 |
3,5±0,6 |
9,3±1,5 |
60,4±8,1 |
3,4±0,3 |
11,5±2,1 |
60,9±10,0 |
3,4± 0,5 |
11,5±2 |
Таблица 3. Результаты МСКТ головного мозга (ширина III желудочка, ВКИ) у пациентов двух групп
Table 3. The results of cerebral computed tomography (width of the third ventricle, ventriculocranial index) in patients of two groups
При ПКТ не удалось выявить предикторы отдаленных церебральных осложнений. Таким образом, можно сказать, что состояние предоперационного церебрального кровотока
Список литературы Морфологические и перфузионные предикторы отдаленных церебральных нарушений у кардиохирургических пациентов
- Захарова Е.М. Роль лейкоареоза в развитии цереброваскулярных заболеваний. Современные технологии в медицине. 2010;1:81-83.
- Левин О.С. Патология белого вещества при дисциркуляторной энцефалопатии: диагностические и терапевтические аспекты. Трудный пациент. 2011;12:134-136.
- Schmidt R., Fazekas F., Offenbacher H., Machler H., Freidl W., Payer F., et al. Brain magnetic resonance imaging in coronary artery bypass grafts A pre-and postoperative assessment. Neurology. 1993;43(4):775-778.
- Michałowska I., Furmanek M.I., Walecki J.M. Evaluation of brain lesions in patients after coronary artery bypass grafting using MRI with the emphasis on susceptibility-weighted imaging. Polish Journal of CardioThoracic Surgery. 2015;12(1):1-7.
- Wahlund L.O., Barkhof F., Fazekas F., Bronge L., Augustin M., Sjögren M., et al. A new rating scale for age-related white matter changes applicable to MRI and CT. Stroke. 2001;32:1318-1322.
- Pantoni L. Cerebral small vessel disease. The Lancet Neurology. 2010;7:689-701.
- Zupan M. Pathogenesis of Leukoaraiosis: A Review. In: Ed. Lenasi H. Microcirculation Revisited. IntechOpen;2016:155-173. e 978-953- 51-2731-4.
- ISBN: 9789535127314
- Huang W-Q., Yi K-H., Li Z., Wang H., Li M-L., Cai L-L., et al. DNA Methylation Profiling Reveals the Change of Inflammation-Associated ZC3H12D in Leukoaraiosis. Front. Aging Neurosci. 2018;10:143.
- DOI: 10.3389/fnagi.2018.00143
- Young V.G., Halliday G.M., Kril J.J. Neuropathologic correlates of white matter hyperintensities. Neurology. 2008;71(11):804-811.
- Kim K.W., MacFall J.R., Payne M.E. Classification of white matter lesions on magnetic resonance imaging in elderly persons. Biol. Psychiatry. 2008;64(4):273-280.
- Xiong Y.Y., Mok V. Age-related white matter changes. J. Aging Res. 2011;2011:617927.
- DOI: 10.4061/2011/617927
- Lin R., Svensson L., Gupta R., Lytle B., Krieger D. Chronic ischemic cerebral white matter disease is a risk factor for nonfocal neurologic injury after total aortic arch replacement. Thorac. Cardiovasc. Surg. 2007;133:1059-1065.
- Morimoto N., Okada K., Uotani K., Kanda F., Okita Y. Leukoaraiosis and hippocampal atrophy predict neurologic outcome in patients who undergo total aortic arch replacement. Ann. Thorac. Surg. 2009;88:476-481.
- Семенов С.Е., Портнов Ю.М., Хромов А.А., Нестеровский А.В., Хромова А.Н., Семенов А.С. Исследования перфузии при нарушениях церебрального кровообращения. Часть II (Частная КТи МР-семиотика, паттерны патологических изменений). Обзор. Комплексные проблемы сердечно-сосудистых заболеваний. 2017;6(1):102-111.
- DOI: 10.17802/2306-1278-2017-1-102-111
- Портнов Ю.М., Семенов С.Е., Короткевич А.А., Милиневский Н.И. Морфологические и функциональные изменения головного мозга в отдаленном периоде после операции коронарного шунтирования в условиях искусственного кровообращения. Медицинская визуализация. 2017;21(4):41-46.
- DOI: 10.24835/1607-0763-2017-4-41-46


