Морфологические изменения миентеральных ганглиев при экспериментальном остром язвенном колите
Автор: Хочанский Дмитрий Николаевич, Макарова Ольга Васильевна, Худоерков Рудольф Михайлович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.23, 2015 года.
Бесплатный доступ
Проведено морфологическое исследование энтеральной нервной системы ободочной кишки у мышей линии C57Bl/6 при экспериментальном декстраниндуцированном остром язвенном колите. Изучены клеточный состав миентеральных ганглиев и цитометрические показатели миентеральных нейронов. При колите по сравнению с контролем выявлено снижение числа гипохромных нейронов и глиоцитов, увеличение числа гиперхромных нейронов на ганглий, уменьшение размеров нейронов и их ядер. Выявленные морфологические изменения миентеральных ганглиев ободочной кишки при остром язвенном колите могут обусловливать нарушения моторной и секреторной функции.
Энтеральная нервная система, морфология, колит, нейроны, глия
Короткий адрес: https://sciup.org/143177052
IDR: 143177052
Текст научной статьи Морфологические изменения миентеральных ганглиев при экспериментальном остром язвенном колите
Введение. По данным клинических исследований в последние годы отмечается увеличение распространенности воспалительных заболева- ний кишечника, таких как болезнь Крона и язвенный колит [1, 2]. В патогенезе этих заболеваний важную роль наряду с иммунной играет энтеральная нервная система (ЭНС) - собственная нервная система желудочно-кишечного тракта, состоящая из двух нервных сплетений - субмукозного и миен-терального, которые содержат нервные ганглии, в их составе различают нейроны и глиальные клетки [3, 4]. ЭНС регулирует функциональное состояние кишечника, его моторную и секреторную функции [5]. Структурные и функциональные нарушения ЭНС играют важную роль в развитии клинических проявлений воспалительных заболеваний кишечника. Однако, литературные данные, посвященные изменениям ЭНС при колитах, особенно у человека, фрагментарны [3, 6]. Авторы, исследовавшие ЭНС у пациентов с воспалительными заболеваниями кишечника и у животных с экспериментальным колитом, чаще всего отмечают уменьшение числа нейронов в миентеральном и субмукозном сплетениях [7]. У больных язвенным колитом выявляется гиперплазия и гипертрофия энтеральных нейронов [3, 6].
Цель исследования - изучить морфологические изменения нейронов и глиоцитов миен-теральных ганглиев ободочной кишки при остром язвенном колите, индуцированном декстрансульфатом натрия у самцов мышей C57Bl/6.
Материалы и методы исследования. Работа выполнена на 10 половозрелых мышах самцах С57Bl/6, массой тела 20-28 г. Животных содержали в клетках при естественном освещении, температуре +20-22 ˚С., со свободным доступом к воде и пище. При работе с экспериментальными животными руководствовались приказом Минздрава СССР № 755 от 12.08.1977. На проведение эксперимента получено разрешение биоэтической комиссии ФГБНУ «НИИ морфологии человека». Для индуцирования острого колита (n=5) питьевую воду в поилках на 5 дней заменяли 2,5% раствором декстрансульфата натрия (40 kDa, ApliChem). Контрольная группа мышей (n=5) получала питьевую воду. В течение эксперимента ежедневно проводили оценку общего состояния животных и проявлений колита, которые характе- ризовались загрязнением фекалиями анальной области, иногда с примесью крови. На 7-ые сутки животных опытной и контрольной групп выводили из эксперимента передозировкой диэтилового эфира. Ободочную кишку извлекали из брюшной полости, отмывали от содержимого фосфатносолевыми буфером комнатной температуры и разделяли на проксимальный, медиальный и дистальный отделы, которые фиксировали в жидкости Буэна и заливали в парафиновые блоки. Изготавливали продольно ориентированные гистологические срезы толщиной 10 мкм, затем окрашивали их гематоксилином и эозином и по методу Ниссля крезиловым фиолетовым.
Для морфометрии и фотосьемки использовали микроскоп Leica DM2500 (обьективы x10, x40, x100), оснащенный цифровой фотокамерой Leica DFC 295 с матрицей с разрешающей способностью 3,2 Мп. Использовали программное обеспечение ImageJ и графический планшет Wacom. Подсчет клеток в миентеральных ганглиях проводили визуально при увеличении 640 под микроскопом по глубине препарата. При оценке клеточного состава в 40 миентеральных ганглиях на каждом препарате подсчитывали нейроны центрального сечения с нормо-, гипо- и гиперхромным тигроидом, с ядром без ядрышка, гиперхромные пикнотические, нейроны с отчетливо визуализируемым тигроидом, но без ядра и глиальные клетки (рис. 1). Нейронами центрального сечения считали те нейроны, в которых определялось ядро с четкой границей и ядрышко (8). Глиальные клетки характеризовались относительно небольшим размером ядра с более плотным хроматином и от- сутствием тигроида. Определяли площадь 15 нейронов центрального сечения и их ядер в каждом препарате. Результаты морфометрии трех отделов ободочной кишки суммировались. Проводили статистическую обработку полученных данных в программах Statistica 8.0, AtteStat. Достоверность различий между показателями устанавливали с использованием непараметрического критерия Манна-Уитни. Различия считали статистически значимыми при p < 0,05.
Результаты исследования и их обсуждение. На 3-5 сутки от начала потребления декстрансульфата натрия общее состояние животных опытной группы по сравнению с контролем прогрессирующее ухудшалось, двигательная активность и потребление пищи снижались, отмечалась пилоэрекция. На 7-ые сутки эксперимента у всех мышей опытной группы выявлялось загрязнение анальной области фекалиями с примесью крови. При вскрытии животных опытной группы отмечалось уменьшение длины толстой кишки с чередованием зон расширения и сужения просвета. Содержимое толстой кишки у мышей опытной группы было жидким и темно-красного цвета, а в контрольной группе желто-коричневого цвета с увеличением плотности содержимого в дистальном отделе ободочной кишки.
При микроскопическом исследовании у животных опытной группы по сравнению с контролем во всех трех отделах ободочной кишки в слизистой оболочке отмечались язвы и эрозии, отек и воспалительная инфильтрация из макрофагов, нейтрофилов и лимфоцитов (рис. 2). Выраженность язвенного поражения была максимальной в
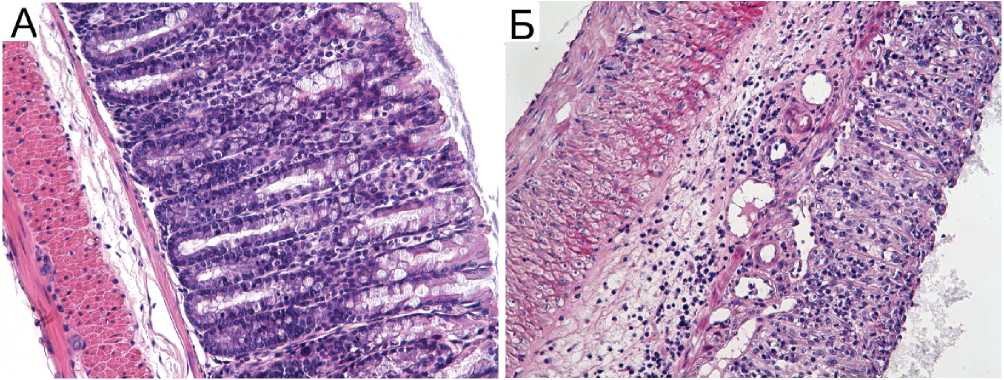
Рис. 1 Стенка дистальной отдела ободочной кишки мыши контрольной группы (А) и с острым язвенным колитом (Б). А - патологических изменений не выявляется; Б - острая язва представлена грануляционной тканью с выраженной воспалительной инфильтрацией. Отек и воспалительная инфильтрация подслизистого слоя. Окраска гематоксилином и эозином. Ув. 200.
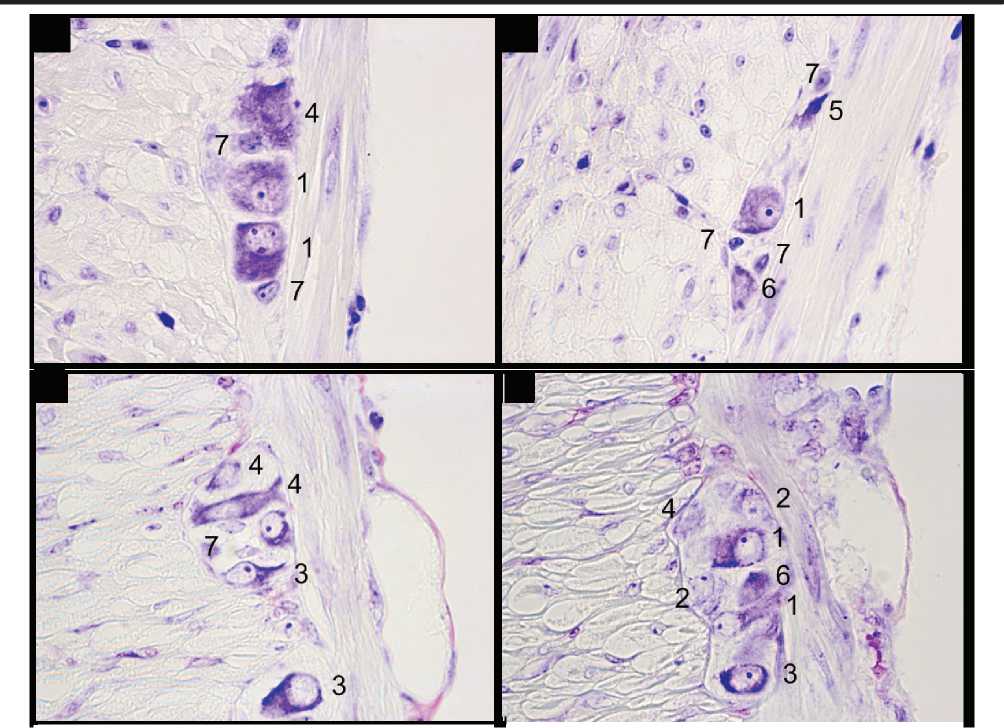
Рис. 2 Миентеральный ганглии ободочной кишки мышей контрольной группы (А, Б) и при остром язвенном колите (В, Г): 1 – нормохромные нейроны; 2 – гипохромные нейроны ; 3 – гиперхромные нейроны;4 – нейроны с ядром без ядрышка;5 – пикнотические гиперхромные нейроны; 6 – нейроны без ядра;7 - глиальные клетки. Окраска по Нисслю. Ув.640.
дистальном отделе ободочной кишки. В мышечной оболочке и миентеральных ганглиях воспалительные изменения отсутствовали.
В миентеральных ганглиях у животных опытной группы по сравнению с контролем определялось очаговое разряжение нейропиля. При анализе клеточного состава миентераль-ных ганглиев выявлено статистически значимое снижение количества гипохромных и увеличение гиперхромных нейронов, снижение числа клеток нейроглии. Общее количество нейронов на ганглий при остром язвенном колите по сравнению с контролем статистически значимо не изменилось (табл.1), а площадь миентеральных нейронов центрального сечения и их ядер статистически значимо уменьшилась (табл. 2). Показатели глио-нейронального индекса миентеральных ганглиев и ядерно-цитоплазматического отношения нейронов при колите не отличались между группами (табл.1, табл. 2) .
В настоящей работе использована окраска гистологических препаратов по Нисслю крези- ловым фиолетовым, которая широко применяется нейроморфологами. Этот метод основан на взаимодействии щелочного красителя, например крезилового фиолетового, с нуклеиновыми кислотами, сконцентрированными в ядре или шероховатом ретикулуме нейронов [9]. Тинкториальные свойства (хромность) цитоплазмы нейронов зависят от состояния тигроида и отражают гетерогенность популяций нейронов [10].
По данным литературы, основанным на исследовании морфологических изменений нейронов в ЦНС, гипохромия нейронов с неизмененной морфологией ядра может быть связана с центральным хроматолизом, острым или гидропическим набуханием нейронов [10]. При центральном хроматолизе отмечается разряжение тигроида в центральных участках клетки, а ядро сдвигается к ее краю. При остром набухании тигроид разряжается и цитоплазма нейрона приобретает гомогенный вид. При гидропичесских изменениях нейронов вокруг ядра выявляются светлые вакуоли. Гиперхромия или сморщивание нейронов в ЦНС
Таблица 1.
Клеточный состав миентеральных ганглиев
|
Показатели на ганглий |
Контроль |
Острый язвенный колит |
Отклонение от контроля, % |
Достоверность различий, p |
|
Нормохромные нейроны |
0,58±0,03 |
0,59±0,03 |
+2% |
0,82 |
|
Гипохромные нейроны |
0,44±0,03 |
0,28±0,02 |
-36% |
<0,05 |
|
Гиперхромные нейроны |
0,08±0,01 |
0,18±0,02 |
+55% |
0,05 |
|
Все нейроны центрального сечения |
1,1±0,05 |
1,05±0,04 |
-5% |
0,37 |
|
Нейроны с ядром не центрального сечения |
0,32±0,03 |
0,34±0,03 |
+6% |
0,49 |
|
Пикнотические нейроны |
0,08±0,02 |
0,08±0,01 |
0% |
0,77 |
|
Нормохромные нейроны без ядра |
1,22±0,05 |
1,09±0,05 |
-11% |
0,2 |
|
Глиоциты |
1,95±0,08 |
1,38±0,06 |
-30% |
<0,05 |
|
Глио-нейрональ-ный индекс |
1,77 |
1,31 |
-26% |
Таблица 2.
Площадь цитоплазмы и ядра миентеральных нейронов центрального сечения
|
Показатели |
Контроль |
Острый язвенный колит |
Отклонение от контроля,% |
Достоверность различий, p |
|
Площадь нейронов в мкм² |
103,11±3,34 |
90,32±2,26 |
-12% |
<0,05 |
|
Площадь ядер в мкм² |
46,88±1,06 |
43,56±0,85 |
-7% |
<0,05 |
|
Ядерно-цитоплазма-тический индекс |
0,48±0,01 |
0,50±0,08 |
+4% |
у человека проявляется в уменьшении размеров нейронов и их ядер, слиянии гранул тигроида в темную массу [10]. Выраженная гиперхромия так называемых темных нейронов традиционно считается признаком их повреждения [11]. Конечным этапом повреждения нейронов является кариоцитолиз с появлением бледных клеток-теней, лишенных ядра. При использовании классических нейрогистологических методов окраски выделяют прогрессивные и регрессивные формы изменения астроцитов. При первом состоянии отмечается гипертрофия астроцитов и нередко их многоядерность, при втором сморщивание клеток и гиперхромия их ядер [10]. Следует отметить что по нашим наблюдениям в большинстве нейронов миентеральных ганглиев мышей опытной и контрольной групп ядро занимает эксцентрическое положение из-за небольшого размера клетки, а детальная оценка морфологии тигроида невозможна из-за небольшого размера цитоплазмы нейронов, вследствие чего экстраполяция данных, полученных на нейронах ЦНС у человека на нейроны миентеральных ганглиев у мышей затруднена. Выявленные при экспериментальном остром колите морфологические изменения ми-ентеральных ганглиев, такие как снижение числа гипохромных нейронов без изменений их ядер и ядрышек, отражают нарушения функционального состояния нейронов, а увеличение числа гиперх-ромных нейронов и уменьшение размеров их ядер и цитоплазмы, уменьшение количества глиоцитов и глиально-нейронального индекса - процессы их альтерации.
Литературные данные об изменении количества энтеральных нейронов и глиоцитов при колите противоречивы. При иммуногистохимическом исследовании энтеральной нервной системы большинство исследователей отмечает снижение количества нейронов при экспериментальном остром и хроническом колите [12 -17].
Ряд авторов указывает что количество нейронов при экспериментальном колите не изменяется [18, 19], имеются сообщения о парадоксальном увеличении числа энтеральных нейронов при колите (20). Количество глиальных клеток по данным литературы может как уменьшаться [17], так и увеличиваться [21 - 22].
Противоречия в результатах исследования количества нейронов и глиальных клеток в энтеральных ганглиях при остром колите может быть связано с тем, что высокоспецифические иммуногистохимические методы, применяемые для выявления клеточных популяций не позволяют идентифицировать клетки с выраженными изменениями в результате потери ими иммунореактивности [23]. Так в зонах некроза слизистой оболочки и подслизистого слоя при остром колите, индуци-рованом тринитробензолсульфоновой кислотой, описывается исчезновение иммунореактивных нейронов и глиальных клеток и постепенное их появление по мере стихания воспалительного процесса [24]. Поэтому оценка патологических изменений энтеральной нервной системы с помощью традиционного метода Ниссля является достаточно информативной.
Выводы. При декстраниндуцированном остром язвенном колите у самцов мышей C57Bl/6 общее количество нейронов на ганглий в ободочной кишке по сравнению с контролем не изменяется, но снижается число гипохромных нейронов и глиоцитов и увеличивается число гиперхромных нейронов на ганглий. Глио-нейрональный индекс уменьшается, что указывает на снижение трофической функции глиоцитов. Размеры нейронов и их ядер уменьшаются. Выявленные морфологические изменения миентеральных ганглиев ободочной кишки при остром язвенном колите могут обусловливать нарушения моторной и секреторной функции.
Список литературы Морфологические изменения миентеральных ганглиев при экспериментальном остром язвенном колите
- Shi X.Z. Differential immune and genetic responses in rat models of Crohn's colitis and ulcerative colitis / Shi X.Z., Winston J.H., Sarna S.K.// Am J Physiol Gastrointest Liver Physiol. 2011 Jan;300(1):G41-51
- Shokrani M. Inflammatory bowel disease: diagnosis and research trends: the clinical lab is playing an increasingly important role. //MLO Med Lab Obs. 2012 Aug; 44(8):8, 10, 12; quiz 14.
- Cirillo C. Ulcerative Colitis - Epidemiology, Pathogenesis and Complications Edited by Mortimer B. O'Connor, Publisher: InTech, Chapters published December 14, - 2011. - P. 29-50. Enteric Nervous System Abnormalities in Ulcerative Colitis By Carla Cirillo, Giovanni Sarnelli and Rosario Cuomo
- Furness J.B. The enteric nervous system and neurogastroenterolog y/ Furness J.B. // Nature Reviews Gastroenterology and Hepatology. - 2012. - № 9. - P. 286-294.
- Furness, J. B. The Enteric Nervous System. Publisher: Blackwell, Oxford. - 2006.
- Geboes K. Structural abnormalities of the nervous system in Crohn's disease and ulcerative colitis / Geboes K., Collins S.// Neurogastroenterol Motil. 1998 Jun;10(3):189-202.
- Moynes D.M. Effects of inflammation on the innervation of the colon / Moynes D.M., Lucas G.H., Beyak M.J., Lomax A.E. // Toxicol Pathol. 2014 Jan;42(1):111-7.
- Худоерков Р.М. Методы компьютерной морфометрии в нейроморфологии. - М.:ФГБУ «НЦН» РAМН, 2014. 53 с.
- Kádár A. Improved method for combination of immunocytochemistry and Nissl staining / Kádár A., Wittmann G., Liposits Z., Fekete C.// J Neurosci Methods. 2009 Oct 30; 184(1): 115-118.
- Ермохин П.Н. Гистопатология центральной нервной системы. М: Медицина -1969 241 с.
- Ooigawa H. The fate of Nissl-stained dark neurons following traumatic brain injury in rats: difference between neocortex and hippocampus regarding survival rate / Ooigawa H., Nawashiro H., Fukui S., Otani N., Osumi A., Toyooka T., Shima K.//Acta Neuropathol 2006 Oct 21;112(4):471-81. Epub 2006 Jul 21.
- Sanovic S., Damage to the Enteric Nervous System in Experimental Colitis /Sanovic S., Lamb D.P., Blennerhassett M.G.//Am J Pathol. 1999 Oct; 155(4): 1051-1057.
- Boyer L. Myenteric plexus injury and apoptosis in experimental colitis /Boyer L., Ghoreishi M., Templeman V., Vallance B.A., Buchan A.M., Jevon G., Jacobson K.// Auton Neurosci. 2005 Jan 15;117(1):41-53.
- Linden D.R. Indiscriminate loss of myenteric neurones in the TNBS-inflamed guinea-pig distal colon. /Linden D.R., Couvrette J.M., Ciolino A., McQuoid C., Blaszyk H., Sharkey K.A., Mawe G.M.// Neurogastroenterol Motil. 2005 Oct;17(5):751-60.
- Lin A. Selective loss of NGF-sensitive neurons following experimental colitis./ Lin A., Lourenssen S., Stanzel R.D., Blennerhassett M.G.// Exp Neurol. 2005 Feb;191(2):337-43.
- Sarnelli G., Myenteric neuronal loss in rats with experimental colitis: role of tissue transglutaminase-induced apoptosis /Sarnelli G., De Giorgio R., Gentile F., Cali G., Grandone I., Rocco A., Cosenza V., Cuomo R., D'Argenio G.//Dig Liver Dis. 2009 Mar;41(3):185-93.
- Sigalet D.L. The effects of glucagon-like peptide 2 on enteric neurons in intestinal inflammation / Sigalet D.L., Wallace L., De Heuval E., Sharkey K.A.// Neurogastroenterol Motil. 2010 Dec;22(12):1318-e350.
- Auli M. Neuromuscular changes in a rat model of colitis /Auli M., Nasser Y,. Ho W., Burgueño J.F., Keenan C.M., Romero C., Sharkey K.A., Fernández E. //Auton Neurosci. 2008 Aug 18;141(1-2):10-21
- Winston J.H. Paradoxical regulation of ChAT and nNOS expression in animal models of Crohn's colitis and ulcerative colitis/ Winston J.H., Li Q., Sarna S.K. //Am J Physiol Gastrointest Liver Physiol. 2013 Aug 15; 305(4): G295-G302.
- Belkind-Gerson J., Colitis induces enteric neurogenesis through a 5-HT4-dependent mechanism /Belkind-Gerson J., Hotta R., Nagy N., Thomas A.R., Graham H., Cheng L., Solorzano J., Nguyen D., Kamionek M., Dietrich J., Cherayil B.J., Goldstein A.M.// Inflamm Bowel Dis. 2015 Apr;21(4):870-8.
- Bradley J.S. Effects of inflammation on cell proliferation in the myenteric plexus of the guinea-pig ileum/Bradley J.S. Jr, Parr E.J., Sharkey K.A. //Cell and Tissue Research, Vol. 289, No. 3,(September 1997), pp. 455-461
- Ippolito C. An integrated assessment of histopathological changes of the Enteric neuromuscular compartment in experimental colitis / Ippolito C., Segnani C., Errede M., Virgintino D., Colucci R., Fornai M., Antonioli L., Blandizzi C., Dolfi A., Bernardini N.//J. Cell. Mol. Med. Vol. XX, No X, 2014 pp. 1-16
- Lomax A.E. Plasticity of the enteric nervous system during in test in alinflammation/Lomax A.E., Fernandez E., Sharkey K.A.//Neurogastroenterol Motil (2005) 17, 4-15
- Poli E., Morphological and functional alterations of the myenteric plexus in rats with TNBS-induced colitis./Poli E., Lazzaretti M., Grandi D., Pozzoli C., Coruzzi G.//Neurochem Res. 2001 Sep;26(8-9):1085-93.


