Морфологические изменения ткани тимуса у экспериментальных животных с моделированным адьювантным артритом под влиянием лечения
Автор: Меметова Эльмаз Ягъяевна, Каладзе Николай Николаевич, Загорулько Александр Кимович
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Фундаментальная биология и медицина
Статья в выпуске: 1, 2014 года.
Бесплатный доступ
Проведено морфологическое исследование тимуса у 18 белых лабораторных чистопородных крыс линии Wistar с моделированным адьювантным артритом, 6 из которых получали физиотерапевтическое лечение БРВС (биорезонансной вибростимуляцией). В условиях данного эксперимента выявлены дистрофические изменения клеточных элементов органа, а также признаки апоптоза. Положительная динамика морфологических изменений ткани тимуса свидетельствовала о необходимости физиолечения сеансами БРВС.
Адьювантный артрит, эксперимент, тимус, крысы, лечение
Короткий адрес: https://sciup.org/14112954
IDR: 14112954 | УДК: 616.72-002.77:611.4:616.092:612.419:615.834-058.86(477.75)
Текст научной статьи Морфологические изменения ткани тимуса у экспериментальных животных с моделированным адьювантным артритом под влиянием лечения
Введение. Проблема ювенильного ревматоидного артрита (ЮРА) продолжает оставаться одной из наиболее актуальных в современной педиатрической ревматологии.
ЮРА – хроническое аутоиммунное системное заболевание соединительной ткани, развивающееся в возрасте до 16 лет, с поражением суставов и возможным вовлечением в процесс внутренних органов, нередко приводящее к ранней инвалидизации больных [1, 3, 5, 14]. В последние годы на территории Украины насчитывается более 3000 больных ЮРА, что составляет 0,41, а первичная заболеваемость – 0,07 на 1000 детского населения (по данным МЗ Украины) [1, 4, 10, 11].
Аутоиммунный процесс заболевания развивается вследствие активации как клеточного, так и гуморального звеньев иммунитета [6]. Преобладание реакций того или иного звена зависит от типа дифференцировки Т-хелперов. Формирование иммунного ответа зависит также и от факторов наследственности, функционального состояния желез внутренней секреции и кроветворных органов. В последние годы большое внимание уделяется выяснению роли тимуса (вилочковой железы) в развитии аутоиммунных заболеваний. Известно, что тимус является уникальным комплексным органом нейроэндокринной и иммунной систем, способным продуцировать ряд пептидных гормонов – α1-тимозин, тимулин и др., которые обеспечивают дифференцировку Т-лимфоцитов и играют важную роль в клеточных иммунных реакциях. В связи с этим очень важным является своевременное выявление структурных изменений в ткани тимуса, происходящих в результате воспалительных процессов при заболевании, что позволит вовремя обнаружить нарушение функциональной активности органа [2].
Для изучения механизма аутоиммунного воспаления, лечения и профилактики ревматоидного полиартрита, а также поиска и разработки новых методов коррекции большое значение имеет создание адекватной модели на животных [16]. Широкое распространение в настоящее время получила экспериментальная модель полиартрита у крыс при подкожном введении полного (содержащего взвесь убитых микобактерий туберкулеза) адъюванта Фрейнда [9]. Разработанная модель по клиническому течению, патологическим и гистологическим данным близка к ревматоидному артриту человека. Она надежна в отношении воспроизведения и позволяет изучать звенья патогенеза ревматоидного артрита, а также выявлять профилактическое и терапевтическое действие лекарственных средств. Адъювантный артрит сопровождается типичной аутоиммунной реакцией, основным звеном которой является Т-клеточный иммунитет, а также изменением функциональной активности тимуса.
Наличие сложного комплекса аутоиммунных нарушений обуславливает большие трудности, связанные с разработкой рациональных методов лечения ревмозаболеваний. Немаловажную роль играет и тот факт, что эти заболевания относятся к разряду болезней, имеющих высокий риск лекарственных взаимодействий, а ряд применяемых при этом медикаментозных средств имеет достаточно узкий терапевтический диапазон. В связи с этим перспективным является использование у данной категории пациентов лечебных комплексов, которые характеризуются многоплановым влиянием на различные звенья патогенеза ревмозаболеваний, что позволяет улучшить результаты лечения [12]. Потребность в создании эффективных методов коррекции отклонений в системе иммунного гомеостаза положила начало новому направлению в иммунологии – иммунореабилитации, под которой подразумевается восстановление нарушенных иммунологических функций, способствующих выздоровлению больного или достижению ремиссии. В последние годы все большее место в общей системе иммунореабилитации занимают природные и преформированные физические факторы. Показано, что оптимальный иммуномодулирующий эффект физических факторов достигается при воздействии на эндокринные (надпочечники и др.) и иммунокомпетентные органы (тимус и др.) [15].
Одним из активно изучающихся физиотерапевтических методов является биорезонанс-ная вибростимуляция (БРВС), которая после независимой технической и клинической экспертизы разрешена к применению в медицинской практике как средство локальной вибростимуляции и массажа в целях профилактики и лечения нарушений периферического кровообращения и трофики тканей (выписка из протокола заседания комиссии Президиума Комитета по новой медицинской технике при МОЗ Украины от 30.05.94 г. № 7). Действие данного метода лечения основано на активизации и нормализации собственных биоритмов организма с одновременным накоплением запасов свободной клеточной энергии и направлено на функциональное восстановление и нормализацию биоритмологической активности систем микроциркуляции организма. По данным литературы, к основным достоинствам комплексной терапии с использованием аппарата «БРС-2М» относится нормализация иммунного и гормонального статуса организма [8]. Однако остается недостаточно изученным влияние БРВС на основные патогенетические звенья ЮРА, о чем свидетельствует незначительное количество публикаций.
Цель исследования. Выявление и изучение изменений в ткани тимуса у экспериментальных животных с моделированным адъювантным артритом на фоне применения физиолечения сеансами БРВС.
Материалы и методы. Исследование проведено на 18 белых лабораторных чистопородных крысах (самцы и самки) линии Wistar, 3-месячного возраста, со средней массой 80–120 г. Крысы содержались в условиях вивария. Экспериментальная модель была сопоставима с детским возрастом человека: были взяты белые крысы породы Wistar в возрасте 14–18 дней (8–10 мес. жизни человека) и массой 16–20 г. Все эксперименты на животных проводились с соблюдением международных принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 1986), а также в соответствии с правилами проведения работы с использованием экспериментальных животных [7, 13].
Способ моделирования выполняли следующим образом: после 2 нед. жизни на протяжении 1 мес. 2 раза в нед. под кожу задней лапки крыс (субплантарно) вводили 0,01 мл полного адъюванта Фрейнда, который содержал 0,01 мг БЦЖ. Аутоиммунный процесс моделировался путем сенсибилизации организма животного в течение 28–30 дней.
Животные, у которых предполагалось исследовать ткань тимуса, были разделены на 3 группы; в каждой группе по 6 крыс (n=6): 1-я группа – здоровые животные породы Wistar (КГ); 2-ю группу составили животные этой же породы с моделью адъювантного артрита, не получавшие лечения; 3-я группа – животные с воспроизведенным адьювантным артритом, которым проводилось физиолечение биорезонансной вибростимуляцией (аппарат «БРС-2М» на область проекции тимуса насадкой В (№ 3), режим интенсивности I, продолжительность процедуры – 3 мин, курс лечения – 8–10 процедур, проводимые через день (3 раза в нед.)).
Через 10 дней после окончания эксперимента животных выводили под эфирным наркозом [17]. Отпрепарированный тимус фиксировали в растворе 2,5 % буферного глютаральдегида для электронной микроскопии. Полутонкие срезы органов (1 мкм) изготавливались на ультратоме УМПТ-7 (Украина). Ультратонкие срезы просматривали и фотографировали на электронных микроскопах ПЭМ-100 (Украина). Увеличение подбиралось адекватно целям исследования и колебалось в пределах 2000–10000.
Результаты и обсуждение. У всех экспериментальных животных к 6–7 нед. развивался полиартрит с преимущественной локализацией в коленных, тазобедренных и плечевых суставах. Клинически отмечалась болезненность суставов при пальпации, ограничение движения в них, особенно в задних конечностях; снижение мышечного тонуса; отсутствие аппетита и потеря веса.
Полученные при электронной микроскопии морфологические результаты свидетельствовали о том, что в ходе эксперимента удалось смоделировать хроническое системное воспаление, характерное для ревматоидного артрита, выявить изменения в ткани тимуса у экспериментальных животных, а также провести правильную коррекцию выявленных нарушений.
В исследуемой КГ здоровых экспериментальных животных неизмененная ткань тимуса имела физиологическое строение. Дольки тимуса состояли из коркового и мозгового вещества.
Клетки тимуса животных второй группы при моделированном адъювантном артрите носили определенные изменения, не имеющие характерной локализации и стереотипные как в корковом, так и в мозговом веществе. Прежде всего обращала на себя внимание разрыхленность соединительнотканного каркаса тимуса, что может быть расценено как проявление экстрацеллюлярного отека, которая сопровождалась снижением плотности лимфоцитарного инфильтрата в петлях звездчатых эпителиоцитов (рис. 1). В самих эпителиоцитах имели место как явления, свидетельствующие о гидропической дистрофии, так и изменения, трактуемые как признаки апоптоза. Причем число клеток с такими изменениями по сравнению со здоровыми животными значительно возрастало. В частности, на апоптоз указывали такие признаки, как резкое повышение электроннооптической плотности цитозоля с уменьшением объемной плотности цитоплазмы (ци-топикноз) и сморщивание ядра (кариопик-ноз), сопровождаемое повышением конденсации хроматина в кариоплазме (рис. 2).
Вместе с тем во многих эпителиоцитах отмечалось разрыхление цитозоля с уменьшением оптической плотности цитоплазмы, снижение плотности матрикса митохондрий с просветлением органелл и нарушением упорядоченного расположения в них крист, расширение профилей канальцев цитоплазматической сети, а также снижение уровня содержания хроматина в ядрах. Описанные ульт-раструктурные изменения расценивались нами как проявления гидропической дистрофии, имеющей, однако, обратимый характер. Аналогичные изменения наблюдались и в лимфоцитах тимуса (рис. 3). Так, в частности, в ядрах клеток отмечалось резкое снижение содержания хроматина, что приводило к просветлению центральной части ядер и конден- сации небольших количеств гетерохроматина вблизи ядерной мембраны (рис. 4). Изменения отечного характера, описанные в отношении внутриклеточных органелл звездчатых эпителиоцитов, имели место и в лимфоцитах (рис. 5).
Эффективным, по данным электронной микроскопии, оказалось применение в третьей группе физиолечения методом БРВС. Прежде всего в этой группе животных обращала на себя внимание нормализация общего строения долек железы с уменьшением межклеточных промежутков и восстановлением плотности лимфоцитарного инфильтрата (рис. 6) за счет исчезновения экстрацеллюлярного отека рыхловолокнистой соединительной ткани. Ультраструктурная организация звездчатых эпителиоцитов приближалась к нормальной. В этих клетках, в частности, нормализовывалось строение ядер, которые приобретали слегка фестончатую форму и содержали умеренное количество хроматина, лишь часть которого была конденсирована в виде гетероформы; ядрышки были выражены отчетливо (рис. 7). Межклеточные контакты вновь становились плотными, из-за чего сетчатое строение долек тимуса восстанавливалось. Лишь в отдельных эпителиоцитах отмечались сохраняющиеся, слабо выраженные признаки интрацеллюлярного отека, проявляющиеся, как правило, просветлением матрикса митохондрий с дезориентацией и дис-комплектацией крист (рис. 8). В большинстве же звездчатых эпителиоцитов восстанавливалась умеренная плотность цитозоля, митохондрии и другие органеллы имели характерное для них строение, а в ядрах количество хроматина достигало нормального уровня (рис. 9).
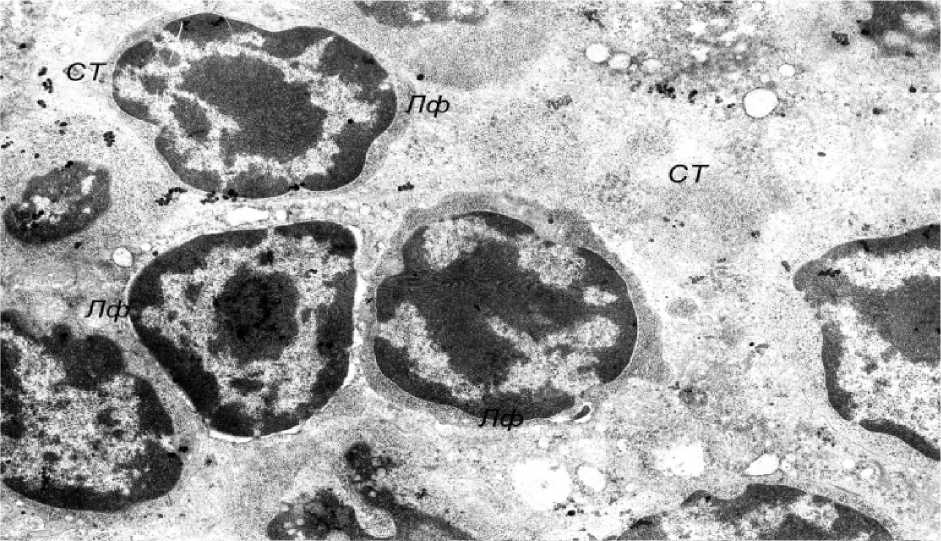
Рис. 1. Разрыхленность соединительнотканного каркаса тимуса (Ст) со снижением плотности лимфоцитарного (Лф) инфильтрата (электронная микрофотография, ×4800)
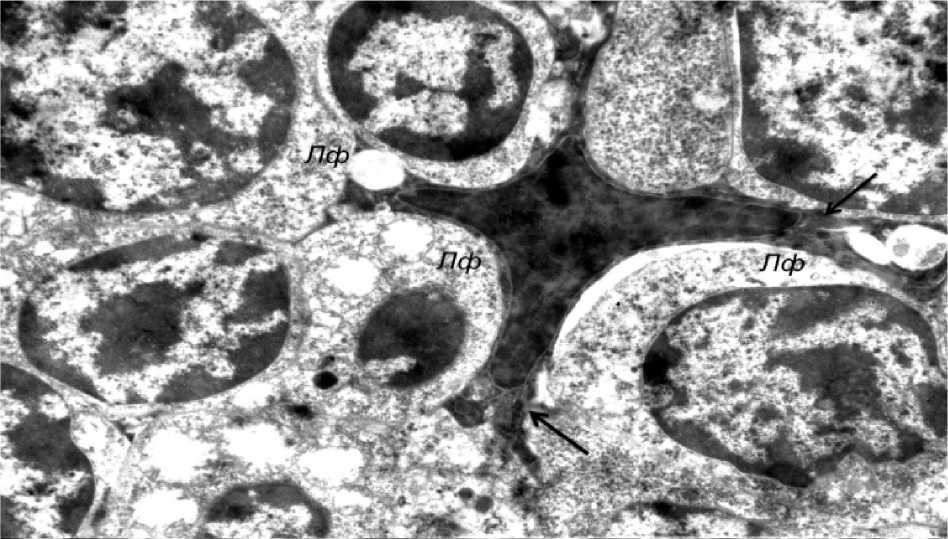
Рис. 2. Явления цитопикноза (стрелки). Кариопикноз (электронная микрофотография, ×3200)
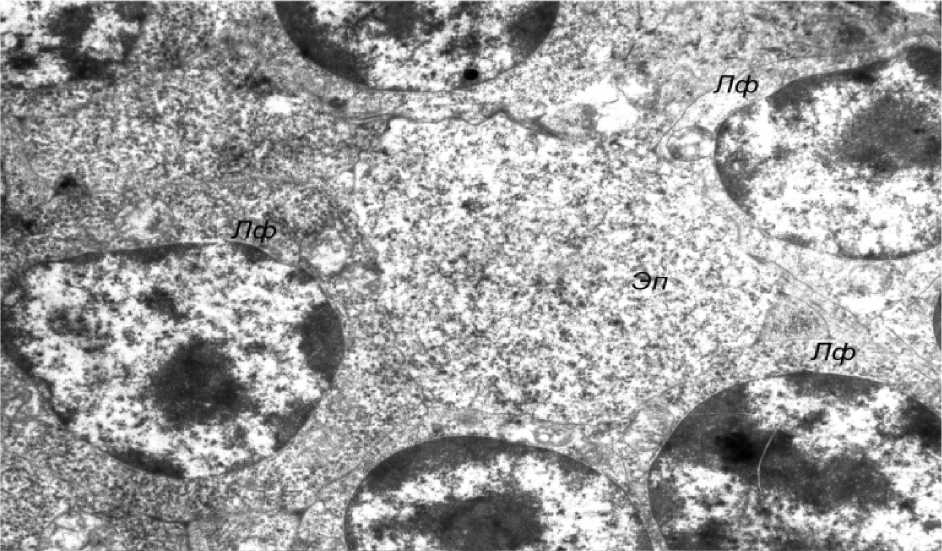
Рис. 3. Ультраструктурные изменения обратимой гидропической дистрофии в звездчатых эпителиоцитах (Эп) и лимфоцитах тимуса (электронная микрофотография, ×4800)
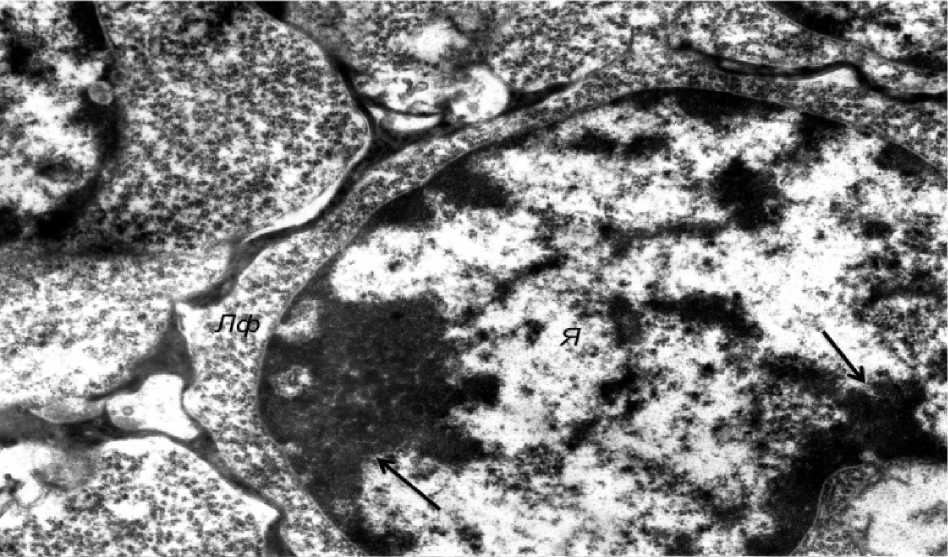
Рис. 4. Снижение содержания хроматина в ядрах (Я) лимфоцитов с просветлением центральной части и конденсацией глыбок гетерохроматина (стрелки) вблизи мембраны (электронная микрофотография, ×9000)
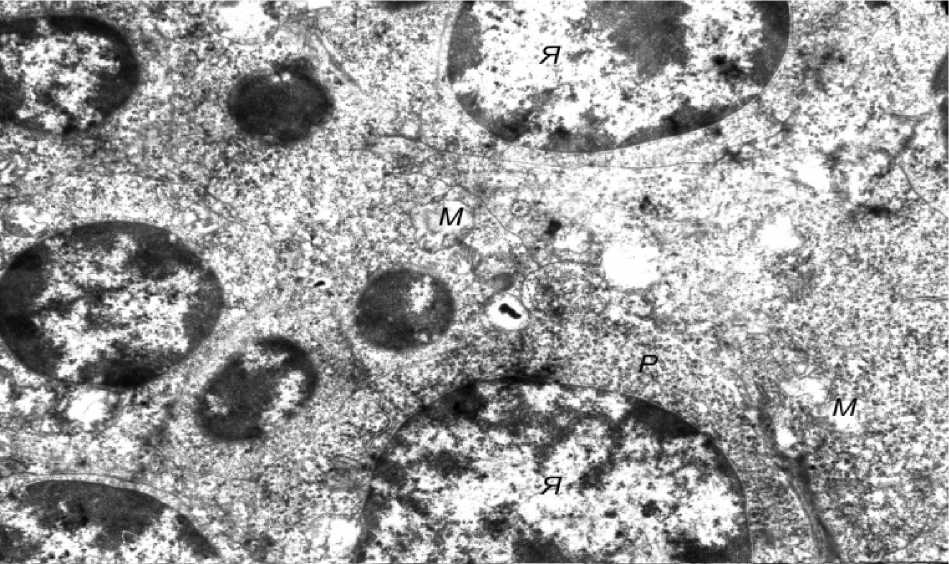
Рис. 5. Появление гидропической дистрофии в лимфоцитах тимуса: М – митохондрии, Р – рибосомы (электронная микрофотография, ×4800)

Рис. 6. Нормализация плотности лимфоцитарного инфильтрата: (электронная микрофотография, ×3200)
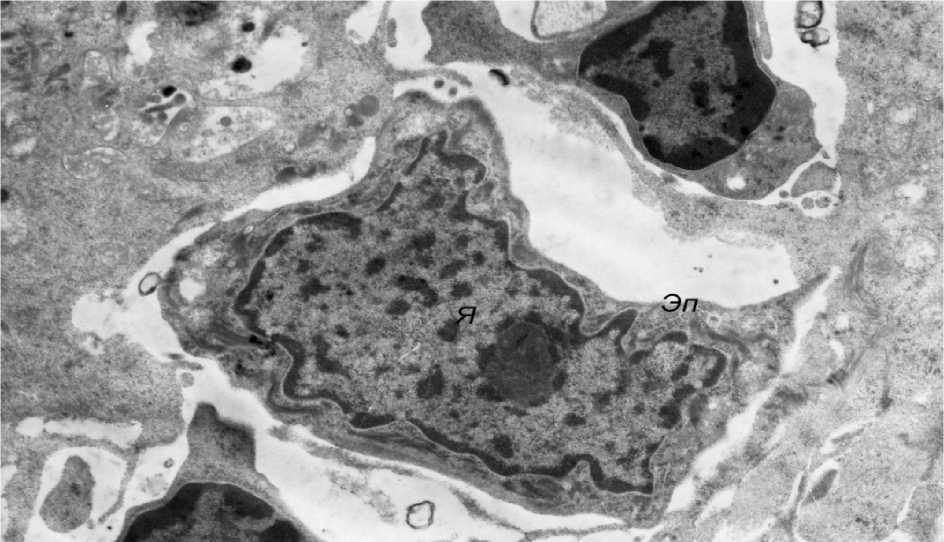
Рис. 7. Нормализация ультраструктурной организации звездчатых эпителиоцитов (электронная микрофотография, ×6400)
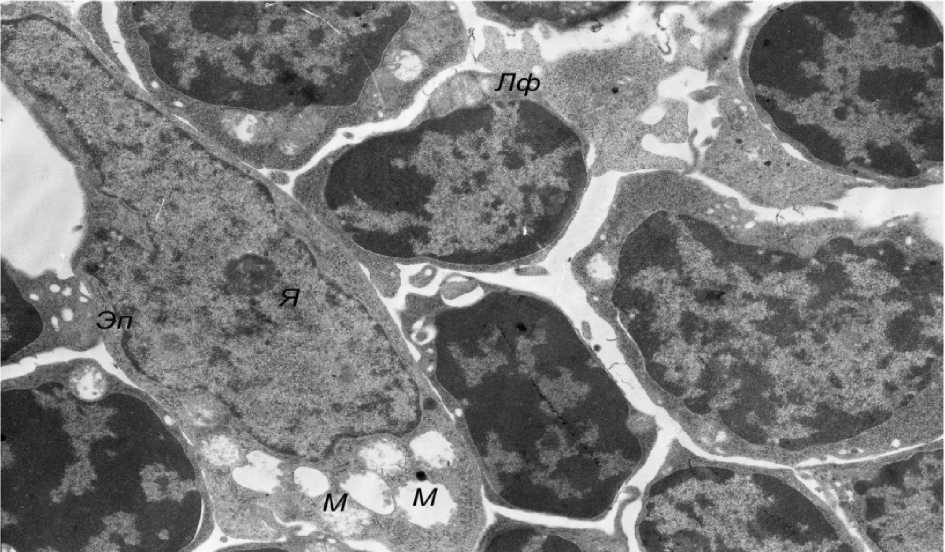
Рис. 8. Слабовыраженные признаки сохраняющегося интрацеллюлярного отека в эпителиоцитах (электронная микрофотография, ×4800)
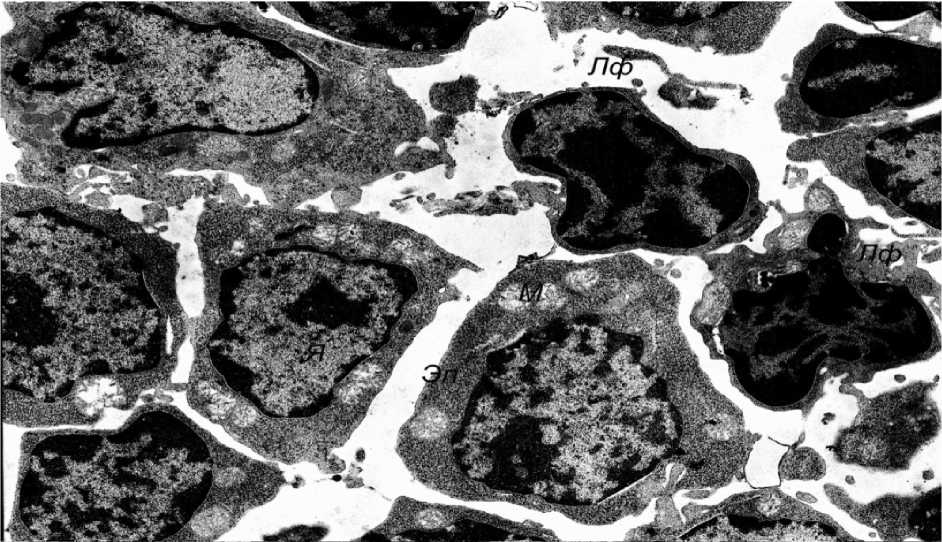
Рис. 9. Нормализация ультраструктурной организации эпителиальных клеток и лимфоцитов (электронная микрофотография, ×3200)
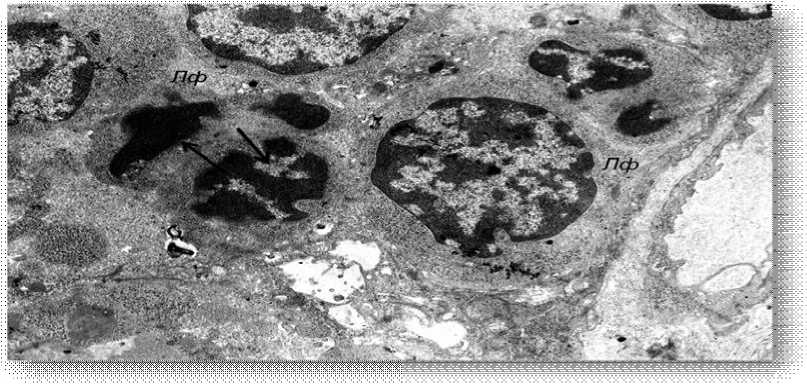
Рис. 10. Митоз (стрелки) в лимфоцитах тимуса (электронная микрофотография, ×4800)
Наиболее важным признаком, демонстрирующим эффективность применяемого лечения, являлось значительное усиление митотической активности лимфоцитов, о чем свидетельствовали многочисленные фигуры митозов в этих клетках (рис. 10). Кроме того, позитивные изменения фиксировались и со стороны сосудов тимуса. Так, большинство сосудов содержало в своем просвете эритроциты, их эндотелий выглядел нормальным, а в околососудистой зоне часто обнаруживались активно функционирующие фибробласты, синтезирующие вновь формирующуюся соединительную ткань.
Выводы:
-
1. Анализ полученных при электронномикроскопическом исследовании ткани тимуса в условиях адъювантного артрита данных свидетельствовал о создании смоделированного хронического воспаления, характерного для ювенильного ревматоидного артрита.
-
2. Результаты электронной микроскопии свидетельствовали о развитии в клеточных элементах тимуса при воспроизведенном адъювантном артрите обратимых изменений по типу гидропической дистрофии, с одной стороны, и усилении процессов апоптоза – с другой.
-
3. Обратимые дистрофические изменения в клетках и других компонентах тимуса наиболее успешно корригировались при лечении с использованием физиотерапевтиче-
- ского метода лечения БРВС, что, вероятнее всего, сказывалось положительным образом на восстановлении нейро-иммунно-эндокринного статуса организма.
MORPHOLOGICAL CHANGES OF THYMUS TISSUEIN EXPERIMENTAL ANIMALS WITH SIMULATED ADJUVANT ARTHRITIS UNDER THE INFLUENCE OF TREATMENT
E.Ya. Memetova, N.N. Kaladze, A.K. Zagorulko
SI «Crimean State Medical University named after S.I. Georgiyevsky», Simferopol
Список литературы Морфологические изменения ткани тимуса у экспериментальных животных с моделированным адьювантным артритом под влиянием лечения
- Алексеева Е. И. Клинические рекомендации по ведению больных, страдающих ЮРА/Е. И. Алексеева, Т. М. Бзарова//Российский педиатрический журн. -2005. -№ 5. -С. 36-40.
- Анисимова В. П. Роль морфофункциональных перестроек тимуса в обменно-эндокринных нарушениях организма/В. П. Анисимова//Рос. вестник перинатологии и педиатрии. -1994. -Т. 39, № 1. -С. 35.
- Баранов А. А. Ревматические болезни у детей: проблемы и пути их решения/А. А. Баранов, Е. И. Алексеева//Вопросы современной педиатрии. -2004. -№ 1. -С. 7-11.
- Бiлявська Ю. В. Особливостi клiнiки та дiагностики ревматоїдного артриту на раннiх стадiях/Ю. В. Бiлявська//Український ревматологiчний журн. -2007. -№ 2. -С. 66-68.
- Волосовець О. П. Стан i перспективи дитячої кардiоревматологiчної служби України/О. П. Волосовець//Експериментальна i клiнiчна медицина. -2008. -№ 4. -С. 16-20.
- Детская кардиоревматология/В.С. Приходько [и др.]. -Киев: Здоровье, 2005. -С. 390-409.
- Западнюк В. И. Лабораторные животные/В. И. Западнюк, И. П. Западнюк, Е. А. Захария. -Киев: Высшая школа, 1985. -385 с.
- Инструкция медицинского назначения аппарата биорезонансной стимуляции БРС-2М/А. Е. Кушнир [и др.]. -Евпатория, 2006. -С. 27.
- Кейтель В. Комплексное исследование экспериментального полиартрита у крыс/В. Кейтель, А. Лопатенок//Вопросы ревматологии. -1970. -№ 3. -С. 24.
- Лукьянова Е. М. Ревматоидный артрит у детей/Е. М. Лукьянова; под ред. Е. М. Лукьяновой, Л. И. Омельченко. -Киев: Книга плюс, 2002. -176 с.
- Марушко Т. В. Ураження очей при ювенiльному ревматоїдному артритi та особливостi лiкування/Т. В. Марушко, В. В. Бережний, Н. М. Тютюкова//Современная педиатрия. -2005. -№ 4 (9). -С. 101-103.
- Мирютова Н. Ф. Физиологическая и лечебная значимость так называемых слабых воздействий физиотерапии//Вопросы курортологии, физиотерапии и лечебной физической культуры/Н. Ф. Мирютова, Е. Ф. Левицкий. -М.: Медицина. -2003. -№ 1. -С. 21-25.
- Науково-практичнi рекомендацiї з утримання лабораторних тварин та роботи з ними/Ю. М. Кожемякiн [и др.]. -Київ: Авiцена, 2002. -156 с.
- Омельченко Л. Роль i мiсце iнгiбiторiв ЦОГ-2 в лiкуваннi ревматоїдного артриту у дiтей/Л. Омельченко, В. Миколаєнко, I. Дудка//Лiки України. -2004. -№ 10. -С. 46-49.
- Пономаренко Г. Н. Некоторые достижения и перспективы физиотерапии/Г. Н. Пономаренко//Вопросы курортологии, физиотерапии и лечебной физической культуры. -2000. -№ 2. -С. 38-41.
- Ундрицов М. Н. О роли глюкокортикоидных гормонов в патогенезе экспериментального ревматизма/М. Н. Ундрицов, В. Б. Розен, Л. С. Чернин//Вопросы ревматологии. -1964. -№ 1. -С.7.
- Эвтаназия животных: методические рекомендации по выведению животных из эксперимента. -М., 1985. -18 с.


