Морфологические особенности эпителиально- мезенхимальной трансформации и ее влияние на опухолевую прогрессию рака молочной железы
Автор: Р.Б. Кондратюк, И.С. Греков, Д.С. Швороб, Е.А. Селезнёв
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.38, 2023 года.
Бесплатный доступ
Введение. Рак молочной железы (РМЖ) занимает первое место в структуре заболеваемости среди всех злокачественных новообразований у женщин. Прогноз течения заболевания зависит от степени опухолевой прогрессии, включающей в себя наличие эпителиально-мезенхимальной трансформации (ЭМТ), степень инвазии, пролиферативный индекс, сохранение или отсутствие рецепторов к эстрогену, прогестерону и эпидермальному фактору роста. Цель: исследование иммуногистохимической и морфологической характеристики эпителиально-мезенхимальной трансформации РМЖ. Материал и методы. Иммуногистохимическое исследование с антителами к AE1/AE3, HMW, CK18, Snail, HER2/neu, E-cadherin, Vimentin, α-SMA, CD34, Ki-67 и p63 проводилось в отношении 60 случаев РМЖ у пациенток разных возрастных категорий. Нативные препараты окрашивали пикрофуксином по ван Гизону альциановым синим. Клетки воспалительного инфильтрата исследовали к антителам CD45, CD3, CD4, CD8, CD20, CD68. Результаты. В протоковом раке положительная экспрессия к эстрогену и прогестерону встречалась в 82,7 и 86,3% соответственно, индекс пролиферации составил до 66,6%, а p-53 был положителен в 97% случаев. В дольковом раке положительная экспрессия к эстрогену и прогестерону наблюдалась в 83,4 и 66,6% соответственно, индекс пролиферативной активности на уровне был 50%, а p-53 был положителен в 66,6% случаев. Положительная умеренная экспрессия HER-2/neu определялась в 47% протокового и 50% долькового рака. Эстроген играет важную роль в развитии инвазивной формы РМЖ, ведет к опухолевой прогрессии и способствует эпителиально-мезенхимальной трансформации (ЭМТ). ЭМТ, в свою очередь, приводит к экспрессии E-cadherin, связанным с более худшим прогнозом выживаемости. ЭМТ опосредованно приводит к интенсификации ангиогенеза, а наличие большого количества новообразованных сосудов увеличивает риск метастазирования. Гистохимическими методами было определено разрастание волокнистой соединительной ткани вокруг инвазивно растущих комплексов рака. Клетки, располагающиеся перифокально, имели вид фибробластов, иммуногистохимически умеренно экспрессировали Vimentin и слабо – панцитокератин, что доказывало опухолевую природу клеток и приобретение ими мезенхимальных особенностей. Воспалительный инфильтрат по периферии опухолевого роста состоял преимущественно из Т- и В-лимфоцитов, а вокруг комплексов рака – из В-лимфоцитов и макрофагов. Заключение. Исследование иммуногистохимического фенотипа опухоли позволит назначать адекватную полихимиотерапию и определить прогноз течения заболевания.
Рак молочной железы, эпителиально-мезенхимальная трансформация, иммуногистохимия
Короткий адрес: https://sciup.org/149141584
IDR: 149141584 | УДК: 576.31.017.35:618.19-006.6-039.36-02 | DOI: 10.29001/2073-8552-2023-38-1-82-89
Текст научной статьи Морфологические особенности эпителиально- мезенхимальной трансформации и ее влияние на опухолевую прогрессию рака молочной железы
Как известно, рак молочной железы (РМЖ) по-прежнему занимает лидирующие позиции в общей смертности среди женского населения во всем мире. Зачастую опухоль молочной железы манифестирует в период постменопаузы, однако не исключено его развитие и у женщин молодого возраста. Огромное значение в развитии и прогрессии новообразования играет эпителиально-мезенхимальная трансформация, характеризующаяся сменой эпителиального фенотипа опухоли на мезенхимальный. Это во многом определяет особенности поведения опухолевых клеток, способность к метастазированию и приобретению ряда других, потенциально новых свойств. Поэтому определение ранних признаков такой трансдук- ции является просто необходимым. Современная морфологическая диагностика опухолей требует не только верификации гистологического варианта и степени дифференцировки новообразования, но и обязательной оценки прогноза течения болезни, а также предполагаемого ответа на терапию, представление о которых можно получить с помощью иммуногистохимических методов исследования [1–3]. При РМЖ наиболее важными прогностическими показателями являются экспрессия рецепторов к эстрогенам и прогестерону, маркеру пролиферации Ki-67, р-53 и рецептору эпидермального фактора роста (HER2/neu).
Рецепторы эстрогена и прогестерона, относящиеся к группе стероидных рецепторов, играют решающую роль в нормальном развитии молочной железы и экспрессируются в наиболее распространенных подтипах злокачественных новообразований молочной железы. Именно наличие рецепторов к эстрогену в опухоли свидетельствует о ее потенциальной чувствительности к препаратам антиэстрогенового ряда, медикаментозной или хирургической кастрации. В свою очередь прогестероновые рецепторы являются первым необходимым звеном реакции клетки на прогестины и определяют ее чувствительность к соответствующим препаратам. Синтез прогестинов в клетках опухоли молочной железы индуцируется эстрогенами. Гормонозависимые опухоли молочной железы, содержащие один или оба типа рецепторов, имеют более благоприятное течение, послеоперационный прогноз, эффект гормонального лечения у них отмечается в 60–81% (два рецептора) и 41% наблюдений (один рецептор) [4–7].
Изучение Ki-67 (маркера пролиферации), экспрессирующегося во всех клетках, вышедших из G0-фазы, представляется актуальным и позволяет определить именно «скрытый» пролиферативный потенциал данной опухоли, а также судить о степени ее злокачественности. Положительная реакция с маркером Ki-67 является достоверным прогностическим фактором для проведения более агрессивной лучевой и химиотерапии. Установлена корреляция между количеством клеток, экспрессирующих Ki-67, и степенью злокачественности опухоли, а также митотическим потенциалом [8, 9].
Чем выше в опухоли экспрессия мутантного типа mt р53 (протеин, «имитирующий» свойства природного p53, блокирующий апоптоз в опухоли), тем более агрессивное поведение свойственно для РМЖ: короткий безметастаз-ный и безрецидивный период, худший прогноз и, следовательно, более «жесткая» терапия при выборе схемы лечения [10, 11].
Значимым фактором опухолевого роста, способным стимулировать рост как опухоли, так и стромы, является белок HER-2/neu [8, 9, 12]. Прогностическая ценность этого маркера заключается в следующем: при позитивном HER-2/neu-статусе пятилетняя выживаемость составляет 58%, при негативном – 77%; при наличии метастазов эти показатели составляют 31 и 61% соответственно. Также сверхэкспрессия HER-2/neu свидетельствует о резистентности опухоли к проводимой химиотерапии. Несомненно, весь диагностический спектр исследований напрямую зависит от формы, стадии и степени дифференцировки новообразования, однако своевременная и правильная диагностика поможет выбрать наиболее оптимальную стратегию лечения, что значительно улучшит прогноз и выживаемость таких больных.
Цель исследования: изучение иммуногистохимического статуса и морфологических характеристик эпителиально-мезенхимального перехода протокового и долькового форм РМЖ.
Материал и методы
Были обследованы 60 женщин с РМЖ в возрасте от 21 до 80 лет: из них на первый период зрелого возраста пришлось 2 женщины, на второй период – 44, на пожилой возраст – 26, старческий возраст – 2. При уточнении формы рака у 53 женщин выявлен протоковый РМЖ, у 7 – дольковый.
Иммуногистохимическое исследование проводилось с использованием моноклональных антител к панцитокератину АЕ1/АЕ3, высокомолекулярному ци-токератину (HMW), цитокератину 18, который является прямой мишенью Snail, а также к рецептору эпидермального фактора роста HER2/neu (c-erb B2), E-кад-герину, виментину, альфа-гладкомышечному актину, Ki-67 (mib-1) и белка p-53 для оценки пролиферативной активности.
Срезы после парафиновой проводки окрашивали гематоксилином и эозином по ван Гизону, альциановым синим при рН 2,5 и при рН 1,0; иммуногистохимические методы исследования проводили с маркерами к эпителию (АЕ1/АЕ3, СК18, HMW), с маркером соединительной ткани (виментин), гладкомышечных волокон (αSMA) и десмин. Раково-ассоциированные фибробласты, располагающиеся в строме с альцианофилией при рН 2,5, обозначали как CAF I, миофибробласты с экспрессией αSMA и виментина как CAF II.
Качественный состав воспалительного и иммунокле-точного инфильтрата стромы оценивали с использованием маркеров к общему лейкоцитарному антигену CD45, Т-лимфоцитам CD3, CD4, CD8, В-лимфоцитам CD20, макрофагам CD68.
Длину сосудистого русла опухоли определяли стереометрическим методом по Г.Г. Автандилову, подсчитывали число концов сосудов в срезе после иммуногистохимического мечения эндотелия сосудов с СD34. Более 20 концов в поле зрения при увеличении х 100 оценивали как большое количество сосудов.
Гистологические препараты были изучены под светооптическим микроскопом Olympus ВХ-40, микрофотографирование произведено цифровой фотокамерой Olympus U-TV1X с программным обеспечением Olympus DP-Soft. Статистическая обработка результатов проводилась в пакете Medstat с применением базовых методов математической статистики. Статистический анализ показателей, полученных в результате обработки ста-билограмм, показал, что их распределение отличается от нормального (критерий Шапиро – Уилка, р < 0,001). Для сравнения частот встречаемости в группах применялся χ2 -критерий Пирсона.
Результаты и обсуждение
Проведена сравнительная оценка показателей иммуногистохимического статуса у больных РМЖ двух форм: протокового и долькового. Иммуногистохимически исследована экспрессия рецепторов к эстрогену и прогестерону, экспрессия белка HER2/neu (рецептора к эпидермальному фактору роста), Ki-67 (маркера пролиферации). Полученные результаты случаев протокового рака внесены в таблицу 1.
Таблица 1. Распределение случаев протокового рака молочной железы по наличию и частоте маркеров в опухолевых клетках Table 1. Distribution of cases of ductal breast cancer by the presence and frequency of markers in tumor cells
|
Маркеры Markers |
Исследование не проводилось No research |
Отрицательная Negative (0%) |
Умеренно выраженная Moderate (1-20%) |
Выраженная Severe (> 21%) |
Количество исследований Number of researches |
|
Рецепторы к эстрогену Estrogen receptors |
1 |
9 (17,3%) |
17 (32,7%) |
26 (50%) |
52 (100%) |
|
Рецепторы к прогестерону Progesteron receptors |
2 |
7 (13,7%) |
20 (39,2%) |
24 (47,1%) |
51 (100%) |
|
Ki – 67 |
22 |
– |
23 (74,1%) |
8 (25,9%) |
31 (100%) |
|
р-53 |
21 |
1 (3%) |
22 (68,7%) |
9 (28,3%) |
32 (100%) |
Таким образом, рецепторы к стероидным гормонам (эстрогену и прогестерону) не встречались в 17,3 и 13,7% случаев соответственно; умеренно выраженное содержание выявлено в 32,7 и 39,2% случаев, наибольшее количество наблюдений – с выраженным содержанием рецепторов: 50 и 47,1% соответственно.
Наиболее часто встречались случаи с умеренной выраженностью экспрессии индекса пролиферации и частоты р-53 протеина, 74,1 и 68,7% соответственно. Выраженная экспрессия наблюдалась в меньшем количе- стве случаев – 25,9 и 28,3%. Индекс пролиферации был установлен во всех обследованных случаях, в 3% клеток протеин р-53 не был выявлен.
Для долькового рака, также как и для протокового, характерна высокая экспрессия рецепторов к стероидным гормонам, эстрогену и прогестерону – 50%. Умеренно выраженная экспрессия их определялась в 33,4 и 16,6% соответственно, не было выявлено ее в 16,6 и 33,4% случаев соответственно ( p < 0,01); (для эстрогена Uэмп = 155,5; Uкр = 64. Для прогестерона Uэмп = 141; Uкр = 63), таблица 2.
Таблица 2. Распределение случаев долькового рака молочной железы по наличию и частоте маркеров в опухолевых клетках
Table 2. Distribution of cases of lobular breast cancer by the presence and frequency of markers in tumor cells
|
Маркеры Marker |
Исследование не проводилось No research |
Отрицательная Negative (0%) |
Умеренно выраженная Moderate (1-20%) |
Выраженная Severe (> 21%) |
Количество исследований Number of researches |
|
Рецепторы к эстрогену Estrogen receptors |
1 |
1 (16,6%) |
2 (33,4%) |
3 (50%) |
6 (100%) |
|
Рецепторы к прогестерону Progesteron receptors |
1 |
2 (33,4%) |
1 (16,6%) |
3 (50%) |
6 (100%) |
|
Ki – 67 |
4 |
1 (33,4%) |
2 (66,6%) |
– |
3 (100%) |
|
р-53 |
4 |
1 (33,4%) |
2 (66,6%) |
– |
3 (100%) |
Не наблюдалось случаев с высокой экспрессией индекса пролиферации Ki – 67 и р-53 протеина. Умеренно выраженная экспрессия составляла 66,6%, для обоих маркеров она не была выявлена в 33,4% случаев долькового рака ( p < 0,01); Uэмп = 23, Uкр менее 1.
В дольковом раке несколько реже (16,6%) по сравнению с протоковым встречается умеренная экспрессия рецепторов к прогестерону и чаще экспрессия была отрицательной (p < 0,01). Среди обследованных клеток протокового и долькового рака выраженной экспрессии (+++) HER-2/neu рецепторов не выявлено, умеренная экспрессия (++) определялась в 47% случаев протокового рака и 50% долькового, низкая (+) – в 41,1% протокового и 50% долькового рака. Отрицательный результат выявлен в 11,9% случаев протокового рака (р < 0,01), таблица 3.
Таблица 3. Определение HER-2/neu рецепторов при различных формах рака молочной железы
Table 3. Determination of HER-2/neu receptors in various forms of breast cancer
|
Формы рака Forms of cancer |
Исследование не проводилось No research |
Отрицательный Negative |
+ |
++ |
+++ |
Количество исследований Number of researches |
|
Протоковый Ductal |
36 |
2 (11,9%) |
7 (41,1%) |
8 (47%) |
– |
17 (100%) |
|
Дольковый Lobular |
5 |
– |
1 (50%) |
1 (50%) |
– |
2 (100%) |
Эпителиально-мезенхимальная трансформация (ЭМТ) часто встречается в опухолях молочной железы. Экспрессия Snail1 и Snail2 (Slug) ведет к репрессии Е-кадгерина, связанной с локальными или дистантными метастазами, рецидиву, снижению чувствительности к химиотерапии и плохому прогнозу.
Установлено, что эстрогены, играющие важную роль в развитии инвазивного протокового рака, не только ведут к опухолевой трансформации эпителиальных клеток РМЖ, но и способствуют ЭМТ в нем.
В эксперименте создана модель ингибиторного эффекта на опухолевый рост антагониста рецептора I к TGF-α, применение которого на РМЖ показало ингибицию роста опухоли. В опухолях большое значение в развитии и метастазировании имеет ангиогенез, который усилен в раках, особенно при ЭМТ. При быстром росте опухоли в ней создаются очаги гипоксии, которая индуцирует синтез HIF-1α (гипоксией индуцированный фактор 1α). В свою очередь HIF-1α способствует экспрессии васкулярного эндотелиального фактора роста (VEGF), вызывающего ангиогенез. Интенсивный ангиогенез может быть показанием к антиангиогенной терапии.
В исследуемом материале мы обнаруживали признаки ЭМТ при рутинной окраске гематоксилином и эозином, оценивали ее особенности при иммуногистохимических методах исследования, включая выраженность ангиогенеза. Так, в инвазивном протоковом раке с распространением его на жировую клетчатку (рис. 1) рядом с краем инвазии наблюдалось разрастание плотной волокнистой соединительной ткани, среди которой располагались разных размеров тяжи опухолевых клеток, нередко вытянутых, фибробластоподобных с заостренным краем (рис. 2); тяжи опухолевых клеток с заостренными концами их в крае инвазии среди фиброзной соединительной ткани, такие опухолевые клетки теряли экспрессию эпителиального маркера панцитокератина (рис. 3a). Отсутствие экспрессии цитокератина в крае тяжа опухолевых клеток среди фиброзной ткани сопровождалось приобретением экспрессии мезенхимального, соединительнотканного маркера виментина (рис. 3b). Интересно, что в опухоли много кровеносных сосудов, эндотелий которых экспрессирует виментин (рис. 4a) и меньше сосудов с экспрессией специфического для эндотелия маркера CD31 (рис. 4b).
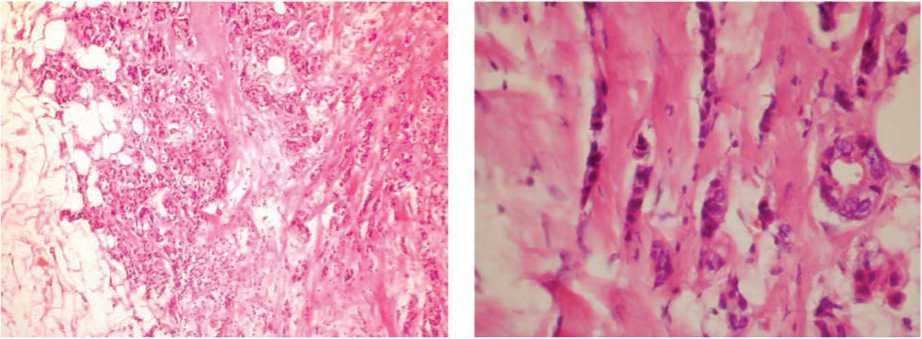
Рис. 2. Тяжи опухолевых клеток разных размеров, нередко вытянутых, фибробластоподобных с заостренным краем. Окраска гематоксилином и эозином, ×400
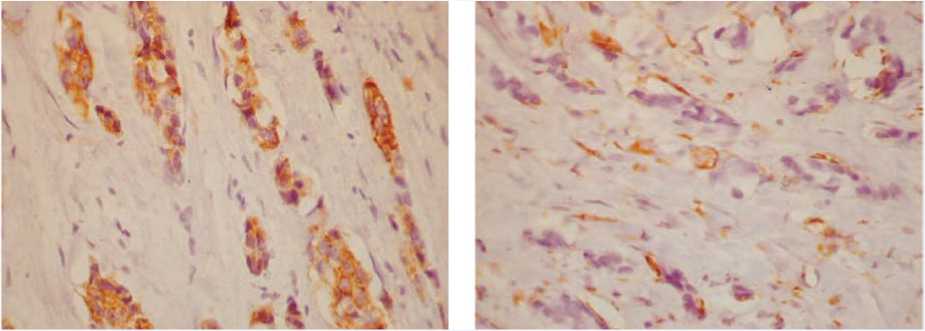
Рис. 3b. Приобретение вытянутыми опухолевыми клетками экспрессии мезенхимального, соединительнотканного маркера виментина, ×400
Fig. 3b. Acquisition by elongated tumor cells of the expression of the mesenchymal, connective tissue marker vimentin, ×400
Рис. 3a. Опухолевые клетки с потерей экспрессии эпителиального маркера панцитокератина AE1/АЕ3, ×400 Fig. 3a. Tumor cells with loss of expression of the epithelial marker pancytokeratin AE1/AE3, ×400
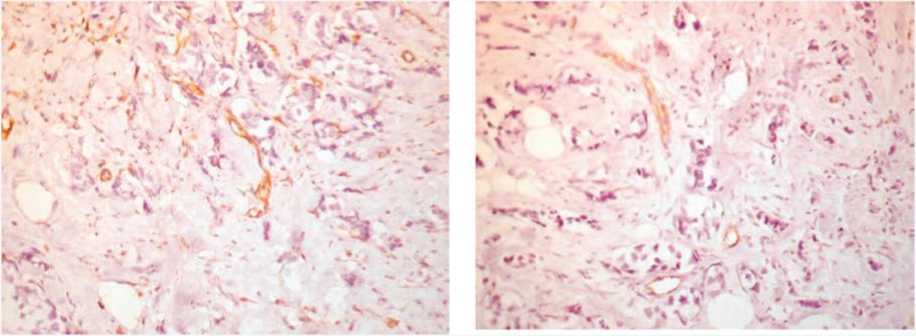
Рис. 4a. Большое число резко полиморфных тонкостенных кровеносных сосудов в опухоли, экспрессирующих виментин, ×200
Fig. 4a. A large number of sharply polymorphic thin-walled blood vessels in the tumor expressing vimentin, ×200
Рис. 4b. Меньшее количество кровеносных тонкостенных сосудов с экспрессией специфического для эндотелия маркера CD31, ×200
Fig. 4b. Fewer thin-walled blood vessels expressing endothelial-specific marker CD31, ×200
Иммуногистохимическое исследование позволяет оценить качественный состав иммуноклеточного инфильтрата в опухоли, его локализацию и выраженность. По периферии опухоли, на ее границе была выражена инфильтрация Т-лимфоцитами (рис. 5a). Их было меньше среди опухолевых клеток (рис. 5b). Также густой крупный инфильтрат на границе опухоли образовывали В-лимфо-циты (рис. 5c), В-лимфоциты обнаруживались и в строме рядом с опухолевыми железами (рис. 5d). В строме среди опухолевых желез располагались и CD68 – положительные макрофаги (рис. 5e).
Обычно для ЭМТ в раках многих локализаций характерна активированная строма с большим количеством миофибробластов, экспрессирующих альфа-гладкомышечный актин. В этом случае он не обнаруживался в строме между опухолевыми клетками, был только в стенке сосуда (рис. 6). Вероятно, это связано с далеко зашедшей стадией образования и созревания стромы, когда между опухолевыми железами виден уже гиалиноз коллагеновых волокон (рис. 7). В зоне инвазии строма более молодая, активированная, с наличием сульфатированных гликозаминогликанов (рис. 8).
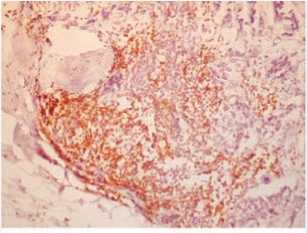
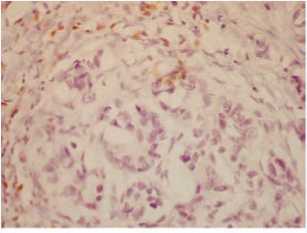
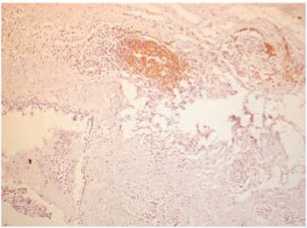
Рис. 5a. Выраженная инфильтрация CD3+ Т-лимфоцитами на периферии опухоли, ее границе, ×200
Fig. 5a. Severe infiltration of CD3+ T-lymphocytes on the periphery of the tumor, its border, ×200
Рис. 5b. Единичные рассеянные СD3+ Т-лимфоциты среди опухолевых клеток, ×400
Fig. 5b. Single scattered CD3+
T-lymphocytes among tumor cells, ×400
Рис. 5c. CD20+ В-лимфоциты в инфильтрате на границе с опухолевыми клетками, ×100
Fig. 5c. CD20+ B-lymphocytes in the infiltrate at the border with tumor cells, ×10
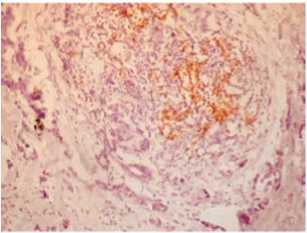
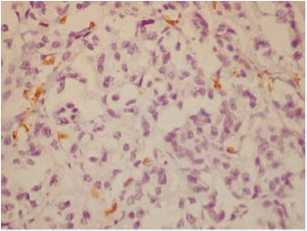
Рис. 5e. CD68+ макрофаги в строме среди опухолевых желез, ×400
Fig. 5e. CD68+ macrophages in the stroma among tumor glands, ×400
Рис. 5d. CD20+ В-лимфоциты в строме рядом с опухолевыми железами, ×200
Fig. 5d. CD20+ B-lymphocytes in the stroma next to the tumor glands, ×200
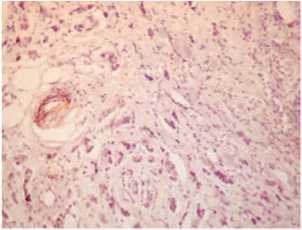
Рис. 6. aSMA экспрессирован только в стенке сосуда, отсутствует в фиброзной строме между опухолевыми клетками, ×200
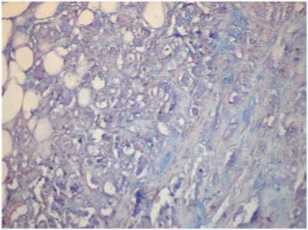
Рис. 8. Сульфатированные гликозаминогликаны в строме опухоли и секрет в просвете опухолевых желез. Окраска альциановым синим при рН 1,0; ×200
Fig. 6. aSMA is expressed only in the vessel wall, absent in the fibrous stroma between tumor cells, ×200
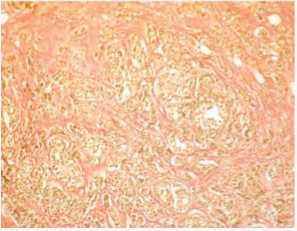
Рис. 7. Наличие гиалиноза коллагеновых волокон между очагами опухоли, тонкие волокна коллагена внутри этих очагов. Окраска по Ван Гизону, ×200 Fig. 7. The presence of hyalinosis of collagen fibers between tumor foci, thin collagen fibers inside these foci. Van Gieson stain, ×200
Fig. 8. Sulfated glycosaminoglycans in the tumor stroma and secretion in the lumen of the tumor glands. Alcian blue staining at pH1.0, ×200
По данным литературы, имеются отдельные признаки ЭМТ в РМЖ, например, потеря Е-кадгерина обнаруживается в дольковых раках, приобретение экспрессии вимен-тина наблюдается в так называемом базалоидном раке (из миоэпителия базального слоя желез), но эти признаки не сопоставлялись друг с другом и особенностями ЭМТ.
Выводы
Исследованный и определенный иммуногистохимический статус больных позволит назначить адекватную полихимиотерапию и определить прогноз течения заболевания.
Список литературы Морфологические особенности эпителиально- мезенхимальной трансформации и ее влияние на опухолевую прогрессию рака молочной железы
- Thiery J.P., Acloque H., Huang R.Y.J., Nieto M.A. Epithelial-mesenchymal transitions in development and disease. Cell. 2009;139(5):871–890. DOI: 10.1016/j.cell.2009.11.007.
- Кокорев А.В., Могилёва А.С., Пюрвеев С.С., Лебеденко Е.А., Некрасов М.С. Эпителиально мезенхимальный переход и его роль в процессах метастазирования. Forcipe. 2020;3(1):173–174. [Kokorev A.V., Moguileva A.S., Puirveev S.S., Lebedenko E.A., Nekrasov M.S. Epithelial-mesenchymal transition and its role in metastasis processes. Forcipe. 2020;3(1):173–174. (In Russ.)].
- Cumin C., Huang Y.L., Everest-Dass A., Jacob F. Deciphering the importance of glycosphingolipids on cellular and molecular mechanisms associated with epithelial-to-mesenchymal transition in cancer. Biomolecules. 2021;11(1):62. DOI: 10.3390/biom11010062.
- Nieto M.A. The ins and outs of the epithelial to mesenchymal transition in health and disease. Annu. Rev. Cell Dev. Biol. 2011;27:347–376. DOI: 10.1146/annurev-cellbio-092910-154036.
- Гапонова А.В., Родин С., Мазина А.А., Волчков П.В. Эпителиально-мезенхимальный переход: злокачественная прогрессия и перспективы противоопухолевой терапии. Acta Naturae. 2020;12;3:4–23. [Gaponova A.V., Rodin S., Mazina A.A., Volchkov P.V. Epithelial-mesenchymal transition: Role in cancer progression and the perspectives of antitumor treatment. Acta Naturae. 2020;12;3:4–23. (In Russ.)]. DOI: 10.32607/actanaturae.11010.
- Abaurrea A., Araujo A.M., Caff arel M.M. The role of the IL-6 сytokine family in еpithelial-mesenchymal plasticity in сancer progression. Int. J. Mol. Sci. 2021;22(15):8334. DOI: 10.3390/ijms22158334.
- Chou M.Y., Yang M.H. Interplay of immunometabolism and epithelial- mesenchymal transition in the tumor microenvironment. Int. J. Mol. Sci. 2021;13;22(18):9878. DOI: 10.3390/ijms22189878.
- Saitoh M. Involvement of partial EMT in cancer progression. J. Biochem. 2018;164(4):257–264. DOI: 10.1093/jb/mvy047.
- Засадкевич Ю.М., Бриллиант А.А., Сазонов С.В. Особенности экспрессии маркеров эпителиально-мезенхимального перехода E-кадгерина и виментина при разных иммуногистохимических вариантах карциномы молочной железы. Уральский медицинский журнал. 2014;116(2):29–32. [Zasadkevich Yu.M., Brilliant A.A., Sazonov S.V. Expression of epithelialmesenchymal transition markers E-cadherin and vimentin in diff erent immunohistochemical variants of breast carcinoma. Ural Medical Journal. 2014;116(2):29–32. (In Russ.)].
- Radisky D.C. Epithelial-mesenchymal transition. J. Cell Sci. 2005;118(19):4325–4326. DOI: 10.1242/jcs.02552.
- Кондратюк Р.Б., Греков И.С., Ярков А.М., Русина А.А., Швороб Д.С. Роль эпителиально-мезенхимальной трансформации в раках различной локализации (часть 1). Новообразование. 2021;13(2):91–95. [Kondratyk R.B., Grekov I.S., Yarkov A.M., Rusina A.A., Shvorob D.S. The role of epithelial-mesenchymal transition in carcinomas by diff erent localizations (Part 1). Neoplasm. 2021;13(2):91–95. (In Russ.)].
- Ramesh V., Brabletz T., Ceppi P. Targeting EMT in сancer with repurposed metabolic inhibitors. Trends Cancer. 2020;6(11):942–950. DOI: 10.1016/j.trecan.2020.06.005


