Морфологические особенности микрососудов и лимфоидной ткани в регионарных лимфатических узлах при раке желудка
Автор: Томчук Олеся Николаевна, Сеньчукова Марина Алексеевна, Стадников Александр Абрамович, Зайцев Никон Владимирович, Никитенко Наталья Викторовна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.23, 2015 года.
Бесплатный доступ
Изучены морфологические особенности лимфоидной ткани и микрососудов в регионарных лимфоузлах (РЛУ) без метастазов у 49 пациентов раком желудка (РЖ). Гистологические срезы окрашивались гематоксилином Майера и эозином и иммуногистохимически с использованием антител к CD34, что позволило выделить в ткани РЛУ несколько типов микрососудов: микрососуды (МС) обычного строения, дилятированные капилляры (ДК) и атипичные капилляры (АК) с бластным фенотипом эндотелиальных клеток. Установлены положительные корреляции площади РЛУ с площадью лимфоидных фолликулов (ЛФ), площадью герминативных центров в них, диаметром ЛФ, с количеством ЛФ на границе слизистой оболочки желудка (СОЖ) и опухоли и наличием ДК в подслизистой основе СОЖ и отрицательные корреляции - с плотностью ЛФ и плотностью МС в них. Площадь ЛФ положительно коррелировала с площадью герминативных центров, плотностью МС в герминативных центрах и отрицательно -с плотностью ЛФ. Диаметр ЛФ положительно коррелировал с Т стадией РЖ и отрицательно с 3-х летней безрецидивной выживаемостью, а их плотность - с размером опухоли, N стадией и Т стадией РЖ...
Рак желудка, ангиогенез, лимфатические узлы, лимфоидные фолликулы
Короткий адрес: https://sciup.org/143177070
IDR: 143177070
Текст научной статьи Морфологические особенности микрососудов и лимфоидной ткани в регионарных лимфатических узлах при раке желудка
Следует отметить, что организм представляет собой единую систему. Хорошо известно, что воспалительные изменения в эпителиальных тканях приводят к реактивным изменениям в регионарных лимфатических коллекторах. Учитывая, что процессы опухолевого роста, воспаления и ангиогенеза тесно связаны между собой, можно предположить, что эти факторы могут вызывать и соответствующие изменения в ткани регионарных ЛУ. Однако в доступной научной литературе мы не встретили публикаций, которые комплексно изучали бы эту проблему.
Цель исследования - изучить особенности ангиогенеза и реактивных изменений в ткани РЛУ при РЖ и их связь с клиническими характеристиками и прогнозом заболевания.
Материал и методы исследования. В данное проспективное исследование были включены 44 пациента РЖ, которым была выполнена радикальная операция в Оренбургском областном клиническом онкологическом диспансере в период с января 2008 по декабрь 2010 года. Среди них 26 (%) мужчин и 18 (%) женщин. Средний возраст больных составил 61,6±1,27 лет. Опухоль располагалась в верхней трети у 13 (29,5%), в средней трети - 9 (20,5%) и нижней трети у 21 (47,7%). Тотальный рак был выявлен у 1(2,3%) пациента.
РЖ кишечного типа наблюдался у 19 (43,2%) пациентов, диффузного – у 25 (56,8%). Высокодифференцированная аденокарцинома была выявлена в 12 (27,3%) случаях, умеренно-дифференцированная аденокарцинома - в 7 (15,9%), низкодифференцированная аденокарцинома и недифференцированный РЖ - в 5 (11,4%) случаях и перстевидно-клеточный рак - у 20 (45,4%) пациентов.
Стадия T1-2N0M0 была у 7 (15,9%) пациентов, T3N0M0 - у 6 (13,2%), T3-4N1M0 - у 7 (15,9%) и T3-4N2M0 - у 14 (28,8%).
Пациенты с хроническими заболеваниями на стадии декомпенсации, острыми воспалительными заболеваниями, обострением аллергического процесса, а также больные, получающие кортикостероидные, антигистаминные, нестероидные противовоспалительные средства и неоадьювант-ную терапию не вошли в исследование.
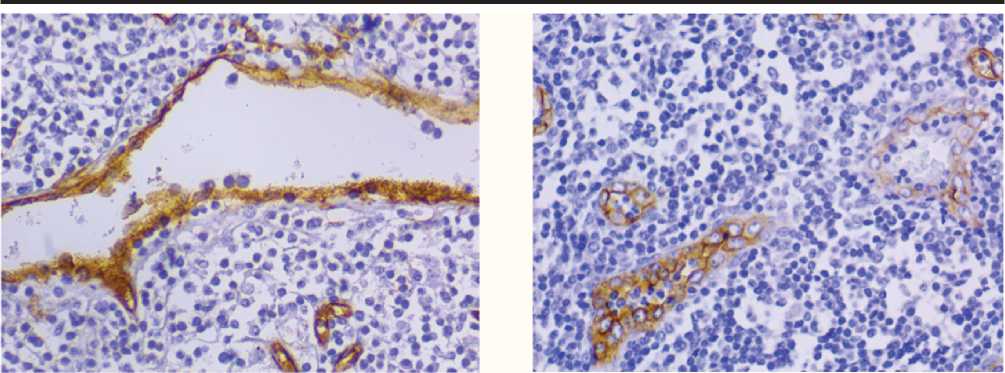
Рис. 1. Типы сосудов в ткани лимфатического узла: А – дилятированные капилляры, Б – атипичные капилляры с бластным фенотипом выстилающих клеток. ИГХ окраска с антителами к CD34. Ув. 600.
В ткани ЛУ оценивали: площадь ЛУ, площадь лимфоидных фолликулов (ЛФ) и их герминативных центров, средний диаметр ЛФ. В зависимости от диаметра ЛФ пациенты были разделены на 2 группы: с диаметром менее 865 мкм и диаметром равным или более 865 мкм (66 перцентиль). На условную единицу площади (УЕП) ЛУ равную 1 см2 подсчитывали плотность ЛФ, плотность микрососудов (МС) обычного строения в ЛФ, их герминативных центрах и в мозговом слое ЛУ. В зависимости от плотности ЛФ пациенты были распределены на 2 группы: в 1 группу вошли пациенты с низкой плотностью ЛФ меньше 3,5 на 1 см2, во 2 группу - с нормальной и высокой плотностью ЛФ (равной или больше 3,5 на 1 см2- 34 перцентиль). Плотность МС оценивали в точках «максимальной васкуляризации», путем подсчета суммарного количества капилляров и отдельных клеток, экспрессирующих CD34 на УЕП (GoddardJ.C. etal, 2002).
Полуколичественным способом при малом увеличении (х100) оценивали количество дилятированных капилляров с атипией (нет, единичные, множественные) и наличие атипических сосудов с бластным фенотипом эндотелиальных клеток (нет, есть).
Полученные данные были сопоставлены с клинико-морфологическими характеристиками РЖ: локализацией, гистологическим типом, степенью дифференцировки опухоли, Т и N стадией. Также оценивали связь отмеченных показателей с наличием дилятированных капилляров (ДК) в подслизистой основе СОЖ и наличием ЛФ и очаговых лимфоидных инфильтратов в прилежащей к опухоли СОЖ, изученных нами ранее [17, 18]. В частности было отмечено, что наличие дилятированных капилляров в подслизистой основе СОЖ связано с наличием метастазов в регионарных ЛУ и ухудшение отдаленных результатов лечения
РЖ [17].
Статистическая обработка проводилась с использованием программы Statistica 6.0. Взаимосвязь между различными показателями определяли, используя непараметрические методы (ранговой корреляции по Spearman (ρ) и гамма). Достоверность различий частот признаков в изучаемых группах оценивали с помощью критерия χ2. Анализ общей и безрецидивной 3-х летней выживаемости выполняли по методу Каплана-Майера (Kaplan-Meier). Сравнение показателей выживаемости между группами больных проводили с использованием Long-Rank теста. Различия между показателями считали достоверными при p<0,05.
Результаты исследования и их обсуждение. При изучение особенностей ангиогенеза в ткани регионарных ЛУ было отмечено несколько типов сосудов, отличающихся по морфологии и клинической значимости: МС обычного строения, дилятированные капилляры (ДК) и атипичные капилляры (АК) с бластным фенотипом выстилающих эндотелиальных клеток. МС обычного строения имели диаметр 5-40 мкм. Выстилающие эндотелиальные клетки имели обычное строение (рис. 1).
ДК были представлены сосудами неправильной формы с диаметром 40 и более мкм. Эндотелиальные клетки, выстилающие описанные сосуды часто располагались хаотично, имели неправильную форму и размытые контуры. Во многих сосудах данного типа наблюдался стаз форменных элементов крови.
АК были представлены капиллярами разных размеров, чаще всего правильной формы Эндотелиальные клетки имели крупные светлые ядра с нежно-сетчатой структурой хроматина, что характерно для бластных клеток, и тонкий ободок
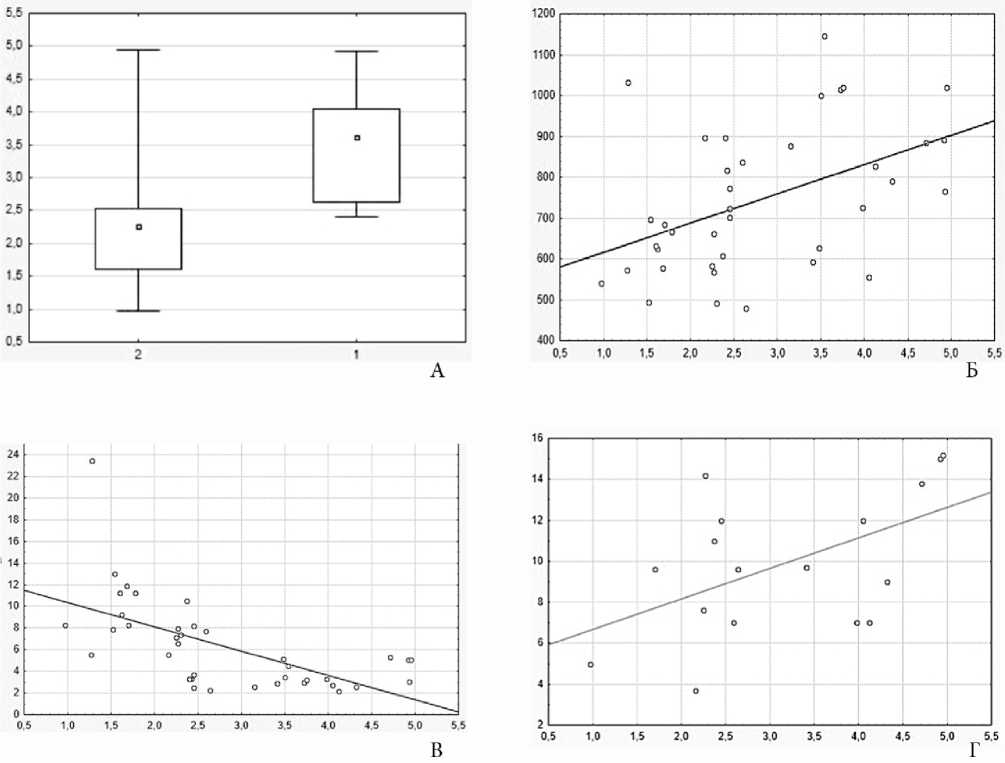
Рис. 2. Площадь лимфоузлов в зависимости от: А – площади лимфоидных фолликулов, Б – размеров лимфоидных фолликулов, В – плотности лимфоидных фолликулов, Г – плотности микрососудов в лимфоидных фолликулах.
цитоплазмы, слабо окрашивающийся маркером CD34. Клетки вплотную прилежали друг к другу и нередко были вертикально ориентированы к стенке сосуда.
При сравнении реактивных изменений в ткани регионарных ЛУ с клинико-морфологическими характеристиками РЖ, особенностями ангиогенеза и воспалительной инфильтрации в прилежащей к опухоли СОЖ установлено следующее:
Площадь ЛУ положительно коррелировала с площадью ЛФ (ρ=0,644, р=0,0001) и площадью герминативных центров (ρ=0,394, р=0,014), диаметром ЛФ (ρ=0,465, р=0,003) и отрицательно - с плотностью ЛФ (ρ=-0,388, р=0,02) и плотностью МС в них (ρ=-0,504, р=0,003). Увеличение площади ЛУ было связано с увеличением площади и размеров ЛФ и снижением плотности ЛФ и плотности МС в них (рис. 2).
Также отмечены отрицательные корреляции площади ЛУ с количеством ЛФ на границе СОЖ и опухоли (ρ=-0,618, р=0,01) и наличием ДК в подслизистой основе СОЖ (ρ=-0,508, р=0,008). Площадь ЛУ была меньше множественных ЛФ на границе СОЖ и опухоли (2,9±1,1 и 1,87±0,6, соответственно при отсутствии или единичных ЛФ и при множественных ЛФ, р=0,002) и при наличии ДК в подслизистой основе СОЖ (3,49±1,3 и 2,36±0,9, соответственно при отсутствии и наличии ДК в подслизистой основе СОЖ, р=0,03).
Площадь ЛФ положительно коррелировала с площадью герминативных центров (ρ=0,72, р=0,003), плотностью МС в герминативных центрах (ρ=0,667, р=0,003) и отрицательно коррелировала с плотностью ЛФ (ρ=-0,338, р=0,016). Увеличение площади ЛФ сопровождалось увеличением площади герминативных центров, увеличением плотности МС в них и снижением плотности ЛФ.
В свою очередь, диаметр ЛФ положительно коррелировал с Т стадией РЖ (ρ=0,464, р=0,003) и отрицательно с 3-х летней безрецидивной выживаемостью (гамма=-0,484, р=0,002). Размеры ЛФ были больше при Т3-4 стадии, чем при Т1-Т2
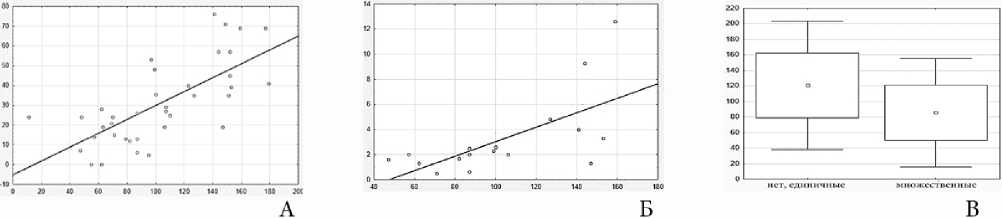
Рис. 3. Площадь лимфоидных фолликулов в зависимости от: А – площади герминативных центров, Б – плотности микрососудов в герминативных центрах, В – плотности лимфоидных фолликулов.
(665,7±145,6 и 808,6±176,8, соответственно, при Т1-2 и Т3-4, р=0,009). Отмечено достоверное снижение 3-х летней безрецидивной выживаемости (БВ) с 87,5% до 42,5% (p=0,005) в группе пациентов со средним размером ЛФ больше 865 мкм.
Плотность ЛФ была связана с Т-стадией (гам-ма=-0,598 , р=0,001) и N стадией (гамма=-0,524, р=0,07) РЖ. При высокой плотности ЛФ (больше 3,5 на УЕП) чаще выявлялась Т1-Т2 стадия (в 62,5% и 14,3%, соответственно, при высокой и низкой плотности ЛФ, р=0,004) и отсутствовали метастазы в РЛУ (66,67% и 35,71%, соответственно, при низкой и при высокой плотности ЛФ, р=0,04). При низкой плотности ЛФ отмечена тенденция к снижению 3-х летней общей выживаемости (ОВ) с 91,7% до 71,4% (p=0,11).
Плотность МС и наличие ДК не было связано с клиническими и морфологическими характеристиками РЖ. В тоже время, наличие АК с бластным фенотипом эндотелиальных клеток было связано со степенью дифференцировки РЖ (гамма=0,516, р=0,002), типом роста опухоли (гамма=0,739, р=0,0004) и количеством ЛФ на границе опухоли и СОЖ (гамма=-0,714, р=0,02). АК чаще наблюдались при низкодифференцированном и перстневидно-клеточном РЖ (в 33%, 0%, 60% и 65%, соответственно при высокодифференцированной, умеренно-дифференцированной, низкодифференцированной аденокарциноме и перстневидноклеточном раке, р=0,005), при диффузном типе роста (в 21,1% и 64,0%, соответственно, при кишечном и диффузном типе роста, р=0,004) и реже при множественных ЛФ на границе опухоли и СОЖ (в 66,67% и 25%, соответственно, при отсутствии и единичных и при множественных ЛФ на границе опухоли и СОЖ, р=0,05).
Обсуждение. На сегодняшний день ангиогенез рассматривают как важнейший маркер, влияющий на рост и метастазирование злокачественных новообразований, исход заболевания, чувствительность к противоопухолевой терапии [19]. Однако следует отметить, что большинство исследований особенностей ангиогенеза при злокачественных опухолях, в том числе и при РЖ, связаны с изучением сосудов стромы опухоли и прилежащей к ней СОЖ. Что касается особенностей ангиогенеза в регионарных ЛУ, то эта проблема остается малоизученной. Имеющиеся в научной литературе данные относятся преимущественно к изучению экспрессии VEGF (фактора роста эндотелия сосудов) в ткани ЛУ [20,21,22]. В частности установлено, что увеличение экспрессии VEGF в ткани регионарных ЛУ связано с гиперплазией перитуморальных лимфатических сосудов и метастатическим поражением ЛУ, что, в свою очередь, может свидетельствовать о связи неоангиогенеза в ткани регионарных ЛУ с прогрессией злокачественных новообразований. Таким образом, учитывая, что лимфоузлы выполняют лимфопролиферативную, иммунную и барьерную функцию [23] исследование особенностей реактивных изменений лимфоидной ткани и особенностей ангиогенеза при злокачественной росте несомненно представляют интерес, как с научной, так и с клинической точки зрения.
Многочисленные исследования свидетельствуют о том, что сосуды в опухоли и прилежащих тканях неоднородны по морфологии и клинической значимости [11, 12, 17, 18]. При изучение особенностей ангиогенеза в ткани регионарных ЛУ также были выделены три типа сосудов: МС обычного строения, ДК и АК с бластным фенотипом выстилающих эндотелиальных клеток. С клиническими характеристиками РЖ, а именно с диффузным типом РЖ, были связаны только АК. В тоже время отмечено, что плотность МС обычного строения в ЛФ и герминативных центрах связаны, соответственно, с площадью ЛУ и площадью ЛФ, что может свидетельствовать о тесной связи плотности МС с лимфопролиферативными процессами в ткани лимфоузла.
Не менее интересной выглядит и связь между диаметром и плотностью ЛФ и клиническими характеристиками РЖ. Снижение плотности ЛФ было связано с более распространенными стадиями РЖ и ухудшением отдаленных результатов лечения этой патологии. Эти данные косвенно свидетельствуют о том, что снижение лимфопролиферативных процессов в ткани регионарных ЛУ может способствовать прогрессии РЖ. Истощение же лимфоидной ткани, согласно полученным данным, может быть обусловлено активными воспалительными изменениями на границе опухоли и СОЖ, что проявляется отрицательными корреляциями между размерами ЛУ и наличием ЛФ в перитуморальной области.
Выводы. Таким образом, полученные данные свидетельствуют о том, что процессы ангиогенеза, и выраженность воспаления в строме опухоли и ткани ЛУ связаны между собой, а также с клиническими характеристиками и прогнозом РЖ.
Список литературы Морфологические особенности микрососудов и лимфоидной ткани в регионарных лимфатических узлах при раке желудка
- Onoyama H1, Iwasaki Y., Ohashi M., Iwanaga T., Ohinata R., Maeda Y., Omuro Y., Sasaki E, Shimoyama T., Tateishi Y. A case of gastric neuroendocrine cell carcinoma successfully treated by neoadjuvant chemotherapy//Gan To Kagaku Ryoho. - 2011. - Vol. 38(12). - P. 2131-3.
- Злокачественные новообразования в России в 2012 году (заболеваемость и смертность) / Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. - М.: ФГБУ «МНИОИим. П.А. Герцена» Минздравсоцразвития России, 2014. - 249 с.
- Давыдов М.И., Тер-Ованесов М.Д., Маховский В.В. Состояние проблемы и пути оптимизации тактики хирургического лечения больных раком желудка старшей возрастной группы //Хирургия. - 2008. - № 10. - с. 73 - 79.
- Khedmat H., Panahian M., Mashahdian M. et al. Prognostic factors and survival in stomach cancer -analysis of 15 years of data from a referral hospital in iran and evaluation of international variation // Onkologie. - 2011. - Vol. 34(4) - P. 178-8.
- Nagini S. Carcinoma of the stomach: A review of epidemiology, pathogenesis, molecular genetics and chemoprevention // World J Gastrointest Oncol. -2012. - Vol. 4(7). - Р.156-169.
- Folkman J. Is tissue mass regulated by vascular endothelial cells? Prostate as the first evidence // Endocrinology. - 1998. - Vol. 139(2). - P. 441-2.
- Lazar D., Taban S., Raika M., Sporea I., Cornianu M., Goldis A. et al. Immunohistochemical evaluation of the tumor neoangiogenesis as a prognostic factor for gastric cancers. Romanian Journal of Morphology and Embryology. 2008; 49 (2): 137-148.
- Wang Y. D., Wu P., Mao J. D., Huang H., Zhang F. Relationship between vascular invasion and microvessel density and micrometastasis. World J Gastroenterol. 2007; 46 (13): 6269-6273.
- Pollard J.W. Trophic macrophages in developm ent and disease//Nat Rev Immunol.- 2009. - Vol. 9(4). - P. 259-70.
- Shen Z., Zhou S., Wang Y. et al. Higher intratumoral infiltrated Foxp3 Treg numbers and Foxp3 /CD8 ratio are associated with adverse prognosis in resectable gastric cancer // J Cancer Res Clin Oncol. - 2010. - Vol. 136(10). - P. 1585-95.
- Nagy J.A., Dvorak H.F. Heterogeneity of the tumor vasculature: the need for new tumor blood vessel type-specific targets// Clin Exp Metastasis. - 2012. - Vol. 29(7). - P. 657-62.
- Dvorak H.F., Brown L.F., Detmar M., Dvorak A.M. Vascular permeability factor/vascular endothelial growth factor, microvasculary permeability, and angiogenesis //Am J Pathol. - 1995. - Vol. 146. - P. 1029-1039.
- Sallusto F., Lanzavecchia A., Mackay C.R. Chemokines and chemokine receptors in T-cell priming and Th1/Th2-mediated responses // Immunol Today. - 1998. - Vol. 19. - P. 568-74
- Sato E., Olson S.H., Ahn J. et al. Intraepithelial CD8 tumor-infiltrating lymphocytes and a high CD8 /regulatory T cell ratio are associated with favorable prognosis in ovarian cancer // Proc Natl Acad Sci USA. - 2005. - Vol.102(51). - P. 18538-43.
- Pagano L., Viola A., Fioretti G., Ammirabile M., Ricchi P., Prossomariti L. Neapolis (CD 126 beta+ GGT-> GGG): a result of a screening in Campania, a region in Southern Italy. // Haematologica. - 2007. - Vol. 92(7). -P. 990-1.
- Liu K., Yang K., Wu B., Chen H., Chen X., Chen X., Jiang L., Ye F., He D., Lu Z., Xue L., Zhang W., Li Q., Zhou Z., Mo X., Hu J. Tumor-infiltrating immune cells are associated with prognosis of gastric cancer // Medicine (Baltimore). 2015; 94(39): e1631.
- Стадников А.А., Сеньчукова М.А., Шевлюк Н.Н., Боков Д.А. Морфологическая характеристика сосудов подслизистой основы желудка на участках, прилежащих к опухоли //Морфология. - 2011. -том.140, № 4. - С. 18 - 22.
- Senchukova M., Ryabov A., Karmakova T., Tomchuk O. and Stadnikov A. The Morphological Features of "Cavitary" Type Angiogenesis in Diffuse and Intestinal Types of Gastric Cancer and Its Relationship with Tumor-Infiltrating Immune Cells. // British Journal of Medicine & Medical Research. - 2015. - Vol. 7(4). - P. 272-84.
- Eiro N., Vizoso F.J. Inflammation and cancer // World J Gastrointest Surg. - 2012. - Vol. 4(3). - P. 62-72.
- Hoshida T., Isaka N., Hagendoorn J. et al. Imaging steps of lymphatic metastasis reveals that vascular endothelial growth factor-C increases metastasis by increasing delivery of cancer cells to lymph nodes: therapeutic implications//Cancer Res. - 2006. - Vol. 66 (16). -P. 75-80.
- Nwogu C.E., Yendamuri S., Tan W., Kannisto E., Bogner P. et al. Lung cancer lymph node micrometastasis detection using real-time polymerase chain reaction: correlation with vascular endothelial growth factor expression // J Thorac Cardiovasc Surg. - 2013. - Vol. 145 (3). -P. 185-189.
- Zeng Y., Opeskin K., Baldwin M.E., Horvath L.G., et al. Expression of vascular endothelial growth factor receptor-3 by lymphatic endothelial cells is associated with lymph node metastasis in prostate cancer//Clin Cancer Res. - 2004.- Vol. 10 (15). - P. 218-225
- Russell J. Лимфатический узел. Изд. VSD, 2012. - 60 стр


