Морфологические особенности органов желудочно-кишечного тракта при субхроническом воздействии нанодисперсного оксида марганца (III, IV)
Автор: Землянова М.А., Звездин В.Н., Довбыш А.А., Кондрашова Н.Б., Акафьева Т.И.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Практика оценки риска
Статья в выпуске: 3 (3), 2013 года.
Бесплатный доступ
Исследование морфологических особенностей органов желудочно-кишечного тракта экспериментальных животных при субхроническом (в течение 30 дней) внутрижелудочном введении водной суспензии нанодисперсного оксида марганца (III, IV) в дозе 10,4 мг/кг показало комплекс патоморфологических изменений в виде умеренно выраженной диффузно-распространенной воспалительной реакции в слизистом и подслизистом слое желудка, тонкого и толстого кишечника, проявляющейся лимфомакрофагальной инфильтрацией со значительной примесью эозинофилов и плазмоцитов. В межмышечных нервных ганглиях зафиксированы дистрофические изменения с выраженным периневральным отёком. При введении микродисперсного аналога таким же способом воспалительная реакция в исследуемых органах имела очаговый характер, слабую степень выраженности. Явления периневрального отека и дистрофии в межмышечных нервных ганглиях не установлены.
Нанодисперсный оксид марганца, морфологические изменения, желудок, тонкий и толстый кишечник, субхроническое воздействие
Короткий адрес: https://sciup.org/14237834
IDR: 14237834 | УДК: 615.9,614.7
Текст научной статьи Морфологические особенности органов желудочно-кишечного тракта при субхроническом воздействии нанодисперсного оксида марганца (III, IV)
Мировое развитие и распространение нанотехнологий и нанобиотехнологий диктует необходимость системного развития работ по изучению потенциальных угроз в сфере жизнедеятельности человека [5]. В ведущих странах мира – в России, США, Канаде, Японии, Китае, Южной Корее, странах Евросоюза – осуществляются масштабные исследования по оценке безопасности и потенциальных рисков, связанных с производимыми наноматериалами [12]. В силу неизученности уникальных физических, химических и био- логических свойств наноразмерных частиц, отличающих их от веществ в форме макроскопических дисперсий и сплошных фаз, актуальным является детальное исследование токсических эффектов и патофизиологических механизмов действия наноразмерных материалов на жизненно важные органы и системы [11].
Наиболее перспективными для использования в ведущих отраслях промышленности – наноэлектронике, нанооптике, синтетической нанохимии, в потребительском секто-
-
© Землянова М.А., Звездин В.Н., Довбыш А.А., Кондрашова Н.Б., Акафьева Т.И., 2013
ре – являются оксиды металлов, в том числе оксид марганца [4]. Планируемое производство матриц на основе наноразмерного оксида марганца для наномагнитных и сорбирующих материалов, нанокатализаторов, полупроводниковых термистеров в объеме до 1000 тонн в год оценивается как «массово выпускаемый продукт» [8]. При этом возможно прямое экспонирование персонала, участвующего в процессе производства, и населения, находящегося в зоне экспозиции.
Растущие по экспоненте разработка, производство и коммерциализация продуктов нанотехнологий, содержащих нанораз-мерный оксид марганца, требуют фундаментального исследования особенностей токсического действия на органы-мишени, включающие патоморфологические аспекты изменений, при различных путях поступления. Накопление и обобщение информации необходимо для прогнозирования и разработки критериев безопасности для человека продукции, содержащей в своем составе наночастицы.
Материалы и методы. В экспериментальных исследованиях изучена водная суспензия нанодисперсного оксида марганца (III, IV), полученная методом непосредственного взаимодействия ионов Mn2+ + MnO4– в присутствии нанореакторов – мицелл цетилтриметиламмония бромида (СТАВ, C16H33(CH3)3NBr) [3]. Синтез осуществлен в лаборатории многофазных дисперсных систем Института технической химии Уральского отделения РАН. Использование мицелл поверхностно-активного вещества предотвращало рост частиц и позволило синтезировать стабилизированные частицы определенных размеров, коррелирующих с размерами мицелл [10]. СТАБ удаляли многократной экстракцией этанолом в подкисленной среде (с помощью соляной кислоты), степень экстракции составила не менее 98 %. Для сравнительного анализа при оценке морфологических особенностей синтезирован водный микродис-персный раствор оксида марганца (III, IV) по аналогичной методике, но без добавления CTAB. Оценку размера и формы нано-и микродисперсных частиц вещества в водной суспензии выполняли методом динамического светорассеяния на анализаторе Horiba LB-550 (Horiba, Япония) и на лазерном анализаторе Microtrac S3500 (Microtrac, США) соответственно. Удельную площадь поверхности (SBET) частиц определяли методом Брунауэра, Эммета и Тейлора [2], текстурные параметры – сорбцией азота при температуре –196 °С на анализаторе ASAP 2020 (Micromeritics, США). Концен- трацию оксида марганца в водной суспензии оценивали методом атомно-адсорбционной спектрометрии с ацетиленовоздушным пламенем на анализаторе Perkin Elmer 3110 (Perkin Elmer Inc. США).
Оценку морфологических особенностей тканей органов желудочно-кишечного тракта при субхроническом введении (30 дней) тестируемых веществ проводили на материале половозрелых крыс линии Wistar, самцов массой 190,0±20,0 г. Экспериментальные животные были разделены на три группы по 10 особей в каждой. Животным 1-й группы (опытной) вводили водную суспензию нанодисперсного оксида марганца (III, IV) в концентрации 41,0 мг/дм3 однократно зондово внутриже-лудочно в дозе 10,4 мг/кг (1/250ЛД 50 ). Животным 2-й группы (сравнения) в аналогичной дозе и способом вводили микро-дисперсный водный раствор оксида марганца (III, IV) в концентрации 54,6 мг/дм3. Животным 3-й группы (контрольной) вводили дистиллированную воду в эквивалентном объёме (1,2 мл).
Животные на протяжении всего эксперимента содержались в условиях лабораторного вивария (по 5 особей в полипропиленовых клетках стандартного размера Т/3) на полусинтетическом рационе согласно методическим указаниям «Токсиколого-гигиеническая оценка безопасности наноматериалов» (МУ 1.2.2520-09). Доступ к корму и питью не ограничивали. Температура в помещениях в период наблюдения составляла 23,0±2,0 Cº, влажность воздуха – 60,0±5,0 %. Экспериментальные манипуляции производили в соответствии с международными рекомендациями (этическим кодексом) по проведению медико-биологических исследований с использованием животных [6].
У животных через 30 дней после выведения из эксперимента методом декапитации забирали кровь, желудок, тонкую и толстую кишку. Отобранный материал (толстый и тонкий кишечник) фиксировали в 10%-ном нейтральном формалине, далее обезвоживали в спиртах восходящей концентрации, пропитывали хлороформом и парафином, а затем заливали гомогенизированной парафиновой средой «Histomix». Серийные срезы с блоков толщиной 4 мкм изготавливали на санном микротоме Leica JUNG SM 2000R и окрашивали по общепринятой методике гематоксилином и эозином. Полученные гистологические препараты исследовали в светооптическом микроскопе Axiostar (Carl Zeiss, Германия). Микрофотографии выполняли на светооптическом микроскопе MEIJI (Япония) с установленной камерой microscopy VISION (Канада) при увеличении х 100, х 200, х 400, х 800.
Идентификацию нано- и микроразмер-ных частиц оксида марганца в пробах крови экспериментальных животных осуществляли методом электронной микроскопии на сканирующем микроскопе высокого разрешения (3–10 нм, максимальное увеличение 300000Х) S-3400N (HITACHI, Япония) с приставкой для рентгеновского энергодисперсионного микроанализа (Bruker, Германия) и на автоэмиссионном сканирующем электронном микроскопе Ultra 55 (Carl Zeiss, Германия) в режиме вторичных электронов при ускоряющем напряжении в диапазоне 1– 20 кВ и увеличении от 1000 до 50 000 крат. Пробоподготовка образцов заключалась в нанесении нативного материала на кварцевую подложку в виде тонкого мазка без фиксации, высушивании при комнатной температуре в эксикаторе, напылении углеродного проводящего слоя толщиной до 15 нм на поверхность образца. Оценка размеров частиц в образцах выполнена с использованием программного обеспечения Smart SEMTM, анализ элементного состава – с помощью энергодисперсионного спектрометра Inca Energy (Oxford Instrument, Великобритания) с разрешением < 137 эВ, совмещенного со сканирующим электронным микроскопом Ultra 55 (Carl Zeiss, Германия).
Результаты и их обсуждение. Исследованная в эксперименте водная суспензия на-нодисперсного оксида марганца (III, IV) имела структуру бернессита. Размер частиц в 97,8 % случаев от их общего количества в дисперсном растворе составил 34–39 нм, форма – несферическая (рис. 1–3).

пт
Рис. 1. Изображение синтезированных частиц нанодисперсного оксида марганца с помощью атомно-силовой микроскопии
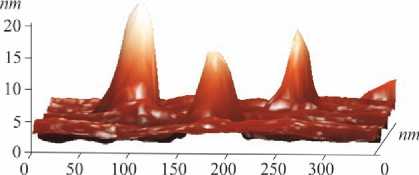
Рис. 2. 3D-конфигурация поверхности синтезированных частиц нанодисперсного оксида марганца

Рис. 3. Электронное изображение синтезированных частиц нанодисперсного оксида марганца с помощью сканирующей электронной микроскопии, ув. × 50 тыс. Визуализация методом обратных электронов (S-3400N «HITACHI»)
Микрочастицы оксида марганца являлись частицами «традиционной» дисперсности» (1 мкм и более), в 98,0 % случаев в меньшей из осей имели размер частиц 5,5 мкм, форму частиц – несферическую.
Удельная площадь поверхности наночастиц оксида марганца составила 150,23 м2/г, что в 1,2 раза выше таковой поверхности мик-родисперсного аналога.
При электронной микроскопии в образцах крови экспериментальных животных опытной группы по всему полю зрения на поверхности агрегированных эритроци- тов визуализируются частицы несферической формы, имеющие наноразмерный диапазон (менее 0,1 мкм) (рис. 4).

а
Рис. 4. Электронное изображение образца крови крысы опытной группы.
Доза нанодисперсного оксида марганца 10,4 мг/кг. Визуализация методом сканирующей электронной микроскопии с обратным захватом электронов: а - ув. х 5 тыс.; б - ув. х 50 тыс.

б
Оценка результатов элементного анализа свидетельствует, что данные частицы по химическому составу относятся к марганцу, доля которого составляет 3,4 %.
Анализ электронных снимков крови животных группы сравнения показал, что на фоне единичных эритроцитов все поле зрения заполнено частицами, соответствующими микроразмерному диапазону
(рис. 5). Результаты элементного анализа состава изучаемого образца крови подтверждают, что данные частицы являются частицами марганца. Данные электронной микроскопии и элементного анализа состава образцов крови животных контрольной группы свидетельствует об отсутствии в образцах нано- и микроразмерных частиц марганца (рис. 6).
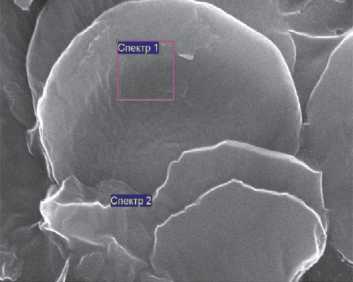
Рис. 5. Электронное изображение образца крови крысы группы сравнения. Доза микродисперсного оксида марганца 10,4 мг/кг. Визуализация методом сканирующей электронной микроскопии с обратным захватом электронов (ув. х 1000)

Рис. 6. Электронное изображение образца крови крысы контрольной группы. Визуализация методом автоэмиссионной сканирующей электронной микроскопии (ув. х 30000)
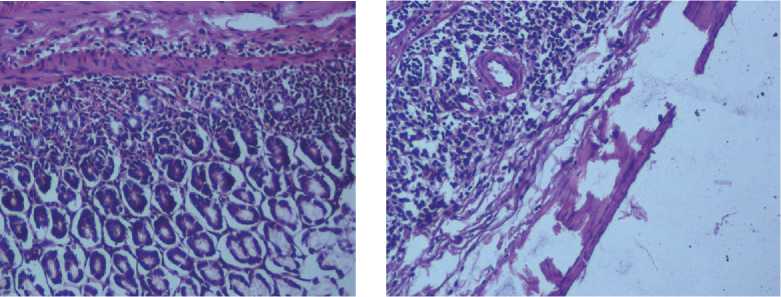
а б
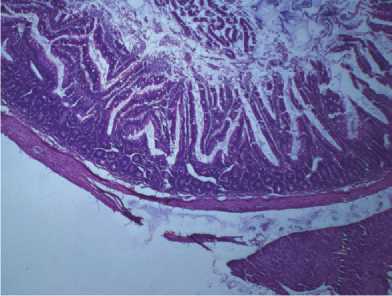
Рис. 7. Желудок крысы при субхроническом зондовом внутрижелудочном введении тестируемого вещества в дозе 10,4 мг/кг. Окраска гематоксилином и эозином, ув. х 400: а – нанодисперсный оксид марганца; б – микродисперсный оксид марганца
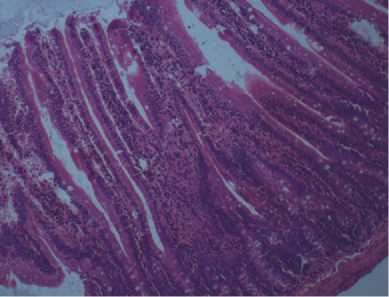
а
б
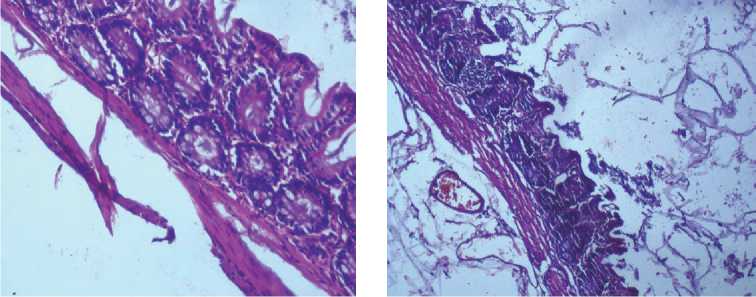
Рис. 8. Тонкая кишка крысы при субхроническом зондовом внутрижелудочном введении тестируемого вещества в дозе 10,4 мг/кг. Окраска гематоксилином и эозином: а - нанодисперсный оксид марганца, ув. х 100; б - микродисперсный оксид марганца, ув. х 200
а б
Рис. 9. Толстая кишка крысы при субхроническом зондовом внутрижелудочном введении тестируемого вещества в дозе 10,4 мг/кг. Окраска гематоксилином и эозином: а - нанодисперсный оксид марганца, ув. х 200; б - микродисперсный оксид марганца, ув. х 400
Кроме этого, в тонкой и толстой кишке воспалительные изменения сопровождались развитием выраженного отека слизистого и подслизистого слоев, гиперплазией лимфоидной ткани кишки, ассоциированной со слизистой оболочкой с образованием фолликулов со светлыми центрами. В межмышечных нервных ганглиях с зернистой эозинофильной цитоплазмой установлены дистрофические изменения с выраженным периневральным отёком (рис. 8, а , 9, а ). У животных группы сравнения при субхроническом введении микроразмерной суспензии в анализируемых органах отмечается очаговая слабо выраженная воспалительная реакция, характеризующаяся слабой лимфомакрофагальной инфильтрацией с примесью единичных эозинофилов в слизистой и подслизистой оболочке (рис. 7, б – 9, б ).
Выводы. Патоморфологические изменения тканей органов желудочно-кишечного тракта экспериментальных животных при внутрижелудочном введении водной суспензии нанодисперсного оксида марганца (III, IV) в течение 30 дней в дозе
Для получения комплексного представления об особенностях патоморфоло-гических изменений органов желудочнокишечного тракта при пероральном поступлении изучаемого вещества и для решения задач гигиенического регламентирования необходимо проведение развернутых экспериментальных исследований в условиях хронического поступления нанодисперсно-го оксида марганца.
Список литературы Морфологические особенности органов желудочно-кишечного тракта при субхроническом воздействии нанодисперсного оксида марганца (III, IV)
- Воздействие на организм человека опасных и вредных экологических факторов. Метрологические аспекты: в 2 т/под ред. Л.К. Исаева. -М.: ПАИМС, 1997. -Т. II. -496 с.
- Грег С., Синг К. Адсорбция, удельная поверхность, пористость. -М.: Мир, 1984. -306 с.
- Гырдасова О.И., Красильников В.Н., Базуев Г.В. Синтез микро-и наноразмерных оксидов марганца из гидратированных оксалатов марганца и продуктов их химического модифицирования этиленгликолем//Неорганическая химия. -2009. -№ 7. -С. 1097-1102.
- Маркетинговое исследование рынка нанопорошков (вер. 5): аналитический отчет от 16.12.2011 [Электронный ресурс]. -URL: http://www.research-techart.ru-/report-/nanopowder-market.htm (дата обращения: 02.09.2013).
- Маркетинговый анализ рынков нанопродуктов. -М.: Техносфера, 2008. -349 с.
- Международные рекомендации (этический кодекс) по проведению медико-биологических исследований с использованием животных/Совет международных научных организаций. -М., 1985. -С. 1-2.
- Морфологические особенности тканей внутренних органов и систем при воздействии нанодисперсного оксида марганца (III, IV)/Н.В. Зайцева, М.А. Землянова, В.Н. Звездин, О.В. Лебединская, С.В. Мелехин, Е.В. Саенко, Р.Р. Махмудов//Вестник РАМН. -2013. -№ 2. -С. 18-23.
- МР 1.2.2522-09. Методические рекомендации по выявлению наноматериалов, представляющих потенциальную опасность для здоровья человека [Электронный ресурс]. -URL: http://snip.ruscable.ru/Data1/56/56401/(дата обращения: 12.07.13).
- МУ 1.2.2520-09. Токсиколого-гигиеническая оценка безопасности наноматериалов [Электронный ресурс]. -URL: http://www.tuk.ru/wiki/index.php/МУ_1.2.2520-09 (дата обращения: 09.07.13).
- Нанотехнология в ближайшем десятилетии. Прогноз направления исследований: пер. с англ./Дж. Уайтсайдс, Д. Эйглер, Р. Андерс [и др.]; под ред. М.К. Роко, Р.С. Уильямса и П. Аливисатоса. -М.: Мир, 2002. -292 с.
- Онищенко Г.Г. Стратегия безопасности наноиндустрии//Здоровье населения и среда обитания. -2011. -№ 5. -С. 4-8.
- Проект долгосрочного прогноза научно-технологического развития Российской Федерации (до 2025 года) [Электронный ресурс]. -URL: www.strf.ru/attach/prognoz (дата обращения: 12.09.2013).
- Токсиколого-гигиеническая оценка безопасности водной суспензии нанодисперсного диоксида кремния, синтезированного методом жидкокристаллического темплатирования/Н.В. Зайцева, М.А. Землянова, В.Н. Звездин, Е.В. Саенко//Анализ риска здоровью. -2013. -№ 1. -С. 65-72.


