Морфологические особенности сульпиридной модели доброкачественной гиперплазии предстательной железы у крыс
Автор: Тишевская Н.В., Максаков Д.А., Головнева Е.С.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 2, 2017 года.
Бесплатный доступ
Для создания экспериментальной модели доброкачественной гиперплазии предстательной железы (ДГПЖ) крысам в возрасте 16-18 мес ежедневно вводили сульпирид в дозе 40 мг/кг веса в течение 30 дней. Через 10 дней после последней инъекции относительная масса дорсолатеральных долей ПЖ была больше контрольного уровня в 2 раза, объем железистой ткани возрос на 25%, толщина эпителиального слоя желез увеличилась в 1,6 раза. Гиперплазия предстательной железы развивалась не только за счет усиленного деления клеток, но и за счет внутриклеточной гипертрофии: эпителиальные клетки ПД подопытных крыс содержали в 1,5 раза больше цитоплазмы, чем клетки контрольных животных. Уровень экспрессии Ki-67 в клетках железистого эпителия у крыс с сульпиридной моделью ДГПЖ не отличался от контрольных значений. Через 10 дней после окончания курса сульпирида в ткани ПЖ в 1,7 раза увеличилась экспрессия каспазы-3, что свидетельствует об активации апоптоза и обратимости экспериментально созданного патологического процесса. Корреляционный анализ выявил наличие прямых связей между массой железы, объемом железистой ткани в ней, толщиной эпителия ацинусов, количеством цитоплазмы в эпителиоцитах и экспрессией каспазы-3 в предстательной железе как подопытных, так и контрольных животных.
Доброкачественная гиперплазия предстательной железы, внутриклеточная гипертрофия, сульпирид, моделирование патологических состояний, апоптоз
Короткий адрес: https://sciup.org/142188189
IDR: 142188189
Текст научной статьи Морфологические особенности сульпиридной модели доброкачественной гиперплазии предстательной железы у крыс
экспериментальная и клиническая урология № 2 2 0 17
экспериментальная и клиническая урология № 2 2 0 17
Абсолютную массу ПЖ и ее дорсолатеральных отделов определяли путем взвешивания на электронных весах. Относительную массу железы и ее дорсолатеральных отделов рассчитывали на 100 г веса животного. Для проведения морфологического исследования ткани фиксировали в 10% растворе формалина и подвергали стандартной гистологической проводке с последующей окраской парафиновых срезов гематоксилином и эозином. Морфометрические исследования проводились с помощью компьютерной системы анализа цветового изображения: микроскопа Leika DMRXA (Германия), системы анализа изображения Диаморф Цито® (Россия) и комплекта компьютерных программ Диаморф Ипсо® (Россия). Морфометрия проводилась по методу Г.Г. Автандилова [7]. В каждом препарате измеряли общую площадь, занимаемую железистой тканью, толщину эпителиального слоя, площади ядра и цитоплазмы эпителиальных клеток. Экспрессию ядер-ного антигена Ki-67 (маркер пролиферативной активности) определяли с помощью кроличьих моноклональных антител (SP6) (CELL MARQUE, США), экспрессию каспазы-3 (маркер апоптоза) – с использованием кроличьих поликлональных антител (GenTex, США). Результаты иммуногистохимических реакций выражали в виде процентного отношения окрашенных клеток к общему числу клеток в препарате.
Таблица 1. Морфологические изменения в предстательной железе крыс с сульпиридной моделью ДГПЖ
|
Показатели |
Контроль (n=28) |
Крысы с ДГПЖ(n=30) |
|
Абсолютная масса всей железы (г) |
2,84±0,04 |
3,33±0,04* |
|
Относительная масса всей железы |
0,66±0,01 |
0,90±0,01* |
|
Абсолютная масса дорсолатеральных долей (г) |
1,03±0,02 |
1,75±0,02* |
|
Относительная масса дорсолатеральных долей |
0,22±0,01 |
0,45±0,01* |
|
% железистой ткани |
47,61±0,43 |
75,14±0,56* |
|
Толщина эпителия (мкм) |
19,23±0,45 |
30,06±0,48* |
|
Площадь ядра 1 эпителиальной клетки (мкм) |
24,45±0,11 |
24,79±0,11 |
|
Площадь цитоплазмы 1 эпителиальной клетки (мкм) |
55,85±0,27 |
83,47±0,47* |
|
Ядерно-цитоплазматическое отношение |
0,438±0,003 |
0,297±0,002* |
|
Ki-67 (%) |
0,39±0,13 |
0,40±0,11 |
|
Каспаза-3 (%) |
44,75±4,42 |
74,23±4,75* |
Результаты представлены в виде M±m
* отмечено наличие достоверных различий между группами ( p < 0,05)
Полученные данные были подвергнуты статистической обработке с помощью компьютерной программы IBM SPSS Statistics 19,0. Сравнения групп проводились методами непараметрической статистики с использованием критериев Манна-Уитни и хи-квадрат, корреляционные связи оценивались по величине и уровню значимости коэффициента ранговой корреляции Спирмена.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Несмотря на то, что в «Руководстве по проведению доклинических исследований лекарственных средств» указано, что для создания сульпиридной модели ДГПЖ наряду с крысами старше 10 мес. возможно использовать крыс молодого репродуктивного возраста [3], нам не удалось воспроизвести данную модель у половозрелых 8-9-месячных самцов при 30-дневном курсе сульпирида: абсолютные и относительные массы их ПЖ, а также массы дорсолатеральных отделов достоверно не отличались от контрольных значений.
У 16-18-месячных крыс через 10 дней после окончания 30-дневного курса сульпирида абсолютная масса ПЖ превышала контрольные значения на 17,3%, относительная масса – на 36,4% (табл. 1). При этом относительная масса дорсолатеральных долей у крыс с сульпирид- ной моделью ДГПЖ была больше контрольного уровня в 2 раза.
Морфологические изменения, развившиеся в ПЖ крыс после длительного введения сульпирида, были аналогичны морфологической картине ДГПЖ у человека [8]. При гистологическом исследовании в препаратах дорсолатеральных отделов ПЖ подопытных животных на долю железистого эпителия приходилось 75%, тогда как в контроле железистая ткань составляла не более половины всей площади. У крыс с ДГПЖ эпителиальные клетки имели преимущественно цилиндрическую форму в отличие от ПЖ контрольных животных (рис. 1,2), ацинусы которых были выстланы кубическим эпителием, что характерно для ткани дорсолатеральных отделов ПЖ интактных половозрелых крыс [9]. Толщина эпителиального слоя ацинусов у животных опытной группы была в 1,6 раза больше, чем в контроле, при этом эпителиальная ткань формировала многочисленные выросты. Изменение толщины эпителия было обусловлено преимущественно внутриклеточной гипертрофией: железистые клетки ПЖ крыс опытной группы,
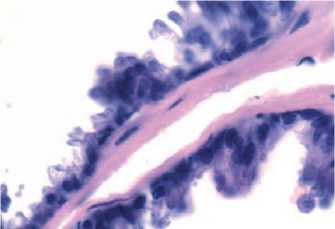
Рис.2. Железистый эпителий дорсолатеральных отделов предстательной железы крысы с сульпи-ридной моделью ДГПЖ (световая микроскопия, увеличение х1000, окраска гематоксилином и эозином)
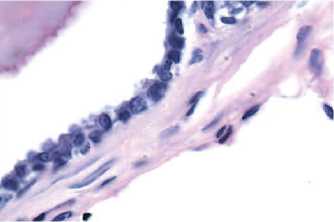
Рис.1. Железистый эпителий дорсолатеральных отделов предстательной железы контрольной крысы (световая микроскопия, увеличение х1000, окраска гематоксилином и эозином)
экспериментальная и клиническая урология № 2 2 0 17 по сравнению с контролем, содержали в 1,5 раза больше цитоплазмы. В соответствии с этим, ядерно-ци-топлазматическое отношение в эпителиоцитах у животных с ДГПЖ оказалось в 1,5 раза меньше.
В настоящее время одним из распространенных молекулярных маркеров активного пролиферативного процесса в тканях является ядерный антиген Ki-67, экспрессирующийся в течение всех фаз клеточного цикла, кроме G0. В онкоурологии Ki-67 является критерием распространенности и степени дифференцировки опухолевого процесса [10,11]. При этом Ki-67 в 100% случаев выявляется в ядрах клеток низкодифференцированных опухолей ПЖ и не обнаруживается в клетках высокодифференцированной аденокарциномы [12]. В нашем исследовании наблюдалось полное отсутствие статистически значимых различий между уровнем экспрессии Ki-67 в клетках железистого эпителия у контрольных и подопытных животных (табл. 1). С одной стороны, это свидетельствует о несомненной доброкачественности моделируемого гиперпластического процесса, с другой – о том, что сульпиридная модель ДГПЖ только частично воспроизводит картину данной патологии у человека, поскольку у мужчин с ДГПЖ помимо признаков доброкачественной гиперплазии в ткани железы, как правило, обнаруживаются и очаги интраэпителиальной неоплазии низкой степени. По этой причине, как показано другими исследователями, относительная площадь экспрессии Ki-67 в железистых клетках в 3,5 раза превышает таковую у здоровых муж-
Таблица 2. Корреляционные взаимоотношения между показателями, характеризующими состояние предстательной железы у пожилых крыс
|
Показатели |
% железистой ткани |
Толщина эпителия |
Площадь цитоплазмы |
ЯЦО * |
|
Абс. масса всей железы |
0,570 |
0,657 |
0,727 |
- 0,683 |
|
Отн. масса всей железы |
0,783 |
0,807 |
0,698 |
- 0,702 |
|
Абс. масса дорсолатер. долей |
0,753 |
0,813 |
0,668 |
- 0,730 |
|
Отн. масса дорсолатер. долей |
0,719 |
0,720 |
0,805 |
- 0,768 |
|
% железистой ткани |
– |
0,737 |
0,704 |
- 0,731 |
|
Толщина эпителия |
0,737 |
– |
0,699 |
- 0,739 |
|
Каспаза-3 |
0,503 |
0,468 |
0,516 |
- 0, 519 |
В таблице представлены значения коэффициентов ранговой корреляции Спирмена с уровнем статистической значимости р < 0,01
* ЯЦО - ядерно-цитоплазмическое отношение
чин [13]. Мы полагаем, что экспрессия этого ядерного антигена в эпителиоцитах ацинусов подопытных животных регистрировалась на уровне показателей интактных крыс именно потому, что в ткани ПЖ через 10 дней после окончания курса сульпирида не было выявлено морфологических признаков злокачественного роста.
Мы выводили животных из эксперимента не сразу по окончании курса сульпирида (как делали другие исследователи [5,14]), а через 10 дней после последней инъекции препарата для того, чтобы одновременно с оценкой пролиферативного потенциала клеток железистого эпителия можно было проследить и появление признаков регрессии ДГПЖ. Известно, что одним из ведущих механизмов поддержания тканевого гомеостаза является апоптоз – запрограммированная гибель клеток, связанная с активацией разрушающих ДНК ферментов – каспаз. Среди всех каспаз наибольшей активностью обладает каспаза-3, поскольку после включения ее в процесс фрагментации ДНК клетка необратимо вступает на путь гибели [15]. В нашем исследовании у крыс с экспериментальной ДГПЖ через 10 дней после завершения курса сульпирида, морфологически отмечалась выраженная гиперплазия железистого эпителия, однако результаты иммуногистохимического анализа экспрессии каспазы-3 продемонстрировали наличие несомненных признаков активации апоптоза. В ПЖ подопытных животных доля клеток, содержащих этот проапоптотический фермент, была в 1,7 раза больше, чем в ткани
ПЖ контрольных крыс (табл. 1). Этот факт свидетельствует о начале восстановительных процессов в гиперплазированной железе, ранее подвергшейся влиянию медикаментозно измененных гуморальных механизмов регуляции, и служит доказательством обратимости экспериментальной сульпиридной модели данной патологии.
Подтверждением того, что у здоровых крыс временная гиперпролактинемия не приводит к фатальным изменениям регуляции морфогенеза, явились данные корреляционного анализа, проведенного между показателями всех животных, участвующих в эксперименте – и контрольных, и подопытных (табл. 2). Наличие прямых связей между массой железы, объемом железистой ткани в ней, толщиной эпителия ацинусов, количеством цитоплазмы в эпителиоцитах и экспрессией каспазы-3 не зависело от того, в каком состоянии находились крысы – в интактном или же экспериментальном патологическом. Это означает, что в данном эксперименте в организме животных сохраняется способность регулировать и поддерживать тканевой гомеостаз и, следовательно, сульпи-ридная модель ДГПЖ, не провоцирующая возникновения неоплазии, является адекватной моделью естественных возрастных гиперпластических процессов в ПЖ у человека.
ВЫВОДЫ
-
1. Для создания экспериментальной модели ДГПЖ с помощью многократного введения сульпирида необходимо использовать крыс старше 10 мес. В нашем исследовании у крыс 16-18-месячного возраста модель была воспроизведена в 100% случаев.
-
2. Через 10 дней после 30-дневного курса сульпирида в предстательной железе пожилых крыс регистрируются выраженные морфологические признаки доброкачественной гиперплазии.
-
3. Механизмами развития ДГПЖ под влиянием сульпирида являются усиленная пролиферация и
- экспериментальная и клиническая урология № 2 2 0 17 www.ecuro.ru
-
4. Одновременно с развитием
Резюме:
Для создания экспериментальной модели доброкачественной гиперплазии предстательной железы (ДГПЖ) крысам в возрасте 16-18 мес ежедневно вводили сульпирид в дозе 40 мг/кг веса в течение 30 дней. Через 10 дней после последней инъекции относительная масса дорсолатеральных долей ПЖ была больше контрольного уровня в 2 раза, объем железистой ткани возрос на 25%, толщина эпителиального слоя желез увеличилась в 1,6 раза. Гиперплазия предстательной железы развивалась не только за счет усиленного деления клеток, но и за счет внутриклеточной гипертрофии: эпителиальные клетки ПД подопытных крыс содержали в 1,5 раза больше цитоплазмы, чем клетки контрольных животных. Уровень экспрессии Ki-67 в клетках железистого эпителия у крыс с сульпиридной моделью ДГПЖ не отличался от контрольных значений. Через 10 дней после окончания курса сульпирида в ткани ПЖ в 1,7 раза увеличилась экспрессия каспазы-3, что свидетельствует об активации апоптоза и обратимости экспериментально созданного патологического процесса. Корреляционный анализ выявил наличие прямых связей между массой железы, объемом железистой ткани в ней, толщиной эпителия ацинусов, количеством цитоплазмы в эпителиоцитах и экспрессией каспазы-3 в предстательной железе как подопытных, так и контрольных животных.
Список литературы Морфологические особенности сульпиридной модели доброкачественной гиперплазии предстательной железы у крыс
- Ткачук В.Н. Современные представления об этиологии и патогенезе доброкачественной гиперплазии предстательной железы. Нефрология 2004; 8(2): 90-93.
- Тиктинский О.Л., Калинина С.Н. Заболевания предстательной железы. СПб.: Питер. 2006. 464 с.
- Боровская Т.Г., Фомина Т.И., Дурнев А.Д., Удут В.В., Пахомова А.В., Юрмазов З.А., Дыгай А.И. Методические рекомендации по доклиническому изучению простатотропной активности лекарственных средств. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. М.: ФГБУ "НЦЭМСП" Минздравсоцразвития России. 2012. С. 727-739.
- Лесовая Е.А., Кирсанов К.И., Антошина Е.Е. Моделирование доброкачественной гиперплазии предстательной железы. Вопросы биологической, медицинской и фармацевтической химии 2013;(12):55-64.
- Беспалов В.Г., Муразов Я.Г., Кужанов А.А., Семенов А.Л. Сравнительное изучение простатотропных эффектов хвойного провитаминного концентрата и экстракта Serenoa repens на модели доброкачественной гиперплазии предстательной железы у крыс. Экспериментальная и клиническая урология 2013;(2):30-34.
- Van Coppenole F., Slomianny C., Carpentier F. Effects of hyperprolactinemia on rat prostate growth: evidence of androgeno-dependence. Am J Physiol Endocrinol Metab 2001;280(1): 120-129.
- Автандилов Г.Г. Медицинская морфометрия. М. «Медицина». 1990. 384 с.
- Кудрявцев Ю.В., Сивков А.В. Морфологические изменения в ткани предстательной железы при доброкачественной гиперплазии. Экспериментальная и клиническая урология 2010;(1):18-22.
- Цветков И.С., Макарова О.В., Мхитаров В.А. Структурно-функциональная характеристика предстательной железы крыс. Клиническая и экспериментальная морфология 2013;(4): 69-74.
- Nilsson S, Nordgren H, Karlberg L, Harvig B, Busch C, Hall T, Bjork P. Expression of estramustine -binding protein (EMBP) and the proliferation-associated antigen Ki-67 in prostatic carcinomas. Scand J Urol Nephrol 1988;110:31-37.
- Theodoropoulos V. E., Tsigka A., Mihalopoulou A., Tsoukala V., Lazaris A.C., Patsouris E., Ghikonti I. Evaluation of neuroendocrine staining and androgen receptor expression in incidental prostatic adenocarcinoma: prognostic implications. Urology 2005;66(4):897-902.
- Ковылина М.В., Прилепская Е.А., Сергейко И.П., Моисеенко Т.Н., Колонтарев К.Б., Говоров А.В., Пушкарь Д.Ю. Прогностическое значение иммуногистохимических маркеров Ki-67 p53 после радикальной простатэктомии. Онкоурология 2014;(1): 49-52.
- Попков В.М. Прогностическое значение молекулярных маркеров при опухолях предстательной железы. Медицинская наука и образование Урала 2010;11(2):30-34.
- Ходченкова И.П., Зарубина И.В., Шабанов П.Д. Метаболические изменения в предстательной железе и иммунный статус крыс при доброкачественной гиперплазии. Психофармакология и биологическая наркология 2005;5 (4):1081-1085.
- Самуилов В.Д. Биохимия программируемуей клеточной смерти (апоптоза) у животных. Соросовский образовательный журнал 2001;7 (10): 18-25.


