Морфологическое исследование компонентов клеточного и гуморального звеньев иммунного ответа селезенки лабораторных крыс при экспериментальной гиперкальциемии
Автор: Мельникова Ольга Владимировна, Сергеева Валентина Ефремовна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.24, 2016 года.
Бесплатный доступ
Данное исследование посвящено комплексной морфологической оценке компонентов клеточного и гуморального звеньев иммунитета селезенки лабораторных крыс в ответ на повышение уровня кальция в периферической крови. Цель исследования - изучение морфологических характеристик CD4-, CD8-, CD20-позитивных клеток селезенки лабораторных крыс при экспериментальной гиперкальциемии на фоне длительного употребления соединения кальция с питьевой водой. Доказано, что экспериментальная гиперкальциемия вызывает перераспределение компонентов клеточного и гуморального звеньев иммунного ответа селезенки: повышением количества CD4+ клеток белой пульпы, CD8+ клеток красной пульпы на фоне сокращения количества CD20+ клеток во всех морфо-функциональных зонах, кроме герминативных центров. Выявленный морфологический комплекс изменений селезенки при гиперкальциемии свидетельствует о ее избирательном характере воздействия на различные звенья иммунного ответа. Происходит повышение активности Т-хелперных и Т-цитотоксических лимфоцитов с компенсаторным снижением показателей В-лимфоцитарного звена, что отражает проявление адаптации и ауторегуляции иммунного ответа.
Селезенка, гиперкальциемия, хлорид кальция
Короткий адрес: https://sciup.org/143177096
IDR: 143177096
Текст научной статьи Морфологическое исследование компонентов клеточного и гуморального звеньев иммунного ответа селезенки лабораторных крыс при экспериментальной гиперкальциемии
Введение. Известно, что функцию адаптивного иммунитета, определяющую клеточный и гуморальный гомеостаз организма, осуществляют органы иммунной системы. Ее морфологическую основу составляет лимфоидная ткань, организованная в функциональные образования, самым крупным из которых является селезенка [1]. Исследование структурно-функциональных особенностей селезенки является актуальной проблемой, поскольку иммунный аппарат селезенки, по мнению многих исследователей, имеет более сложное строение, чем другие периферические органы иммунной системы [2]. Она отличается множественной зональностью и высокой специфичностью каждой зоны, определяющейся уникальным взаимодействием лимфоидных клеток и клеток стромы, создающих особое микроокружение каждой зоны селезенки и обеспечивающих формирование адекватного иммунного ответа [3].
Кальций является самым распространенным и эссенциальным макроэлементом в организме человека с ключевой ролью в поддержании нормальной жизнедеятельности всего организма, интеграции функций его систем, является кофактором активации многих ферментов, гормонов, витаминов и других биологически активных ве- ществ [4]. Отмечена иммунологическая активность кальция, которая заслуживает внимание с позиций иммунофизиологии и морфологии [5]. Кальций принимает участие в активации иммунной системы, контролирует антителообразование, обладает антагонистическим действием на процессы клеточной пролиферации и дифференциации [4].
CD4 идентифицирован на мембранах Т-лимфоцитов с помощью моноклональных антител как маркер Т-хелперов. CD4 локализуется на поверхности кортикальных тимоцитов, части зрелых периферических Т-лимфоцитов (40–50% из них – T-хелперы), моноцитов, макрофагов, эозинофилов, мегакариоцитов, дендритных клеток [6, 7]. Функция CD4 обусловлена, в первую очередь, способностью связываться с молекулами MHC класса II и участвовать в распознавании антигенных комплексов на поверхности антигенпрезентирующих клеток [7, 8].
CD8 идентифицирован как маркер субпопуляции цитотоксических T-лимфоцитов, а также на части натуральных киллеров. На зрелых Т-клетках экспрессируется либо CD8, либо CD4, на незрелых иммунокомпетентных клетках они коэкспрес-сируются. Роль CD8 при распознавании антигена состоит в обеспечении клеточной адгезии, повышении сродства комплекса CD3-TcR-CD8 к антигену, ассоциированому с антигеном MHC класса I, и передаче сигнала в клетку [6, 7, 8].
CD20 экспрессирован у человека, мышей и крыс на В-лимфоцитах. Он встречается как на покоящихся, так и на активированных В-лимфоци-тах, но отсутствует на плазматических клетках [6]. CD20 начинает синтезироваться на ранних стадиях дифференцировки B-клеток – в пре-B-клетках – до появления тяжёлых цепей иммуноглобулинов в цитоплазме. CD20 принимает участие в В-кле-точной активации и пролиферации, в обеспечении оптимального B-лимфоцитарного иммунного ответа, в частности против T-независимых антигенов [7].
Таким образом, комплексная морфологическая оценка компонентов клеточного и гуморального звеньев иммунитета селезенки необходима для избирательного, целенаправленного воздействия на нарушенные гистофизиологические процессы органа, что является обязательным условием успешной иммуномодуляции.
Материал и методы исследования. Экспериментальные исследования проведены на 72 нелинейных лабораторных крысах-самцах в возрасте 3–4 месяцев, массой 150–200 г, содержавшихся в обычных условиях вивария при естественном освещении и сбалансированном рационе питания. Уход за ними осуществлялся согласно правилам и нормам обращения с лабо- раторными животными («Санитарные правила по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» от 06.04.1973 г.) [9]. Исследование проведено согласно государственному плану по теме «Нейроиммуногистохимия органов и тканей в норме и в эксперименте» (№ госрегистрации 115041410191 от 14. 04. 2015 г.) и одобрено локальным этическим комитетом медицинского факультета ФГБОУ ВПО «Чувашский государственный университет имени И.Н. Ульянова» (протокол № 3/1 от 30. 11. 2015 г.).
Животные разделены на 2 группы: 1-я (контрольная) группа (n = 36) – крысы, получавшие по требованию чистую питьевую воду, соответствующую требованиям ГОСТ Р 51309-99, ГОСТ Р 52109-2003, СанПиН 2.1.4.1116-02; 2-я (опытная) группа (n = 36) – крысы, получавшие по требованию питьевую воду, соответствующую требованиям ГОСТ Р 51309-99, ГОСТ Р 52109-2003, СанПиН 2.1.4.1116-02, с добавлением хлорида кальция в концентрации 235 мг/л в пересчете на кальций. Ежедневно в течение двух месяцев опытные животные получали с питьевой водой в среднем 8,1–10,2 мг/кг кальция.
Объектом исследования являлись 72 селезенки, которые забирались в зимнее время с 16 до 18 часов. Выведение животных из эксперимента проводилось на 60 сутки путем декапитации с соблюдением требований гуманности согласно Правилам проведения работ с использованием экспериментальных животных «О порядке проведения эвтаназии животного» (Приказ МЗ РФ № 708н от 23. 08. 2010 г.).
Иммуногистохимические реакции методом трехэтапного непрямого иммуноферментного анализа с использованием первичных моноклональных антител к антигенным маркерам CD4 (клон 1F6), CD8 (клон 4В11), CD20 (клон 7D1) (Novocastra Laboratories Ltd, Великобритания) использовались для идентификации CD4, CD8-, CD20-позитивных клеток селезенки лабораторных крыс [10, 11]. После депарафинирования и реги-тратации в этаноле нисходящей концентрации срезы селезенки погружали в восстанавливающий цитратный буфер (рH 6,0). Затем проводили высокотемпературную обработку прогреванием на водяной бане при 90-95°С в течение 30 минут с целью демаскировки искомых антигенов в тканях. После ингибирования эндогенной пероксидазы 3%-ным раствором перикиси водорода на метаноле в течение 30 минут с последующей промывкой 0,1М фосфатным буфером проводили иммуногистохимическую реакцию методом трехэтапного непрямого иммуноферментного анализа с использованием первичных моноклональных антител к антигенным маркерам CD4, CD8, CD20 в разведении 1:100 согласно рекомендации фир- мы-изготовителя (Dako, Дания). Визуализацию первичных моноклональных антител, связавшихся с антигенами, проводили стандартным биотин-стрептавидин-пероксидазным методом с использованием набора LSAB-2 (Labeled Streptavidin Biotin System Peroxidase Dako, Дания). Для блока неспецифического связывания срезы инкубировались в течение 1 часа в 10% козьей сыворотке, после чего к ним были добавлены первичные антитела к белкам CD4, CD8, CD20 на 18 часов при температуре 4°С. В качестве вторичных антител были использованы антивидовые антиим-муноглобулиновые биотилированные антитела. С целью выявления биотиновой метки срезы обрабатывались авидин-пероксидазным комплексом. Пероксидазную активность проявляли в инкубационной среде с диаминобензидином. В результате ферментативной реакции субстрат превращался в нерастворимый продукт коричневого цвета, совпадающий по локализации с местонахождением белков. На заключительном этапе срезы докрашивались гематоксилином и эозином. В каждой серии иммуногистохимических реакций выполнялось контрольное исследование c инкубированием нескольких срезов в отсутствие первичных антител. Специфичность экспрессии искомого антигена в опытных срезах селезенки подтверждалась отсутствием ее в контрольных срезах, не обработанных первичными антителами.
Морфометрический анализ включал измерение количества CD4-, CD8-, CD20-позитивных клеток селезенки после фотографирования препаратов при увеличении объектива 40 или 90 и окуляра 10 светового микроскопа МИКМЕД-5 (ОАО Ломо, Россия) с применением компьютерной программы «Sigma Scan Pro 5.0» [12].
Для количественного определения содержания общего кальция в сыворотке крови контрольных и опытных животных использовался колориметрический метод с о-крезолфталеин-комплексоном [13]. Определение концентрации общего кальция в сыворотке крови проводился у лабораторных крыс контрольной и опытной групп до начала и по окончании сроков эксперимента на 60 сутки. Количественный анализ проводился с использованием набора «Кальций-Витал» (ООО «Витал Диагностикс», Россия) на анализаторе биохимическом фотометрическом кинетическом АБхФк-02–«НПП-ТМ» («БиАн», Россия). Метод основан на том, что кальций в щелочной среде образует красно-фиолетовый комплекс с о-кре-золфталеинкомплексоном. В реакционную смесь добавляют 8-оксихинолин, который связывает металлы, мешающие определению, но образует с кальцием менее прочный комплекс, чем кре-золфталеинкомплексон. Интенсивность окраски раствора при длине волны 540-590 нм прямо про- порциональна концентрации кальция в сыворотке.
Статистический анализ полученных цифровых данных проводился с использованием пакета программ Microsoft Office® Excel 2010 и STATISTICA 10.0 (2008). Для оценки различий качественных признаков использовался доверительный интервал по t-критерию Стьюдента. Различия считались статистически значимыми при значениях p ≤ 0,05. В случае, когда гипотеза о нормальности распределения отвергалась, использовали непараметрические критерии Вил-коксона-Манна-Уитни [14].
Цель исследования – изучение морфологических характеристик CD4-, CD8-, CD20-пози-тивных клеток селезенки лабораторных крыс при экспериментальной гиперкальциемии на фоне длительного употребления соединения кальция с питьевой водой.
Результаты исследования и их обсуждение. В результате иммуногистохимической реакции CD4-позитивные клетки принимают неоднородную коричневую окраску на фоне голубой лимфоидной ткани селезенки лабораторных крыс и выявляются во всех морфо-функциональных зонах как белой, так и красной пульпы органа (рис. 1).
Количество CD4-позитивных клеток в различных морфо-функциональных зонах селезенки варьирует: от полного отсутствия в герминативных центрах лимфоидных узелков контрольных животных до 189,45 ± 7,35 клеток/мм2 в красной пульпе этой же группы (р < 0,05) (рис. 2). Более половины изучаемых клеток зафиксировано в красной пульпе органа обеих групп животных: контрольная группа – 54,6%, опытная группа – 37,4% (р < 0,02). Значительное количество клеток с Т-хелперной активностью выявляется в области периартери-олярной лимфоидной муфты (16,2%), которая функционально относится в Т-зависимой зоне, и вдоль маргинальных синусов (19,0%) селезенки контрольных животных.
На фоне экспериментальной гиперкальциемии наблюдается увеличение количества СD4-по-зитивных клеток в белой пульпе селезенки: вокруг центральной артериолы – на 6,5%, в маргинальной зоне – на 5,9% (р < 0,05). Отличительной особенностью срезов селезенки опытных крыс является наличие клеток с экспрессией CD4 в герминативных центрах (7,8%) (р < 0,005) при их отсутствии в контрольной группе. В красной пульпе органа опытных животных происходит уменьшение количества CD4-реактивных клеток на 17,2% (р < 0,02) (рис. 1, 2).
СD8-позитивные клетки селезенки приобретают коричневую окраску продукта иммуногистохимической реакции и хорошо контрастируются на голубом негативном фоне. Обращает на себя
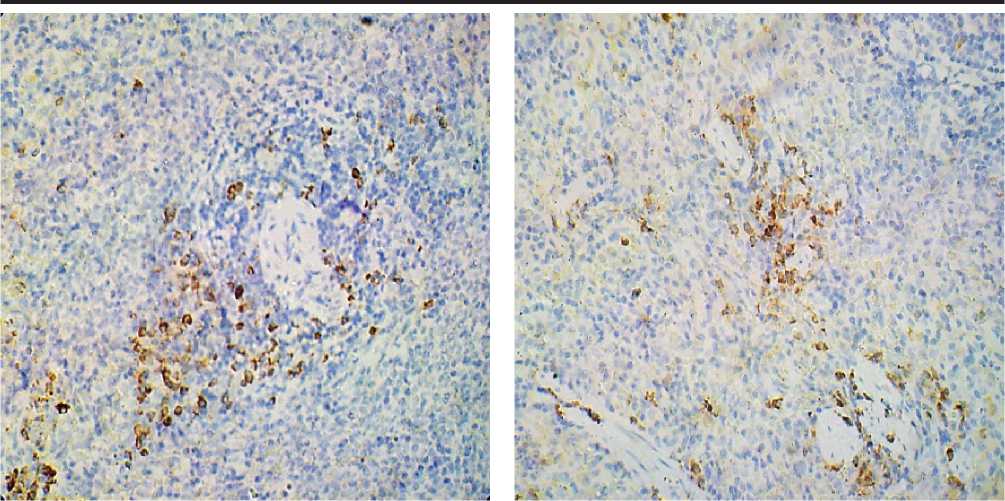
Рис. 1А. Рис. 1Б.
Рис. 1. Селезенка лабораторных крыс. Иммуногистохимический метод с антителами к CD4. Микроскоп МИКМЕД-5. Об. 40. Ок. 10. А – контрольная группа. Б – опытная группа. 1 – CD4-позитивные клетки.
внимание, что клетки селезенки крыс, экспрессирующие CD8, имеют различную морфологию. При большом увеличении микроскопа выявляется неоднородное расположение продукта иммуногистохимической реакции в иммунокомпетентных клетках от светло до темно-коричневого цвета. CD8-положительные клетки селезенки лабораторных крыс располагаются большими группами по 20–40 штук, концентрируясь вокруг пульпарных артерий, маргинальных синусов и соединительнотканных трабекул с одноименными сосудами. Обобщая локализацию цитотоксических Т-лимфоцитов обеих экспериментальных групп, можно определить ее, как сопровождающую всю богатую сосудистую сеть органа. Внутри компонентов белой пульпы CD8+ клетки встречаются единично, однако в маргинальной зоне исследуемые клетки плотно располагаются вдоль маргинального синуса (рис. 3).
Количество цитотоксических Т-лимфоцитов находится в пределах от 20,0 ± 1,52 клеток/мм2 до 136,95 ± 4,0 клеток/мм2 в зависимости от их локализации в морфо-функциональных зонах селезенки обеих групп животных (р < 0,05) (рис. 2). В результате морфометрического анализа выявлена основная локализация CD8-положительных клеток в красной пульпе селезенки крыс. Так, практически половина всех выявленных цитотоксических Т-лимфоцитов располагается в данной функциональной зоне: в контрольной группе
– 41,3%, в опытной группе – 45,9% (р < 0,004). Т-лимфоциты с цитотоксической активностью часто располагаются в маргинальной зоне лимфоидных узелков, вдоль одноименных синусов селезенки: в контрольной группе – 31,7%, в опытной группе – 30,6% от всех выявленных клеток с CD8 на поверхности (р < 0,04). При экспериментальной гиперкальциемии наблюдаются незначительные количественные вариации в морфо-функциональных зонах селезенки с преимущественным увеличением количества изучаемых клеток в красной пульпе (на 4,6%) и сокращением их числа в мантийной зоне (на 2,6%) (р < 0,05).
В-лимфоциты располагаются крупными скоплениями по 20–50 клеток и обнаруживаются во всех морфо-функциональных зонах селезенки крыс. При морфологическом анализе CD20-по-ложительных клеток выявляется гетерогенность популяции. Максимальная экспрессия CD20 наблюдается на мембранах клеток красной пульпы селезенки – вдоль пульпарных артерий и эллипсоидных капилляров, а также в белой пульпе вдоль маргинальных синусов. В отличие от CD4- и CD8-положительных клеток, В-лимфоциты часто обнаруживаются в герминативных центрах лимфоидных узелков обеих групп животных. Маркер CD20 экспрессируют клетки центра размножения, находящиеся как на периферии, на границе с мантийной зоной, так и с диффузным расположением внутри данной структуры. В первичных лимфоид-
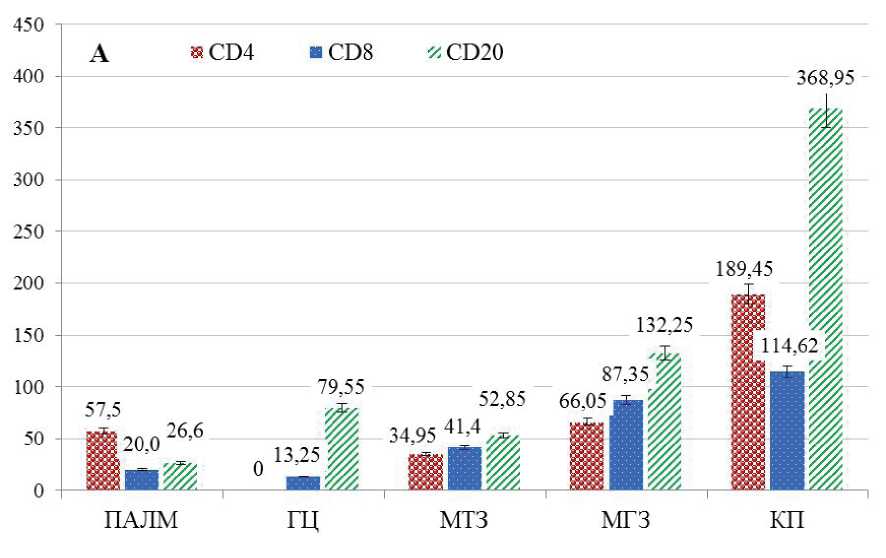
Рис. 2А.
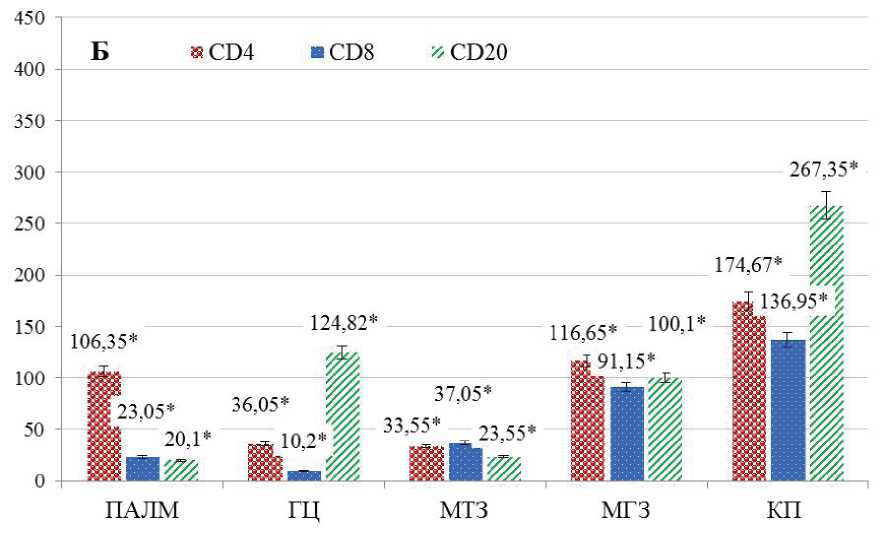
Рис. 2Б.
Рис. 2. Соотношение среднего количества CD4-, CD8-, CD20-позитивных клеток селезенки в морфо-функциональных зонах селезенки лабораторных крыс на единицу площади, шт./мм2. А – контрольная группа. Б – опытная группа.
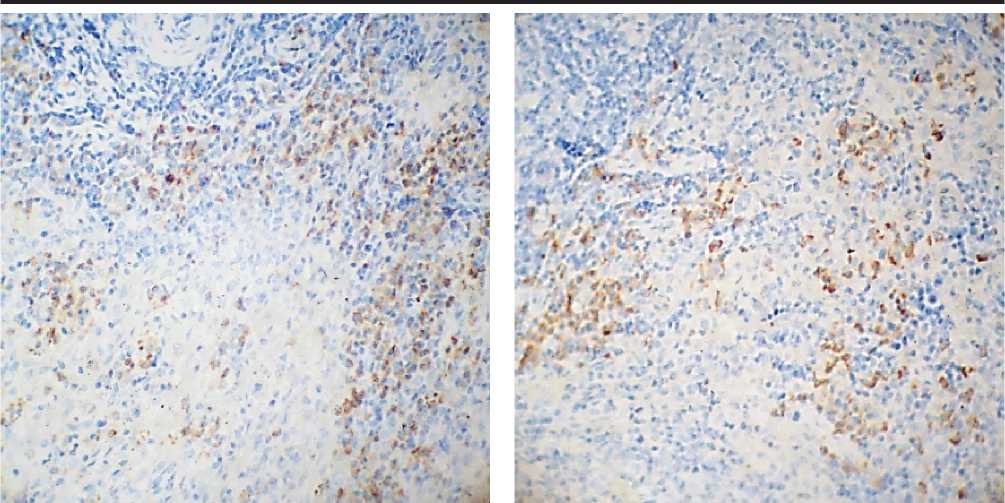
Рис. 3А. Рис. 3Б.
Рис. 3. Селезенка лабораторных крыс. Иммуногистохимический метод с антителами к CD8. Микроскоп МИКМЕД-5. Об. 40. Ок. 10. А – контрольная группа. Б – опытная группа. 1 – CD8-позитивные клетки.
Таблица.
Уровни экспрессии CD4, CD8, CD20 и иммунорегуляторный индекс (ИРИ) в клетках селезенки лабораторных крыс контрольной группы и при экспериментальной гиперкальциемии (М ± m)
Около половины всех выявленных В-лим-фоцитов селезенки располагаются в красной пульпе, преимущественно вокруг просветов ее богатой сосудистой сети: в контрольной группе – 56,2%, в опытной группе – 49,9% (р < 0,05). При употреблении хлорида кальция с питьевой водой происходит количественное перераспределение CD20-позитивных клеток с увеличением их количества в герминативных центрах на 10,9% (р < 0,05) и сокращением на 0,4–6,3% – в остальных функциональных зонах селезенки (р < 0,05) (рис. 2).
Иммунорегулярный индекс (ИРИ) – количественное соотношение Т-хелперов и Т-цитотоксиче-ских клеток (CD4/СD8) [8, 15]. Исследованию подвергнуты клетки селезенки, экспрессирующие на мембране CD4 и CD8, в обеих группах животных.
Уровни экспрессии CD4, CD8, CD20 и им-мунорегуляторный индекс (ИРИ) в клетках селезенки лабораторных крыс контрольной группы и при экспериментальной гиперкальциемии (М ± m)
Уровень экспрессии маркеров Т-хелперов более активно отвечает на экспериментальные условия с увеличением уровня экспрессии CD4-позитивных клеток селезенки на 4,69 ± 1,11% (p < 0,04). Цитотоксические Т-лимфоциты органа под влиянием соединения кальция увеличивают экспрессию в пределах 1,63 ± 0,57% (p < 0,007)
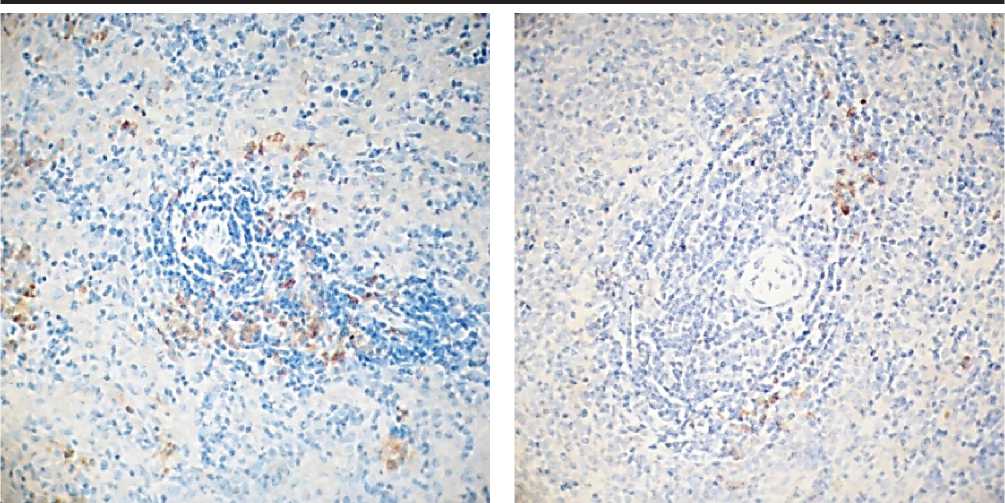
Рис. 4 А. Рис. 4 Б.
Рис. 4. Селезенка лабораторных крыс. Иммуногистохимический метод с антителами к CD20. Микроскоп МИКМЕД-5. Об. 40. Ок. 10. А – контрольная группа. Б – опытная группа. 1 – CD20-по-зитивные клетки.
(табл. 1). Как следствие, на фоне употребления соединения кальция происходит индукция клеточного иммунитета селезенки с повышением иммунорегуляторного индекса на 10,46 ± 4,27% (p < 0,03).
Сравнительный анализ количества клеток с экспрессией маркеров клеточного (CD4+, CD8+) и гуморального (CD20+) звеньев иммунитета выявил, что практически во всех функциональных зонах селезенки крыс контрольной группы преобладает число В-лимфоцитов с максимальной их локализацией в красной пульпе органа (Рисунок 2). Исключение составляет периартериолярная лимфоидная муфта, где локализуется наибольшее количество лимфоцитов с Т-хелперной активностью, которые более чем в два раза превышают число В-лимфоцитов в данной зоне. В герминативном центре наблюдается противоположная картина с преимущественно В-лимфоцитарной локализацией. Маргинальная зона, особенно вокруг одноименного синуса, имеет богатую лимфоцитарную обеспеченность с преобладанием гуморальных CD20-позитивных компонентов. В мантийной зоне локализуются относительно равное количество клеток гуморального и клеточного звена иммунного ответа.
Употребление хлорида кальция с питьевой водой сопровождается количественными изменениями иммунокомпетентных клеток селезенки (рис. 2). В периартериолярной лимфоидной муфте лимфоидных узелков наблюдается увеличение количества Т-хелперов в 1,84 раза при относительно стабильном количестве цитотоксических Т-лимфоцитов и В-лимфоцитов. Также отмечается превышение числа Т-хелперов в 2,16 раз в данной зоне контрольных животных, относительно В-лим-фоцитарного пула, а на фоне эксперимента эти различия достигают 5,28 раз (р < 0,05). В герминативных центрах лимфоидных узелков селезенки наблюдается увеличение числа CD20-позитивных клеток в 1,54 раза (р < 0,05) ), а в мантийной зоне – их сокращение в 2,24 раза (р < 0,05).
По результатам данного исследования употребление хлорида кальция с питьевой водой сопровождается изменениями иммунокомпетентных клеток селезенки лабораторных крыс: гиперактивностью хелперного и цитотоксических звеньев иммунной системы (CD4+ и CD8+), повышением иммунорегуляторного индекса, инверсией гуморального иммунитета со снижением уровня экспрессии и количества CD20+ клеток. Данные изменения находятся в рамках современных представлений о гомеостатической регуляции клеточного и гуморального звеньев иммунитета по типу замещения [8].
Выявленный нами комплекс изменений в селезенке крыс при гиперкальциемии свидетельствует о повышении клеточного звена с компенсаторным снижением показателей гуморального иммунитета, что отражает проявление активации и ауторегуляции иммунного ответа. Таким образом, проведенное исследование свидетельствует об избирательном характере воздействия кальция на модуляцию кооперативного взаимодействия Т- и В-клеточных звеньев иммунного ответа.
Основой адекватного воздействия соединения кальция на организм и оценки сопутствующих морфологических изменений в селезенке лабораторных крыс является достоверное повышение концентрации общего кальция в периферической крови [16]. Для лабораторного подтверждения эффективности употребления и абсорбции хлорида кальция с питьевой водой в течение 60 суток в дозе 235 мг/л в пересчете на кальций нами проведены биохимические анализы с определением концентрации общего кальция в сыворотке крови лабораторных крыс контрольной и опытной групп до начала и по окончании эксперимента на 60 сутки.
До начала эксперимента концентрация общего кальция в сыворотке крови лабораторных крыс контрольной группы составляла 2,24 – 2,52 ммоль/л (2,43 ± 0,007 ммоль/л). Исходный показатель уровня общего кальция крови крыс, выбранных для прохождения эксперимента в составе опытной группы, находился в пределах от 2,22 ммоль/л до 2,56 ммоль/л и в среднем равен 2,42 ± 0,009 ммоль/л.
По окончании сроков эксперимента (на 60 сутки) у всех лабораторных животных обеих групп были повторно проведены биохимические анализы. У крыс, употреблявших чистую питьевую воду, и находившихся на стандартном сбалансированном рационе питания вивария, уровень общего кальция крови не имел значительных вариаций относительно исходных показателей и сохранился на уровне 2,22 – 2,61 ммоль/л (2,41 ± 0,01 ммоль/л). При употреблении питьевой воды с добавлением хлорида кальция в течение 60 суток у крыс опытной группы концентрация общего кальция варьирует от 2,51 ммоль/л до 3,16 ммоль/л (2,86 ± 0,02 ммоль/л). Таким образом, в модулируемых условиях эксперимента в периферической крови опытной группы лабораторных крыс происходит статистически значимое повышение концентрации общего кальция в крови на 0,41 ± 0,01 ммоль/л, что составляет 14,39 ± 0,69% от исходных значений (р < 0,008).
Выводы:
-
1. На фоне экспериментальной гиперкальциемии происходит увеличение количества СD4-позитивных клеток (Т-хелперов) белой пульпы селезенки: в периартериолярной лимфоидной муфте – на 6,5%, в герминативных центрах – на 7,8%, в маргинальной зоне – на 5,9% (р < 0,05). В красной пульпе органа опытных животных наблюдается сокращение числа исследуемых клеток на 17,2% (р < 0,02).
-
2. CD8-позитивные клетки (цитотоксические Т-лимфоциты) селезенки реагируют на экспе-
- риментальную гиперкальциемию увеличением количества в красной пульпе (на 4,6%) и сокращением – в мантийной зоне лимфоидных узелков (на 2,6%) (р < 0,05).
-
3. При употреблении хлорида кальция с питьевой водой происходит количественное перераспределение CD20-позитивных клеток (В-лимфоцитов) с увеличением их количества в герминативных центрах на 10,9% (р < 0,05) и сокращением – в остальных функциональных зонах селезенки на 0,4–6,3% (р < 0,05).
-
4. Экспериментальная гиперкальциемия сопровождается повышением общего уровня экспрессии маркеров клеточного звена иммунного ответа CD4 (на 4,69 ± 1,11%) и CD8 (на 1,63 ± 0,57%) (p < 0,04), а также снижением данного показателя маркера гуморального звена иммунитета CD20 (на 19,29 ± 4,93%) (p < 0,04) в клетках селезенки лабораторных крыс.
-
5. Употребление водного раствора хлорида кальция в концентрации 235 мг/л в течение 60 суток вызывает достоверное повышение уровня общего кальция в сыворотке крови на 14,39 ± 0,69% от контрольных значений (р < 0,008) и является адекватной моделью для формирования экспериментальной гиперкальциемии у крыс с последующей оценкой морфологических и иммуногистохимических изменений селезенки.
Список литературы Морфологическое исследование компонентов клеточного и гуморального звеньев иммунного ответа селезенки лабораторных крыс при экспериментальной гиперкальциемии
- Онтогенетические аспекты стромально-паренхиматозных взаимоотношений в селезенке/А. И. Рябикина, М. Ю. Капитонова, А. А. Нестерова, З. Ч. Морозова // Морфология. - 2008. - Т. 132, № 2. - С. 58.
- Auerbach, A. Diagnostic Pathology: Spleen / Auerbach A. - Lippincott Williams & Wilkins. - 2014. - 536 p.
- Соотношение иммуномодуляционных сдвигов в центральных и периферических органах иммунной защиты при хроническом стрессе / А. А. Нестерова, М. Ю. Капитонова, H. A. Мураева, А. И. Краюшкин и др. // Морфология. - 2006. - № 5. - С. 49-50.
- Кудрин, А. В. Микроэлементы в иммунологии и онкологии/А. В. Кудрин, О. А. Громова. - М.: ГЭОТАР - Медиа, 2007. - 544 с.
- Физиологическая роль кальция в организме / В. М. Студеникин, А. С. Николаев, О. В. Чумакова, Е. М. Мазурина и др. // Научные труды I съезда физиологов СНГ. - М.: Медицина-Здоровье, 2005. - С. 6.
- Ярилин, А. А. Транскрипционные регуляторы дифференцировки Т-хелперов: обзор / А. А. Ярилин // Иммунология. - 2010. - Т. 31, № 3. - С. 153-168.
- Иммунология: учебник/Р. М. Хаитов. - 2-е изд., перераб. и доп. - М.: ГЭОТАР-Медиа, 2013. - 528 с.
- International Guiding Principles for Biomedical Research Inroling Animals. Council for international organization of medical sciences and the international council for laboratory animal science. - Committee to revise the international guiding principles. - Geneva, 2012.
- Яглов, В. В. Маркеры в морфологии и стратегия их исследования / В. В. Яглов // Клиническая морфология новообразований эндокринных желез. - М., 2010. - С. 116-120.
- Lorette, J. Immunocytochemical Methods and Protocols / J. Lorette //Methods in Molecular Biology. - 2003. - Vol. 115. - Second Edition. - Humana Press Inc., Totowa, NJ. - 457p.
- Дьячкова, И. М. Некоторые адаптационные реакции тимуса на поступление кальция и кремния с питьевой водой / И. М. Дьячкова, В. С. Гордова, В. Е. Сергеева, С. П. Сапожников. - Чебоксары: Изд-во Чуваш. ун-та, 2014. - 140 с.
- Клиническая лабораторная диагностика /В. В. Долгов, С. А. Луговская, В. Т. Морозова и др. - М.: Медицина, 2002. - 157 с.
- Реброва, О. Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA/О. Ю. Реброва. - М.: Ме диаСфера, 2006. - 312 с.
- Abbas, A. K. Cellular and Molecular Immunology /A. K. Abbas, A. H. Lichtman, S. Pillai. - 2014. - 8th Ed. - 544 p.
- Мирошников, С. А. Диапазон концентраций (референтные значения) химических элементов в теле животных/ С. А. Мирошников, С. В. Лебедев // Вестник Оренбургского государственного университета. - 2009. - № 6. - С. 241-243.


