Морфологическое исследование локального влияния имплантатов с покрытиями на основе сверхтвердых соединений на костную ткань в условиях индуцированной травмы
Автор: Ахтямов Ильдар Фуатович, Шакирова Фаина Владимировна, Гатина Эльмира Бикантемировна, Манирамбона Жан Клод, Алиев Эльчин Ибрагим-Оглы
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2015 года.
Бесплатный доступ
Цель. Сравнительное морфологическое исследование ответной реакции костной ткани на чрескостное введение в диафизы большеберцовых костей экспериментальных крыс имплантатов из меди (Cu), медицинской стали 12X18H9T, стали 12X18H9T с вариантами покрытий нитридами титана и гафния (TiN+HfN), а также нитридами титана и циркония (TiN+ZrN). Материалы и методы. Были созданы 4 группы крыс, из которых 2 группы сравнения (12Х18Н9Т и Cu) и 2 опытных (TiN+HfN и TiN+ZrN) с вышеуказанными имплантатами. В конце каждого срока опытного наблюдения проводили гистологическое исследование участков большеберцовых костей, непосредственно контактировавших с имплантатами. Результаты. Полученные результаты показали, что восстановление травмированной имплантатом кости и костного мозга в группах с имплантатами из стали 12Х18Н9Т происходило без участия грануляционной и хрящевой тканей, а с имплантатами из стали с покрытием нитридами титана и гафния (TiN+HfN) происходило без осложнений и в более ранние сроки. В то же время в группах, где были применены медные имплантаты (Cu), имплантаты из стали с покрытием из комбинации нитридов титана и циркония (TiN+ZrN), регистрировались явления некроза, деструкция и лизис костной ткани, а восстановление происходило вторично через хрящевую ткань. Заключение. Наносимые на имплантаты покрытия из комбинации нитридов титана и гафния (TiN+HfN) придают имплантатам химическую и биологическую инертность и могут быть рекомендованы для внедрения в клиническую практику.
Крыса, имплантат, нитрид титана и гафния, нитрид титана и циркония
Короткий адрес: https://sciup.org/142121813
IDR: 142121813 | УДК: [616-001-089.84:669.018.674:612]-092.9
Текст научной статьи Морфологическое исследование локального влияния имплантатов с покрытиями на основе сверхтвердых соединений на костную ткань в условиях индуцированной травмы
Частота осложнений, развивающихся после использования имплантируемых материалов, сопряжена с образованием ложных суставов, деформацией костей из-за нарушения принципа иммобилизации [1-7]. Миграция ионов металлов применяемых имплантатов вызывает воспалительные процессы и дестабилизацию имплантата с последующим его отторжением с одной стороны и аллергические явления в организме пациента – с другой [8-10]. Указанные факторы затягивают процессы остеорегенерации, и возникают нежелательные осложнения. Повышаются и затраты на лечение пациента. В этой связи разработка химически и биологически инертных гипоаллергенных покрытий для имплантируемых материалов остается актуальным вопросом в травматологии и ортопедии [11-12]. В настоящее время в качестве покрытия широко применяется нитрид титана. Данное покрытие характеризуется биосовместимостью, обеспечивает биоинтеграцию [13]. Потенциально перспективными представляются также покрытия, содержащие нитрид гафния, который характеризуется химической инертностью, низкой окисляемостью в экстремальных условиях, а также биологической совместимостью с тканями организма, однако исследования этого вида покрытий единичны [14, 15, 16]. Выбор нитридов переходных металлов обусловлен их физическими и химическими свойствами: прочностью при воздействии высоких температур, давления и низкой степенью окисляемости.
Исследования на гистологическом уровне реакции костной ткани на введение имплантатов из меди, медицинской стали с различными видами покрытий из производных сверхтвердых металлов является решающим этапом в оценке локального влияния имплантатов на организм экспериментальных крыс, что и составило цель настоящей работы.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводились согласно ГОСТ ИСО 10993(Р) и были одобрены Локальным Этическим Комитетом Казанского государственного медицинского университета (протокол заседания № 5 от 25 июня 2013 г.). Экспериментальные исследования проводились на белых крысах- самцах. Масса животных составила 250-300 г. Кормление и содержание лабораторных животных осуществляли согласно рекомендациям по кормлению и содержанию лабораторных животных, а также Приказа Минздрава СССР от 12.08.1977 № 755. Животных содержали в индивидуальных клетках по 5 крыс в каждой. В рацион включали продукты животного и растительного происхождения.
Характеристика имплантатов и технология нанесения покрытий
Имплантаты, изготовленные на НПО «Мединстру-мент» (г. Казань), представляли собой шпильки длиной 8-10 мм, диаметром Ø=0,8 мм. Данные образцы обезжиривались бензином Б-70 и осушались 96° этиловым спиртом. Образцы устанавливались внутри рабочей камеры установки ННВ 6.6-И1 с давлением в камере в 1,6×10-2 Па. Нанесение покрытия осуществлялось путем ионной бомбардировки при следующих параметрах: энергия ионов металла 0,8-1 кЭв, температура подложки 500°С, давление в камере 1,6×10-2 Па, частота вращения карусели 2 об/мин. Перед нанесением покрытия в рабочую камеру подавался реакционный газ (азот) для формирования нитридного покрытия. Толщина покрытия составила 5μм.
Имплантацию производили в среднюю треть диафиза большеберцовой кости чрескостно после пред- варительного рассверливания с соблюдением правил асептики и антисептики с рассечением параоссальных тканей под общей анестезией (0,2 % раствор рометара в дозе 0,1 мл/100 г массы тела животного). Концы шпилек загибали в виде скобы и погружали под кожу. Рана ушивалась наглухо.
В зависимости от материала, из которого были изготовлены имплантаты, животных разделили на четыре группы. Две группы сравнения: 1 – с имплантатами из стали 12Х18Н9Т (n=20) и 2 – с имплантатами из меди Cu (n=20), не имевшими покрытия. Две опытных группы: 3 – с имплантатами из стали 12Х18Н9Т, покрытыми комбинацией нитридов титана и гафния (TiN+HfN) (n=20), 4 – с имплантатами из стали 12Х18Н9Т, покрытыми нитридами титана и циркония (TiN+ZrN) (n=20).
Для оценки воздействия имплантатов на организм крыс были исследованы морфологические изменения костной ткани большеберцовых костей на каждом сроке опытного наблюдения: на 10-е, 30-е, 60-е и 90-е сутки. По окончании каждого срока выводили опытных крыс из эксперимента путем декапитации, затем извлекали участки большеберцовых костей в зоне непосредственного контакта с имплантатами. Полученный материал фиксировали в 10 % нейтральном формалине. Декальцинацию проводили препаратом «BIODEC» (Италия). После обезвоживания в спиртах возрастающей концентрации и ксилоле материал заливался в парафин. На микротоме изготавливались гистологические срезы толщиной 5-7 мкм, которые окрашивались гематоксилином и эозином и по методу Ван Гизона.
РЕЗУЛЬТАТЫ
На 10-е сутки в области контакта с имплантатами из стали 12Х18Н9Т обнаруживались соединительнотканные структуры с разрастанием коллагеновых волокон и явлениями остеогенеза. Образовывались костные балки с поперечными перемычками, пространство между которыми заполняла рыхлая волокнистая соединительная ткань, т.е. формировалась грубоволокнистая кость. Практически во всех случаях на данном этапе не встречались участки грануляционной и хрящевой ткани, а также очаги некроза. Воспалительная клеточная реакция либо отсутствовала, либо была представлена отдельными небольшими лимфогистиоцитарными инфильтратами.
На 30-е сутки эксперимента имелась сформированная грубоволокнистая кость. По краям перфоративного отверстия костные трабекулы резорбировались с началом перестройки грубоволокнистой кости в пластинчатую (рис. 1, a). В костном мозге развивались новые трабекулы параллельно с заполнением жировой ткани клетками гематогенного происхождения (рис. 1, б).
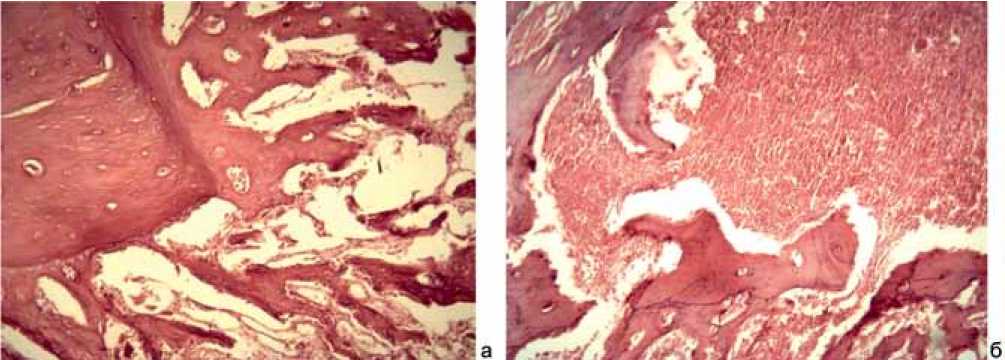
Рис. 1: а – перестройка грубоволокнистой кости в пластинчатую. Окраска гематоксилином и эозином. ×200. Группа с имплантатами из стали 12Х18Н9Т. 30 сутки эксперимента; б – костный мозг: развитие трабекул и заполнение жировой ткани клетками гематогенного происхождения. Окраска гематоксилином и эозином. ×200. Группа с имплантатами из стали 12Х18Н9Т. 30 сутки эксперимента
На 60-е сутки по границе с имплантатами была сформирована пластинчатая кость с развитой системой гаверсовых каналов и восстановлением костного мозга.
На 90 сутки картина оставалась аналогичной.
В группе с имплантатами из меди (Cu) на 10 сутки, так же как и в группе с имплантатами из стали 12Х18Н9Т, по краю дефекта происходило разрастание соединительной ткани и формирование костных балок. Однако встречались и случаи формирования хрящевой ткани на границе со спицей (рис. 2, a). В то же время, часто сохранялись участки грануляционной ткани, что, как правило, сопровождалось воспалительной реакцией. Встречались скопления лимфоцитов и макрофагов, иногда с примесью нейтрофилов. Имели место и некротические процессы в кости, граничащей с имплантатами.
На 30-е сутки в большинстве наблюдений имелась сформированная грубоволокнистая кость с перестройкой ее в пластинчатую. В некоторых случаях край костного дефекта был выстлан хрящевой тканью без признаков оссификации, а глубже представлен незрелой грубоволокнистой костью (рис. 2, б). В костном мозге при этом сохранялись участки жировой ткани, не заполненные гемопоэтическими элементами. Имелись и признаки воспаления, которое иногда носило характер гнойного с расплавлением близлежащей к спице костной ткани.
На 60-е сутки по границе со спицей в одних случаях была сформирована пластинчатая кость, а в других (когда в процессе заживления образовывалась хрящевая ткань) на данном этапе происходило рассасывание хряща, обызвествление и замещение его костной тканью (рис. 3, a). При наличии гнойного воспаления на указанном сроке происходило увеличение объема лейкоцитарно-некротических масс, которые занимали пространство между краем кости и имплантатом (рис. 3, б).
На 90-е сутки при наличии сформированной пластинчатой кости хрящевая ткань не обнаруживалась, так же как и грубоволокнистая кость. В случаях наличия на предыдущих сроках гнойного воспаления происходило его прогрессирование по типу остеомиелита с расплавлением костных структур (рис. 4).
Процесс заживления дефекта на границе со спицей из стали с покрытием нитридами титана и циркония (TiN+ZrN) аналогичен группе с имплантатами из меди (Cu) с задержкой регенерации как кости, так и костного мозга и осуществлением заживления через формирование хряща, а также наличием случаев гнойного воспаления с деструкцией кости (рис. 5, a).
В группе с имплантатами из стали с покрытием нитридами титана и гафния (TiN+HfN) в целом динамика трансформации костной ткани была такой же, как и в 1 группе наблюдений (12Х18Н9Т): на 10-е сутки – формирование грубоволокнистой кости балочного строения, на 30-60 сутки – трансформация ее в пластинчатую кость (рис. 5, б), регенерация костного мозга и отсутствие каких-либо изменений на 90-е сутки. Также не встречались участки грануляционной и хрящевой ткани, очаги некроза и воспаления.
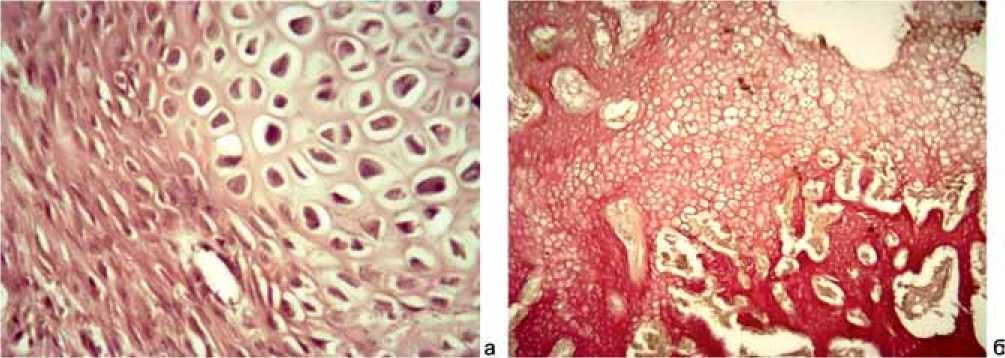
Рис. 2: а – разрастание соединительной ткани и формирование хряща на границе со спицей. Окраска гематоксилином и эозином. ×400. Группа с имплантатами из меди (Сu). 10-е сутки эксперимента; б – край костного дефекта: хрящевая ткань и незрелая грубоволокнистая кость. Окраска по Ван Гизону. ×200. Группа с имплантатами из меди (Сu). 30-е сутки эксперимента
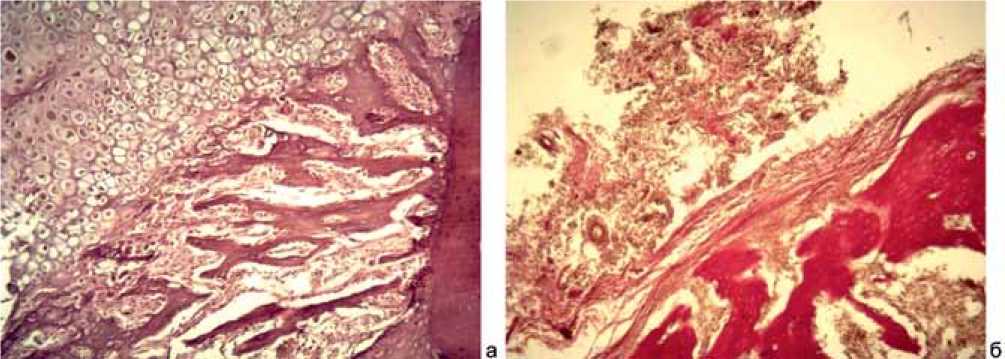
Рис. 3: а – рассасывание хряща, обызвествление и замещение его костной тканью. Окраска гематоксилином и эозином. ×200. Группа с имплантатами из меди (Сu). 60-е сутки эксперимента; б – лейкоцитарно-некротические массы в пространстве между краем кости и спицей. Окраска по Ван Гизону. ×200. Группа с имплантатами из меди (Сu). 60 сутки эксперимента
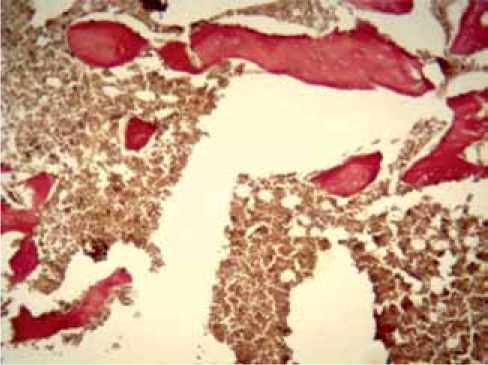
Рис. 4. Гнойное воспаление (остеомиелит). Окраска по Ван Гизону. ×200. Группа с имплантатами из меди (Сu). 90-е сутки эксперимента
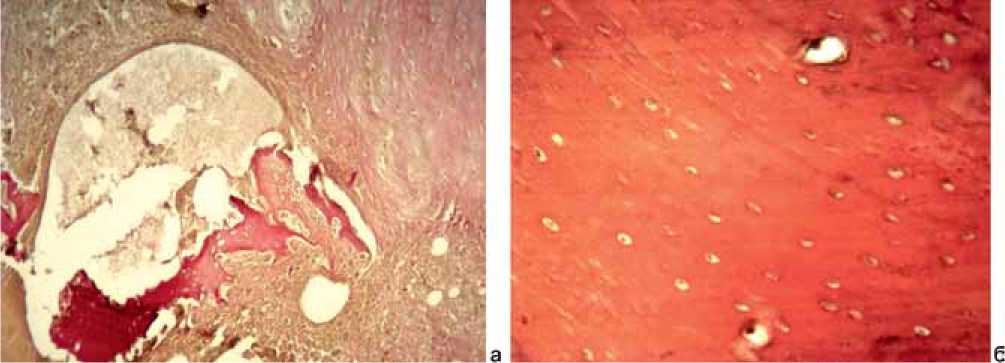
Рис. 5: а – деструкция, некроз и лизис костной ткани. Окраска по Ван Гизону. ×200. Группа c имплантатами из стали с покрытием нитридами титана и циркония (TiN+ZrN). 90-е сутки эксперимента; б – зрелая пластинчатая кость с гаверсовыми каналами. Окраска по Ван Гизону. ×400. Группа c имплантатами из стали с покрытием нитридами титана и гафния (TiN+HfN). 90-е сутки эксперимента
ОБСУЖДЕНИЕ
Травмирование и введение инородного материала в костную ткань сопровождается стадийным ответом, включающим реактивную воспалительную фазу и развитие грануляций, занимающую дни; репаративную фазу, длящуюся неделями, и фазу ремоделирования костной ткани продолжительностью до нескольких месяцев или лет [17].
В нашем исследовании уже на 10-е сутки наблюдения в группе крыс с имплантатами из стали 12Х18Н9Т наблюдалось формирование грубоволокнистой кости. Практически во всех случаях на данном этапе не встречались участки грануляционной и хрящевой ткани, а также очаги некроза. Воспалительная клеточная реакция либо отсутствовала, либо была представлена отдельными небольшими лимфогистиоцитарными инфильтратами. Аналогичная картина наблюдалась и в группе крыс с имплантатами из стали с покрытием нитридами титана и гафния (TiN+HfN).
По данным ряда авторов, вокруг никелид титановых имплантатов в первые 10 суток оперативного вмешательства в остеоиде зоны остеоинтеграции выявляется сеть коллагеновых волокон с локализацией функционально активных остеобластов [18]. В некоторых исследованиях отмечено, что проявляется выраженная периостальная реакция со значительным утолщением ткани вокруг зоны введения имплантата, при этом реакция параоссальных тканей была незначительной [19].
На 30-е сутки эксперимента в группах 12Х18Н9Т и TiN+HfN имелась сформированная грубоволокнистая кость, регистрировалась перестройка грубоволокнистой кости в пластинчатую, жировая ткань костного мозга уже заполнялась клетками гематогенного происхождения, что согласуется с данными литературы, в которых на данном сроке описана васкуляризация регенерата, окружающего имплантат [18].
На 60-е сутки эксперимента в группах 12Х18Н9Т и TiN+HfN на границе с имплантатами была сформирована пластинчатая кость с развитой системой гаверсовых каналов и восстановлением костного мозга. Такая тенденция сохранялась и на сроке 90 суток. Таким образом, в вышеуказанных группах процессы восстановления травмированного участка кости протекали без осложнений и в ранние сроки в отличие от групп с медными имплантатами и с имплантатами с покрытием нитридами титана и циркония (TiN+ZrN), где процессы остеорегенерации характеризовались явлениями гнойного воспаления, некроза, остеомиелита и образованием хрящевой ткани. Формирование хрящевой ткани в зоне имплантации характерно при введении имплантатов из сплава Ti-6Al-4V и характеризуется воспалительным процессом [19].
ЗАКЛЮЧЕНИЕ
Проведенный морфологический анализ костной ткани показал, что восстановление кости и костного мозга происходило в более ранние сроки и без осложнений в группе
с имплантатами из стали с покрытием нитридами титана и гафния (TiN+HfN), что подтверждает целесообразность применения имплантатов с исследуемым покрытием.
Список литературы Морфологическое исследование локального влияния имплантатов с покрытиями на основе сверхтвердых соединений на костную ткань в условиях индуцированной травмы
- Профилактика и лечение осложнений закрытого блокируемого остеосинтеза переломов длинных костей у пострадавших с политравмой/П.А. Иванов, В.А. Соколов, Е.И. Бялик, А.М. Файн, Ю.А. Воронцов//Вестн. травматологии и ортопедии им. Н.Н. Приорова. 2008. № 2. С. 29-32.
- Берченко Г.Н. Заболевания костно-суставной системы//Патология: руководство/под ред. М.А. Пальцева, В.С. Паукова, Э.Г. Улумбекова. М.: ГЭОТАР-МЕД, 2002. С. 565-597.
- Дюрантный препарат на основе гидроксиапатита в комплексном лечении оскольчатых переломов длинных трубчатых костей/Г.А. Кесян, Р.З. Уразгильдеев, Г.Н. Берченко, И.Г. Берченко//FROM UNCOMMON CASES TO GLOBAL ISSUES: междунар. конф., посвящ. 80-летию со дня рождения акад. О.Н. Гудушаури. Tbilisi, 2005. С. 42-43.
- Уразгильдеев З.И., Бушуев О.М., Берченко Г.Н. Применение Коллапана для пластики остеомиелитических дефектов костей//Вестн. травматологии и ортопедии им. Н.Н. Приорова. 1998. № 2. С. 31-35.
- Backfill for iliac-crest donor sites: a prospective, randomized study of coralline hydroxyapatite/J.A. Bojescul, D.W. Polly Jr, T.R. Kuklo, T.W. Allen, K.E. Wieand//Am. J. Orthop. (Belle Mead NJ). 2005. Vol. 34, No 8. P. 377-382.
- Mangano C., Bartolucci E.G., Mazzocco C. A new porous hydroxyapatite for promotion of bone regeneration in maxillary sinus augmentation: clinical and histologic study in humans//Int. J. Oral Maxillofac. Implants. 2003. Vol. 18, No 1. P. 23-30.
- Steinemann S.G. Metal implants and surface reactions//Injury. 1996. Vol. 27, Suppl. No 3. P. SC16-22.
- Beta-tricalcium phosphate as a bone substitute for dorsal spinal fusion in adolescent idiopathic scoliosis: preliminary results of a prospective clinical study/M. Muschik, R. Ludwig, S. Halbhübner, K. Bursche, T. Stoll//Eur. Spine J. 2001. Vol. 10. Suppl No 2. P. S178-184.
- Evaluation of the expression of collagen type I in porous calcium phosphate ceramics implanted in an extra-osseous site/S.X. Qu, X. Guo, J. Weng, J.C. Cheng, B. Feng, H.Y. Yeung, X.D. Zhang//Biomaterials. 2004. Vol. 25, No 4. P. 659-667.
- HA/TCP compounding of a porous CaP biomaterial improves bone formation and scaffold degradation-a long-term histological study/C. Schopper, F. Ziya-Ghazvini, W. Goriwoda, D. Moser, F. Wanschitz, E. Spassova, G. Lagogiannis, A. Auterith, R. Ewers//J. Biomed. Mater. Res. B. Appl. Biomater. 2005. Vol. 74, No 1. P. 458-467.
- Некачалов В.В. Патология костей и суставов: руководство. СПб., 2000. C. 288-291.
- Szpalski M., Gunzburg R. Recombinant human bone morphogenetic protein-2: a novel osteoinductive alternative to autogenous bone graft?//Acta Orthop. Belg. 2005. Vol.71, No 2. P. 133-148.
- Sovak G., Weiss A., Gotman I. Osseointegration of Ti6AI4V alloy implants coated with titanium nitride by a new method//J. Bone Joint Surg. Br. 2000. Vol. 82, No 2. P. 290-296.
- Nanomechanical properties of hafnium nitride coating/Y. Chen, T. Laha, K. Balani, A. Agarwal//Scripta Materialia. 2008. Vol. 58, Issue 12. P. 1121-1124.
- Abdullin I.Sh., Mironov M.M., Garipova G.I. Bactericidal and biologically stable coatings for medical implants and instruments//Med. Tekh. 2004. No 4. P. 20-22.
- Изучение костной ткани и имплантатов из нитритов титана и гафния на остеорегенерацию с использованием рентгенографических исследований/И.Ф. Ахтямов, Э.Б. Гатина, Ф.Ф. Кадыров, М.Ф. Шаехов, Ф.В. Шакирова//Вестник Казанского Технологического Университета. 2012. Т. 15, № 20. С. 186-187.
- Einhorn T.A. One of nature's best kept secrets//J. Bone Miner. Res. 1998. Vol. 13, No 1. P. 10-12.
- Ирьянов Ю.М., Ирьянова Т.Ю. Замещение дефекта кости в условиях чрескостного остеосинтеза и применения имплантата из никелида титана//Морфология. 2012. Т. 142, № 4. С.83-86.
- Экспериментально-морфологическое исследование эффективности применения титана с наноструктурой в качестве имплантатов для ортопедии и травматологии/Ф.Ф. Мухаметов, В.Ш. Вагапова, В.В. Латыш, У.Ф. Мухаметов, Д.Ю. Рыбалко, Г.Х. Салимгалеева//Вестн. травматологии и ортопедии им. Н.Н. Приорова. 2008. № 4. С. 78-83.


