Морфология органов пищеварения и микрофлора кишечника цыплят при заражении Escherichia coli
Автор: Ленченко Е.М., Ванина Н.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Иммунитет и ветеринария
Статья в выпуске: 4 т.40, 2005 года.
Бесплатный доступ
Рассматривается влияние патогенных штаммов Escherichia coli на морфологические признаки органов пищеварения, а также состав и численность микрофлоры кишечника цыплят.
Короткий адрес: https://sciup.org/142133101
IDR: 142133101 | УДК: 636.52/.58:591.434:579.842.11:57.083
Текст научной статьи Морфология органов пищеварения и микрофлора кишечника цыплят при заражении Escherichia coli
Высокая заболеваемость и падеж молодняка птицы связаны с расстройством деятельности органов пищеварения. Из числа бактериальных агентов в этиологии заболеваний желудочно-кишечного тракта существенную роль играют патогенные штаммы Escherichia coli (сем. Enterobacteriaceae) (1-3). Поэтому представляет интерес исследование влияния бактерий E. coli на морфологию органов пищеварения, а также количественный и качественный состав микрофлоры кишечника цыплят, что и явилось целью нашей работы.
Методика . Объектом исследования служили 30-суточные цыплята кросса Иза-Ведетта, подобранные по принципу аналогов ( n = 25). В опыте цыплят заражали (интраназальная инокуляция) 18-часовой культурой E. coli 1111 (О149:К91:К88) в дозе 5 ⋅ 109 бактериальных клеток; в контроле птице вводили стерильную водопроводную воду. По ходу эксперимента проводили клиникогематологические исследования. До заражения и через 5, 10, 15 и 20 сут после заражения из каждой группы убивали по 5 гол., проводили патологоанатомический анализ и отбирали образцы тонких и толстых кишок, печени, фабрициевой бурсы для гистологического и гистохимического исследований. Для оценки морфологических особенностей, строения соединительной, мышечной ткани, наличия волокон фибрина, микроорганизмов и содержания жира срезы окрашивали соответственно гематоксилин-эозином, по Ван Гизону, Маллори, Шуенинову, Крантцу и суданом 3; активность щелочной фосфатазы определяли по Гомори. При подготовке препаратов для электронной микроскопии перед фиксацией образцы промывали солевым раствором (рН 7,2-7,4). Фиксацию проводили теплым 1-3 % раствором глутарового альдегида в течение 72-96 ч; обезвоживание — в спиртах возрастающей крепости. Для оценки численности микрофлоры кишечника осуществляли дозированный посев из диагностически значимых разведений 1 г feces. При выделении бифидобактерий использовали модифицированную среду Blaurock, бактерий E. coli — среды Эндо, Левина, Плоскирева и кровяной агар. Для дифференциации эшерихий от сходных с ними энтеробактерий применяли комплекс ТИМАЦ: Т — температурный тест (тест Эйкмана); И — тест индолообразования; М — реакция с метиловым красным, А — реакция на ацетилметилкарбинол; Ц — цитратный тест. Статистическую обработку полученных данных проводили общепринятыми методами (4).
Результаты . У цыплят, зараженных культурой E. coli , клинические признаки заболевания были отмечены через 3-5 сут в виде прогрессирующей депрессии, отсутствия аппетита, жажды, цианоза слизистых оболочек; в последующие сутки развивались признаки диареи. У зараженных цыплят температура тела поднималась до 43,1 оС, у ослабевших в последние сутки особей — опускалась ниже нормы. По данным гематологических исследований, у зараженных цыплят увеличивалось количество эритроцитов, лейкоцитов (эозинофилов, псевдоэозинофилов, лимфоцитов и моноцитов) и концентрация гемоглобина в крови по сравнению с контролем (табл.).
Гематологические показатели цыплят-бройлеров кросса Иза-Ведетта при экспериментальном заражении культурой E scherichia coli (n = 25)
|
Показатель |
Контроль |
Опыт |
|
Эритроциты, млн/мкл |
3,51 ± 0,12 |
3,72 ± 0,15 |
|
Гемоглобин, г% |
9,6 ± 0,3 |
9,7 ± 0,4 |
|
Лейкоциты, тыс/мкл |
28,2 ± 3,6 |
33,8 ± 2,6 |
|
Базофилы, тыс/мкл |
0,5 ± 0,10 |
0,5 ± 0,09 |
|
Эозинофилы, тыс/мкл |
2,4 ± 0,3 |
2,5 ± 0,2 |
|
Псевдоэозинофилы, тыс/мкл |
7,6 ± 0,7 |
9,4 ± 0,9 |
|
Лимфоциты, тыс/мкл |
15,7 ± 0,8 |
18,8 ± 0,7 |
|
Моноциты, тыс/мкл |
2,0 ± 0,5 |
2,6 ± 0,4 |
При патолого-анатомическом исследовании цыплят-бройлеров изменения оценивали по 4-балльной шкале: 0 баллов — нарушений нет; 1 балл — острый катаральный энтерит; 2 балла — острый катаральный энтерит, серознофибринозный аэросаккулит, гиперплазия селезенки; 3 балла — острый катаральный энтерит, серозно-фибринозный перигепатит, атрофия фабрициевой бурсы, серозно-фибринозный аэросаккулит; 4 балла — геморрагический энтерит, серозно-фибринозный перигепатит, атрофия фабрициевой бурсы, серознофибринозный аэросаккулит, серозно-фибринозный перитонит. В течение и конце опыта у погибших или убитых цыплят выявлены патолого-анатомические изменения с оценкой 1, 2, 3 и 4 балла — соответственно 4, 56, 28 и 12 %.
При гистологическом анализе органов пищеварения цыплят наблюдались частичная десквамация покровного эпителия ворсинок слизистой оболочки тонкой кишки, а также увеличение количества бокаловидных клеток, переполненных светло-розовым секретом. К концу эксперимента каемчатые эпителиоциты ворсинок слизистой оболочки тонкой кишки (особенно в апикальной части) находились в состоянии слизистой дистрофии, некроза и отторжения; на поверхности слизистой оболочки встречались волокна фибрина. При окраске по Крантцу в собственной пластинке слизистой оболочки тонкой кишки обнаружены бактерии; в подслизистом слое слизистой оболочки наблюдались отек и кровенаполнение кровеносных сосудов; в слизистой, мышечной и серозной оболочках — инфильтрация лимфоцитами, гистиоцитами и псевдоэозинофилами соединительной ткани. В опыте активность щелочной фосфатазы эпителиоцитов ворсинок слизистой оболочки двенадцатиперстной кишки цыплят снижалась в 1,5 раза по сравнению с контролем.
При электронно-микроскопическом исследовании тонкой кишки зараженных цыплят обнаружены объемные ворсинки конусовидной формы, ширина которых в основании была в 1,5-2,5 раза больше, чем в апикальной части. При более сильном увеличении микроскопа на складках ворсинок выявлялись четкие границы эпителиоцитов, имеющих полигональную форму, в большинстве случаев на апикальной поверхности эпителиоцитов наблюдался гликокаликс. Апикальные поверхности бокаловидных энтероцитов имели вид небольших щелей правильной округлой формы. Целостность эпителиального слоя ворсинок была нарушена, в этих участках располагались палочковидные бактерии и гетероморфные бактерии L-формы.
Для эпителиального слоя слизистой оболочки толстой и слепой кишок были характерны следующие нарушения: слизистая дистрофия, некробиоз и частичная десквамация эпителия; вследствие слизистой дистрофии и увеличения числа бокаловидных клеток просвет крипт был сужен. В подслизистом слое слизистой оболочки слепых отростков наблюдалось разволокнение коллагеновых волокон, а также инфильтрация клеточных элементов в рыхлую соединительную ткань. Лимфатические фолликулы слизистой оболочки толстой кишки имели не- четкие границы и оказались увеличенными; количество лимфоцитов в центре фолликулов было ниже нормы.
В целом следует отметить, что при патолого-анатомических нарушениях в 4 балла у цыплят наблюдалась гиперемия всех слоев слизистой оболочки тонкой и толстой кишок. Во всех отделах пищеварительного тракта выявлена множественная бактериальная эмболия сосудов серозной оболочки.
У цыплят в опыте на поверхности печени располагались волокнистые эозинофильные массы фибрина, между волокнами последнего — псевдоэозино-фильные лейкоциты и колонии бактерий. Капсула печени и междольковая соединительная ткань были инфильтрированы псевдоэозинофильными и лимфоидными клетками; в балочной структуре долек печени произошла дискомплексация. На отдельных участках выявлены гранулемы с клеточным детритом по центру (преимущественно из псевдоэозинофилов), к которым непосредственно примыкали многоядерные гигантские клетки. Отмечены участки, состоящие из распавшихся гепатоцитов и псевдоэозинофилов. Вследствие переполнения кровью центральной вены и капилляров размер некоторых гепатоцитов уменьшался и они находились в состоянии атрофии; некоторые гепатоциты были увеличены и характеризовались белковой и жировой дистрофией. В мелкозернистой цитоплазме содержались капли белкового и жирового происхождения; ядра имели нечеткий контур и располагались ацентрично (рис., а).
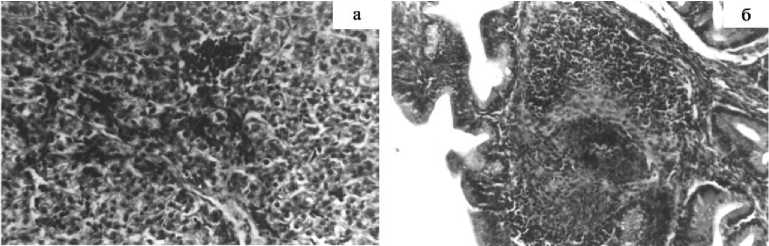
Клетки печени (а) и лимфатического фолликула фабрициевой бурсы (б) цыплят-бройлеров кросса Иза-Ведетта, зараженных культурой Escherichia coli 1111 (О149:К91:К88) в дозе 5 ⋅ 109 бактериальных клеток: а и б — соответственно 5-е и 10-е сут эксперимента (окраска гематоксилином и эозином).
Активность щелочной фосфатазы в печени снижалась от центра к периферии долек по ходу желчных капилляров (в 1,5 раза), что свидетельствует о нарушении обмена веществ. Отмечено набухание многорядного призматического эпителия складок фабрициевой бурсы; в некоторых клетках встречались мелкие вакуоли; строма бурсы находилась в состоянии отека. Корковое вещество фолликулов было истончено, выявлялись просветленные участки; в мозговом веществе лимфатических фоллликулов зарегистрированы очаги деструкции и лизиса лимфоцитов с явлениями кариопикноза и кариорексиса. Клетки в таких очагах находились на различных стадиях разрушения и имели вид неравномерно окрашенной бесструктурной массы, в центре которой при окраске по Крантцу обнаружены колонии микроорганизмов. К концу эксперимента в лимфатических фолликулах было отчетливо видно разграничение на корковое и мозговое вещество, причем разреженное расположение клеток сохранялось в обоих зонах. Кровенаполнение сосудов было хорошим, стенки некоторых из них имели утолщения. В строме органа отмечено скопление плазматических клеток, корковое вещество имело темную окраску. При большом увеличении микроскопа в корковом веществе лимфатических фолликулов фабрициевой бурсы обнаруживались близкораспо-71
ложенные лимфоциты, у которых объем ядра был больше, чем цитоплазмы, а мозговое вещество — более светлой окраски. Клетки, располагающиеся в этой зоне, имели бобовидные ядра и широкий ободок цитоплазмы (рис., б).
Таким образом, патоморфологические изменения органов пищеварения цыплят, зараженных штаммом E. coli , обусловлены подострой септикотоксемией. При наличии бактериальной эмболии и нарушения кровообращения в органах характерными изменениями являются геморрагический энтерит, серознофибринозный перигепатит, атрофия фабрициевой бурсы, серозно-фибринозный аэросаккулит, серозно-фибринозный перитонит.
При бактериологическом анализе для выделения анаэробных бифидобактерий производили посевы исследуемого материала в разведениях от 10–4 до 10– 11, так как при невысоких разведениях могут вырастать микроорганизмы других видов (чаще E. coli ). К роду Bifidobacterium относили микроорганизмы, колонии которых имели вид «комет», «гвоздиков» или «крошек». При микроскопическом анализе нами были выявлены грамположительные палочки, разветвленные на утолщенных концах в виде римской цифры V. Бифидобактерии не разжижали каллоид желатины, не выделяли CO 2 и H 2 S, не восстанавливали нитраты. Титр бифидобактерий в содержимом тонкой кишки цыплят через 5 и 10 сут после заражения составлял соответственно 10–6 и 10–5 , в контроле — 10–7.
При идентификации E. coli учитывали, что в мазках из первичного материала бактерии располагаются одиночно и попарно, окрашиваются по Граму отрицательно, спор и капсул не образуют, на МПА формируют выпуклые колонии S-формы (блестящие, прозрачные, круглой формы с ровными краями). В нашем эксперименте бактерии E. coli росли на МПБ диффузно с образованием аморфного осадка серо-белой окраски, легко разбивающегося при встряхивании; на средах Эндо, Левина и Плоскирева — образовывали колонии соответственно темновишневой (с металлическим оттенком), темно-фиолетовой (приподнятые в центре) и розовато-сиреневой окраски.
Штаммы E. coli обладали следующими свойствами: ферментировали глюкозу, маннит, арабинозу, сорбит и ксилозу; выделяли индол; утилизировали ацетат; давали положительную реакцию с метиловым красным; синтезировали лизиндекарбоксилазу; не ферментировали инозит и адонит; не образовывали H2S; не утилизировали цитрат и малонат; не синтезировали фенилаланиндезаминазу, уреазу и желатиназу; давали отрицательную реакцию Фогеса-Проскауэра. Выделенные штаммы E. coli оказались чувствительными к эритромицину, полимиксину, мономицину, стрептомицину, неомицину, канамицину, ампициллину, карбе-нициллину, устойчивыми к тетрациклину, олеандомицину, оксациллину.
Количество бактерий группы кишечной палочки в 1 г содержимого тонкой кишки определяли по числу колоний, выросших на соответствующей питательной среде с пересчетом на количество посеянного материала и степень его разведения. Так, через 5, 10, 15 и 20 сут после заражения содержание бактерий Escherichia в кишечнике цыплят составляло соответственно 8,95 ± 0,17; 8,77 ± 0,23; 8,45 ± 0,56 и 8,27 ± 0,63 lg/г, тогда как в контроле — 8,05 ± 0,45 lg/г.
При оценке свойств E. coli отмечены различия между культурами микроорганизмов, выделенных из feces в опыте и контроле. Так, доля лактозопозитивных негемолитических бактерий составляла в опыте и контроле соответственно 9,7-11,5 и 79,8-92,7 %. При этом в опыте возрастала доля бактерий E. coli , имеющих низкую лактазную активность и обладающих гемолитическими свойствами, — соответственно 14,7-32,3 и 7,2-31,5 %; в контроле эти показатели составляли соответственно 1,7-4,6 и 0-1,1 % от общего числа выделенных бактерий этого вида.
Итак, при экспериментальном заражении цыплят бактериями E. coli происходят количественные и качественные изменения микрофлоры кишечника, характерные для дисбактериоза. В частности, наблюдается увеличение численности бактерий, имеющих низкую лактазную активность или обладающих гемолитическими свойствами. В то же время уменьшается количество лактозопозитивных бактерий E. coli и микроорганизмов рода Bifidobacterium , одной из ведущих функций которых является обеспечение колонизационной резистентности (предотвращение заселения кишечника условно-патогенными и патогенными микроорганизмами). В комплексе лечебных средств большое значение приобретает метод бактериотерапии — применение препаратов из живых микроорганизмов, являющихся представителями нормальной кишечной микрофлоры и получивших название пробиотики. Следует отметить, что к настоящему времени разработаны концепция применения пробиотиков и схемы их применения в зависимости от физиологического периода и возраста особей (4-6).
Л И Т Е Р А Т У Р А
-
1. С т р е л ь н и к о в А.П. Патоморфология и иммуноморфологические реакции у кур при инфекционном бронхите, оспе, колибактериозе и пастереллезе. Автореф. докт. дис. М., 1983.
-
2. П и р о ж к о в М.К. Биологические препараты для специфической профилактики и терапии эшерихиоза животных. Автореф. докт. дис. М., 2002.
-
3. Б о в к у н Г.Ф. Роль микрофлоры при заболеваниях органов пищеварения у цыплят. Ветеринария, 2004, 4: 14-16.
-
4. П л о х и н с к и й Н.А. Алгоритмы биометрии. М., 1980.
-
5. З и н ч е н к о Е.В., П а н и н А.Н. Иммунобиотики в ветеринарной практике. Пущино, 2000.
-
6. С и д о р о в М.А., С у б б о т и н В.В., Д а н и л е в с к а я Н.В. Нормальная микрофлора жи
вотных и ее коррекция пробиотиками. Ветеринария, 2000, 11: 17-22.
-
7. М а л и к Н.И. Новые пробиотические препараты ветеринарного назначения. Автореф. докт. дис. М., 2002.
Московский государственный университет прикладной биотехнологии , 109316, Москва, ул. Талалихина, 33


