Морфометрическая характеристика влияния пренатальной алкоголизации на сосуды микроциркуляторного русла и нейроны головного мозга человека
Автор: Солонский Анатолии Владимирович, Потапов Алексей Валерьевич, Шумилова Софья Николаевна, Логвинов Сергей Валентинович, Герасимов Александр Владимирович, Варакута Елена Юрьевна
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 4 (101), 2018 года.
Бесплатный доступ
На материале мозга человека, развивающегося в условиях пренатальной алкоголизации, установлены морфометрические особенности формирования сосудов микроциркуляторного русла и нейронов большого мозга. Обнаружено уменьшение диаметра и периметра капилляров с увеличением срока развития в условиях пренатальной алкоголизации, приводящее к общему снижению васкуляризации ткани мозга. Выявлено уменьшение размеров нейробластов как следствие изменения васкуляризации, вызванной воздействием алкоголя.
Алкоголь, головной мозг, нейрон, развитие, микроциркуляторное русло
Короткий адрес: https://sciup.org/142215878
IDR: 142215878 | УДК: 616.8.89-008.441.13-055.26:340.636.1:612.82 | DOI: 10.26617/1810-3111-2018-4(101)-5-10
Текст научной статьи Морфометрическая характеристика влияния пренатальной алкоголизации на сосуды микроциркуляторного русла и нейроны головного мозга человека
В настоящее время большое внимание уделяется вопросам развития головного мозга в целом и механизмам влияния на эти процессы токсических веществ в частности. Это связано с развитием промышленности, появлением новых повреждающих агентов и отравляющих веществ. Токсическое влияние различных веществ имеет сходные последствия, что проявляется в том числе в нарушении развития сосудистого компонента головного мозга [1, 2, 3].
Наиболее распространённым и употребляемым токсическим веществом является этанол. Наибольшую опасность представляет женский алкоголизм, поскольку употребление алкоголя беременными может привести к различным морфологическим и структурным аномалиям, описанным в рамках фетального алкогольного синдрома (FAS) [4], который проявляется умственной отсталостью, поведенческими аномалиями, физическими дефектами [5] и может сопровождаться пренатальным ишемическим поражением [6].
Имеются данные, что воздействие этанола на развитие мозга мышей может привести к нарушению кровотока в мозговых артериях плода [7]. На современном этапе считается, что одним из наиболее вероятных факторов возникновения сосудистых аномалий является уменьшение васкуляризации за счет снижения уровня нейротрофических факторов. Возможны несколько вариантов объяснения данного феномена. Вероятно, нарушение ангионеогенеза, а вслед за этим и нейронального развития происходит за счет снижения уровня PGF (плацентарного фактора роста) [8] или нейротрофина [9]. На модели мембраны куриного желточного мешка было показано, что этанол резко ингибирует ангиогенез за счет повышения уровня реакционно-способных форм кислорода [10].
Исследование с помощью когерентной компьютерной томографии позволило выявить, что через несколько минут после употребления этанол приводил к быстрому и значительному уменьшению диаметра сосуда по сравнению с интактной группой [11]. Противоположный результат был получен при исследовании на бабуинах. В нем дилатация артерий мозга была получена за счет воздействия этанола на каннабиноидные рецепторы головного мозга эмбриона [12].
Все перечисленные исследования были направлены на поиск механизмов, обусловливающих нарушение процессов васкуляризации, но в литературе отсутствуют данные, которые описывали бы то, как именно нарушается сосудистая сеть.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить влияние пренатальной алкоголизации на особенности развития структур головного мозга эмбриона – нейробластов и сосудов МЦР на разных сроках развития.
МАТЕРИАЛЫ И МЕТОДЫ
В ходе исследования было изучено 26 эмбрионов 8–11 недель развития. Весь материал был разделен на 4 группы в зависимости от наличия алкогольной зависимости у матери и срока внутриутробного развития. Таким образом были сформированы первые две группы: Алкоголь1 (А1) – эмбрионы в возрасте
8–9 недель; Алкоголь2 (А2) – эмбрионы в возрасте 10–11 недель, по 6 образцов в каждой. В этих группах материал был получен от матерей, употреблявших алкоголь в период беременности и страдающих алкоголизмом I–II стадии (F10.201, F10.202).
Следующие две группы: Контроль1 (К1) – эмбрионы в возрасте 9 недель, Контроль2 (К2) – эмбрионы в возрасте 11 недель, по 7 образцов в каждой. Материал был получен от психически и соматически здоровых женщин. Возраст пациенток был в пределах от 25 лет до 41 года (средний возраст составил 37,1 года). Возраст женщин групп Контроль соответствовал таковому в группах Алкоголь.
Головной мозг эмбрионов получали в процессе проведения операции по искусственному прерыванию беременности в роддомах и гинекологических отделениях больниц Томска, при этом все процедуры выполнялись с учетом требований этического комитета.
В период беременности больные употребляли в зависимости от толерантности от 500 до 800 мл 40% алкоголя в день. Все женщины лечились ранее от алкоголизма и прошли от 1 до 10 курсов лечения, но никто из них в период, предшествующий аборту, не находился на лечении дисульфирамом.
Главным критерием для отбора женщин в контрольную группу являлся факт отсутствия употребления алкоголя в течение одного месяца до зачатия и в течение беременности. Кроме того, в эту группу включали только тех женщин, которые не страдали хроническими заболеваниями, не употребляли лекарств и не имели в быту и на производстве контакта с токсическими веществами, радиацией и др.
Головной мозг эмбрионов при подготовке к изучению методами световой микроскопии фиксировали в 0,5% растворе глутаральдегида на 0,1 М фосфатном буфере рН 7,3–7,4, дофиксировали в 1% растворе OsO 4, обезвоживали в спиртах восходящей концентрации и заливали в аралдит. Для морфометрии использовали полутонкие срезы, окрашенные толуидиновым синим (окраска по Нисслю). Полу-тонкие срезы изготавливали на ультратоме «Ultracut-E» (Reichert, Австрия). Для компьютерной морфометрии сосудов использовали полутонкие (толщиной 0,5–1 мкм) срезы на уровне промежуточного слоя, окрашенные толуидиновым синим. Морфометрический анализ применялся для получения количественных параметров нервных клеток и сосудов коры головного мозга эмбрионов на различных стадиях развития с целью выяснения зависимости изменений структуры указанных компонентов от степени их дифференцировки и оценки влияния патологических воздействий на процесс васкулогене-за.
Микросъемка материала производилась с помощью световых микроскопов AxioScope A1 (Carl Zeiss, Германия), AxioStar (Carl Zeiss, Германия) и цифровой камеры Canon G10. С применением программы AxioVision 4.8 производился подсчет сосудистых и нейрональных структур, определялись площади и диаметры каждого отдельного элемента. При изучении сосудистого компонента подсчитывалось среднее количество сосудов на единицу площади, их средняя площадь и средний периметр, а также относительная площадь сосудов на единицу площади среза (рис. 1).
Рисунок 1. Препарат головного мозга эмбриона группы А1 Здесь и далее окраска толуидиновым синим. Ув. х 400.
На фото процесс подсчета площади сосудов в программе AxioVision 4.8.
Далее подсчитывались средняя площадь и средний диаметр нейронов (рис. 2).
Рисунок 2. Препарат головного мозга эмбриона группы А1
Статистическую обработку полученных данных проводили с использованием программы Statistica 10. Для оценки достоверности различий при сравнении средних величин использовали критерий Манна–Уитни, различия считались значимыми при р<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При изучении мозга плодов было установлено, что в данный период развития нервная ткань достаточно хорошо структурно сформирована, в ней находятся нейробласты и глиобласты, а также кровеносные сосуды.
Нейробласты выглядят как клетки округлой формы, располагающиеся группами. Центрально располагающиеся ядра со светлым матриксом занимают основной объем их перикариона и содержат 1– 3 мелких ядрышка. Базофильное вещество цитоплазмы и нейрофибриллы не прослеживаются. Идентификация начального сегмента аксона затруднена. Глиобласты лежат между группами нервных клеток, имеют так же округлую форму и высокое ядерно-цитоплазматическое соотношение. В их ядрах наблюдаются участки повышенной электронной плотности в виде зерен и нитей хроматина и содержатся крупные хорошо окрашенные ядрышки, занимающие центральное положение. Появляются глиобласты, контактирующие с нейробластами. Встречаются участки, на которых глиобласты располагаются группами, окружая нейробласты.
Среди вышеперечисленных структур наблюдались различные реактивные изменения в виде ги-перхромных несморщенных и гиперхромных сморщенных клеток. В случаях с выраженными реактивными изменениями нейронов отмечалось расширение периваскулярных и перицеллюлярных пространств. Размеры клеточных группировок отличались вариабельностью, динамичного роста показателей не наблюдалось (рис. 3).
Между группой Контроль и А1 достоверных различий выявлено не было (табл. 1 и 2, рис. 3 и 6). Однако между группами Контроль и А2 отмечались следующие различия: выявлено увеличение числа сосудов на единицу площади, а также увеличение средней площади сосуда (рис. 5, 6). Таким образом, в более позднем периоде (11 недель развития) количество сосудов увеличивается, но средняя площадь каждого сосуда уменьшается.
Таблица 1
Динамика численных показателей сосудов в исследуемых группах
|
Анализируемый показатель |
Средняя площадь, мкм2 |
Удельная площадь сосудов, % |
Количество сосудов на 1 мм², шт. |
|
Контроль |
78,0 |
0,42 |
52 |
|
A1 |
75,7 |
0,40 |
52 |
|
А2 |
48,5 |
0,37 |
136 |
Таблица 2
Корреляция влияния алкоголя на площадь сосудов
|
Сравниваемые группы |
Уровень значимость (р) |
Критическое значение (р) |
|
А1 – Контроль |
0,49 |
0,05 |
|
А2 – Контроль |
0,00 |
|
|
А1 – А2 |
0,00 |
Таблица 3
Динамика численных показателей нейронов в исследуемых группах
|
Анализируемый показатель |
Средняя пло- 2 щадь, мкм |
Средний диа- 2 метр, мкм |
|
Контроль |
39,3 |
7,0 |
|
A1 |
35,2 |
6,5 |
|
А2 |
25,4 |
5,6 |
Таблица 4
Корреляция влияния алкоголя на площадь нейронов
|
Сравниваемые группы |
Уровень значимость (р) |
Критическое значение (р) |
|
А1 – Контроль |
0,00 |
0,05 |
|
А2 – Контроль |
0,00 |
|
|
А1 – А2 |
0,00 |
Рисунок 3. Препарат головного мозга эмбриона группы А1
Особенностью этих этапов развития является хорошее развитие МЦР. Оно представлено артериолами, капиллярами и венулами. В стенках артериол наблюдались циркулярно расположенные гладкомышечные клетки. Размеры капилляров на препаратах варьировали от 6–7 мкм до 10–11 мкм. Капилляры соматического типа имели хорошо развитую стенку, состоящую из эндотелиоцитов, базальной мембраны, находящихся в её структуре перицитов, а также адвентициальных клеток. В просветах некоторых сосудов содержались форменные элементы крови.
Количественное исследование позволило установить следующие закономерности. Для удобства разделим данные на два блока.
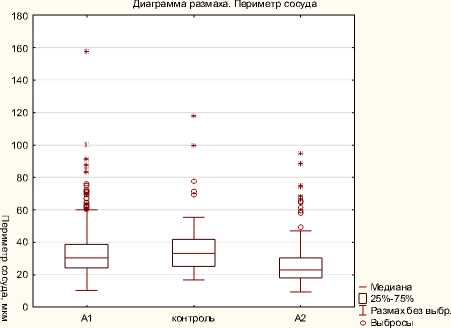
Крайние точки
Группа
Рисунок 4. Сравнение периметра сосудов в группах
Также наблюдалось закономерное уменьшение показателей групп А1 и А2 в зависимости от времени гестации (табл. 3 и 4, рис. 6 и 7). С увеличением срока развития уменьшаются площадь и диаметр нейронов.
ВЫВОДЫ
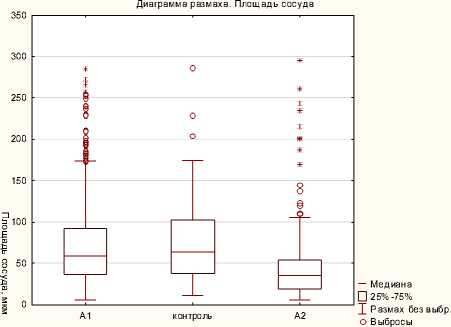
Группа Крайние точки
Рисунок 5. Сравнение площади сосудов в группах
Таким образом, можно утверждать, что алкоголь влияет на развитие нейрососудистого комплекса головного мозга, что проявляется уменьшением объёма нейробластов и снижением удельной площади сосудов. Изменения прогрессируют с увеличением срока развития. Можно предположить, что с уменьшением площади сосудов замедляется рост нейронов.
Список литературы Морфометрическая характеристика влияния пренатальной алкоголизации на сосуды микроциркуляторного русла и нейроны головного мозга человека
- Jégou S., El Ghazi F., de Lendeu P.K., Marret S., Laudenbach V., Uguen A., Marcorelles P., Roy V., Laquerrière A., Gonzalez B.J. Prenatal alcohol exposure affects vasculature development in the neonatal brain. Ann Neurol. 2012. Dec.
- Солонский А.В., Семке В.Я. Бохан Н.А. Логвинов С.В. Онтогенетические закономерности развития мозга плодов человека при алкоголизме матери. Сибирский вестник психиатрии и наркологии. 2010. 2 (59): 9-17.
- Shushpanova T.V., Solonskii A.V. Intech Open, UK (Великобритания) "DRUG ADICTION" "Molecular-Cellular Targets of the Pathogenetic Action of Ethanol in the Human Brain in Ontogenesis and the Possibility of Targeted Therapy Aimed at Correcting the Effect of Pathogenic Factors" OPEN ACCESS WоS™ Core Collection (BKCI), 2018: 2-33.
- Bukiya A.N., Dopico A.M. Fetal Cerebral Circulation as Target of Maternal Alcohol Consumption. Alcohol Clin Exp Res. 2018; Apr 19 DOI: 10.1111/acer.13755
- Seguin D., Gerlai R., Fetal alcohol spectrum disorders: Zebrafish in the analysis of the milder and more prevalent form of the disease. Behavioral Brain Research. 2018; Oct 15 (352): 125-132 doi: 10.1016/j.bbr.2017.10.005
- Jarmasz J.S., Basalah D.A., Chudley A.E., Del Bigio M.R. Human Brain Abnormalities Associated With Prenatal Alcohol Exposure and Fetal Alcohol Spectrum Disorder. Journal of Neuropathology and experimental neuropathology. 2017; Sep 1; 76 (9): 813-833 DOI: 10.1093/jnen/nlx064
- Bake S., Tingling J.D., Miranda R.C. Ethanol exposure during pregnancy persistently attenuates cranially directed blood flow in the developing fetus: evidence from ultrasound imaging in a murine second trimester equivalent model. Alcoholism? Clinical and Experimental Research. 2012; May; 36 (5): 748-58 DOI: 10.1111/j.1530-0277.2011.01676.x
- Lecuyer M., Laquerrière A., Bekri S., Lesueur C., Ramdani Y., Jégou S., Uguen A., Marcorelles P., Marret S., Gonzalez B.J. PLGF, a placental marker of fetal brain defects after in utero alcohol exposure. Acta Neuropathol Commun. 2017; Jun 6.
- Boschen K.E., Klintsova A.Y. In the Brain: interaction with alcohol exposure during development. Vitam Horm. 2017.
- Wang G., Zhong S., Zhang S.Y., Ma Z.L., Chen J.L., Lu W.H., Cheng X., Chuai M., Lee K.K., Lu D.X., Yang X. Angiogenesis is repressed by ethanol exposure during chick embryonic development. JAppl Toxicol.2016; May.
- Raghunathan R., Wu C., Singh M., Liu C.H., Miranda R.C., Larin K.V. Evaluating the effects of maternal alcohol consumption on murine fetal brain vasculature using optical coherence tomography. J Biophotonics. 2018; May; 11 (5) DOI: 10.1002/jbio.201700238
- Seleverstov O., Tobiasz A., Jackson J.S., Sullivan R., Ma D., Sullivan J.P., Davison S., Akkhawattanangkul Y., Tate D.L., Costello T., Barnett S., Li W., Mari G., Dopico A.M., Bukiya A.N. Maternal alcohol exposure during mid-pregnancy dilates fetal cerebral arteries via endocannabinoid receptors. Alcohol. 2017; Jun; 61: 51-61 DOI: 10.1016/j.alcohol.2017.01.014


