Мозаичная анеуплоидия с вовлечением половых хромосом X и Y в клетках головного мозга в норме и при психической патологии: поиск геномных маркеров при шизофрении
Автор: Юров Юрий Борисович, Ворсанова С.Г., Демидова И.А., Востриков В.М., Соловьв И.В., Уранова Н.А., Юров И.Ю.
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 2 (91), 2016 года.
Бесплатный доступ
Проверка гипотезы о возможном вовлечении постзиготических или соматических вариаций генома в патогенез психических болезней, включая шизофрению и аутизм. Методом флуоресцентной гибридизации in situ с ДНК пробами на различные хромосомы (FISH) проведен анализ частоты хромосомных мутаций (анеуплоидии) в клетках постмортальных тканей мозга у 15 больных шизофренией и в 15 контрольных образцах. Для интерфазного анализа вариаций хромосом в клетках мозга использована оригинальная коллекция ДНК зондов на хромосому 1 и половые хромосомы Х и У. Проведено поисковое исследование по определению частоты мозаичных вариаций половых хромосом Х и У непосредственно в клетках головного мозга в норме и при шизофрении. Частота анеуплоидии с участием половых хромосом Х/Y в контроле оставила 0,99 % (медиана 0,8 %; 95 % доверительный интервал 0,60-1,38 %) и при шизофрении - 2,42 % (медиана 2,4 %, 95 % доверительный интервал 1,28-3,58 %), p=0,008 (Манна-Уитни U-тест для независимых групп). Таким образом, выявлено увеличение уровня мозаичной анеуплоидии с вовлечением половых хромосом мозга при шизофрении. Высказано предположение о том, что мозаичная анеуплоидия, являясь значимым биологическим маркером нестабильности генома, может приводить к выраженному генному дисбалансу и нарушению функциональной активности аномальных нервных клеток и нейронных сетей при шизофрении.
Психическая патология, шизофрения, головной мозг, половые хромосомы x, мозаичная анеуплоидия, геномные маркеры
Короткий адрес: https://sciup.org/14295896
IDR: 14295896
Текст научной статьи Мозаичная анеуплоидия с вовлечением половых хромосом X и Y в клетках головного мозга в норме и при психической патологии: поиск геномных маркеров при шизофрении
Введение. Шизофрения является широко распространенным психическим заболеванием, частота которого в общей популяции составляет около 1 %. В этиологии шизофрении значимую роль играют генетические факторы как, например, унаследованные от родителей и возникшие de novo редкие генные и хромосомные мутации, вариации числа копий ДНК (CNV), мутации одиночных нуклеотидов (SNV) и небольшие инсер-ции/делеции (indel), а также однонуклеотидные полиморфные варианты (SNP) [1—3]. Однако многие генетические и эпигенетические факторы, связанные с данным мультифакторным заболеванием и влияющие на процесс взаимодействия генотипа с внешней средой, до настоящего времени не определены. Поэтому вопрос о роли не унаследованных (non-heritable) или приобретенных мутаций и вариаций генома (т. е. постзиготических или соматических изменений хромосом), регулирующих процессы развития и функционирования головного мозга в ходе онтогенеза в норме и при психической патологии, остается открытым [4—6].
Ранее нами была предложена гипотеза о возможной связи хромосомной (геномной) нестабильности и соматических вариаций генома с патогенезом психических заболеваний [7—10]. Нестабильность генома (хромосом) проявляется в форме мозаичных соматических вариаций в клетках разных тканей, включая головной мозг. Например, мозаичная анеуплоидия в нервных клетках ведет к крупномасштабным геномным изменениям (Large-scale Somatic Genomic Alteration – LSGA), вовлекающим сотни и даже тысячи генов, в большинстве случаев негативно влияют на развитие и функционирование головного мозга [7, 10]. Исследования уровня хромосомных мутаций в аутопсийных образцах головного мозга в норме показали, что, по оценкам разных авторов, приблизительно 10—30 % нейрональных клеток являются анеуплоидными [11—13]. Мозаичная анеуплоидия в клетках головного мозга больных шизофренией зафиксирована нами в ряде случаев [4, 5]. Эти данные позволили предположить, что повышенный уровень анеуп-лоидии в нервных клетках может являться характерным признаком поражённого мозга при шизофрении. Таким образом, определение роли геномной нестабильности в клетках мозга при шизофрении может быть ключом к пониманию молекулярных механизмов психических нарушений и их связи с наследственными и экзогенными факторами [9, 10, 14—20]. Однако крупномасштабные спонтанные вариации соматического генома в виде LSGA и наличие мозаичных клонов анеуплоидных клеток в мозге при шизофрении мало изучены [20—22]. Поэтому для проверки гипотезы о патогенной роли хромосомной нестабильности при психических заболеваниях мы исследовали уровень мозаичной анеуп-лоидии в клетках головного мозга индивидуумов без психической патологии и больных шизофренией. Сравнивалась частота хромосомоспецифичных мутаций в виде мозаичной анеуплоидии низкого уровня применительно к половым хромосомам Х/У и аутосомам в клетках головного мозга в норме и при шизофрении.
Материалы и методы. В исследовании применяли метод флуоресцентной гибридизация in situ (FISH) с ДНК пробами, специально разработанными для анализа анеуплоидии в постмортальных клетках головного мозга [12— 19]. Аутопсийные образцы замороженной ткани префронтальной коры головного мозга [5] обработаны в соответствии с протоколом, подробно описанным ранее [4, 5]. Интерфазная флуоресцентная многоцветовая гибридизация in situ (интерфазная МFISH) проведена на выборке 15 пациентов с шизофренией и 15 контрольных образцов, как описано ранее [4, 5]. Препараты были пронумерованы и проанализированы в двойном слепом исследовании. Анализировали по 1000 клеток для хромосомы 1 и половых хромосом Х/Y для каждого исследованного образца головного мозга в норме и при шизофрении. Для каждой из хромосом (1 и Х/Y) было проанализировано по 15000 нервных клеток в контроле (n=15) и 15000 нервных клеток при шизофрении (n=15). Значение p менее 0,050 считалось значимым (критерий Манна-Уитни, U-тест для независимых групп).
Результаты и обсуждение. Используя интерфазную многоцветовую флуоресцентную гибридизацию in situ (FISH), мы оценили частоту анеуплоидии с вовлечением различных половых хромосом и аутосомы в клетках постмортальных образцов мозга (кора головного мозга, поле Бродмана 10) в 15 контрольных образцах и 15 с шизофренией. Применение метода МFISH с ДНК пробами на хромосомы 1 и Х/Y позволило определить относительную частоту анеуплоидных клеток головного мозга в норме и при шизофрении. Анализ контрольных образцов показал, что частота анеуплоидии с вовлечением аутосомы 1 в среднем составила 0,31 % (медиана 0,20 %; 95 % доверительный интервал 0,19—0,44 %), при шизофрении эта величина была достоверно выше и составила 1,47 % (медиана 0,9 %, 95 % доверительный интервал 0,62—2,33 %), p= 0,0015. В случае половых хромосом частота анеуплоидии с участием хромосом Х/Y в контроле оставила 0,99 % (медиана 0,8 %; 95 % доверительный интервал 0,60—1,38 %), при шизофрении эта величина также была значительно выше – 2,42 % (медиана 2,4 %, 95 % доверительный интервал 1,28—3,58 %), p= 0,008. Случаи низкопроцентного мозаицизма в контроле с частотой выше 2,5 % в расчёте на 1 пару исследованных хромосом в данном исследовании не обнаружены. Однако при шизофрении случаи низкопроцентного мозаицизма с частотой выше 2,5 % были отмечены для аутосомы 1 (2 случая) и половых хромосом Х/У (6 случаев) из 15 исследованных образцов постмортального мозга больных.
Анализировали по 1000 клеток для хромосом 1 и Х/Y, а также каждого исследованного образца головного мозга в норме (n=15) и при шизофрении (n=15). Значение p менее 0,050 считалось значимым (критерий Манна-Уитни, U-тест для независимых групп).
Обнаружение соматического хромосомного мозаицизма затруднено ограничениями разрешающей способности многих методов анализа [1—7, 11—17]. Обычно применяемый цитогенетический анализ является наиболее простым и используемым методом, но он ограничен ме-тафазным анализом большого числа клеток для его выявления. Молекулярное кариотипи-рование с помощью array CGH – наиболее высокоразрешающий метод выявления регулярных хромосомных микроперестроек, но позволяет обнаруживать мозаицизм в 20—30 % клеток [11, 16, 21]. Наличие клонов мозаичных клеток с более низкой частотой трудно оценить этим методом. Метод интерфазной FISH принято считать наиболее информативным для оценки межклеточных хромосомных изменений клетки при анализе большого числа (сотен, тысяч и даже больше) интерфазных ядер [10—12].
Таблица 1
Относительная частота анеуплоидии (%) в клетках головного мозга (префронтальная кора) в контроле (1А) и при шизофрении (1Б) после MFISH исследования
|
1 |
a. Контроль |
1Б. |
Шизофрения |
||
|
Хромосомы (% анеуплоидии) (моносомия и трисомия) |
|||||
|
№ хромосомы |
1 |
X+Y |
№ хромосомы |
1 |
X+Y |
|
1 |
0,4 |
1,8 |
1 |
0,3 |
1,0 |
|
2 |
0,3 |
1,1 |
2 |
2,2 |
3,4 |
|
3 |
0,2 |
0,8 |
3 |
0 |
2,8 |
|
4 |
0,3 |
1,9 |
4 |
2,4 |
2,4 |
|
5 |
0,2 |
0,2 |
5 |
0,7 |
3,6 |
|
6 |
0,2 |
1,0 |
6 |
0,9 |
2,6 |
|
7 |
0,4 |
0,3 |
7 |
0,3 |
0,4 |
|
8 |
0,2 |
2,0 |
8 |
1,6 |
1,2 |
|
9 |
0,6 |
0,5 |
9 |
0,2 |
6,7 |
|
10 |
0,1 |
2,4 |
10 |
1,8 |
1,7 |
|
11 |
0,1 |
0,9 |
11 |
1,1 |
0,7 |
|
12 |
0,2 |
0,8 |
12 |
5,7 |
0,3 |
|
13 |
0,9 |
0,5 |
13 |
0,4 |
2,2 |
|
14 |
0,3 |
0,4 |
14 |
3,7 |
6,6 |
|
15 |
0,2 |
0,3 |
15 |
0,6 |
2,4 |
|
Статистическая обработка |
|||||
|
Число клеток в анализе (N) |
N=15000 |
N=15000 |
Число клеток в анализе (N) |
N=15000 |
N=15000 |
|
Медиана |
0,2 |
0,8 |
Медиана |
0,9 |
2,4 |
|
95 % ДИ |
0,19— 0,44 |
0,60— 1,38 |
95 % ДИ |
0,62— 2,33 |
1,28— 3,58 |
|
Среднее значение (М) |
0,31 |
0,99 |
Среднее значение (М) |
1,47 |
2,42 |
|
Анализ выборки 15000 клеток для контроля и выборки 15000 клеток для шизофрении (значение критерия Манна-Уитни, U-тест для независимых групп) |
|||||
|
p < 0,0015 |
р<0,008 |
||||
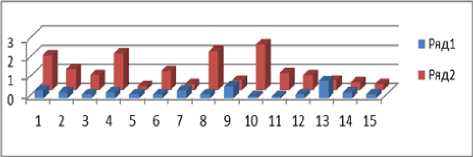
Рис. 1. Частота анеуплоидии (%) в клетках головного мозга (префронтальная кора) в норме (А) и при шизофрении (Б) после MFISH исследования
Примечание . Анализировали по 1000 клеток для хромосом 1 и половых Х/Y и каждого исследованного образца клеток головного мозга в норме (n=15) и при шизофрении (n=15). Ряд 1 – аутосома (хромосома 1); ряд 2 – половые хромосомы Х/Y.
Тем не менее, чтобы избежать наличия возможных FISH артефактов как ложноположительных, так и ложноотрицательных, мы использовали несколько независимых подходов к выявлению аномалий хромосом: сочетание интерфазной МFISH (многоцветовой FISH) и количественной гибридизации (QFISH). Этот прием позволил определять анеуплоидию в клетках постмортального мозга, при этом стало возможным добиться высокого результата в обнаружении анеуплоидии на уровне единичных клеток. Таким образом, настоящая работа определила уровень для фоновой (спонтанной) анеуплоидии в головном мозге взрослого человека в норме, который составил около 0,3 % для хромосомы 1 и около 0,9 % для хромосом Х/Y. С помощь МFISH мы проанализировали клетки мозга пациентов с шизофренией и обнаружили повышенный уровень мозаичной анеуплоидии (более 2,5 %) для хромосом 1 (2 случая) и половых хромосом Х/У (6 случаев). Сравнивая частоту анеуплоидии в контроле и при шизофрении, мы обнаружили увеличение уровня случайной анеуплоидии примерно в 2— 3 раза у пациентов с шизофренией. Однако для сравнения уровня мозаичной анеуплоидии в мозге больных шизофренией и в контрольных образцах необходимы дополнительные крупномасштабные исследования большего числа пациентов.
Принято считать, что большая часть клеток во взрослом головном мозге сформирована из клеток предшественников нейронов и глии, образованных в основном в течение внутриутробного развития и в первые годы жизни после рождения. Анеуплоидия в клетках головного мозга также, возможно, формируется во время раннего развития центральной нервной системы. Исследование анеуплоидии в развивающемся мозге показало, что 30—35 % всех нервных клеток были анеуплоидными [15]. Более того, было обнаружено, что мозаицизм клеточных линий с участием разных хромосом (низкий уровень мозаицизма) ограничен исключительно развивающимся мозгом [15, 18]. Количество анеуплоидных клеток сокращается в 3 раза на протяжении эмбриогенеза и приближается к 10 % в нормальном мозге человека [7, 9, 18]. При этом выявленная хромосомная нестабильность в клетках эмбриона из-за «случайных» хромосомных мутаций является нормальным явлением в процессе онтогенеза. Однако некоторые нейрональные и глиальные анеуплоид-ные клетки могут сохраняться в онтогенезе и остаться во взрослом мозге. Эти данные позволяют предположить, что хромосомная нестабильность, регистрируемая в сформировавшемся мозге человека, является продуктом раннего развития и, следовательно, частично подтверждает гипотезу о связи шизофрении и нарушения развития нервной системы. Однако мы не можем полностью исключить то, что нервные клетки могут образовываться в уже сформировавшемся головном мозге, и анеуп-лоидизация является поздним явлением, связанным со старением мозга. Анеуплоидия соматических клеток может быть вызвана такими экологическими факторами, как экзогенное влияние мутагенов, вирусов, инфекций и, возможно, лекарственных препаратов. Кроме того, естественные процессы старения также могут привести к мозаичной анеуплоидии [7, 18]. Однако предположение о том, что эти экзогенные факторы участвуют в патогенезе шизофрении, по-видимому, предварительные и нуждаются в экспериментальной проверке. Таким образом, чтобы ответить на вопрос о роли генетических и экзогенных факторов в поддержании повышенного уровня мозаичной анеуплоидии в поражённом мозге, необходимы интенсивные исследования в нейрогеномике психических болезней в целом и шизофрении в частности.
Таким образом, гипотеза о возможной связи геномной нестабильности и шизофрении, предложенная нами ранее [7, 10], нашла экспериментальное подтверждение в данном исследовании. Свидетельства о повышенном уровне мозаичной анеуплоидии в поражённом мозге при шизофрении могут быть использованы в качестве основы для дальнейшего анализа роли генетической нестабильности, проявляющейся в виде анеуп-лоидии в головном мозге, при других психических заболеваниях, например, при аутизме. Можно предположить, повышенный уровень анеуплоидных нейронов в головном мозге с частотой выше, чем «случайный» фоновый уровень, может приводить к повышенной «генетической» нагрузке постзиготических CNV на нейрональный геном и негативно влиять на нормальное функционирование мозга [20—22]. Возможно, что при средней частоте спонтанной анеуплоидии около 1 % в расчете на хромосому интегральная величина низкопроцентной анеуп-лоидии в расчёте на весь геном (т. е. 23 пары хромосом) составит около 20—25 %. Следовательно, мозаичная низкоуровневая анеуплоидия может представлять собой ранее неизвестную форму патогенных мозаичных LSGA. Кроме того, высокая частота спорадических хромосомных мутаций в головном мозге больных шизофренией позволяет обоснованно предположить, что низкоуровневая мозаичная анеуплоидия, по-видимому, является отличительной чертой геномных нарушений при психической патологии. Свидетельство о геномной (хромосомной) нестабильности, проявляющейся в виде мозаичной анеуплоидии, позволяет подтвердить гипотезу о патогенной роли межклеточных геномных вариаций в поражённом мозге при шизофрении.
Исследование генетической нестабильности в постмортальных клетках головного мозга при психических заболеваниях осуществлено при финансовой поддержке Российского научного фонда (грант № 14-35-00060).
Список литературы Мозаичная анеуплоидия с вовлечением половых хромосом X и Y в клетках головного мозга в норме и при психической патологии: поиск геномных маркеров при шизофрении
- Girirajan S., Campbell C. D., Eichle E. E. Human copy number variation and complex genetic disease//Annual. Review of Genetics. -2011. -V. 45. -P. 203-226.
- Kirov G., Pocklington A. J., Holmans P., Ivanov D., Ikeda M., Ruderfer D., Moran J., Chambert K., Toncheva D., Georgieva L., Grozeva D., Fjodorova M., Wollerton R., Rees E., Nikolov I., van de Lagemaat L. N., Bayés A., Fernandez E., Olason P. I., Böttcher Y., Komiyama N. H., Collins M. O., Choudhary J., Stefansson K., Stefansson H., Grant S. G., Purcell S., Sklar P., O'Donovan M. C., Owen M. J. De novo CNV analysis implicates specific abnormalities of postsynaptic signaling complexes in the pathogenesis of schizophrenia//Molecular Psychiatry. -2012. -V. 17. -P. 142-153.
- Тиганов А. С., Юров Ю. Б., Ворсанова С. Г., Юров И. Ю. Нестабильность генома головного мозга: этиология, патогенез и новые биологические маркеры психических болезней//Вестник Российской Академии медицинских наук. -2012. -№ 9. -С. 45-53.
- Yurov Y. B., Vostrikov V. M., Vorsanova S. G., Monachov V. V., Iourov I. Y. Multicolor fluorescent in situ hybridization on post-mortem brain in schizophrenia as an approach for identification of low-level chromosomal aneuploidy in neu-ropschychiatric diseases//Brain & Development. -2001. -Vol. 23 (S1). -P. 186-190.
- Yurov Y. B., Iourov I. Y., Vorsanova S. G., Demidova I. A., Kravetz V. S., Beresheva A. K., Kolotii A. D., Monakhov V. V., Uranova N. A., Vostrikov V. M., Soloviev I. V., Liehr T. The schizophrenia brain exhibits low-level aneuploidy involving chromosome 1//Schizophrenia Research. -2008. -Vol. 98. -Is. 1-3. -P. 137-147.
- Юров И. Ю., Ворсанова С. Г., Юров Ю. Б. Хромосомные аномалии при шизофрении//Журнал неврологии и психиатрии им. С. С. Корсакова. -2006. -Т. 106, вып. 3. -С. 75-82.
- Iourov I. Y., Vorsanova S. G., Yurov Y. B. Chromosomal variation in mammalian neuronal cells: known facts and attractive hypotheses//International Review of Cytology. -2006. -V. 249. -P. 143-191.
- Юров И. Ю., Ворсанова С. Г., Юров Ю. Б. Молекулярная нейроцитогенетика: нестабильность генома в мозге при психических заболеваниях//Психиатрия. -2007. -№4 (28). -С. 36-43.
- Iourov I. Y., Vorsanova S. G., Yurov Y. B. Molecular cytogenetics and cytogenomics of brain diseases//Current Genomics. -2008. -V. 9. -P. 452-465.
- Iourov I. Y., Vorsanova S. G., Yurov Y. B. Interphase chromosomes of the human brain: the biological and clinical meaning of neural aneuploidy//Human Interphase Chromosomes (Biomedical Aspects)/Edited by Y. B. Yurov, S. G. Vorsanova, I. Y. Iourov. -Springer. New York, Heidelberg, Dordrecht, London, 2013. -P. 53-83.
- Vorsanova S. G., Yurov Y. B., Iourov I. Y. Technological solutions in human interphase cytogenetics//Human Interphase Chromosomes (Biomedical Aspects)/Edited by Y. B. Yurov, S. G. Vorsanova, I. Y. Iourov. -Springer. New York, Heidelberg, Dordrecht, London, 2013. -P. 179-203.
- Iourov I. Y., Liehr T., Vorsanova S. G., Yurov Y. B. Interphase chromosome-specific multicolor banding (ICS-MCB): a new tool for analysis of interphase chromosomes in their integrity//Biomolecular Engineering. -2007. -V. 24. -Is. 4. -P. 415-417.
- Iourov I. Y., Soloviev I. V., Vorsanova S. G., Monakhov V. V., Yurov Y. B. An approach for quantitative assessment of fluorescence in situ hybridization (FISH) signals for applied human molecular cytogenetics//Journal of Histochemistry & Cytochemistry. -2005. -V. 53 (3). -P. 401-408.
- Erickson R. P. Somatic gene mutation and human disease other than cancer: an update//Mutation Research. -2010. -V. 705. -P. 96-106.
- Yurov Y. B., Iourov I. Y., Vorsanova S. G., Liehr T., Kolotii A. D., Kutsev S. I., Pellestor F., Beresheva A. K., Demidova I. A., Kravets V. S., Monakhov V. V., Soloviev I. V. Aneuploidy and confined chromosomal mosaicism in the developing human brain//PLoS One. -2007. -V. 2. -P. e558.
- Yurov Y. B., Vorsanova S. G., Iourov I. Y., Demidova I. A., Beresheva A. K., Kravetz V. S., Monakhov V. V., Kolotii A. D., Voinova-Ulas V. Y., Gorbachevskaya N. L. Unexplained autism is frequently associated with low-level mosaic aneuploidy//Journal of Medical Genetics. -2007. -V. 44 (8). -P. 521-525.
- Mosch B., Morawski M., Mittag A., Lenz D., Tarnok A., Arendt T. Aneuploidy and DNA replication in the normal human brain and Alzheimer's disease//Journal Neuroscience. -2007. -V. 27. -P. 6859-6867.
- Iourov I. Y., Vorsanova S. G., Liehr T., Yurov Y. B. Aneuploidy in the normal, Alzheimer's disease and ataxia-telangiectasia brain: differential expression and pathological meaning//Neurobiology Disease. -2009. -V. 34. -P. 212-220.
- Iourov I. Y., Vorsanova S. G., Liehr T., Kolotii A. D., Yurov Y. B. Increased chromosome instability dramatically disrupts neural genome integrity and mediates cerebellar degeneration in the ataxia-telangiectasia brain//Human Molecular Genetics. -2009. -V. 18. -P. 2656-2669.
- Bundo M., Toyoshima M., Okada Y., Akamatsu W., Ueda J., Nemoto-Miyauchi T., Sunaga F., Toritsuka M., Ikawa D., Kakita A., Kato M., Kasai K., Kishimoto T., Nawa H., Okano H., Yoshikawa T., Kato T., Iwamoto K. Increased L1 retrotransposition in the Neuronal genome in schizophrenia//Neuron. -2014. -V. 81. -P. 306-313.
- Iourov I. Y., Vorsanova S. G., Yurov Y. B. Somatic cell genomics of brain disorders: a new opportunity to clarify genetic-environmental interactions//Cytogenetic and Genome Research. -2013. -V. 139. -P. 181-188.
- Pidsley R., Viana J., Hannon E., Spiers H. H., Troakes C., Al-Saraj S., Mechawar N., Turecki G., Schalkwyk L. C., Bray N. J., Mill J. Methylomic profiling of human brain tissue supports a neurodevelopmental origin for schizophrenia//Genome Biology. -2014. -V. 15. -P. 483.


