MUC1 антиген как иммунотерапевтическая мишень
Автор: Боженко В.К., Уразаева И.Х., Ранджит Р., Кудинова Е.А.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Обзоры
Статья в выпуске: 4 т.23, 2023 года.
Бесплатный доступ
Резюме: MUC1 является высоко гликозилированным белком. Он имеет две субъединицы, которые играют разные роли в нормальном и патологическом состоянии. В нормальных условиях N- конец служит барьером для защиты клеток от вредных экологических и бактериальных инфекций. В опухолях С-конец локализуется внутри клеток и больше вовлечен в передачу различных сигналов, которые влияют и регулируют рост опухоли, ее выживание, инвазию, миграцию и апоптоз. MUC1 - это онкоген, который провоцирует воспаление в рак, повышает устойчивость к лекарствам, способствует метастазированию опухоли и, как было показано, играет важную роль в прогрессировании рака. Основываясь на этих характеристиках, исследователи разработали различные терапевтические подходы, основанные на использовании MUC1 для лечения рака. В отличие от других органов, чрезмерная экспрессия MUC1 была обнаружена во многих типах рака, что делает его хорошим маркером для диагностики и прогноза в клиническом лечении.В области целенаправленной доставки терапевтических средств в раковые клетки исследователи разработали различные типы вакцин, направленных против чрезмерной экспрессии MUC1, которые могут быть эффективными в профилактике и лечении рака. Сообщалось также о разработке иммунотерапевтических стратегий на основе MUC1. В обзоре раскрываются структурные особенности MUC1 и его основные функции в прогрессировании рака, а также обсуждаются возможности его клинического применения, разработанные за последнее десятилетие.
Муцин 1, muc1, иммунотерапия, онкотерапия, злокачественные опухоли
Короткий адрес: https://sciup.org/149145027
IDR: 149145027
Текст научной статьи MUC1 антиген как иммунотерапевтическая мишень
Муцины (MUC) — это крупные и высоко гликозилированные белки, которые обеспечивают защиту, гидратацию и смазку эпителиальной поверхности, включая желудочнокишечный, дыхательный и репродуктивный тракты [1]. Муцины подразделяются на два типа: секретированные и трансмембранные (мембранно-связанные) муцины. Секретируемые муцины представлены гелеобразующими (MUC2, MUC5AC, MUC5B, MUC6, MUC19) и не гелеобразующими муцинами (MUC7, MUC8, MUC9 (OVGP1)). Трансмембранные муцины содержат один мембранный домен и цитоплазматический домен, они были идентифицированы как MUC1, MUC3A, MUC3B, MUC4, MUC12, MUC13, MUC14 (эндомуцин), MUC15, MUC16, MUC17, MUC20, MUC21 (эпигликанин) и MUC22 [2,3]. MUC1 был одним из самых первых обнаруженных муцинов [4]. Трансмембранный гликопротеин муцин 1, благодаря своим структурным и биохимическим свойствам, способствует формировании слизи, участвует как смазка и увлажнитель в стенках нормальных клеток, выполняет барьерную функцию и таким образом защищает от инфекций [5]. Опухоль- ассоциированный MUC1 отличается от MUC1 по экспрессии в нормальных клетках, биохимическим характеристикам, клеточному распределению и функции [6]. Однако в раковых клетках MUC1 часто подвергается аберрантному гликозилированию и сверхэкспрессии [5]. Он вовлечен в опухолевую инвазию, метастазирование, ангиогенез и апоптоз за счет участия в процессах передачи внутриклеточных сигналов и регуляции связанных биомолекул. В данном обзоре будет рассмотрено строение и функция MUC1 в нормальных и раковых клетках, а также регуляторные механизмы, отвечающие за эти функции. В настоящее время наблюдается большой прогресс в исследовании и клиническом применении MUC1 в онкотерапии [5,6].
Строение МUC1
MUC1, наиболее изученный трансмембранный муцин, имеет переменное количество высокогликозилированных 20-аминокислотных тандемных повторов (VNTR) , домен спермы белок-энтерокиназы-агарин (SEA) (внеклеточный), трансмембранный домен и 72-аминокислотный цитоплазматический хвостовой домен, выходящий на 200-500 нм за пределы клеточной поверхности (рис. 1A) [4,5]. MUC1 кодируется как единая полипептидная цепь, которая сразу после трансляции подвергается самозащитному расщеплению по мотиву GSVV (расположенному в домене SEA) на два пептидных сегмента: более длинную N-концевую субъединицу (MUC1-N) и более короткую C-концевую субъединицу (MUC1-C) (рис. 1A) [6]. Эти две субъединицы связаны стабильными водородными связями [7]. Тем не менее, в опухоль ассоциированном MUC1 было обнаружено структурное изменение в связи с потерей полярности в эпителиальных клетках, а боковые цепочки углеводов становились незавершенными и образовывали новые углеводные побочные цепи (Thomsen-Friedenreich (TF или T), Tn и Sialyl-Tn (STn)) и воздействие основного пептида (рис. 1В) [8-11].
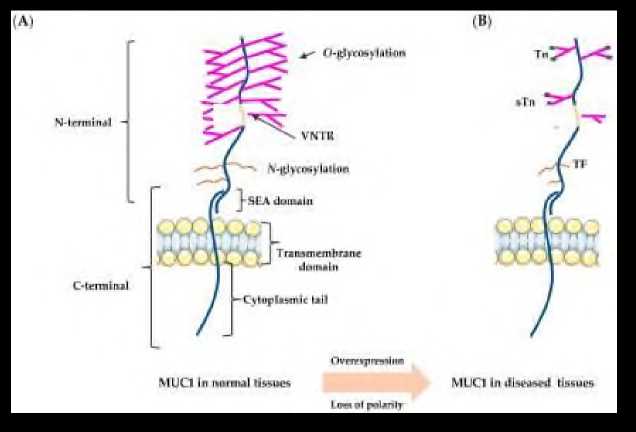
Рис. 1 . Структура MUC1 в нормальных и пораженных тканях. (А) Структура MUC1 в нормальных тканях. (B) Структура MUC1 в пораженных тканях [8].
Функция MUC1 в нормальных тканях
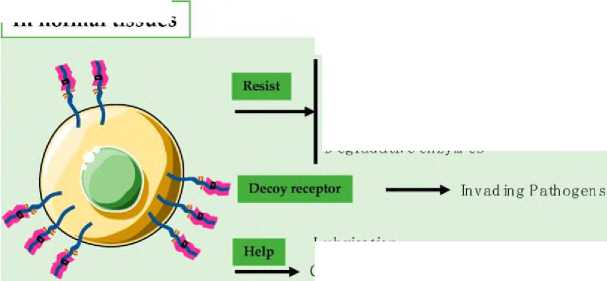
В здоровых тканях MUC1 выполняет барьерную функцию, защищая клетки, в основном благодаря своему внеклеточному домену [12]. Связанный с мембраной MUC1 действует как физический барьер через свой внеклеточный домен SEA, что позволяет ему регулировать кровоток и адгезию клеток при метастазировании; защищать апикальную клеточную мембрану эпителиальных клеток от разрыва, вредных условий и иммунной атаки; обеспечивать устойчивость к стимулам; подавлять иммунные реакции через защиту рецепторов; действовать как рецептор-приманка для вторгающихся патогенов [13]. Он также участвует в смазывании, гидратации клеточной поверхности и защите от деградирующих ферментов (рис. 2A) [14,15]. В нормальном эпителии слизистой оболочки рта MUC1, вместе с MUC5B и MUC7, оказывает антимикробное действие, постоянно смазывая и стабилизируя слизь на поверхности клеток и обеспечивая защиту от протеолиза, тем самым предотвращая дегидратацию [6]. MUC1, трансмембранный продукт расщепления белка MUC1, может помочь в размножении большого количества плюрипотентных стволовых клеток для терапевтических вмешательств [16].
Функции MUC1 при патологииВоспалительная и противовоспалительная функции
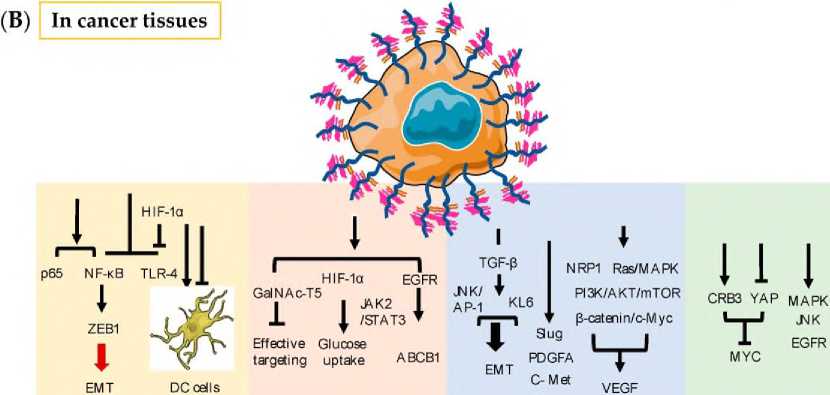
MUC1 может выполнять, как и воспалительную, так и функции в различных индуцированных инфекцией видах противовоспалительную рака, действуя как
иммуномодулирующий переключатель [9,10]. При рассеянном склерозе MUC1 играет противовоспалительную роль, ингибируя реакцию дендритных клеток, которые необходимы для возникновения воспаления (рис. 2B) [11]. MUC1 может также влиять на ответные реакции Toll-подобных рецепторов через иммуномодуляцию [12].
In normal tissues
Tm m une a Hack
H arm fu 1 en v iron m en t
Apical cell m em brane rupture
D egradative enzym es
(A)
Lubrication
C e 13 surface h уd ration
C ellshedd ing and adhesion
Or Glycosylation
Pro- or anti-inflammatory role Pharmacodynamic inhibitors
Migration and invasion of cancer cd Is promoters
Рис. 2. Различные функции MUC1 в здоровых и раковых тканях. (А) Функция MUC1 в нормальных тканях. (B) Функция и главные пути MUC1 в опухолевых тканях [12].
Фармакодинамические ингибиторы
MUC1 может привести к появлению лекарственной устойчивости во время проведения онкотерапии, так как он обычно в большом количестве выделяется в различных эпителиальных раковых клетках. Сообщалось, что чрезмерная экспрессия MUC1 ограничивает эффективность флюороурацила, снижая внутриклеточное поглощение лекарств и противоопухолевое действие препарата в опухолях поджелудочной железы. Стимулируя активацию и ядерную транслокацию EGFR, MUC1 увеличивает экспрессию АТФ-связывающего кассетного транспортера B1 (ABCB1) . MUC1-опосредованный метаболизм нуклеотидов также играет ключевую роль в резистентности к лучевой терапии при раке поджелудочной железы и может блокировать эффективное таргетирование через гликолиз [13]. В клетках гепатоцеллюлярной карциномы MUC1 может способствовать радиорезистентности, активируя этим янус-киназу-2, которая является преобразователем сигнала и активатором транскрипции-3. Кроме того, MUC1-CT проявляет онкогенную активность, воздействуя на гликозилтрансферазу GalNAc-T5, связанную с функцией опухолевого супрессора при раке поджелудочной железы [14].
MUC1 способствует миграции и распространению рака
MUC1 способствует миграции и инвазии различных видов рака; регуляторные механизмы, отвечающие за это явление избыточны и сложны. Первый механизм заключается в регуляции факторов, тесно связанных с проникновением опухолевых клеток и метастазами. Было показано, что при колоректальном раке олигосахаридная форма MUC1 определяет метастатический потенциал колоректальных раковых клеток и имеет клиникопатологическую значимость при оценке исхода и прогноза пациентов. Раковые клетки выживают в гипоксических условиях, стимулируя экспрессию проангиогенных генов в дальнейшей стимуляции ангиогенеза. Экспрессия MUC1 способствует ангиогенезу при раке и, в определенной степени, способствует миграции и инвазии опухоли. Экспрессия MUC1 и фактора роста эндотелия сосудов в раке молочной железы человека сильно коррелируют, и было показано, что экспрессия MUC1 усиливает ангиогенез в раке молочной железы человека как in vivo , так и in vitro [15].
MUC1 блокирует рост раковой клетки и апоптоза
MUC1 также участвует в регуляции различных путей роста раковых клеток и апоптоза. Трансформация и потеря полярности эпителиальных клеток рака молочной железы приводит к сверхэкспрессии MUC1, который, в свою очередь, индуцирует экспрессию Crumbs homolog-3 (CRB3) и ингибирует экспрессию “ да-ассоциированного белка” (YAP) и YAP/β-связанного белка, опосредованную Myc [8]. Чрезмерная экспрессия MUC1-C, но не MUC1-N достаточна для индуцирования трансформации и устойчивости к вызванному стрессом апоптозу [16]. MUC1 способствует росту и выживанию клеток рака поджелудочной железы, активируя путь митоген-активируемая протеинкиназа; фармакологическое ингибирование этого пути подавляет пролиферацию MUC1-экспрессирующих клеток [8].
MUC1 влияет на различные пути прогрессирования опухоли. Клетки из высокоопухолевой субпопуляции CD133+ клеток поджелудочной железы демонстрируют более высокий уровень экспрессии MUC1, что способствует их опухолевому фенотипу за счет усиления взаимодействия между MUC1-C и β-катенином, которые, в свою очередь, модулируют онкогенные сигнальные каскады [17]. В эпителиальных тканях рака яичников сверхэкспрессия опухоль-ассоциированного MUC1 способствует клеточной адгезии, передаче сигналов, миграции, пролиферации и дифференцировке раковых клеток; таким образом, повышение регуляции MUC1 в злокачественных клетках может изменять пути канцерогенеза [18].
Научные исследования трансмембранных муцинов в онкотерапии
Муцины являются перспективной мишенью для лечения раковых клеток. Благодаря своей роли в трансдукции сигнальных путей раковых клеток, трансмембранные муцины могут иметь важный потенциал в исследованиях противоопухолевой терапии. Внеклеточный домен мембранно-связанных муцинов также может быть хорошей мишенью для антителоопосредованной терапии, основанной на нейтрализующих антителах, химерных антигенных рецепторах, биспецифических активаторах Т-клеток и конъюгатах антитело-лекарство. Специфическая для рака экспрессия некоторых муциновых белков также предполагает возможность разработки противоопухолевой вакцины на основе муцинов [19]. Терапевтические препараты MUC1 находятся в стадии разработки для различных типов рака, включая как твердых опухолей, так и злокачественных патологий крови (табл. 1). Отсутствие ферментативного кармана в белке MUC1 не позволяет нацеливать на него ингибиторы на основе малых молекул, но пептидные ингибиторы и РНК-аптамеры могут быть жизнеспособными вариантами ингибиторов прямого связывания MUC1. Онкопротеин MUC1-C является внутриклеточной мишенью, на которую можно воздействовать с помощью ингибиторов клеточных проникающих пептидов, например GO-203 [20]. Цитоплазматический домен MUC1 связывает ряд ключевых онкогенных белков, и блок димеризации MUC1 может иметь антиопухолевые эффекты через различные механизмы, в зависимости от типа клетки. Так как AKT-S6K1-eIF4A является одним из основных путей, измененных MUC1, GO-203 обладает антиопухолевым потенциалом, блокируя AKT-путь в нескольких типах опухолей, таких как опухоли толстой кишки, пищевода, мочевого пузыря и молочных желез [21,22]. GO-203 также обладает хорошим потенциалом в сочетании со стандартными химиотерапевтическими препаратами в раковых клетках, устойчивых к химиотерапии, или трудноизлечимых [22]. При трижды негативном раке молочной железы GO-203 в комбинации с ингибитором поли (АДФ-рибозы)-полимеразы (PARP) проявляет противоопухолевую активность, блокируя MUC1-C-индуцированное эпигенетическое перепрограммирование и активируя ответ на повреждение ДНК [23]. В KRAS (Kirsten Rat Sarcoma Virus) мутантной аденокарциноме легких GO-203 подавляет MUC1-индуцированную транскрипцию MYC синергически в сочетании с ингибитором JQ-1 BET (Bromodomain and extra-terminal) [24]. GO-203 также показывает синергизм с леналидомидом и бортезомибом против лекарственноустойчивой множественной миеломы, регулируя TCF4/β-катенин (Фактор транскрипции 4) и механизмы ER/окислительного стресса [25]. GO-203 также оказывает противораковое действие на FLT3 (fms-like tyrosine kinase 3)-мутантный лейкоз и Т-клеточную лимфому [26]. В сочетании с иммунным микроокружением опухоли GO-203 подавляет PD-L1 и индуцирует IFN-γ в немелкоклеточном раке легкого [27].
Избирательное связывание РНК-аптамеров с внеклеточным доменом MUC1 - еще одна стратегия, позволяющая с высокой специфичностью воздействовать на MUC1-сверхэкспрессирующие раковые клетки. Были разработаны MUC1-аптамер-гибридные наночастицы для доставки противоопухолевых микроРНК в MUC1- сверхэкспрессирующие раковые клетки. Эти микроРНК-29b-загруженные гибридные наночастицы (MAFMILHNs) демонстрируют противоопухолевые эффекты в модели рака легких мышей, снижая регулирование DNMT3B (ДНК метилтрансферазы 3 beta), прямой мишени полезной нагрузки микро-РНК [28,29]. Кроме того, при двойной нагрузке, гейстин-микро-РНК-29b-биконьюгатные гибридные наночастицы (GMLHNs) показали больший эффект по сравнению с одиночной нагрузкой наночастицами в модели рака легких мыши, снижая уровни экспрессии AKT, PI3K, DNMT3B и MCL-1 (myeloid cell leukemia sequence 1) [29].
Последние достижения в области технологии антител привели к появлению различных методов лечения на основе антител, таких как ADC, BiTE (Bispecific T-Cell engager) и CAR, а также к нейтрализации терапевтических антител. BM7-PE и M-1231 являются ведущими терапевтическими препаратами ADCs MUC1 в текущих клинических испытаниях. Препарат BM7-PE, разработанный в Университетской больнице Осло (Норвегия), содержит антитела BM7 против MUC1, сопряженные с псевдотоксином A. В доклиническом исследовании BM7-PE показал антиметастатическую эффективность и повысил долгосрочную выживаемость в модели рака молочной железы голой крысы [30]. BM7-PE в настоящее время находится в фазе 1/2 клинических испытаний для метастатического колоректального рака (NCT04550897). М1231 является биспецифическим антитело-лекарственным конъюгатом, направленным на рецептор эпидермального фактора роста и MUC1; в настоящее время он находится в фазе 1 клинических испытаний для различных метастатических твердых опухолей. Pab-001 является первым в своем классе терапевтическим антителом к мишени OT-MUC1 (онко-привязанный MUC1). Высокогликозилированная область трансмембраны MUC1 подвержена расщеплению внеклеточными матричными протеазами. Расщепляемая субъединица MUC1-N высвобождается в кровь, тем самым изолируя антитела против MUC1, которые распознают домен MUC1-N. Pab-001 нацелен на внеклеточную часть расщепляемой субъединицы MUC1-C, чтобы преодолеть этот недостаток [31,32]. Pab-001-MMAE ADC показал многообещающие результаты против TNBC и других видов рака в различных доклинических исследованиях. DS-3939 — это PankoMab-GEX (gatipotuzumab) ADC [33], предназначенный для опухолевоспецифического углеводно-белкового эпитопа муцина (TA-MUC1). Биспецифические антитела с использованием PankoMab находятся в стадии разработки. PM-CD3-GEX - это BiTE, который рекрутирует антиопухолевые CD3+ T-клетки в MUC1-экспрессирующие раковые клетки. PM-IL15-GEX - это иммуноцитокин, который сочетает интерлейкин-15 с PankoMab-GEX для стимуляции анти-опухолевых NK или T-клеток. PM-PDL-GEX -трифункциональное антитело, направленное на MUC1, PD-L1 и FcγR. Ингибирование PD-L1 и активация FcγR действуют как иммуностимуляторы противоопухолевых лейкоцитов.
После замечательных достижений в борьбе с диффузной В-крупноклеточной лимфомой и множественной миеломой для химерных антигенных рецепторов (CAR) ищут новые целевые молекулы, чтобы расширить их применение на солидные опухоли. В настоящее время разрабатываются несколько CAR-терапий, направленных на антиген MUC1, поскольку MUC1 является целевым препаратом из-за его способности к аберрантной экспрессии в различных твердых опухолях. Следует отметить, что базальная экспрессия MUC1 в нормальных тканях может вызывать значительные побочные эффекты. Это привело к разработке новых стратегий анти-MUC1 CAR-терапии, которые призваны обеспечить безопасность и эффективность. О последних достижениях в этой области будет рассказано ниже.
Tn-MUC1 CAR, разработанный Tmunity Therapeutics, является ведущим методом клеточной терапии MUC1 CAR-T, который в настоящее время находится на стадии 1 клинических испытаний (NCT04025216). Из-за того, что Tn (GalNAcα1-O-Ser/Thr) является наиболее распространённой аномальной гликоформой в раковых тканях, Tn-гликоформа MUC1 (Tn-MUC1) является перспективной целью для CAR-терапии. Tn-MUC1 CAR-T показал противоопухолевую активность против Т-клеточных лимфом и опухолей поджелудочной железы [34]. MUC-1 pCAR, разработанный Leucid Bio, является параллельной платформой CAR (pCAR), которая представляет два химерных антиген-рецептора бок о бок с различными антигенсвязывающими доменами и ко-стимулирующими доменами или цитокинстимулирующими рецепторами соответственно (WO2020183158). Эта комбинация двойных рецепторов, как ожидается, даст Т-клеткам больше специфичности против MUC1-положительных опухолей и большую эффективность, чем стандартные CAR-T, которые имеют низкий потенциал против твердых опухолей. Клетки huMNC2-CAR44 T, производимые Minerva Biotechnologies Corp, укрывают scFv против расщепленной формы MUC1, присутствующей на твердых раковых клетках. huMNC2-CAR44 находится в фазе 1 клинических испытаний (NCT04020575) для рака молочной железы, яичников, поджелудочной железы и легких, которые являются MUC1-положительными типами опухоли [35,36]. Клетки NK также считаются хорошими «хозяевами» для CAR терапии. ONKT-103 является MUC1 ориентированной клеточной терапией CAR-NK, разработанной ONK Therapeutics. ONKT-103 максимизирует противоопухолевую активность, вводя DR5-TRAIL вариант сигнального пути рецептора смерти. TRAIL в клетках NK стимулирует рецепторы смерти DR5 раковых клеток и приводит к FADD-каспазе-опосредованному апоптозу. ONKT-103 в настоящее время находится на доклинической стадии и тестируется для терапии рака яичников, груди и легких [37].
Табл. 1 . Современные терапевтические препараты, нацеленные на белок MUC1 [1].
|
Название препарата |
Компан ия |
Тип лекарств а |
Направление |
Статус развития |
Идентифика торы |
Статус набора |
Дата начала испытан ия |
|
BM7-PE |
Госпита ль при Универс итете Осло |
ADC |
Метастатичес кий колоректальн ый рак |
Этап 2 |
NCT04550897 |
Рекрутинг |
31 августа 2020 г. |
|
Gatipotuzuma b (PankoMab-GEX) |
Glycotop e GmbH |
Антитела IgG1 |
Рак яичников на поздней стадии |
Этап 2 |
NCT01899599 |
Завершен |
Сентябрь 2013 |
|
M-1231 |
EMD Serono; Sutro Biophar ma |
ADC |
Метастатичес кий рак |
Этап 1 |
NCT04695847 |
Рекрутинг |
13 января 2021 года |
|
Клеточная терапия Анти-CDЗ/анти-MUC1BiTE CIK |
Benhealt h Biophar maceutic al (Shenzhe n) |
BiTE; Клеточна я терапия |
Метастатичес кий рак |
Этап 2 |
NCT03146637 |
Рекрутинг |
1 мая 2017 г. |
|
GO-203-2C |
Genus Oncolog y LLC |
Пептидны й |
R/R AML |
Этап 2 |
NCT02204085 |
Активный, без рекрутинга |
Сентябрь 2014 |
|
GO-203-2C |
Genus Oncolog y LLC |
Пептидны й |
Твердая опухль |
Этап 1 |
NCT01279603 |
Завершенн ый |
19 января 2011 года |
|
huMNC2-CAR44 T cells |
Minerva Biotechn ologies Corp. |
CAR-T |
Рак |
Этап 1 |
NCT04020575 |
Рекрутинг |
15 января 2020 г. |
|
Tn MUC-1 CAR-T |
Tmunity Therapeu tics |
CAR-T |
Рак |
Этап 1 |
NCT04025216 |
Рекрутинг |
10 октября 2019 г. |
|
Клеточнаяте рапияAnti-MUC1 CART (w or w/o) PD-1 knockout T cell |
Guangzh ou Anjie Biomedi cal Technolo gy |
CAR-T |
Метастатичес кий рак |
Этап 2/3 |
NCT03525782 |
Рекрутинг |
1 февраля 2018 г. |
Заключение
Несмотря на активное изучение роли MUC1 в связи с прогрессией рака и его полезности в качестве биомаркера, качественное и количественное обнаружение MUC1 в опухолевых клетках стало возможным только после разработки специфических детекторов. Несмотря на достигнутые успехи, детальные механизмы, с помощью которых MUC1 проявляет свою активность, остаются в значительной степени неизученными. В настоящее время разрабатываются вакцины и антитела против MUC1, и некоторые из них продемонстрировали значительный терапевтический эффект и сейчас проходят I/II фазу клинических испытаний, однако их побочные эффекты и вопросы клинической безопасности требуют дальнейшего изучения и подтверждения.
Вклад авторов. В.К. Боженко: концепция и подбор литературных источников, анализ информации, корректировка рукописи; И.Х. Уразаева: подбор литературных источников, написание текста статьи, корректировка рукописи; Р. Ранджит: подбор литературных источников, корректировка рукописи; Е.А. Кудинова: анализ представленных литературных данных, обоснование актуальности выбранной тематики, корректировка рукописи. Все авторы прочитали и согласились с версией рукописи, представленной для публикации. Все авторы ознакомились и согласились с представленным к публикации вариантом рукописи.
В.К. Боженко и И.Х. Уразаева внесли равный вклад в данное исследование.
Финансирование. Публикация подготовлена в рамках Государственного задания № 1022040800109-5-3.2.21.
Соблюдение прав пациентов и правил биоэтики. Данное обзорное исследование было основано на опубликованных работах и поэтому не требовало одобрения этического комитета.
Список литературы MUC1 антиген как иммунотерапевтическая мишень
- Lee DH, Choi S, Park Y, Jin HS. Mucin1 and Mucin16: Therapeutic Targets for Cancer Therapy. Pharmaceuticals (Basel). 2021 Oct;14(10):1053. doi: 10.3390/ph14101053.
- Bhatia R, Gautam SK, Cannon A, Thompson C, Hall BR, Aithal A, et al. Cancer-associated mucins: role in immune modulation and metastasis. Cancer Metastasis Rev. 2019 Jun;38(1-2):223-236. doi: 10.1007/s10555-018-09775-0.
- Dhanisha SS, Guruvayoorappan C, Drishya S, Abeesh P. Mucins: Structural diversity, biosynthesis, its role in pathogenesis and as possible therapeutic targets. Crit Rev Oncol Hematol. 2018 Feb;122:98-122. doi: 10.1016/j.critrevonc.2017.12.006.
- Hattrup CL, Gendler SJ. Structure and function of the cell surface (tethered) mucins. Annu Rev Physiol. 2008;70:431-457. doi: 10.1146/annurev.physiol.70.113006.100659.
- 5. Syrkina MS, Maslakova AA, Potashnikova DM, Veiko VP, Vassetzky YS, Rubtsov MA. Dual Role of the Extracellular Domain of Human Mucin MUC1 in Metastasis. J Cell Biochem. 2017 Nov;118(11):4002-4011. doi: 10.1002/jcb.26056.
- Khodabakhsh F, Merikhian P, Eisavand MR, Farahmand L. Crosstalk between MUC1 and VEGF in angiogenesis and metastasis: a review highlighting roles of the MUC1 with an emphasis on metastatic and angiogenic signaling. Cancer Cell Int. 2021 Apr;21(1):200. doi: 10.1186/s12935-021-01899-8.
- Nath S, Mukherjee P. MUC1: a multifaceted oncoprotein with a key role in cancer progression. Trends Mol Med. 2014 Jun;20(6):332-342. doi: 10.1016/j.molmed.2014.02.007.
- Chen W, Zhang Z, Zhang S, Zhu P, Ko JK, Yung KK. MUC1: Structure, Function, and Clinic Application in Epithelial Cancers. Int J Mol Sci. 2021 Jun;22(12):6567. doi: 10.3390/ijms22126567.
- Kashyap B, Kullaa AM. Regulation of mucin 1 expression and its relationship with oral diseases. Arch Oral Biol. 2020 Sep;117:104791. doi: 10.1016/j.archoralbio.2020.104791.
- Johansson ME, Sjövall H, Hansson GC. The gastrointestinal mucus system in health and disease. Nat Rev Gastroenterol Hepatol. 2013 Jun;10(6):352-361. doi: 10.1038/nrgastro.2013.35.
- Yen JH, Xu S, Park YS, Ganea D, Kim KC. Higher susceptibility to experimental autoimmune encephalomyelitis in Muc1-deficient mice is associated with increased Th1/Th17 responses. Brain Behav Immun. 2013 Mar;29:70-81. doi: 10.1016/j.bbi.2012.12.004.
- Wang YM, Qi X, Gong FC, Chen Y, Yang ZT, Mao EQ, Chen EZ. Protective and predictive role of Mucin1 in sepsis-induced ALI/ARDS. Int Immunopharmacol. 2020 Jun;83:106438. doi: 10.1016/j.intimp.2020.106438.
- Gunda V, Souchek J, Abrego J, Shukla SK, Goode GD, Vernucci E, Dasgupta A, et al. MUC1-Mediated Metabolic Alterations Regulate Response to Radiotherapy in Pancreatic Cancer. Clin Cancer Res. 2017 Oct;23(19):5881-5891. doi: 10.1158/1078-0432.CCR-17-1151.
- Caffrey T, Sagar S, Thomas D, Lewallen ME, Hollingsworth MA, Radhakrishnan P. The glycoprotein mucin-1 negatively regulates GalNAc transferase 5 expression in pancreatic cancer. FEBS Lett. 2019 Oct;593(19):2751-2761. doi: 10.1002/1873-3468.13532.
- Kitamoto S, Yokoyama S, Higashi M, Yamada N, Takao S, Yonezawa S. MUC1 enhances hypoxia-driven angiogenesis through the regulation of multiple proangiogenic factors. Oncogene. 2013 Sep;32(39):4614-4621. doi: 10.1038/onc.2012.478.
- Bouillez A, Rajabi H, Pitroda S, Jin C, Alam M, Kharbanda A, et al. Inhibition of MUC1-C Suppresses MYC Expression and Attenuates Malignant Growth in KRAS Mutant Lung Adenocarcinomas. Cancer Res. 2016 Mar;76(6):1538-1548. doi: 10.1158/0008-5472.CAN-15-1804.
- Sousa AM, Rei M, Freitas R, Ricardo S, Caffrey T, David L, et al. Effect of MUC1/β-catenin interaction on the tumorigenic capacity of pancreatic CD133+ cells. Oncol Lett. 2016 Sep;12(3):1811-1817. doi: 10.3892/ol.2016.4888.
- Deng J, Wang L, Chen H, Li L, Ma Y, Ni J, Li Y. The role of tumour-associated MUC1 in epithelial ovarian cancer metastasis and progression. Cancer Metastasis Rev. 2013 Dec;32(3-4):535-551. doi: 10.1007/s10555-013-9423-y.
- Chen W, Zhang Z, Zhang S, Zhu P, Ko JK, Yung KK. MUC1: Structure, Function, and Clinic Application in Epithelial Cancers. Int J Mol Sci. 2021 Jun;22(12):6567. doi: 10.3390/ijms22126567.
- Gendler SJ, Lancaster CA, Taylor-Papadimitriou J, Duhig T, Peat N, Burchell J, et al. Molecular cloning and expression of human tumor-associated polymorphic epithelial mucin. J Biol Chem. 1990 Sep;265(25):15286-15293.
- Gao T, Cen Q, Lei H. A review on development of MUC1-based cancer vaccine. Biomed Pharmacother. 2020 Dec;132:110888. doi: 10.1016/j.biopha.2020.110888.
- Singh R, Bandyopadhyay D. MUC1: a target molecule for cancer therapy. Cancer Biol Ther. 2007 Apr;6(4):481-486. doi: 10.4161/cbt.6.4.4201.
- van Putten JPM, Strijbis K. Transmembrane Mucins: Signaling Receptors at the Intersection of Inflammation and Cancer. J Innate Immun. 2017;9(3):281-299. doi: 10.1159/000453594.
- Marczynski M, Jiang K, Blakeley M, Srivastava V, Vilaplana F, Crouzier T, Lieleg O. Structural Alterations of Mucins Are Associated with Losses in Functionality. Biomacromolecules. 2021 Apr;22(4):1600-1613. doi: 10.1021/acs.biomac.1c00073.
- Yin L, Kufe T, Avigan D, Kufe D. Targeting MUC1-C is synergistic with bortezomib in downregulating TIGAR and inducing ROS-mediated myeloma cell death. Blood. 2014 May;123(19):2997-3006. doi: 10.1182/blood-2013-11-539395.
- Jain S, Washington A, Leaf RK, Bhargava P, Clark RA, Kupper TS, et al. Decitabine Priming Enhances Mucin 1 Inhibition Mediated Disruption of Redox Homeostasis in Cutaneous T-Cell Lymphoma. Mol Cancer Ther. 2017 Oct;16(10):2304-2314. doi: 10.1158/1535-7163.MCT-17-0060.
- Bouillez A, Adeegbe D, Jin C, Hu X, Tagde A, Alam M, et al. MUC1-C promotes the suppressive immune microenvironment in non-small cell lung cancer. Oncoimmunology. 2017 Jul;6(9):e1338998. doi: 10.1080/2162402X.2017.1338998.
- Perepelyuk M, Sacko K, Thangavel K, Shoyele SA. Evaluation of MUC1-Aptamer Functionalized Hybrid Nanoparticles for Targeted Delivery of miRNA-29b to Nonsmall Cell Lung Cancer. Mol Pharm. 2018 Mar;15(3):985-993.
- Sacko K, Thangavel K, Shoyele SA. Codelivery of Genistein and miRNA-29b to A549 Cells Using Aptamer-Hybrid Nanoparticle Bioconjugates. Nanomaterials (Basel). 2019 Jul;9(7):1052. doi: 10.3390/nano9071052.
- Engebraaten O, Sivam G, Juell S, Fodstad O. Systemic immunotoxin treatment inhibits formation of human breast cancer metastasis and tumor growth in nude rats. Int J Cancer. 2000 Dec 15;88(6):970-976. doi: 10.1002/1097-0215(20001215)88:6<970::aid-ijc21-3.0.co;2-q.
- Bouillez A, Rajabi H, Pitroda S, Jin C, Alam M, Kharbanda A, et al. Inhibition of MUC1-C Suppresses MYC Expression and Attenuates Malignant Growth in KRAS Mutant Lung Adenocarcinomas. Cancer Res. 2016 Mar;76(6):1538-1548. doi: 10.1158/0008-5472.CAN-15-1804.
- Yamamoto M, Jin C, Hata T, Yasumizu Y, Zhang Y, Hong D, et al. MUC1-C Integrates Chromatin Remodeling and PARP1 Activity in the DNA Damage Response of Triple-Negative Breast Cancer Cells. Cancer Res. 2019 Apr;79(8):2031-2041. doi: 10.1158/0008-5472.CAN-18-3259.
- Danielczyk A, Stahn R, Faulstich D, Löffler A, Märten A, Karsten U, Goletz S. PankoMab: a potent new generation anti-tumour MUC1 antibody. Cancer Immunol Immunother. 2006 Nov;55(11):1337-1347. doi: 10.1007/s00262-006-0135-9.
- Posey AD Jr, Schwab RD, Boesteanu AC, Steentoft C, Mandel U, Engels B, et al. Engineered CAR T Cells Targeting the Cancer-Associated Tn-Glycoform of the Membrane Mucin MUC1 Control Adenocarcinoma. Immunity. 2016 Jun;44(6):1444-1454. doi: 10.1016/j.immuni.2016.05.014.
- Ahmad R, Alam M, Hasegawa M, Uchida Y, Al-Obaid O, Kharbanda S, Kufe D. Targeting MUC1-C inhibits the AKT-S6K1-elF4A pathway regulating TIGAR translation in colorectal cancer. Mol Cancer. 2017 Feb;16(1):33. doi: 10.1186/s12943-017-0608-9.
- Shigeta K, HasegawaM, Kikuchi E, Yasumizu Y, Kosaka T, Mizuno R, et al. Role of the MUC1-C oncoprotein in the acquisition of cisplatin resistance by urothelial carcinoma. Cancer Sci. 2020 Oct;111(10):3639-3652. doi: 10.1111/cas.14574.
- Wu G, Maharjan S, Kim D, Kim JN, Park BK, Koh H, et al. A Novel Monoclonal Antibody Targets Mucin1 and Attenuates Growth in Pancreatic Cancer Model. Int J Mol Sci. 2018 Jul; 19(7):2004. doi: 10.3390/ijms19072004.


