Мультипотентные мезенхимные стромальные клетки, выделенные из подкожного жира млекопитающих, для изучения Sarcoptes scabiei/mange in vitro
Автор: Савченкова И.П.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Культуры клеток
Статья в выпуске: 4 т.53, 2018 года.
Бесплатный доступ
Резюме: Sarcoptes scabiei / mange - это мелкий клещ округлой формы, бледно-серого цвета, который живет в эпидерме кожи млекопитающих и вызывает чесотку. Несмотря на то, что биология клеща хорошо изучена, а его взаимодействие с хозяином интенсивно исследуется, анализ данных демонстрирует отсутствие культуры клеток, на которой клещ мог бы размножаться in vitro. Это факт сдерживает разработку современных эффективных методов диагностики заболевания и изучение иммунного ответа после заражения паразитом с перспективой создания вакцин, оценку результатов использования препаратов для клинического лечения заболевания, вызванного клещом. В связи с этим особенно актуален поиск клеточной системы, которая позволила бы поддерживать жизнеспособность Sarcoptes scabiei / mange in vitro. Мы описываем клеточные системы, представленные мультипотентными мезенхимными стромальными клетками (ММСК), которые могут быть использованы для этих целей. ММСК выделяли из подкожно-жировой ткани (ПЖТ) крупного рогатого скота (КРС) и человека...
Мультипотентные мезенхимные стромальные клетки, подкожно-жировая ткань, культура клеток, культивирование, замораживание
Короткий адрес: https://sciup.org/142216607
IDR: 142216607 | УДК: 619+616.5]:57.085.23 | DOI: 10.15389/agrobiology.2018.4.868rus
Текст научной статьи Мультипотентные мезенхимные стромальные клетки, выделенные из подкожного жира млекопитающих, для изучения Sarcoptes scabiei/mange in vitro
Чесоточный зудень (для человека Sarcoptes scabiei или S. mange для животных) — внутрикожный паразит многих млекопитающих, в том числе домашних и сельскохозяйственных животных. Sarcoptes scabiei / mange — облигатный эктопаразит, который живет и воспроизводится в эпидерме кожи хозяев (1, 2). Клещ разрушает клетки хозяина как механически, так и за счет секреции цитолитических компонентов. Эти цитолитические компоненты и полученные из клещей антигенные вещества, фекалии или яйца вызывают иммунопатогенные реакции (3). Первичный клинический признак — интенсивный зуд, позже могут появиться клеточные изменения в коже. В зависимости от иммунопатологического статуса хозяина симптомы, а также интенсивность, распространение и течение заболевания могут сильно варьировать. Чесотка распространена во всем мире и вызывает 868
значительное снижение качества жизни животных, а в некоторых случаях приводит к их гибели (4). Зудневая чесотка сельскохозяйственных животных наносит существенный экономический ущерб отрасли, особенно в свиноводстве.
Несмотря на значительный прогресс в понимании биологии клеща и его взаимодействия с хозяином, многое еще неизвестно (5, 6). Длительное время велась дискуссия о том, является ли S . scabiei одним видом или его следует разделить на несколько видов, специфичных для каждого организма-хозяина, но до сих пор нет генетических доказательств наличия нескольких видов или подвидов этого клеща.
Анализ данных литературы демонстрирует недостаток работ по изучению клеща in vitro. Слюна, ферменты и гормоны линьки, кал и азотистые субстраты, выделяемые клещом в межклеточную жидкость, которая омывает клетки эпидермиса и дермы, могут влиять на реакцию этих клеток, включая кератиноциты, фибробласты, макрофаги, тучные клетки, лимфоциты, клетки Лангерганса, дендритные клетки, а также эндотелиальные клетки. Результаты серии работ, проведенных, в частности, на мо-нонуклеарных и дендритных клетках (7, 8), кератиноцитах и фибробластах (9, 10), клетках эндотелия (11, 12), показали, что экстракт, изготовленный из тел клеща Sarcoptes scabiei , модулирует секрецию цитокинов кератиноци-тами и фибробластами человека в культуре. Так, добавление экстракта при культивировании эпидермальных кератиноцитов человека приводит к значительному усилению секреции интерлейкина-6 (IL-6) и фактора роста сосудистого эндотелия (VEGF). Кроме того, вещества, содержащиеся в этом экстракте, стимулировали увеличению секреции интерлейкинов 6 и 8, а также VEGF в культуре фибробластов кожи человека. Предпринимаются попытки для изучения влияния клеточных взаимодействий между керати-ноцитами и фибробластами, когда клетки подвергаются воздействию чесоточных клещей и их экстрактов in vitro, с использованием трехмерной модели, которая эквивалентна коже (13, 14). Результаты показывают, что клеточные взаимодействия играют важную роль в реакции хозяина на клещей.
Отсутствие культуры клеток, на которой клещ мог бы размножаться in vitro, сдерживает многие исследования, в том числе по разработке современных эффективных методов диагностики этого заболевания, изучению иммунного ответа после заражения паразитом, созданию вакцин (15-18). В настоящее время для лечения зудневой чесотки применяют акарициды (19), но это дорогие препараты, которые к тому же могут представлять опасность для окружающей среды, пищевых продуктов, дрессировщиков животных и т.д. Систематическое использование акарицидов приводит к развитию сильной устойчивости к ним у чесоточного зудня. Считается, что клещ проявляет резистентность к ряду лекарственных средств (20-24). В связи с этим особенно актуален поиск клеточной системы, которая позволила бы оценивать in vitro эффективность противочесоточных препаратов.
В своем исследовании мы впервые обнаружили факт контаминации чесоточным клещом выделенных из подкожного жира мультипотентных мезенхимных стромальных клеток (ММСК) млекопитающих и описали клеточные системы ММСК, которые могут быть использованы поддерживать жизнеспособность Sarcoptes scabiei / mange in vitro.
Цель работы — показать возможность использования мультипотент-ных мезенхимных стромальных клеток для поддержания жизнеспособности Sarcoptes scabiei / mange in vitro.
Методика. ММСК выделяли из подкожно-жировой ткани крупно- го рогатого скота (КРС) и человека. Биоптаты брали у здоровых доноров (без клинической формы чесотки) со случайно обнаруженной контаминацией клещом.
Клетки выделяли по методике, описанной нами ранее (25), и культивировали в среде DMEM с низким (1 г/л) содержанием глюкозы («ПанЭко», Россия), 10 % сыворотки крови плодов коровы (СКПК) (HyClone, «Perbio Scientific», Бельгия) и растворами (1½) заменимых аминокислот и антибиотиков («ПанЭко», Россия). Конечная концентрация стрептомицина в среде составляла 50 мкг/мл, пенициллина — 50 ЕД/мл. Среду меняли каждые 4 сут, по достижении 90 % монослоя его обрабатывали 0,25 % раствором трипсина («ПанЭко», Россия) и продолжали субкультивирование при плотности клеток 5½103/см2.
Морфологию клеток и клеща в культуре оценивали визуально с помощью инвертированного фазово-контрастного микроскопа («Carl Zeiss», Германия), используя для измерений программное обеспечение AxioVision Rel. 4.8 («Carl Zeiss», Германия).
Влияние клеща на контаминированные им ММСК оценивали по жизнеспособности клеток и скорости образования ими монослоя при субкультивировании (3 пассажа). Контролем служили соответствующие каждой группе культуры клеток, посеянные в той же плотности, но не контаминированные клещом. Жизнеспособность клеток оценивали по окрашиванию трипановым синим (0,1 % раствор, «ПанЭко», Россия).
ММСК замораживали по стандартной методике в криозащитной среде с 10 % диметилсульфоксида (DMSO), используя режим постепенного охлаждения до -70 °С со скоростью 1 °С/мин, затем ампулы переносили в жидкий азот (-196 °С) и хранили в течение 1 нед. Клетки быстро размораживали на водяной бане (37 °С) и сразу отделяли DMSO низкоскоростным центрифугированием (1000 об/мин, 5 мин). Наличие клеща в образцах, подвергшихся процедурам замораживания и оттаивания, оценивали после формирования клеточного монослоя.
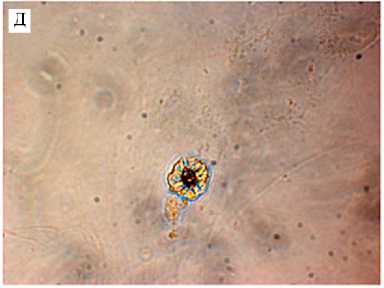
Результаты. Сразу после выделения клеток из ткани визуализировать Sarcoptes scabiei в первичной культуре сложно. Мы случайно обнаружили клещ в ММСК, выделенных из подкожно-жировой ткани (ПЖТ) КРС, после первого субкультивирования. Было отмечено, что в некоторых образцах культур клеток, выделенных из ПЖТ, наблюдается присутствие внеклеточных компонентов в виде мелких темных шарообразных структур, не характерных для ММСК (рис. 1, А), число которых со временем возрастало (см. рис. 1, Б). При более детальном рассмотрении выявили как отдельных особей (см. рис. 1, Д), так и гнезда клещей, которые они формируют в культуре (см. рис. 1, В), со скоплением клеток в этих местах.
При субкультивировании контаминированных клещом ММСК клетки в течение 3 пассажей сохраняли такую же жизнеспособность, как не контаминированные, но монослой формировали медленнее. Так, в контрольных группах ММСК КРС и человека монослой образовался на 7-е сут, а в контаминированных — на 9-10 сут.
Наиболее контаминированными клещами оказались клетки, выделенные из образцов ПЖТ КРС: всего на 2-м пассаже проанализировали 13 культур ММСК КРС, из которых контаминированными были 9, или 69 %.
Для ММСК из ПЖТ человека контаминацию клещом обнаружили только в одной культуре из 6 полученных (16 %). Выявление Sarcoptes sca-biei в культуре мультипотентных мезенхимных стромальных клеток, выделенных из подкожно-жировой ткани человека, иллюстрирует рисунок 2. Особенности, которые мы наблюдали при культивировании клеща в ММСК 870
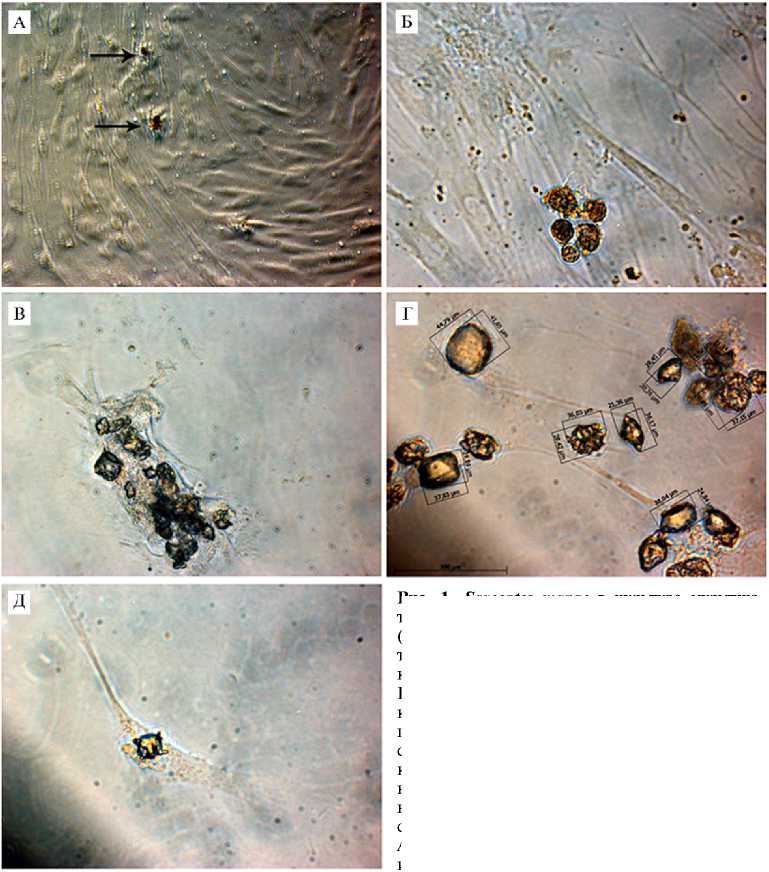
Рис. 1. Sarcoptes mange в культуре мультипо-тентных мезенхимных стромальных клеток (ММСК) , выделенных из подкожно-жировой ткани крупного рогатого скота: А — обнаружена контаминация (стрелки указывают на клеща), Б — увеличение числа особей в процессе культивирования ММСК, В — формирование гнезд в виде скоплений в культуре клеток, Г — состав гнезда, в котором визуализируются клещ на разных стадиях развития, Д — отдельная особь (предположительно нимфа) (нативные препараты, фазово-контрастная микроскопия, «Carl Zeiss», Германия, увеличение: А, В — ½200, Б, Г, Д — ½400; для измерений использовано программное обеспечение Ax-ioVision Rel. 4.8, «Carl Zeiss», Германия).
ПЖТ КРС, отмечались и в ММСК ПЖТ человека. На присутствие клеща указывали темные образования шаровидной формы, не характерные для ММСК (см. рис. 2, А), число которых со временем возрастало (см. рис. 2, Б). При культивировании наблюдали также гнезда (скопления), которые клещи формируют в культуре (см. рис. 2, В, Г). В культуральной среде были выявлены отдельные особи (см. рис. 2, Д).
При субкультивировании контаминированных клещом ММСК клетки в течение 3 пассажей сохраняли такую же жизнеспособность, как не контаминированные, но монослой формировали медленнее. Так, в контрольных группах ММСК КРС и человека монослой образовался на 7-е сут, а в контаминированных — на 9-10 сут.
Возбудитель саркоптоза (чесотки), хорошо известный в ветеринарной медицине, — это мелкие клещи округлой формы, бледно-серого цвета. Известно, что самец клеща (длина 0,23 мм, ширина 0,19 мм) меньше самки (длина 0,45 мм, ширина 0,35 мм). Яйца большие, овальные, 0,150,25 мм в длину, имеют двухслойную оболочку. В развитии клеща имеются стадии личинки и нимфы (1-3). Во всех исследуемых образцах мы не об-
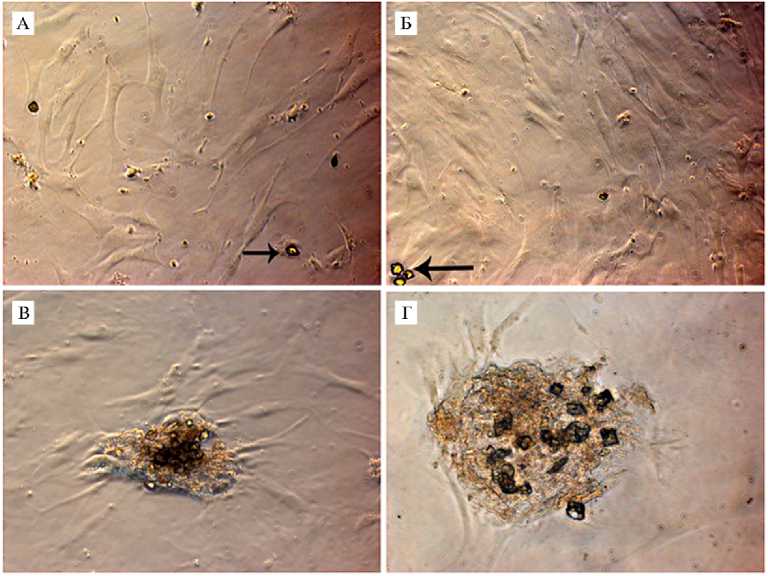
Рис. 2. Sarcoptes scabiei в культуре мультипо-тентных мезенхимных стромальных клеток ( ММСК) , выделенных из подкожно-жировой ткани человека: А — обнаружена контаминация (стрелки указывают на клеща), Б — увеличение числа особей в процессе культивирования ММСК, В, Г — формирование гнезд в виде скоплений в культуре клеток, в которых визуализируются клещи на разных стадиях развития, Д — отдельная особь, обнаруженная вне фокуса клеток (нативные препараты, фазово-контрастная микроскопия, «Carl Zeiss», Германия, увеличение: А, Б, В — ½200, Г, Д — ½400; для измерений использовано программное обеспечение AxioVision Rel. 4.8, «Carl
Zeiss», Германия).
наружили яйца и взрослых особей клеща. Можно предположить, что они не прикрепляются к клеткам, а находятся в суспензии. В культуре были выявлены предположительно личинки и нимфы клеща (см. рис. 1, Г).
Анализ данных, представленных в научной литературе ранее, демонстрирует отсутствие факта контаминации культур клеток клещами in vitro. Мультипотентные мезенхимные стромальные клетки (ММСК), выделенные из стромально-васкулизированной фракции подкожного жира млекопитающих, обладают схожими свойствами с ММСК, выделенными из костного мозга. Считается, что они проявляют иммуномодулирующие свойства и продуцирую ряд ключевых цитокинов для поддержания гематопоэза in vitro (26, 27), что, возможно, влияет на поддержание жизнеспособности клеща в культуре клеток ММСК. Интересна в этом отношении работа (28), в которой оценивали реакцию S. scabiei var. canis на жиры (смесь из 21 липида), типичные для эпидермиса кожи человека, и выявили 13 жирных кислот и их производных, привлекающих этого клеща на всех стадиях его развития. ММСК в культуре могут подвергаться спонтанной дифференцировке в направлении адипогенеза (25), что также может объяснять полученные нами данные.
Представляло интерес оценить, сохраняет ли клещ жизнеспособность после криозаморозки культуры клеток. После замораживания образцов, в которых был обнаружен клещ, и хранения в сосуде Дьюара в жидком азоте в течение 1 нед с последующим размораживанием клетки культивировали до формирования монослоя и оценивали культура на наличие Sarcoptes scabiei / mange . После размораживания клеща выявили в 7 из 7 проанализированных на 2-м пассаже культур ММСК из ПЖТ КРС и в единственной обнаруженной контаминированной клещом культуре ММСК из ПЖТ человека (100 %). Следовательно, клещ сохранял жизнеспособность во всех образцах и хорошо переносил замораживание-оттаивание.
В связи с возможностью использовать культуры ММСК, выделенных из ПЖТ человека, в клеточных технологиях специалистам следует обратить внимание на то, что, как свидетельствуют наши данные, такие культуры могут быть контаминированы подкожным клещом, который способен сохранять жизнеспособность при замораживании и оттаивании, что указывает на необходимость их обязательного тестирования на наличие Sarcoptes scabiei . Культуры, контаминированные клещом, должны выбраковываться на ранних сроках после выделения.
Таким образом, показано, что мультипотентные мезенхимные стромальные клетки млекопитающих (ММСК), выделенные нами из подкожножировой ткани (ПЖТ) крупного рогатого скота и человека, могут представлять собой перспективную клеточную систему для изучения in vitro Sar-coptes scabieis / mange . Выявление возможности контаминации ММСК из ПЖТ человека чесоточным клещом делает тестирование этих культур обязательным в случае их использования в клеточных технологиях.
Sel’skokhozyaistvennaya biologiya [ Agricultural Biology ], 2018, V. 53, ¹ 4, pp. 868-875
MULTIPOTENT MESENCHYMAL STROMAL CELLS ISOLATED FROM SUBCUTANEOUS FAT OF MAMMALS FOR THE STUDY OF Sarcoptes Scabiei/mange in vitro
I.P. Savchenkova
The author declares no conflict of interests
Научные собрания
МЕЖДУНАРОДНАЯ НАУЧНО-ПРАКТИЧЕСКАЯ КОНФЕРЕНЦИЯ «ФУНДАМЕНТАЛЬНЫЕ И ПРИКЛАДНЫЕ АСПЕКТЫ КОРМЛЕНИЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ», посвященная 100-летию со дня рождения академика А.П. Калашникова (1918-2010)
(13-16 июня 2018 года, ФНЦ животноводства — ВИЖ им. академика Л.К. Эрнста, Дубровицы)

Алексей Петрович Калашников — академик РАСХН, профессор, заслуженный деятель науки Российской Федерации, крупнейший ученый в области кормления сельскохозяйственных животных, один из разработчиков технологий силосного и протеинового питания молочного скота, интенсивного выращивания и откорма молодняка, системы выращивания телят под коровами-кормилицами. Алексея Петровича отличала высочайшая целеустремленность и умение убеждать в правоте своих взглядов, основанных на результатах научных экспериментов.
В конференции участвовали 108 ученых из России, Украины, Республики Беларусь, Узбекистана, Таджикистана, Казахстана. На пленарном заседании и во время работы секций был рассмотрен широкий круг вопросов фундаментального и прикладного характера по организации полноценного кормления сельскохозяйственных животных. На пленарном заседании участники заслушали 17 докладов, в которых выступающие отметили важность кормления и перспективы инноваций в животноводстве и зоотехнии, связанных с кормлением, состоялся обмен мнениями. Выступающие отметили заслуги академика А.П. Калашникова в зоотехнической науке. На первой секции обсуждались актуальные проблемы кормопроизводства и кормления, региональные системы кормопроизводства и кормления, инновационные технологии в животноводстве. Всего было представлено 23 доклада. Вторая секция (16 докладов) посвящалась физиолого-биохимическим аспектам полноценности кормления, селекции сельскохозяйственных животных. Рассматривалось влияние полноценных сбалансированных рационов на физиолого-биохимические показатели, здоровье и продуктивность животных, их воспроизводительную функцию. Конференция показала необходимость развития региональных адаптивных систем и технологий нормированного кормления.
Информация:
19-21 сентября 2018 года
Коммерческое предложение для участия в XIV Международной научно-практической конференции


«Балтийский форум ветеринарной медицины и продовольственной безопасности-2018»
21 сентября 2018 года на Балтветфоруме состоится празднование 210-летия высшего ветеринарного образования и основания Санкт-Петербургской государственной академии ветеринарной медицины (СПбГАВМ): 11.00 Регистрация 12.00 Торжественное заседание (актовый зал) 15.00 Праздничный вечер в панорамном ресторане«Беринг»
превратился в одно из самых важных отраслевых событий европейского уровня, из регионального семинара по ветеринарии мелких домашних животных в симпозиум, рассматривающее все аспекты ветеринарной деятельности. Балтийский форум обрёл международное признание — именно поэтому его оргкомитет стал соорганизатором XIX Всевропейского ветеринарного конгресса, который состоится в Санкт-Петербурге в 2019 году.
Последние годы демонстрируют актуальность форума как для специалистов по мелким домашним, так и сельскохозяйственным животным. Этим объясняется высокий отраслевой статус петербургской площадки, где обсуждение теории органично сочетается с её применением на практике.
В форуме 2018 года будут участвовать ведущие специалисты ветеринарной медицины России и зарубежья, руководители и сотрудники управлений ветеринарных служб из России, Белоруссии и Казахстана, а также из Дании, Финляндии и других государств Евросоюза.
МАСТЕР-КЛАССЫ ПО БОЛЕЗНЯМ МЕЛКИХ ДОМАШНИХ ЖИВОТНЫХ:
-
✓ Гастроэнтерология — Dr. Reto Neiger (Германия), Dr. Silke Salavat! (Германия)
v Нефрология — Dr. Christian Stengel (Германия), Dr. Reto Neiger (Германия)
v Онкология — Dr. Aleksandra Marcinowska (Польша), Евгений Корнющенков (Россия, Москва)
V Кардиология — Dr. Gerhard Wess (Германия), Dr. Oriol Domenech (Италия), Андрей Комолов (Россия, Москва)
V Терапия — Ирина Ерина (Россия, Санкт-Петербург), Татьяна Комарова (Россия, Москва), Елена Соловьева (Россия, Москва)
V Болезни экзотических животных — Евгения Бокова (Россия, Москва), Анастасия Высоких (Россия, Москва)
v Стоматология — Dr. Frank Verstraete (USA), Иван Макаров (Россия, Москва)
V Репродукция — Габриэла Имберт (Россия, Москва)
-
✓ Дерматология — Анатолий Албеско (Россия, Санкт-Петербург), Михаил Хотин (Россия, Санкт-Петербург), Наталья Михайлова (Россия, Санкт-Петербург)
-
✓ Профориентация — Сергей Середа (Россия, Москва)
СЕКЦИИ СЕЛЬСКОХОЗЯЙСТВЕННОГО И АГРОПРОМЫШЛЕННОГО БЛОКА:
V Аквакультура
V Птицеводство
V Овцеводство, козоводство и сыроделие
V Животноводство v Совещания и круглые столы на актуальные темы

ФОНД РАЗВИТИЯ ВЕТЕРИНАРИИ ^)
19 сентября 2018 года экспоненты и гости XIV Международной научно-практической конференции «Балтийский форум ветеринарной медицины и продовольственной безопасности» приглашаются на праздничный вечер с фуршетом в честь открытия конференции. Традиционное торжество состоится в ресторане «Беринг»: морской декор обеденного зала, панорама на Неву и легендарный крейсер «Аврора»позволят всем участникам мероприятия почувствовать себя членами дружной корабельной команды!
Список литературы Мультипотентные мезенхимные стромальные клетки, выделенные из подкожного жира млекопитающих, для изучения Sarcoptes scabiei/mange in vitro
- Chosidow O. Scabies. N. Engl. J. Med., 2006, 354: 1718-1727 ( ) DOI: 10.1056/NEJMcp052784
- Currier R.W., Walton S.F., Currie B.J. Scabies in animals and humans: history, evolutionary perspectives, and modern clinical management. Annals of the New York Academy of Sciences, 2011, 1230: E50-Е60 ( ) DOI: 10.1111/j.1749-6632.2011.06364.x
- Elwood H., Berry R.S., Gardner J.M., Shalin S.C. Superficial fibrin thrombi and other findings: a review of the histopathology of human scabietic infections. J. Cutan. Pathol., 2015, 42(5): 346-352 ( ) DOI: 10.1111/cup.12482
- Arlian L.G., Morgan M.S., Rider J.S.D. Sarcoptes scabiei: genomics to proteomics to biology. Parasit. Vectors, 2016, 9(1): 380 ( ) DOI: 10.1186/s13071-016-1663-6
- Walton S.F., Currie B.J. Problems in diagnosing scabies, a global disease in human and animal populations. Clin. Microbiol. Rev., 2007, 20(2): 268-279 ( ) DOI: 10.1128/CMR.00042-06
- Arlian L.G., Morgan M.S. A review of Sarcoptes scabiei: past, present and future. Parasit. Vectors, 2017, 10(1): 297 ( ) DOI: 10.1186/s13071-017-2234-1
- Arlian L.G., Morgan M.S., Neal J.S. Extracts of scabies mites (Sarcoptidae: Sarcoptes scabiei) modulate cytokine expression by human peripheral blood mononuclear cells and dendritic cells. J. Med. Entomol., 2004, 41(1): 69-73 ( ) DOI: 10.1603/0022-2585-41.1.69
- Singh S.K., Dimri U., Sharma B., Saxena M., Kumari P. Assessment of the cytokine profile in peripheral blood mononuclear cells of naturally Sarcoptes scabiei var. canis infested dogs. Vet. Parasitol., 2014, 206(3-4): 253-257 ( ) DOI: 10.1016/j.vetpar.2014.10.024
- Mullins J.S., Arlian L.G., Morgan M.S. Extracts of Sarcoptes scabiei de Geer downmodulate secretion of IL-8 by skin keratinocytes and fibroblasts and of GM-CSF by fibroblasts in the presence of proinflammatory cytokines. J. Med. Entomol., 2009, 46(4): 845-851 ( ) DOI: 10.1603/033.046.0415
- Arlian L.G., Morgan M.S., Neal J.S. Modulation of cytokine expression in human keratinocytes and fibroblasts by extracts of scabies mites. Am. J. Trop. Med. Hyg., 2003, 69(6): 652-656 ( ) DOI: 10.4269/ajtmh.2003.69.652
- Elder B.L., Arlian L.G., Morgan M.S. Sarcoptes scabiei (Acari: Sarcoptidae) mite extract modulates expression of cytokines and adhesion molecules by human dermal microvascular endothelial cells. J. Med. Entomol., 2006, 43(5): 910-915 ( ) DOI: 10.1093/jmedent/43.5.910
- Elder B.L., Arlian L.G., Morgan M.S. Modulation of human dermal microvascular endothelial cells by Sarcoptes scabiei in combination with proinflammatory Cytokines, histamine, and lipid-derived biologic mediators. Cytokine, 2009, 47(2): 103-111 ( ) DOI: 10.1016/j.cyto.2009.05.008
- Morgan M.S., Arlian L.G. Response of human skin equivalents to Sarcoptes scabiei. J. Med. Entomol., 2010, 47(5): 877-883 ( ) DOI: 10.1093/jmedent/47.5.877
- Morgan M.S., Arlian L.G., Markey M.P. Sarcoptes scabiei mites modulate gene expression in human skin equivalents. PLoS ONE, 2013, 8(8): e71143 ( ) DOI: 10.1371/journal.pone.0071143
- Mounsey K., Ho M.F., Kelly A., Willis C., Pasay C., Kemp D.J., McCarthy J.S., Fischer K. A tractable experimental model for study of human and animal scabies. PLoS Negl. Trop. Dis., 2010, 4(7): e756 ( ) DOI: 10.1371/journal.pntd.0000756
- Casais R., Granda V., Balseiro A., Del Cerro A., Dalton K.P., González R., Bravo P., Prieto J.M., Montoya M. Vaccination of rabbits with immunodominant antigens from Sarcoptes scabiei induced high levels of humoral responses and pro-inflammatory cytokines but confers limited protection. Parasit. Vectors, 2016, 9(1): 435 ( ) DOI: 10.1186/s13071-016-1717-9
- Casais R., Millán J., Rosell J.M., Dalton K.P., Prieto J.M. Evaluation of an ELISA using recombinant Ssλ20ΔB3 antigen for the serological diagnosis of Sarcoptes scabiei infestation in domestic and wild rabbits. Vet. Parasitol., 2015, 214(3-4): 315-321 ( ) DOI: 10.1016/j.vetpar.2015.07.011
- Bhat S.A., Mounsey K.E., Liu X., Walton S.F. Host immune responses to the itch mite, Sarcoptes scabiei, in humans. Parasit. Vectors, 2017, 10(1): 385 ( ) DOI: 10.1186/s13071-017-2320-4
- Walton S.F., Myerscough M.R., Currie B.J. Studies in vitro on the relative efficacy of current acaricides for Sarcoptes scabiei var. hominis. Trans. R. Soc. Trop. Med. Hyg., 2000, 94(1): 92-96 ( ) DOI: 10.1016/S0035-9203(00)90454-1
- Currie B.J., Harumal P., McKinnon M., Walton S.F. First documentation of in vivo and in vitro ivermectin resistance in Sarcoptes scabiei. Clinical Infectious Diseases, 2004, 39(1): e8-12 ( ) DOI: 10.1086/421776
- Mumcuoglu K.Y., Gilead L. Treatment of scabies infestations. Parasite, 2008, 15(3): 248-251 ( ) DOI: 10.1051/parasite/2008153248
- Buffet M., Dupin N. Current treatments for scabies. Fundamental & Clinical Pharmacology, 2003, 17(2): 217-225 ( ) DOI: 10.1046/j.1472-8206.2003.00173.x
- McCarthy J.S, Kemp D.J, Walton S.F, Currie B.J. Scabies: more than just an irritation. Postgraduate Medical Journal, 2004, 80(945): 382-387 ( ) DOI: 10.1136/pgmj.2003.014563
- Luo B., Liao F., Hu Y., Liu X., He Y., Wu L., Tan H., Luo L., Zhou Y., Mo Q., Dengl J., Wei Y. Acaricidal activity of extracts from Ligularia virgaurea against the Sarcoptes scabiei mite in vitro. Exp. Ther. Med., 2015, 10(1): 247-250 ( ) DOI: 10.3892/etm.2015.2503
- Волкова И.М., Викторова Е.В., Савченкова И.П., Гулюкин М.И. Характеристика мезенхимных стволовых клеток, выделенных из костного мозга и жировой ткани крупного рогатого скота. Сельскохозяйственная биология, 2012, 2: 32-38 ( ) DOI: 10.15389/agrobiology.2012.2.32rus
- Gornostaeva A., Andreeva E., Buravkova L. Factors governing the immunosuppressive effects of multipotent mesenchymal stromal cells in vitro. Cytotechnology, 2016, 68(4): 565-577 ( ) DOI: 10.1007/s10616-015-9906-5
- Andreeva E., Bobyleva P., Gornostaeva A., Buravkova L. Interaction of multipotent mesenchymal stromal and immune cells: bidirectional effects. Cytotherapy, 2017, 19(10): 1152-1166 ( ) DOI: 10.1016/j.jcyt.2017.07.001
- Arlian L.G., Vyszenski-Moher D.L. Response of Sarcoptes scabiei var. canis (Acari: Sarcoptidae) to lipids of mammalian skin. J. Med. Entomol., 1995, 32(1): 34-41 ( ) DOI: 10.1093/jmedent/32.1.34


