Мультивисцеральные тазовые резекции при раке яичников: непосредственные результаты
Автор: Лядов В.К., Москаленко А.Н., Гарипов М.Р., Невров А.С., Федоринов Д.С.
Журнал: Московский хирургический журнал @mossj
Рубрика: Онкология
Статья в выпуске: 4 (90), 2024 года.
Бесплатный доступ
Введение. В России рак яичников находится на 8 месте в структуре онкологических заболеваний среди женщин.Цель. Изучить непосредственные результаты мультивисцеральных тазовых резекций при раке яичников и оценить эффективность стандартизированного протокола кровосбережения и периоперационного ведения пациенток.Материалы и методы. С 2018 по 2024 гг. выполнено 50 мультивисцеральных резекций органов малого таза при раке яичников. Возраст составил 57,4±12,9 лет, ИМТ - 27,9±6,4 кг/м2. С целью профилактики осложнений был разработан и внедрен в практику стандартизированный протокол кровосбережения и периоперационного ведения пациенток. Наряду с анестезиологическими компонентами протокол включал в себя применение хирургических луп и отказ от «шейвинга» кишки в пользу удаления пораженных узлами карциноматоза органов единым блоком. Оценка тяжести осложнений проводилась в соответствии с классификацией Dindo-Clavien.Результаты. Средняя длительность операций составила 305±99 мин, средний объем кровопотери 242±221 мл, послеоперационная летальность - 0. Всего осложнений II-IVА ст. 42 %. Инфекции области хирургического вмешательства - 20 %. Медиана пребывания в стационаре после операции составила 10,5±9,4 суток. Единственным фактором, оказавшим значимое влияние на частоту развития тяжелых осложнений, стала сложность операции по классификации Aletti: вероятность развития осложнений после «сложных» операций была выше в 7,364 раза (95 % ДИ: 1,671 - 32,440, р=0,007). Объем кровопотери ≥250 мл стал единственным фактором, определявшим высокую вероятность развития инфекционных осложнений.Выводы. Применение стандартизированного протокола периоперационного ведения пациенток позволило достичь приемлемого показателя частоты тяжелых осложнений после обширных мультивисцеральных резекций при раке яичников.
Рак яичников, циторедуктивная хирургия, мультивисцеральная резекция
Короткий адрес: https://sciup.org/142243805
IDR: 142243805 | УДК: 616-006.67 | DOI: 10.17238/2072-3180-2024-4-106-115
Текст научной статьи Мультивисцеральные тазовые резекции при раке яичников: непосредственные результаты
В России рак яичников находится на 8 месте в структуре онкологических заболеваний среди женщин (4,1 % в 2022 г.), уступая раку эндометрия и шейки матки, однако в структуре смертности находится на 7 месте (5,6 %) и опережает другие онкогинекологические заболевания [1]. Относительные неудачи при лечении этого заболевания являются следствием поздней диагностики: в отличие от рака тела и шейки матки рак яичников выявляется на III–IV стадиях более чем у половины пациенток.
В соответствии с актуальными клиническими рекомендациями основой лечения пациенток с распространенными формами рака яичников является выполнение первичного либо интервального циторедуктивного вмешательства, направленного на полное удаление всех видимых проявлений заболевания [2]. В то же время объем циторедуктивной операции при IIIC– IVA стадии заболевания может варьировать от экстирпации матки с придатками и оментэктомией до комбинированной мультивисцеральной резекции с тотальной перитонэктомией и сложным реконструктивным этапом. Характеристики пациенток, профиль осложнений, требования к квалификации лечащей команды специалистов и уровню учреждения будут принципиально различными в вышеописанных ситуациях, однако данное расхождение находит скромное отражение в отечественных исследованиях.
Так, при изучении базы данных РИНЦ (elibrary.ru) нам удалось обнаружить серию работ Е.В. Доломановой и соавт. [3, 4], посвященную оценке непосредственных результатов крупной когорты (343 пациентки) первичных и интервальных циторедукций при раке яичников III–IVстадии, а также разработке номограммы для прогнозирования риска развития тяжелых хирургических осложнений. Несмотря на тщательный статистический анализ, авторы не приводят сведений о частоте и особенностях выполнения мультивисцеральных вмешательств в изученной когорте, хотя и включают комбинированный характер операции в число 5 факторов, определяющих повышенную вероятность развития осложнений. Особенности выполнения задней экзентерации как компонента расширенно-комбинированных операций при распространенном раке яичников изучены также в диссертационном исследовании М.Н. Секер-ской, выполненном под руководством проф. С.О. Никогосян.
В мировой литературе имеется ряд исследований из высокопоточных специализированных центров, демонстрирующих высокую частоту развития тяжелых осложнений при выполнении комбинированных циторедуктивных операций. Так, коллектив авторов из клиники Мэйо под руководством A. Kumar [5] при изучении результатов 620 первичных циторедуктивных операций при раке яичников III–IV стадии показал, что осложнения, требующие инвазивной манипуляции или коррекции органной дисфункции, развиваются у 22,3 % пациенток при показателе 30-дневной летальности 3,2 % и 90-дневной летальности 8,9 %. Специалисты онкологического центра Memorial Sloan-Kettering изучили результаты 700 циторедуктивных вмешательств и выявили осложнения, ведущие к органной дисфункции (IV степень по Dindo-Clavien), у 11,7 % пациенток [6].
Цель: представить непосредственные результаты мульти-висцеральных тазовых резекций, выполненных при раке яичников III–IV стадии, и оценить эффективность мероприятий, направленных на профилактику развития послеоперационных осложнений.
Материалы и методы.
С декабря 2018 по март 2024 гг. в отделении онкологии №4 Онкологического центра № 1 ГБУЗ «ГКБ им. С.С. Юдина ДЗМ» (ранее – ГБУЗ «Городская клиническая онкологическая больница № 1 ДЗМ») выполнено 50 мультивисцеральных резекций органов малого таза у пациенток, страдающих раком яичников. Основные клинико-эпидемиологические характеристики исследуемой группы представлены в таблице 1.
Таблица 1
Характеристика пациенток (n=50)
Patient characteristics (n=50)
Table 1
|
Результат Result |
|
|
Средний возраст, лет ± стандартное отклонение (минимальное-максимальное)/ Age, mean±standart deviation (minimummaximum) |
57,4 ± 12,9 (28–82) |
|
Средний индекс массы тела, кг/м2± стандартное отклонение (минимальное-максимальное)/ Body mass index, mean ±standart deviation (minimum-maximum), kg/m2 |
27,9± 6,4 (17,2–48,8) |
|
Сопутствующие заболевания / Сomorbidity: Гипертоническая болезнь/ Hypertension Ишемическая болезнь сердца / Ischemic heart disease Сахарный диабет/ Diabetes mellitus Ожирение/ Obesity Анемия/ Anemia |
20 (40 %) 5 (10 %) 2 (4 %) 16 (32 %) 25 (50 %) |
|
Тип циторедукции/ Type of cytoreduction: Первичная/ Primary Интервальная/ Interval Вторичная/ Secondary |
11 (22 %) 21 (42 %) 18 (36 %) |
Преобладание в изученной группе пациентов интервальных циторедуктивных операций (медиана числа курсов предоперационной химиотерапии 3, у всех пациенток применялась схема паклитаксел-карбоплатин) обусловлено особенностями маршрутизации пациенток. В отделение онкологии № 4 по решению междисциплинарного онкологического консилиума направляли пациенток, у которых по результатам предоперационной компьютерной томографии (КТ) и диагностической лапароскопии предполагалось проведение комбинированной мультивисцеральной резекции органов малого таза и/или отмечалось обширное опухолевое поражение верхнего этажа брюшной полости. Показанием к выполнению вторичной циторедукции считали олигопрогрессирование рака яичников при отсутствии асцита и длительном (> 6 мес) безрецидивном интервале.
Серозная карцинома высокой степени злокачественности выявлена у 35 (70 %) пациенток, реже показанием к операции были серозная карцинома низкой степени злокачественности – 10 (20 %), эндометриоидная – 3 (6 %) и светлоклеточная карцинома – 2 (4 %).
Для стратификации пациенток применяли балльную схему оценки сложности расширенно-комбинированных циторедуктивных вмешательств по Aletti и соавт. [7]. В соответствии с ней каждому компоненту операции присваивается 1 балл (удаление матки с или без придатков, оментэктомия, тазовая либо парааортальная лимфаденэктомия, тазовая либо абдоминальная перитонэктомия, резекция тонкой кишки), 2 балла (резекция ободочной кишки, печени, спленэктомия, диафрагмальная перитонэктомия либо резекция диафрагмы), 3 балла (резекция сигмовидной или прямой кишки с формированием анастомоза). При наличии 8 баллов и более операцию относят к высокой степени сложности, при наличии 4–7 баллов говорят о средней степени сложности циторедукции.
С целью профилактики осложнений мультивисцеральных тазовых резекций при опухолях различных первичных локализаций нами был ранее разработан и внедрен в практику отделения стандартизированный протокол кровосбережения и периоперационного ведения пациенток (протокол заседания ЛЭК ФГБОУ ДПО «РМАНПО МЗ РФ» № 14 от 12.04.22) [8]. Основой для него стали рекомендации Европейской группы по ускоренному восстановлению после хирургии ERAS для пациентов, нуждающихся в циторедуктивных операциях [9, 10]. На дооперационном этапе основное внимание обращали на тщательное информирование пациенток, отказ отдлительного предоперационного голодания и механической подготовки кишечника, медикаментозную профилактику тромбоэмболических осложнений. Антибиотикопрофилактика вместо антибиотикотерапии применялась при отсутствии осложнений опухолевого процесса и значимой кровопотери на интраоперационном этапе.
Применяли налобные хирургические лупы для прецизионной мобилизации органов и тканей, широко использовали бипо- лярную коагуляцию и предварительное лигирование крупных сосудистых стволов для снижения объема кровопотери. Стремились к удалению основного опухолевого конгломерата единым блоком без разделения спаянных структур или «шейвинга» стенки кишки. Колоректоанастомоз формировали с помощью циркулярных сшивающих аппаратов, у всех пациенток линия скрепочного шва укреплялась в области стыков с линейным швом либо по окружности анастомоза. Прочие анастомозы формировали с помощью однорядного непрерывного шва нитью ПДС 4-0. При мобилизации прямой кишки и выполнении тазовой перитонэктомии стремились по возможности сохранить мочепузырные ветви гипогастрального нервного сплетения. Полость малого таза дренировали у всех пациенток, поддиафрагмальные пространства дренировали выборочно при выполнении диафрагмальной перитонэктомии и/или спленэктомии. При выполнении резекции правого купола диафрагмы ушивали дефект непрерывным обвивным швом на активной аспирации воздуха из плевральной полости, плевральный дренаж не устанавливали ни одной из пациенток.
В послеоперационном периоде выполнялась ранняя (вечером в день операции или на следующий день) активизация пациенток. Пребывание в отделении интенсивной терапии минимизировали. Использовали комбинированную безопиатную анальгезию: продленная эпидуральная анальгезия 3–4 суток, трамадол и/или нефопам, кетопрофен, парацетамол. Показания к удалению желудочного зонда и мочевого катетера ставили индивидуально при отсутствии признаков гастростаза и положительной пробе с введением жидкости в мочевой пузырь. У пациенток, перенесших удаление брюшины, покрывающей мочевой пузырь, катетер обычно удаляли на 3–4 сутки. Рутинно определяли уровень С-реактивного белка на 2 и 4 сутки: сохранение высокого показателя или его нарастание на 4 день после операции служило основанием для выполнения контрольной КТ брюшной полости и проктографии при наличии колоректального анастомоза [11]. Оценка тяжести осложнений проводилась в соответствии с классификацией Dindo-Clavien, эффективность которой в данной группе пациенток ранее показана коллективом авторов из клиники Мэйо и Миланского онкологического центра [12].
Статистический анализ проводился с использованием программы StatTechv. 4.1.2 (разработчик – ООО «Статтех», Россия). Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95 % доверительного интервала (95 % ДИ). Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента, при распределении отличном от нормального использовали U-критерий Манна-Уитни. Построение прогностической модели вероятности определенного исхода выполнялось при помощи метода логистической регрессии. Для оценки диагностической значимости количе- ственных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена. Различия считались статистически значимыми при p < 0,05.
Результаты
Всего операции средней степени сложности по (4–7 баллов по Aletti) выполнены у 30 женщин, операции высокой сложности (8–13 баллов) у 20 пациенток (рис. 1).
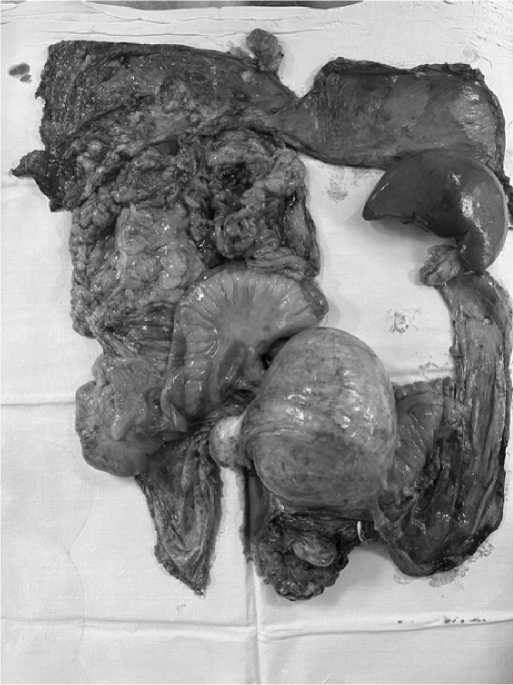
Рис. 1. Макропрепарат после интервальной циторедуктивной операции; рак яичников IIIC стадии, степень сложности операции — высокая. Передняя резекция прямой кишки с анастомозом — 3 балла, экстирпация матки с придатками, оментэктомия, тазовая и абдоминальная перитонэктомия — по 1 баллу, правосторонняя гемиколэктомия, спленэктомия, диафрагмальная перитонэктомия с резекцией правого купола диафрагмы — по 2 балла. Сумма: 13 баллов Fig. 1. Gross specimen after interval cytoreductive surgery; stage IIIC ovarian cancer, high surgery complexity. Anterior rectal resection with anastomosis — 3 points, hysterectomy, omentectomy, pelvic and abdominal peritonectomy — 1 point each, right-sided hemicolectomy, splenectomy, diaphragmatic peritonectomy with resection of the right dome of the diaphragm — 2 points each. Total: 13 points
Задняя супралеваторная экзентерация была выполнена у 31 женщины. Резекция ободочной кишки (наиболее часто выполнялась илеоцекальная резекция или правосторонняя гемиколэктомия) проведена у 17 пациенток, тонкой кишки — у 8 женщин. Всего резекция прямой кишки выполнена у 38 пациенток, в 35 случаях операцию завершали формированием колоректального анастомоза, у 3 пациенток сформирована концевая колостома. Превентивная илеостома сформирована у 4 пациенток по решению оперирующего хирурга. Обструктивный вариант операции выбирали при одномоментной реконструкции мочевыводящих путей и наличии технических трудностей в ходе операции. Также у 14 пациенток проведена диафрагмальная перитонэктомия, дополненная резекцией диафрагмы в 4 и атипичной резекцией печени в 3 случаях. Спленэктомия выполнена у 7 женщин. У 10 пациенток в рамках вторичных циторедукций проводилась резекция мочевого пузыря и/или мочеточника, также выполнены 2 нефруретерэктомии.
Основные непосредственные результаты операций представлены в таблице 2. Несмотря на отсутствие госпитальной и 30-дневной послеоперационной летальности, 2 пациентки пожилого возраста (70 и 74 года) скончались в течение 90 дней после вмешательства на фоне кровотечения из мочевыводящих путей и пневмонии, соответственно. Таким образом, показатель 90-дневной послеоперационной летальности составил 4 %.
При изучении структуры осложнений обращает на себя внимание преобладание инфекций области хирургического вмешательства, которые выявлены у 10 пациенток (20 %) (табл. 3, выделены курсивом). Всего было сформировано 59 межкишечных анастомозов, выявлено 2 случая несостоятельности (3,4 %), при этом несостоятельность колоректоанастомоза отмечена лишь у 1 из 35 пациенток (2,9 %). У единственной пациентки с несостоятельностью колоректоанастомоза была сформирована концевая сигмостома, в последующем с успехом выполнена внутрибрюшная колопластика. У одной из пациенток после илеоцекальной резекции по дренажному каналу стал формироваться кишечный свищ на фоне несостоятельности, что потребовало выполнения релапаротомии и правосторонней гемиколэктомии. У 4 пациенток, перенесших операцию с формированием превентивной илеостомы, непрерывность кишечной трубки была в дальнейшем восстановлена без осложнений.
Были изучены факторы, способные потенциально влиять на частоту развития тяжелых (степень IIIB–IV) послеоперационных осложнений, а также инфекций области хирургического вмешательства (ИОХВ), включая возраст, пол, наличие ожирения, анемии, коморбидности, осложнений опухолевого процесса, тип циторедукции, продолжительность операции >300 мин, объем кровопотери >300 мл, выполнение операции менее опытным хирургом, степень сложности операции.
Выявлена тенденция к снижению числа тяжелых осложнений в группе первичных циторедукций (0 из 11 против 12 из 39, p=0,046), однако различия шансов не были статистически значимыми (ОШ = 0,096; 95 % ДИ: 0,005–1,755). Единственным фактором, оказавшим значимое влияние на частоту развития тяжелых осложнений в рамках одно- и многофакторного анализа, стала сложность операции по Aletti (<8 баллов – 3 из 30 пациенток против 8 баллов и выше — 9 из 20 пациенток, р=0,007). Вероятность развития осложнений в группе сложных операций была выше в 7,364 раза (95 % ДИ: 1,671–32,440).
Таблица 2
Непосредственные результаты операций
Direct results of operations
Table 2
|
Результат Results |
|
|
Средняя длительность операций, минуты ± стандартное отклонение (минимальное-максимальное) / Duration of procedure, mean ± standart deviation (minimum-maximum), minutes |
305 ± 99 (120–580) |
|
Средний объем кровопотери, миллилитры ± стандартное отклонение (минималь-ное-максимальное) / Blood loss, mean ± standart deviation (minimum-maximum), milliliters |
242 ± 221 (0–1500) |
|
Послеоперационная 30-дневная летальность / Postoperative 30-day mortality |
0 |
|
Осложнения (по Клавьен-Диндо) / Complications (Clavien-Dindo) Всего / Total Степень II / Grade II Степень IIIA / Grade IIIA Степень IIIB-IVA / Grade IIIB-IVA Инфекции области хирургического вмешательства/ Surgical site infections |
21 (42 %) 9 (18 %) 5 (10 %) 7 (14 %) 10 (20 %) |
|
Медиана пребывания в стационаре после операции, сутки ± стандартное отклонение (минимальное-максимальное) / Hospital stay, mean ± standart deviation (minimum-maximum), days Операции средней сложности, n=30 / Medium complexity procedure, n=30 Операции высокой сложности, n=20 / High complexity procedure, n=20 |
10,5± 9,4 (6–43) 8 ± 5,4 (6–31) 19 ± (6–43) |
При изучении влияния тех же факторов на вероятность развития инфекционных осложнений единственным фактором, сохранявшим значимость в многофакторном анализе, был объем интраоперационной кровопотери. Пороговое значение объема кровопотери, которому соответствовало наивысшее значение индекса Юдена, составило 250 мл: развитие ИОХВ прогнозировалось при значении кровопотери выше данной величины или равном ей. Площадь под ROC-кривой составила 0,834 ± 0,083 (95% ДИ: 0,671–0,997). Полученная модель была статистически значимой (p<0,001). Чувствительность и специфичность модели составили 80,0 % и 80,0 %, соответственно, положительная прогностическая ценность 50 %, отрицательная прогностическая ценность 94,1 %.
Таблица 3
Структура послеоперационных осложнений
Structure of postoperative complications
Table 3
|
Степень/ Grade |
Вид осложнения / Complication |
Количество / Number |
|
I–II |
Гастростаз / Gastrostasis |
1 |
|
Тромбоз глубоких вен голени / Deep vein thrombosis of the leg |
1 |
|
|
Тромбоэмболия мелких ветвей легочной артерии / Thromboembolism of small branches of the pulmonary artery |
1 |
|
|
Гематома в зоне операции / Surgical site hematoma |
1 |
|
|
Мочевая инфекция / Urinary infection |
1 |
|
|
Нагноение раны / Surgical site infection |
2 |
|
|
Гипертермия без явного источника / Fever of unknown origin |
2 |
|
|
IIIA |
Несостоятельность культи прямой кишки / Rectal stump leakage |
1 |
|
Внутрибрюшной абсцесс / Intraabdominal abscess Некроз хвоста поджелудочной железы |
1 |
|
|
/ Pancreatic tail necrosis |
1 |
|
|
Гидроторакс / Hydrothorax |
1 |
|
|
Внутрибрюшное скопление жидкости / Intra-abdominal fluid collection |
1 |
|
|
IIIB |
Несостоятельность колоректоанасто-моза / Colorectal anastomosis leakage |
1 |
|
Несостоятельность илеоасцендоа-настомоза / Ileoascendoanastomosis |
1 |
|
|
leakage Внутрибрюшной абсцесс / Intra- |
1 |
|
|
abdominal abscess Поддиафрагмальный абсцесс, эмпиема |
1 |
|
|
плевры / Subphrenic abscess, pleural empyema |
1 |
|
|
Перфорация толстой кишки / Colon perforation Спаечная кишечная непроходимость / Adhesive intestinal obstruction |
1 |
|
|
IVA |
Послеоперационный делирий / Postoperative delirium |
1 |
Обсуждение
В целом ряде исследований продемонстрированы высокие показатели частоты послеоперационных осложнений и ле- тальных исходов после циторедуктивных операций по поводу рака яичников. Так, Gerestein и соавт. в 2009 г. обобщили результаты 23 исследований, опубликованных с 1983 по 2007 гг. Было показано, что средняя частота послеоперационных летальных исходов после циторедуктивных операций с резекцией участка кишки составляет 2,7 %, достигая 8,8 % при вмешательствах на верхнем этаже брюшной полости (спленэктомия) [13]. Более того, Thrall и соавт. при оценке результатов 5475 первичных циторедуктивных операций на основе популяционной базы данных SEER установили, что частота летальных исходов в течение 30 суток после операции у планово оперированных пациенток составляла 5,6 % [14]. Kumar и соавт. провели детальный анализ структуры осложнений и предикторов их развития в когорте из 620 пациенток, перенесших циторедуктивные операции при раке яичников III–IV степени. У 22,3 % пациенток развились послеоперационные осложнения, потребовавшие эндоскопического или интервенционного лечения либо приведшие к летальному исходу. Послеоперационная летальность в течение 90 суток составила 8,9 %. Была представлена номограмма для прогнозирования риска развития тяжелых осложнений, включающая возраст, ИМТ, показатель ASA, уровень альбумина, стадию и степень сложности операции [6].
Единственный обнаруженный нами в отечественной литературе детальный анализ непосредственных результатов 343 первичных и интервальных циторедуктивных операций при раке яичников III–IV стадий представлен специалистами Республиканского научно-практического центра онкологии и медицинской радиологии имени Н.Н. Александрова [3]. Средняя продолжительность операций составляла 180 мин (50–465) при среднем объеме кровопотери 641 мл (50–2500). Гемотрансфузия потребовалась 34,4 % пациенток, осложнения отмечены у 40,5 % женщин, включая 8,7 % осложнений III-V степени по Dindo-Clavien. Послеоперационная летальность составила 1,5 % через 30 дней после операции и 3,2 % через 90 суток.
В последующем этот же коллектив авторов представил номограмму на основе 5 параметров для прогнозирования развития тяжелых осложнений [4]. Наличие у пациентки 70 баллов и более по номограмме позволяло отнести ее к группе высокого риска; при этом учитывали низкий ИМТ (<21 кг м2) – 100 баллов, наличие болезней почек – 70 баллов, наличие гидроторакса – 70 баллов, комбинированный характер операции – 52 балла, уровень СА 125 до начала лечения >3000 ед/мл – 66 баллов. У пациенток в группе высокого риска вероятность развития тяжелых осложнений составляла 27,4 %, в группе низкого риска – 2,1 %. Важно отметить, что в соответствии с данной моделью комбинированный характер вмешательства вне зависимости от сложности операции при отсутствии прочих факторов риска позволял отнести пациентку в группу чрезвычайно низкого риска развития осложнений. Данное положение противоречит результатам ряда зарубежных исследований и нашей клини- ческой практике и, возможно, обусловлено недостаточным числом мультивисцеральных резекций в изученной когорте пациентов, поскольку анализ собственно хирургической составляющей в вышеописанном исследовании не приведен. Попытка разработки прогностических инструментов с учетом различного объема выполняемых комбинированных операций представляется остро актуальной задачей в циторедуктивной хирургии рака яичников, поскольку именно подобные инструменты способствуют изучению подходов к профилактике осложнений.
Насколько нам известно, Aletti и соавторы из коллектива клиники Мэйо одними из первых разработали систему оценки риска развития осложнений циторедуктивных операций при раке яичников (детали см. выше). Авторы изучили результаты лечения 219 пациенток, последовательно оперированных в 1994–1998 гг., и предложили балльную систему оценки сложности операции (SCS), позволяющую отнести вмешательство к низкой, промежуточной и высокой степени сложности. В сочетании с двумя дополнительными критериями (возраст 75 лет и старше и показатель шкалы ASA 3–4) данная шкала позволяла прогнозировать развитие тяжелых послеоперационных осложнений в диапазоне от 2,5 % (ASA 1–2, возраст моложе 75 лет, низкая степень сложности) до 67,6 % (ASA 3–4, возраст 75 лет и старше, высокая степень сложности) [16]. В дальнейшем высокая прогностическая ценность данной шкалы была валидирована на когорте из 564 пациенток трех крупнейших медицинских центров США (клиники Мэйо, центр Memorial Sloan-Kettering, университет Johns Hopkins), при этом была дополнительно установлена важность низкого уровня альбумина (<35 г/л) как предиктора развития тяжелых осложнений [16].
Еще одна интересная попытка разработать шкалу для прогнозирования вероятности развития осложнений, сопровождающихся органной дисфункцией или ведущих к смерти (IV–V степень тяжести по Dindo-Clavien), представлена Cham и соавт. [17]. Исследователи на основе анализа результатов 7029 циторедуктивных операций (частота осложнений IV степени 5,8 %, 30-дневная летальность 0,9 %) установили, что наиболее неблагоприятными факторами являются выполнение расширенно-комбинированных операций, возраст старше 80 лет, наличие расстройств гемостаза, класс ASA 4.
Учитывая приближенность шкалы SCS к клинической практике, ее удобство и адаптированность к условиям плановой онкохирургии, нами было принято решение использовать этот индекс в нашем исследовании. Несмотря на небольшой размер выборки, при многофакторном анализе именно высокая сложность операции по шкале SCS оказалась независимым предиктором развития тяжелых послеоперационных осложнений. Существенное значение имеет и профилактика интраоперационной кровопотери: в нашем исследовании объем кровопотери 250 мл и выше оказался предиктором развития инфекционных хирургических осложнений, что в целом соответствует данным из различных областей хирургической онкологии [18, 19]. В целом, мы считаем, что разработка и применение прогностических шкал для оценки риска развития тяжелых осложнений является важным компонентом при разработке стратегии лечения пациенток с распространенными формами рака яичников.
Заключение
Применение стандартизированного протокола кровосбе-режения и периоперационного ведения пациенток с распространенными формами рака яичников позволило нам достичь приемлемого показателя частоты тяжелых послеоперационных осложнений при выполнении обширных мультивисцераль-ных резекций. Мы считаем, что использование современных прогностических инструментов в этой категории пациенток позволит обеспечить более эффективный отбор и подготовку больных для расширенно-комбинированных вмешательств.
Список литературы Мультивисцеральные тазовые резекции при раке яичников: непосредственные результаты
- Состояние онкологической помощи населению России в 2022 году. Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2022. 275 с.
- Тюляндина А.С., Коломиец Л.А., Морхов К.Ю., Нечушкина В.М., Покатаев И.А., Румянцев А.А. и соавт. Практические рекомендации по лекарственному лечению рака яичников, первичного рака брюшины и рака маточных труб. Практические рекомендации RUSSCO, часть 1. Злокачественные опухоли, 2023. № 3. С. 201-215.
- Доломанова Е. В., Мавричев С. А., Мириленко Л. В. Анализ результатов комплексного лечения пациенток, страдающих раком яичников III-IV стадий с использованием первичной и интервальной циторедукции. Онкологический журнал, 2020. 14. № 4 (56). С. 41-48.
- Доломанова Е.В., Мириленко Л.В., Мавричев С.А. Факторы прогноза непосредственных и отдаленных результатов лечения пациенток, страдающих раком яичников IIIС-IV стадий. Репродуктивное здоровье. Восточная Европа, 2021. Том 11. № 2. С. 185-197.
- Kumar A., Janco J.M., Mariani A., Bakkum-Gamez J.N., Langstraat C.L., Weaver A.L., McGree M.E., Cliby W.A. Risk-prediction model of severe postoperative complications after primary debulking surgery for advanced ovarian cancer. Gynecol Oncol., 2016, № 140 (1), рр. 15-21. https://doi.org/10.1016/j.ygyno.2015.10.025
- Straubhar A.M., Wolf J.L., Zhou Q.C. и др. Advanced ovarian cancer and cytoreductive surgery: independent validation of a risk-calculator for perioperative adverse events. Gynecologic oncology, 2021, № 160 (2), рр. 438-444. https://doi.org/10.1016/j.ygyno.2020.11.021
- Aletti G.D., Podratz K.C., Moriarty J.P., Cliby W.A., Long K.H. Aggressive and complex surgery for advanced ovarian cancer: an economic analysis. Gynecologic oncology, 2009, № 112 (1), рр. 16-21. https://doi.org/10.1016/j.ygyno.2008.10.008
- Гарипов М.Р., Москаленко А.Н., Черепанова Е.В., Аюпов Р.Т., Феоктистов Д.В., Тарасов Н.А., Лядов В.К., Галкин В.Н. Протоколы ускоренного выздоровления при расширенно-комбинированных операциях на органах малого таза. Хирургия. Журнал им. Н.И. Пирогова, 2022. № 12 (2). С. 59-65.
- Hübner M., Kusamura S., Villeneuve L., Al-Niaimi A., Alyami M., Balonov K., Bell J., Bristow R., Guiral D.C., Fagotti A., Falcão L.F.R., Glehen O., Lambert L., Mack L, Muenster T, Piso P, Pocard M, Rau B, Sgarbura O, Somashekhar S.P., Wadhwa A., Altman A., Fawcett W., Veerapong J., Nelson G. Guidelines for Perioperative Care in Cytoreductive Surgery (CRS) with or without hyperthermic IntraPEritoneal chemotherapy (HIPEC): Enhanced recovery after surgery (ERAS®) Society Recommendations- Part I: Preoperative and intraoperative management. European Journal of Surgical Oncology,2020, № 46 (12), рр. 2292-2310. https://doi.org/10.1016/j.ejso.2020.07.041
- Hübner M., Kusamura S., Villeneuve L., Al-Niaimi A., Alyami M., Balonov K., Bell J., Bristow R., Guiral D.C., Fagotti A., Falcão L.F.R., Glehen O., Lambert L., Mack L., Muenster T., Piso P., Pocard M., Rau B., Sgarbura O., Somashekhar S.P., Wadhwa A., Altman A., Fawcett W., Veerapong J., Nelson G. Guidelines for Perioperative Care in Cytoreductive Surgery (CRS) with or without hyperthermic IntraPEritoneal chemotherapy (HIPEC): Enhanced recovery after surgery (ERAS®) Society Recommendations- Part II: Postoperative management and special considerations. European Journal of Surgical Oncology, 2020, № 46 (12), рр. 2292-2310. https://doi.org/10.1016/j.ejso.2020.08.006
- Лядов В.К., Гарипов М.Р., Полушкин В.Г. С-реактивный белок как ранний маркер несостоятельности швов толстокишечного анастомоза после резекции толстой кишки по поводу рака. Систематический обзор и метаанализ. Хирургия. Журнал им. Н.И. Пирогова, 2020. № 8. С. 82-87.
- Mohammad A., Ainio C., Narasimhulu D.M., McGree M., Weaver A.L., Kumar A., Garbi A., Mariani A., Aletti G., Multinu F., Langstraat C., Cliby W. Comparison of the Contracted Accordion, Expanded Accordion, and Clavien-Dindo complication grading scales after ovarian cancer cytoreduction. International Journal of Gynecologic Cancer, 2023, № 33 (5). https://doi.org/10.1136/ijgc-2022-003962
- Gerestein C.G., Damhuis R.A., Burger C.W., Kooi G.S. Postoperative mortality after primary cytoreductive surgery for advanced stage epithelial ovarian cancer: a systematic review. Gynecologic oncology, 2009. № 114 (3), рр. 523-527. https://doi.org/10.1016/j.ygyno.2009.03.011
- Thrall M.M., Goff B.A., Symons R.G., Flum D.R., Gray H.J. Thirtyday mortality after primary cytoreductive surgery for advanced ovarian cancer in the elderly. Obstetrics & Gynecology, 2011, № 118 (3), рр. 537-547. https://doi.org/10.1097/AOG.0b013e31822a6d56
- Aletti G.D., Dowdy S.C., Podratz K.C., Cliby W.A. Relationship among surgical complexity, short-term morbidity, and overall survival in primary surgery for advanced ovarian cancer. American journal of obstetrics and gynecology, № 197 (6), рр. 676. https://doi.org/10.1016/j.ajog.2007.10.495
- Aletti G.D, Santillan A., Eisenhauer E.L., Hu J., Aletti G., Podratz K.C., Bristow R.E., Chi D.S., Cliby W.A. A new frontier for quality of care in gynecologic oncology surgery: multi-institutional assessment of short-term outcomes for ovarian cancer using a risk-adjusted model. Gynecologic oncology, 2007, № 107 (1), рр. 99-106. https://doi.org/10.1016/j.ygyno.2007.05.032
- Cham S., Chen L., St Clair C.M., Hou J.Y., Tergas A.I., Melamed A., Ananth C.V., Neugut A.I., Hershman D.L., Wright J.D. Development and validation of a risk-calculator for adverse perioperative outcomes for women with ovarian cancer. American journal of obstetrics and gynecology, № 220 (6), рр. 571. https://doi.org/10.1016/j.ajog.2019.02.019
- Kabir T., Syn N.L., Tan Z.Z.X., Tan H.J., Yen C., Koh Y.X., Kam J.H., Teo J.Y., Lee S.Y., Cheow P.C., Chow P.K.H., Chung A.Y.F., Ooi L.L., Chan C.Y., Goh B.K.P. Predictors of post-operative complications after surgical resection of hepatocellular carcinoma and their prognostic effects on outcome and survival: a propensity-score matched and structural equation modelling study. European Journal of Surgical Oncology, 2020, № 46 (9), рр. 1756-1765. https://doi.org/10.1016/j.ejso.2020.03.219
- Aeschbacher P., Nguyen T.L., Dorn P., Kocher G.J., Lutz J.A. Surgical site infections are associated with higher blood loss and open access in general thoracic practice. Frontiers in Surgery, 2021, № 8. https://doi.org/10.3389/fsurg.2021.656249


