Мультиволновой осветитель для микрофотометрических исследований одиночных клеток
Автор: Хохлов А.А., Шугайло В.В., Кононенко Владимир, Колесников С.С.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборы и устройства
Статья в выпуске: 2 т.23, 2013 года.
Бесплатный доступ
Разработана конструкторская документация и построен опытный образец мультиволнового осветителя, использование которого обеспечивает более высокую чувствительность и точность при микрофотометрических исследованиях одиночных клеток по сравнению с современными промышленными аналогами. Относительное улучшение характеристик разработанного осветителя было достигнуто за счет использования излучающих полупроводниковых диодов в качестве источников, что позволило существенно снизить уровень фонового излучения и девиации интенсивности возбуждающего света по сравнению с ламповыми источниками. Управление длиной волны излучения осветителя — аналоговое, управление зажиганием диодов — по TTL-порту. Программа управления на компьютере через USB-порт позволяет пользователю устанавливать требуемые величины токов излучающих диодов и параметры портов осветителя, а также обеспечивает сохранение всех установок в файл.
Микрофотометрия, осветитель, одиночные клетки, сверхъяркий светодиод, микроконтроллер
Короткий адрес: https://sciup.org/14264850
IDR: 14264850 | УДК: 577.352.42
Текст научной статьи Мультиволновой осветитель для микрофотометрических исследований одиночных клеток
Появление разнообразных флуоресцентных зондов, включая генетически кодируемые сенсоры на основе флуоресцентных белков, сделало флуоресцентную микроскопию и микрофотометрию одними из основных методов исследования метаболических, регуляторных и сигнальных процессов, протекающих в одиночных клетках и клеточных системах. Для возбуждения флуоресценции в нужном диапазоне длин волн применяются осветители нескольких типов. В частности, используются ксеноновые и ртутные лампы высокого давления в сочетании с монохроматорами или оптическими фильтрами, также применяются лазерные источники света. Эти осветительные системы имеют свои достоинства и недостатки. Так, светосильные монохроматоры на дифракционных решетках обеспечивают возбуждение на произвольных длинах волн в широком спектральном диапазоне, однако фоновый свет в таких монохроматорах может достигать 0.05 % потока возбуждающего света в силу неидеальности решеток и осветительной оптики, что ограничивает чувствительность флуоресцентных методов [1]. Для ламповых источников света, которые покрывают весь спектральный диапазон от видимой до ультрафиолетовой областей, также характерен высокий уровень собственных шумов, связанных с физикой плазмы разряда. Лазеры, являясь источниками монохроматического света практически неограниченной яр- кости, имеют ограниченный спектр длин волн. Кроме того, лампы и лазеры непрерывного излучения плохо управляемы по световой мощности и во времени.
Появление в последние годы мощных излучающих диодов (light emitting diode, LED) инициировало развитие еще одного направления в области осветительных систем, поскольку ряд свойств этих полупроводниковых приборов делают их очень привлекательными для использования в качестве источников возбуждающего света для флуоресцентных приложений. Во-первых, для них характерны достаточно высокая светимость и приемлемая монохроматичность. Так, в краснозеленой области спектра спектральная плотность излучения мощных LED (до 1 Вт) сопоставима с таковой ксеноновых ламп мощностью 100 Вт и превосходит последнюю в сине-фиолетовой и ультрафиолетовой областях. В настоящий момент выпускаются серийно LED с максимумом излучения на длинах волн в диапазоне 210–1000 нм и полушириной спектра 10–15 нм. Это покрывает нужды большинства микроскопических и микро-фотометрических задач в биологии. Во-вторых, время установления свечения LED лежит в микро-секундном диапазоне времен, что делает их практически безынерционными для подавляющего большинства приложений. Благодаря сочетанию у LED высокой мощности и пренебрежимо малой инерционности легко находится компромиссное решение для достижения оптимального соотноше- ния сигнал / шум при минимальной фотодеструкции флуорофоров: для этого достаточно возбуждать эмиссию интенсивным светом в импульсном режиме при большой скважности. В-третьих, LED легко сопрягается со световодами для доставки излучения в требуемую область пространства. В-четвертых, стоимость LED, исключая ультрафиолетовые LED (210–350 нм), существенно меньше, чем таковая специализированных осветительных ламп и, тем более, лазеров. При этом производители гарантируют время жизни при непрерывном излучении более 3000–5000 ч для ультрафиолетовых LED и до 60 000 ч для LED, работающих в видимом диапазоне. Для ксеноновых и ртутных ламп эта величина варьирует в пределах 400–800 ч. Таким образом, осветители на LED для биологических исследований могут обеспечить наилучшее соотношение цена / качество при весьма гибком управлении интенсивностью и временем излучения по сравнению с осветителями, использующими лампы и лазеры в качестве источников света.
За рубежом интерес к использованию LED в осветителях для флуоресцентных приложений постоянно увеличивался: вслед за Cairn Research Ltd. (Великобритания) [2], выпускающей свои осветители около пяти лет, за последние 2–3 года целый ряд фирм-производителей, таких как Rapp OptoElectronic (Германия) [3], Carl Zeiss (Германия) [4], Brain Vision Co (Япония) [5], представили свои аналогичные изделия. В России такие осветители не производятся.
Авторами статьи в Институте биофизики клетки РАН была выполнена разработка осветителя на LED, который позволял проводить клеточные исследования с использованием различных флуорес- центных зондов. Построенный лабораторный образец осветителя обеспечивал излучение в дискретном диапазоне на длинах волн 340, 380, 440, 480 и 530 нм (интенсивность и время излучения на каждой из них индивидуально контролировались с помощью компьютера [6, 7]) и позволял работать с программами для регистрации флуоресценции WB6.01 (IDEC, USA) и FeliX 1.41 (PTI, USA). Его испытания и последующее практическое использование для решения ряда биологических задач подтвердили обоснованность исходных посылок, а уникальные характеристики осветителя позволили Лаборатории молекулярной физиологии клетки РАН получить научные результаты мирового уровня, в том числе зарегистрировать стимул-зависимый выброс афферентного нейротрансмиттера АТР из одиночной вкусовой клетки мыши [8], изучить зависимость секреции АТР от мембранного потенциала [9], исследовать ответы одиночных вкусовых клеток на различные агонисты [10]. Тем не менее в процессе эксплуатации лабораторного образца был выявлен ряд конструкторских недостатков в оптической и электронной частях и в программном обеспечении управления осветителя. В частности, у лабораторного образца свет разных длин волн поступал через индивидуальные оптические волокна и смешивался в общем жгуте, что приводило к снижению плотности излучения в объективе. Поэтому при разработке данного муль-тиволнового осветителя решалась задача создания компактной, доступной по стоимости системы на основе использования принципиально другой оптической схемы с возможностями удобной настройки в процессе эксперимента c помощью программы управления.
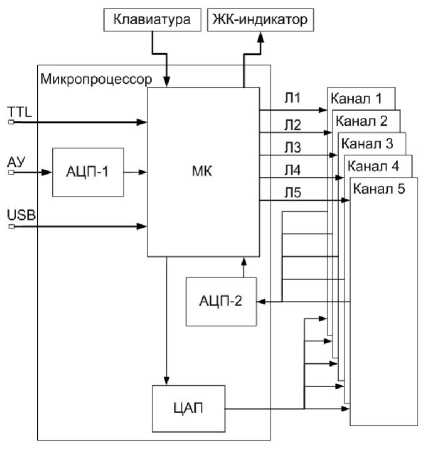
Рис.1 . Схема управления универсальным мульти-волновым осветителем.
Обозначения: МК — микроконтроллер; АЦП-1 и АЦП-2 — аналогово-цифровые преобразователи; ЦАП — цифро-аналоговый преобразователь; Л1–Л5 — линии микроконтроллера; "Канал1"– "Канал5" — оптические блоки с LED, излучающими на длинах волн 340, 380, 440, 480, 530 нм соответственно; "Клавиатура" — виртуальная клавиатура для управления осветителем в автономном режиме; ЖК-индикатор — жидкокристаллическая панель для отображения информации о работе осветителя; ТТL — входной ТТЛ-порт управления осветителем; АУ — входной порт аналогового управления длиной волны излучения осветителя; USB — универсальная последовательная шина обмена данными между персональным компьютером и осветителем
КРАТКОЕ ОПИСАНИЕ УЗЛОВ РАЗРАБОТАННОГО ОСВЕТИТЕЛЯ
Мультиволновой осветитель состоит из оптического блока с LED, схемы управления, стабилизированного блока питания. Все узлы прибора расположены в едином корпусе, связанном с микроскопом оптоволоконным жгутом. Фиксация выходного торца жгута осветителя на эпифлуорес-центном порту микроскопа выполняется адаптером, благодаря которому достигается согласованное взаимное положение люков и окон осветителя и микроскопа, что обеспечивает максимальную и равномерную освещенность поля.
СХЕМА УПРАВЛЕНИЯ ОСВЕТИТЕЛЕМ
Построение схемы управления универсального осветителя на основе современных микропроцессорных контроллеров позволило организовать эффективное управление параметрами излучения от персонального компьютера и не повысило существенно стоимость осветителя. Схема управления универсальным мультиволновым осветителем представлена на рис. 1. Ядром системы является микропроцессорный контроллер МК ATxmega256A3, который выполняет все операции по обработке поступающих на входные порты данных и осуществляет управление каналами 1–5 осветителя.
Микропроцессор содержит два аналоговоцифровых преобразователя (АЦП-1, -2) и цифроаналоговый преобразователь (ЦАП). АЦП-1 оцифровывает поступающий внешний управляющий аналоговый сигнал АУ, задающий длину волны возбуждения. В зависимости от величины этого сигнала микропроцессор выбирает одну из пяти линий Л1–Л5, обеспечивающих включение каналов 1–5 осветителя. Выбранный канал будет включен в течение времени действия сигнала TTL.
Каналы 1–5 управления светодиодами выполнены по идентичным электрическим схемам и представляют собой управляемые напряжением источники тока на ОУ типа AD8534AR и транзисторах КТ829. Установка требуемой величины тока LED (в пределах от нуля до величины рабочего значения) осуществляется по команде компьютера. Эта команда через USB-порт поступает в микропроцессор, обрабатывается там и через ЦАП задает величину рабочего тока LED. Напряжение, пропорциональное току светодиода, измеряется АЦП-2 и отображается на ЖК-индикаторе, расположенном на передней панели осветителя. При работе осветителя в автономном (без компьютера) режиме при помощи клавиатуры можно изменить любые настройки осветителя, в частности, установить величины токов каналов и включить любой из них, при этом ЖК-индикатор отображает ток канала и его номер.
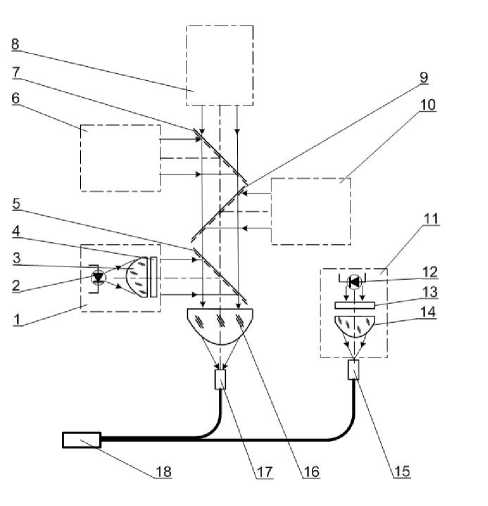
Рис. 2. Схема оптического блока мультиволнового осветителя.
Обозначения: 1 — оптический канал 380 нм; 2 — излучающий диод; 3 — линза; 4 — фильтр; 5 — дихроическое зеркало; 6 — оптический канал 480 нм; 7 — дихроическое зеркало; 8 — оптический канал 530 нм; 9 — дихроическое зеркало; 10 — оптический канал 440 нм; 11 — оптический канал 340 нм; 12 — излучающий диод 340 нм; 13 — фильтр; 14 — линза; 15 — входной торец жгута канала 340 нм; 16 — коллектор;17 — входной торец жгута каналов 380–530 нм; 18 — выходной торец жгута
ОПТИЧЕСКИЙ БЛОК ОСВЕТИТЕЛЯ
Оптический узел предназначен для сложения излучения LED всех длин волн, сопряжения их с оптоволоконным жгутом для передачи суммарного излучения в эпифлуоресцентный порт микроскопа. Устройство и принцип работы оптического узла иллюстрирует рис. 2. Он состоит из четырех идентичных каналов 1, 6, 8, 10 с длинами волн 380, 480, 530, 440 нм соответственно и отдельного канала 11 для излучения 340 нм. Каждый из четырех идентичных каналов (см. 1) включает LED соответствующей длины волны излучения, установленный на теплоотводе, линзу, проецирующую светящуюся площадку LED на бесконечность, фильтр для коррекции спектральной характеристики LED. Сложение параллельных пучков от четырех каналов производится дихроическими зеркалами 5, 7 и 9, покрытие которых способно отражать более 95 % излучения коротковолновой (синей) области и обеспечивает при этом пропускание около 95 % проходящего света в длинноволновой области спектра (красной). Таким образом, зеркало с длиной волны λ50% ≥ λLED, установленное напротив канала с диодом с λLED, практически полностью отражает излучение этого диода во входной зрачок коллектора 16. Расположение каналов и зеркал последовательно по увеличению длин волн λLED и λ50% позволяет сложить потоки излучения всех диодов на апертуре коллектора.
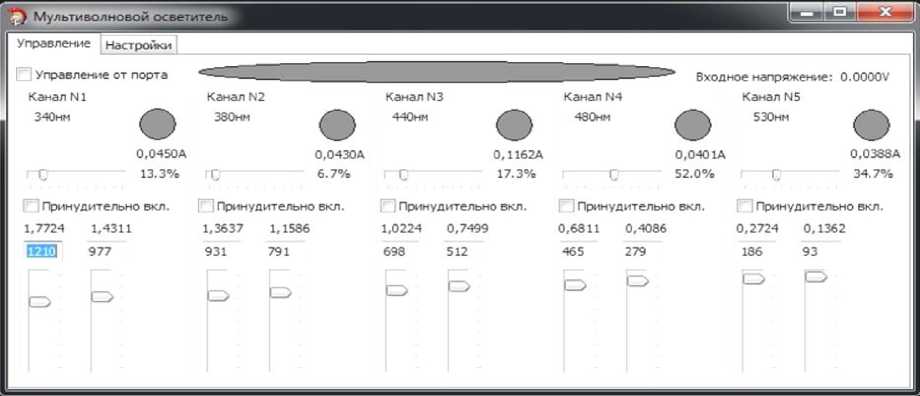
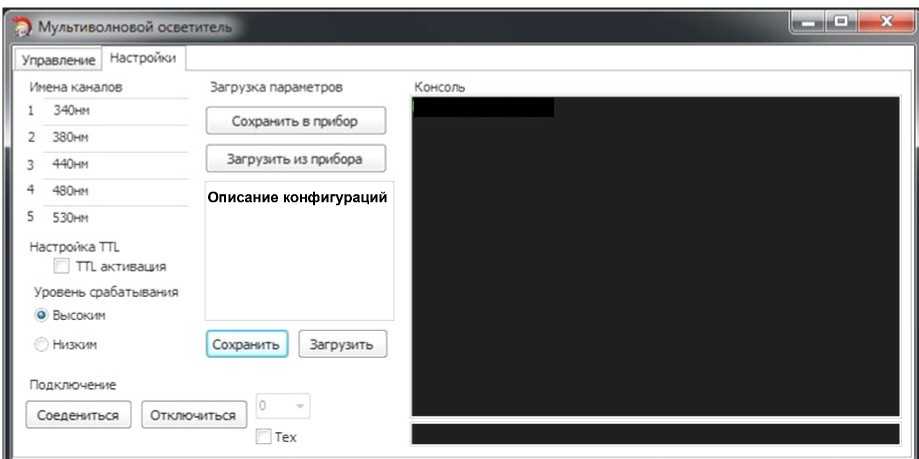
Рис. 3. Внешний вид окна программы управления осветителем. а — вкладка "Управление"; б — вкладка "Настройки"
Излучение канала 8 с длиной волны 530 нм направляется сквозь все дихроические зеркала прямо на коллектор 16. Коллектор 16 строит изображение светящихся площадок диодов на торце 17 первой ветви жгута, при этом апертура пучка после коллектора равна входной апертуре жгута. Канал 11 на 340 нм с помощью линзы 14 проецирует излучение УФ LED 12 во входной торец 15 второй ветви жгута. Обе ветви жгута конвергированы в единый жгут так, чтобы волокна, передающие излучение 340 нм, располагались в выходном торце 18 в центре, а остальные — вокруг, по периметру. Это позволяет, несмотря на малую мощность LED в канале 340 нм, получить на препарате высокую плотность УФ излучения, достаточную для уверенной регистрации эмиссии. Фильтры 4 и 13 устанавливаются при необходимости коррекции спектральных характеристик LED.
В оптическом блоке применены следующие LED (длина волны максимума (нм) / мощность излучения (мВт)): LZ1-00G400F (530 / 375), LZ1-00B700H (475 / 650), LZ1-00B200F (445 / 900) производства Ledengin [11]; NSHU591A (375 / 4.5) — Nichia [12]; UVTOP335TO39BL (340 / 0.5) — SETi [13]. Линзы УФ-каналов (340 и 380 нм), коллектор и оптоволоконный жгут выполнены из кварца (производство ООО "Полироник", г. Москва).
ПРОГРАММА УПРАВЛЕНИЯ ОСВЕТИТЕЛЕМ
Программа управления осветителем запускается на персональном компьютере (ОС WinXP, Win7), связь с осветителем обеспечивается по USB-кабелю (USB 2.0). При помощи графического интерфейса программа позволяет произвести все настройки осветителя и выполнять в процессе эксперимента все необходимые действия по управлению осветителем. Установка требуемой мощности излучения на выходе осветителя выполняется во вкладке "Управление" окна программы (рис. 3, а): перемещение при помощи компьютерной мыши горизонтальных ползунков позволяет задать величины тока каждого канала и относительной мощности (в %), перемещением вертикальных — установить границы интервалов управляющего напряжения (в относительных единицах и / или вольтах) на входном аналоговом порту, при которых происходит включение каналов. В этой же вкладке программы можно принудительно активизировать любой канал осветителя, а также контролировать текущее состояние каналов по изменению цвета их маркеров и величину напряжения, приходящего на аналоговый порт. Вкладка "Настройка" (рис. 3, б) программы позволяет задать имена каналов, настроить режим TTL-порта, а также выполнить сохранение / загрузку всех настроек осветителя в файл. В окне "Консоль", расположенном справа на этой вкладке и предназначенном для диагностики схемы управления, отображаются параметры USB-соединения и состояния схемы управления, сигналы о возможных ошибках.
ЗАКЛЮЧЕНИЕ
Достигаемые при помощи разработанного осветителя высокая чувствительность и точность регистрации сигнала эмиссии позволят проводить первичный отбор и испытания различных биологически активных веществ и новых лекарственных препаратов на одиночных клетках в биологии, медицине и фармакологии. Благодаря использованию оптоволоконного жгута для связи микроскопа и осветителя исключается прямая электрическая связь между измерительной системой и осветителем, поэтому появляется реальная возможность совмещать в экспериментах электрофизиологическую регистрацию (pClamp) и регистрацию флуоресценции, что существенно расширяет универсальность такого осветителя за счет возможности использования с ним комплексов приборов для электрофизиологических исследований.


