Мутанты аспергиллов с повышенной амилолитической активностью
Автор: Шутова В.В., Кудашкина Л.А., Ревин В.В.
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Биотехнология
Статья в выпуске: 4, 2007 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14718907
IDR: 14718907
Текст статьи Мутанты аспергиллов с повышенной амилолитической активностью
Л. А. Кудашкина (Саранск),
В. В. Ревин, доктор биологических наук (Саранск),
По последним прогнозам, микробиологическая промышленность в ближайшие 10 лет будет развиваться темпами, превышающими развитие других областей биотехнологии. Современные и будущие успехи микробиологической технологии зависят от нашей способности создавать микроорганизмы с нужными свойствами [2].
Амилолитические ферменты синтезируются многими микроорганизмами: бактериями, дрожжами, грибами и актиномицетами. Наиболее часто в качестве продуцентов амилолитических ферментов используются плесневые грибы. Способность синтезировать амилазы широко распространена среди плесневых грибов рода Aspergillus, видов niger, oryzae, usamii, awamori, batatae. Аспергиллы синтезируют одновременно комплекс ферментов, но некоторые из них, особенно мутантные штаммы, продуцируют в значительных количествах лишь один фермент. Отбор микроорганизмов-продуцентов проводится, главным образом, по высокой активности 0-амилазы, глюкоамилазы и олиго-1,6-глюкозидазы (декстриназы) [10]. В зависимости от вида и штамма гриба, а также от условий культивирования сочетание этих
-
© В. В. Шутова, Л. А. Кудашкина, В. В. Ревин, 2007
ферментов может быть различным. Применяя разнообразные способы воздействия на микроорганизмы, можно получить штаммы плесневых грибов, отвечающих определенным требованиям |7).
Во многих отраслях пищевой промышленности необходимо проводить гидролиз крахмала. На практике его осуществляют в две стадии: на первой проводят обработку U-амилазой (стадия разжижения крахмала), затем клейстеризовамную и разжиженную суспензию при температуре не выше 60 °C и pH 5,0 — 5,5 обрабатывают глюкоамилазой (стадия осахаривания крахмала). В результате совместного действия ферментов степень гидролиза крахмала достигает 98 — 99 % [1]. Так как в настоящее время растет потребность многих отраслей промышленности в ферментных амилолитических препаратах, проводятся работы по изучению продуцентов амилолитических ферментов, по их культивированию в различных условиях и, конечно же, по получению высокоактивных штаммов, Производство ферментов из штаммов, полученных в ходе мутационных и селекционных программ, является экономически выгодным уже на протяжении многих лет.
Данная работа посвящена получению высокопродуктивных мутантов Asp. awamori и Asp. niger, синтезирующих U-амилазу и глюко амилазу, и изучению физиологических и биохимических особенностей мутантных штаммов.
В качестве объекта исследования использовали культуру грибов Aspergillus niger, предоставленную сотрудниками кафедры микологии и альгологии МГУ им. М. В. Ломоносо-। ва, и Aspergillus awamori.
Споровый посевной материал грибов Asp. niger и Лзр. awamori выращивали при температуре 25 "С в пробирках со скошенным агаром на среде Чапека с крахмалом следующего состава, г / л: крахмал — 20, NaNO — 30, КН2РО4 — 1, MgSO4 — 0,5, КС1 — 0,5, FeSO4 — 0,01, агар-агар — 18.
Получение мутантов- Споры грибов Asp. niger и Asp. awamori суспендировали в чашках Петри в 10 мл дистиллированной воды; 5 мл полученной суспензии помещали в стерильные чашки Петри и подвергали УФ-облучению в течение 30 (97,6 Дж / м ), 25 (81.3 Дж / м ) и 20 (65,1 Дж / м ) мин. Затем контрольные и облученные споры в разведениях 10'7, 107 10э по 0,5 мл высевали на чашки Петри с агаризованной средой, содержащей 1 и 5 % крахмала, инкубировали при 35 °C до появления колоний, после чего подсчитывали процент выживаемости. Каждую выжившую колонию стерильной петлей переносили на обогащенную агаризованную среду Чапека с крахмалом и инкубировали при 35 °C до появления колоний.
Исходные и мутантные штаммы грибов Asp. awamori и Asp. niger культивировали глубинным способом на качалке при 200 об / мин, 25 — 26 “С в течение семи суток в конических колбах Эрленмейера объемом 500 мл со 100 мл питательной среды Чапека того же состава. Засев осуществляли суспензией спор.
Амилолитическую активность определяли спектрофотометрически с использованием йод-крахмального метода, основанного на гидролизе крахмала ферментами амилолитического комплекса до декстринов различной массы. За единицу амилолитической способности (АС) принимали количество фермента, которое способно катализировать гидролиз 1 г растворимого крахмала до продуктов, не дающих окраски с йодом за 1 ч при температуре 30 °C [5]. ~
Метод определения глюкоамилазной активности основан на количественном определении глюкозы, образующейся при гидролизе крахмала. За единицу глюкоамилазной способности (ГлС) принимали количество фермента, которое гидролизует растворимый крахмал при 30 °C и pH 4,7 и в течение I мин освобождает 1 ммоль глюкозы. Количество образующейся глюкозы измеряли глю-козооксидазно-пероксидазным методом [5]. Определение белка проводили по методу Бредфорд [6].
Получение мутантов Лхр. awamori и Asp. niger. Природные штаммы Asp. niger и Asp. awamori были первоначально отобраны в результате скрининга в качестве продуцентов амилолитических ферментов. Для дальнейшего повышения продукции этих ферментов был использован УФ-мутагенез с последующей селекцией высокопродуктивных клонов. Ультрафиолет вызывает как «точковые» мутации, так и хромосомные аберрации. В результате мутагенеза и селекции были отобраны следующие варианты: у Asp. awamori — 1, 2, 3, 4, 5, 6 и 7; у Asp. niger — 1, 2, 3, 4.
На первом этапе грибы облучали ультрафиолетом определенное время, потом вели поверхностное культивирование вариантов (и исходных, и облученных). В результате УФ-облучения в течение 30 мин у Asp, awamori выжило 8 — 28 % спор, получены мутантные варианты 1 — 3. При облучении УФ в течение 25 мин у этого же гриба выжило 72 — 95 % спор, в результате были получены мутантные варианты 4 — 7.
При облучении Asp. nlger УФ в течение 20 мин выжило 80 — 95 % спор, получены мутантные варианты 1—4.
Мутантные варианты Asp. awamori и Asp. nlger от исходной культуры отличались образованием более обильной биомассы, морфологическими признаками (размером колоний), интенсивностью спороношения и образования пигмента, окраской колоний при выращивании на агаризованных средах.
Важно отметить, что при пересеве, мутантных вариантов на селективные среды наблюдалось выщепление лишь около 10 % нетипичных колоний, что свидетельствует о морфологической стабильности.
Изучение культурально-морфологических свойств. У полученных мутантных колоний грибов Aspergillus были описаны культуральные свойства. Визуально наблюдали за морфологическими особенностями три- йлд пппа Д^ПАгтНит пптя ппгтр из тп^ппатя 5гп. ризованной среде (поверхностное культивирование) и на жидкой питательной среде (глубинное культивирование).
Грибы Asp, nlger и Asp. awamori имели I септированный, разветвленный, бесцветный I многоядерный мицелий. Конидии у них одно; клеточные, шаровидные [3] На рис, 1 изображена микрофотография конидий мутантного варианта Asp. awamori 1 (окрашивание метиленовым синим). Форма конидий округлая с заметными небольшими зубчиками. У исходного штамма Asp. awamori конидии более светлые, меньшего размера (рис. 2).
У штаммов Asp. nlger конидии также имели шаровидную форму; зубчики меньше, чем у гриба Asp. awamori.
Макроколонии гриба Asp. nlger на плотных питательных средах (на агаризованной среде Чапека — Докса) по форме в основном круглые, крупные по размеру, мицелий более плотный и густой, чем у Asp. awamori. По направлению к краю мицелий колонии паутинистый. У исходных и мутантных вариантов в процессе длительного роста (около 10 дней) на среде того же состава наблюдалось пигментообразо-вание. Asp. nlger выделял в среду пигмент зеленого цвета, по краям среда была окрашена в бордовый цвет. У мутантных вариантов происходило более раннее спороношение — через двое суток, а у исходного штамма — лишь через трое суток. Спороношение у Asp. nlger черное, образующееся в радиусе 3 — 5 см.
Колонии гриба Asp. awamori, и исходного, и мутантных штаммов различного размера, темно-коричневые, почти черные. Споры и конидии плесневых грибов содержат пигменты, что и придает зрелым культурам характерную окраску [41, Край колонии лишен зрелого сП Annu птп питл ст IZn U ГJ ГТ U <1 ТТ L Т Т L Т Ci ГППППС'Т» ПГСППГТТ _ VHV^ VIIVUJCIIII/J. 1 УЛУОГХП ^UJJ-V^IU- но крупные в центре и более мелкие по направлению к краю. Конидии созревали у мутантных вариантов через двое суток и легко отделялись от мицелия. Гриб Asp. awamori образовывал пигмент бордового цвета у всех вариантов и при длительном росте вызывал растрескивание среды.
Глубинное культивирование грибов.

; Рисунок 1
Конидии мутантного варианта 1 гриба Asp. awamori

Рисунок 2
Конидии исходного штамма Asp. awamori
Сравнение исходных и мутантных штаммов Asp. awamori и Asp. niger проводили также при культивировании в качалочных колбах на среде Чапека — Докса с крахмалом. При глубинном культивировании микроорганизмы развиваются во всем объеме жидкой питательной среды. В глубинной культуре протекают два неразрывно связанных процесса — синтез биомассы и синтез ферментов. Для исследования продуктивности мутантных вариантов по сравнению с исходными штаммами грибов была измерена их амилолитическая активность.
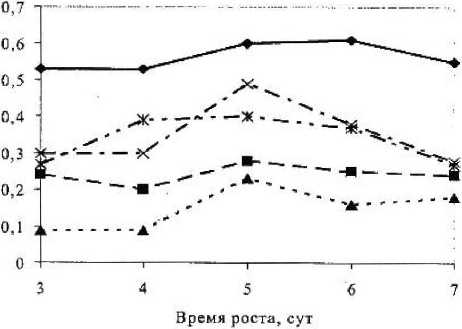
Содержание внеклеточного белка косвенно характеризует показатель биомассы микроорганизма. У исходного штамма гриба Asp. awamori содержание белка медленно повышалось до 6-х суток — до 0,59 мг / мл, затем практически не менялось (рис. 3). У всех мутантных вариантов при культивировании концентрация внеклеточного белка была ниже, чем у исходного штамма. Штаммы-продуценты могут накапливать кроме «полезных» и «вредные» мутации. Вредные мутации часто проявляются в снижении скорости роста, возникновении дополнительных требований к скорости роста [2]. Самая высокая концентрация была на 5-е сутки у мутантного варианта 1, а низкая — у 4-го, причем в течение всего времени культивирования она находилась почти на одном уровне.
Содержание белка у исходного штамма Asp. niger было практически на одном уровне на протя жении всего времени культивирования (рис. 4). У мутантных вариантов 1, 2 и 4 происходило плавное увеличение количества белка. У исходного штамма Asp. awamori образовалось столько же внеклеточного белка, что и у исходного штамма.
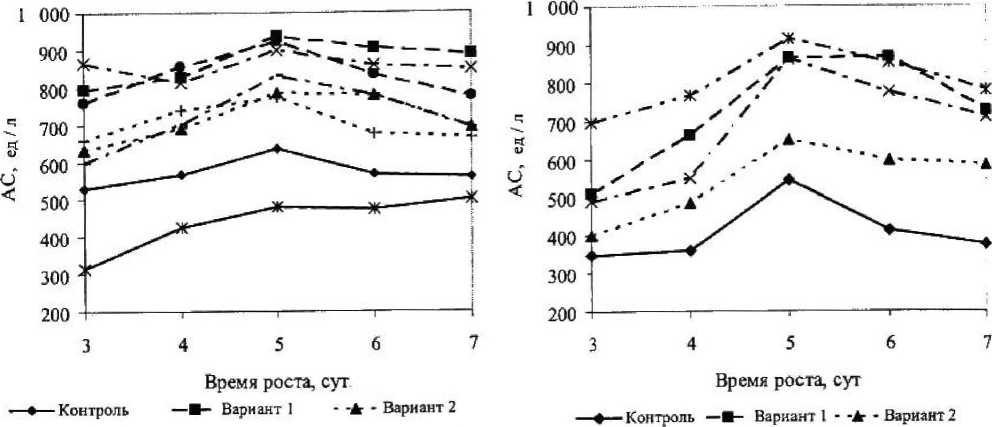
Определение АС основано на гидролизе крахмала ферментами амилолитического комплекса до декстринов различной массы, т. е. АС — это способность ферментов амилолитического комплекса осуществлять гидролиз крахмала до декстринов. Максимальная АС наблюдалась у мутантного варианта 1, и на 5-е сутки она была равна 936,7 ед / л, затем происходило ее снижение (рис. 5). На 5-е сутки у мутантного варианта 1 АС была на 32,1 % больше по сравнению с контролем. Минимальные значения АС оказались у мутантного варианта 4 (происходило плавное увеличение АС в течение всего времени культивирования).
У исходного штамма Asp. niger на 5-е сутки проявился пик АС, который равен 635 ед / л (рис. 6). Самое высокое значение АС было у мутантного варианта 4, и оно составляло на 5-е сутки 914 ед / л, что больше, чем у контроля, на 40 %. Минимальными значениями АС среди мутантов обладал вариант 2, его АС тем не менее была больше, чем у контроля, на 16,4 %.
АС исходного штамма гриба Asp. awamori была больше, чем у исходного штамма гриба Asp. niger, на 15 %.

—►— Контроль
—X *■ Вариант 3
ь —И ■ Вариант 6
Время роста, сут
—■— Вариант 1
- -* - Вариант 2
♦ '-1-1 Контроль —■— Вариант 1 - -* - Вариант 2
—X - Вариант 3 —Ж - Вариант 4
Рисунок 4
Содержание белка исходного и мутантных вариантов Asp. niger
—Ж— В ар и ант 4
—*- Вариант 5
— - — Вариант 7
Рисунок 3
Содержание белка исходного и мутантных вариантов Asp. awamori
—•— Вариант 5
—Ж - Вариант 4
—X - Вариант 3
— Вариант 7
—X - Вариант 3
- ■+ - Вариант 6
Рисунок 5
АС исходного и мутантных вариантов Asp. awamori
Рисунок. 6
АС исходного и мутантных вариантов Asp. niger
—X - Вариант 3 —Ж - Вариант 4
—X - Вариант 3
- -X . Вариант 6
Ж— Вариант 4 —•— Вариант 5
— Вариант 7
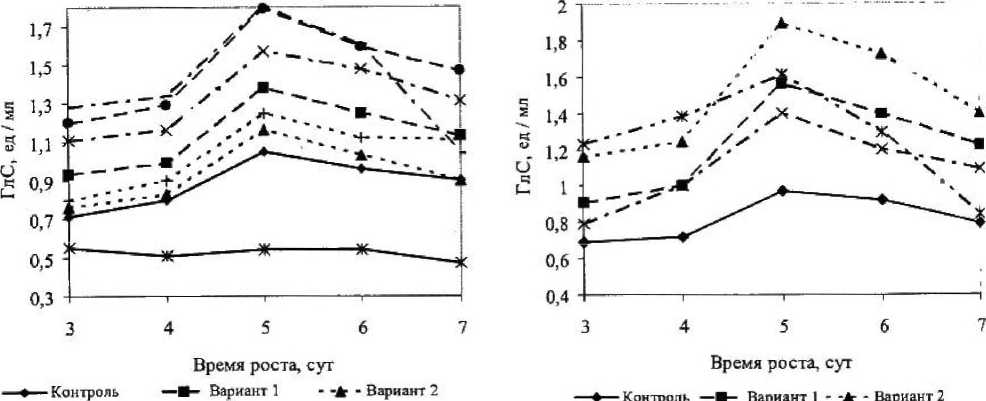
Рисунок 8
ГлС исходного и мутантных вариантов Asp. niger
Рисунок 7
ГлС исходного и мутантных вариантов Asp. awamori
Глюкоамилаза (0-1,4-глюкан-глюканогидро-лаза, К.Ф. 3.2.1.3) представляет собой экзодеполимеразу, последовательно отщепляющую глюкозные остатки от нередуцирующего конца полисахаридных молекул крахмала или мальтоолигосахаридов, превращая их в глюкозу. Кроме U-1,4-глюкозидных связей глюкоамилаза гидролизует 0-1,6-глюкозидные связи. Глюкоамилазы I относятся к промышленно важным ферментам.
поэтому большое значение имеет их получение [8; 9]. Существенными недостатками известных производственных способов получения глюкоамилазы является низкий уровень продуктивности штамма по синтезу этого фермента, а также высокая стоимость культивирования из-за применения высококонцентрированных питательных сред и длительности процесса [7].
У всех мутантных вариантов Asp. awamori ГлС возрастала до 5-х суток и затем снижалась (рис. 7). Максимальным значением ГлС обладал мутантный вариант 7: на 58 % больше контроля; самой низкой ГлС обладал мутантный вариант 4: ниже контрольного значения.
Наибольшей ГлС среди штаммов Asp. niger обладал мутантный вариант 2: выделялось самое большое количество глюкоамилазы, и ГлС на 5-е сутки была равна 18,9 ед / мл, что на 49 % больше, чем у контроля (рис. 8). У всех мутантных вариантов пик ГлС приходился на 5-е сутки культивирования. Исходный штамм по ГлС находился на самом низком уровне.
Итак, задача по получению мутантов с повышенным синтезом амилолитических ферментов была успешно выполнена.
Выводы. Были получены мутанты грибов Asp. awamori (7 мутантных вариантов) и Asp. niger (4 мутантных варианта) путем облучения исходных штаммов ультрафиолетом. Они отличались от исходных штаммов образованием более обильной биомассы, размером колоний, интенсивностью спороношения, интенсивностью об разования пигмента и окраской колоний при выращивании на агаризованных средах.
При культивировании мутантов Asp. awamori на среде Чапека — Докса с крахмалом наибольшее количество внеклеточного белка и амилолитическую активность показал мутантный вариант 1, амилолитическая способность была на 32 % выше, чем у исходного штамма. Глюкоамилазная способность была выше у мутантного варианта 7 (на 58 % больше, чем у исходного штамма).
При культивировании мутантов Д^р. niger на среде Чапека — Докса с крахмалом наибольшее количество внеклеточного белка образовывал мутантный вариант 3, наивысшая амилолитическая способность была у мутантного варианта 4 (на 40 % больше, чем у исходного штамма). Глюкоамилазная способность у мутантного варианта 2 на 49 % выше по сравнению с исходным штаммом.
Использование новых штаммов позволит значительно удешевить процесс производства ферментных препаратов, получаемых на их основе, и увеличить эффективность использования в различных областях биотехнологии [1].
ШИ, ^UUJ. к>Ы1Г. и. ^. I Z,J.
Список литературы Мутанты аспергиллов с повышенной амилолитической активностью
- Высокоактивный штамм гриба Asp. awamori -продуцент глюкоамилазы/А. П. Синицын, О. Н. Окунев, Н. В. Цурикова , . Режим доступа: http://avl6833.comtr.ru/default.html.
- Дебабов В. Г. Селекция микроорганизмов на заре XXI века/В. Г. Дебабов//Биотехнология. 2005. Вып. 5. С. 7 -21.
- Методы выделения, изучения и культивирования микроорганизмов/Т. И. Громовых, В. А. Тюль-панова, В. М. Гукасян . Красноярск: СибГТУ, 2002. 152 с.
- Морозова Е. В. Особенности экзогенного покоя конидий Asp. niger/Е. В. Морозова//Микробиология. 2001. Вып. 5. С. 611 -619.
- Определение активности ферментов: справочник/Г. В. Полыгалина, В. С. Чередниченко, П. В. Рима-рева. М.: Дели Принт, 2003. 375 с.
- Справочник биохимика/Р. Досон, Д. Элиот, У. Элиот, К. Джонс . М.: Мир, 1991. 543 с.
- Яровенко В. Л. Производство и применение глубинной культуры плесневых грибов в спиртовой промышленности/В. Л. Яровенко, Б. А. Устинников. М.: Пищевая промышленность, 1969. 262 с.
- Bioenergetic conseguences of glucoamilase production in carbonlimited chemostat cultures of Asp. Niger/M. Metwully, M. el Sayed, M. Osman //Biotechnol. and Bioeng. 1991. Vol. 59, № 1. P. 35 -43.
- Molecular basis of glucoamylase overproduction by a mutagenised inductrial strain of Aspergillus niger/D. A. Mackenzie, B. J Jeenes, X. Gou //Enzyme Microb. Technol. 2000. Vol. 26, № 1. P. 193 -200.
- Production of alpha-amylase with Asp. oryzae on spent brewing grain by solid substrate fermentation/B. Bogar, G. Szakaes, P. Tengerdy //Biotechnol. and Bioeng. 1999. Vol. 65, № 6. P. 638 -648.


