Наноразмерные структуры в микрофлюидных устройствах (обзор)
Автор: Евстрапов Анатолий Александрович
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Обзоры, исследования, приборы
Статья в выпуске: 3 т.21, 2011 года.
Бесплатный доступ
Интеграция наноразмерных структур в микрофлюидные устройства делает возможным создание приборов и систем, в которых реализуются уникальные свойства наноматериалов, особенности нанофлюидики и разнообразные функциональные возможности микрофлюидики. В статье рассмотрены особенности нанофлюидики. Обсуждены основные востребованные функции наноразмерных структур в микрофлюидных устройствах.
Наноразмерная структура, микрофлюидика, нанофлюидика, биологическая проба, двойной электрический слой, наноканал, нанопора, нановискер, квантовая точка, наночастица
Короткий адрес: https://sciup.org/14264735
IDR: 14264735 | УДК: 53.04:
Текст обзорной статьи Наноразмерные структуры в микрофлюидных устройствах (обзор)
По общепринятому определению [1], к наноструктурам относятся объекты, которые имеют хотя бы один характерный размер в интервале от 0.1 до 100 нм. Так как этому интервалу принадлежат размеры большинства биологических частиц (рис. 1), то переход от микрофлюидики (микрогидродинамики) к нанофлюидике позволяет эффективно воздействовать на отдельные биологические объекты и молекулы. Близость размеров наноструктур к дебаевской длине и размерам биологических молекул (таких как ДНК, белков, вирусов), а также превосходная воспроизводимость размеров и геометрии структур, получаемых методами нанотехнологий, делает возможным осуществлять уникальные действия и операции над биологическими молекулами в микрофлюидных устройствах. В ряде случаев в структурах, размеры которых превышают 100 нм, наблюдаются те же явления, что и в нанофлюидике, поэтому некоторые авторы (например, [2]) используют термин "расширенная нанофлюидика", определяя тем самым более широкий размерный диапазон — от 0.1 нм до 1 мкм. Диапазон переходных размеров от микро- к нанофлюидике оказался наименее изученным в силу отсутствия исследовательских инструментов и приборов. С другой стороны, нанофлюи-дика подразумевает и применение микрофлюиди-ки — хотя бы потому, что необходимо использовать промежуточные элементы микрометровых размеров, например гидравлические и пневматические интерфейсы при вводе пробы извне. Интеграция функциональных наноструктур в микро-флюидные устройства позволяет реализовать не только уникальные свойства наноматериалов и полезные эффекты, наблюдаемые на наноуровне, но и разнообразные функциональные возможности микрофлюидики в одном устройстве.
В этом коротком обзоре, не претендующем на широкомасштабное исследование, рассматриваются только отдельные области применения нано-размерных структур в микрофлюидных устройствах для анализа биологических проб. Современное динамичное развитие микро- и нанофлюидики, огромное число публикаций не позволяют полностью охватить впечатляющую картину развития этих областей, играющих все более важную роль в научных и прикладных исследованиях.
ОСОБЕННОСТИ НАНОФЛЮИДИКИ
Кроме того что в нанофлюидике мы имеем дело со структурами нанометрового размера, следует выделить ряд других характерных особенностей, а именно:
-
— в наномасштабе жидкости имеют свойства, которые не могут быть рассмотрены в рамках модели сплошной среды;
-
— наблюдается доминирование эффектов, связанных с поверхностью (взаимодействие между поверхностью и молекулами более существенно, чем между молекулами и растворителем);
-
— значительными становятся явления, определяемые двойным электрическим слоем (особенно в наноканалах, нанопорах, нанотрубках и т. п.);
-
— проявляются размерно-зависимые явления, связанные с соотношением размеров молекул и наноструктур;
-
— наблюдаются явления, связанные с энтропией и т. д.
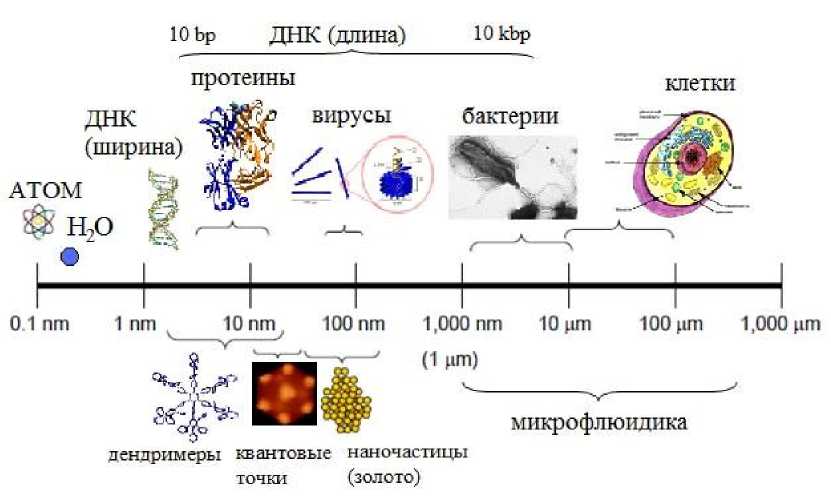
Рис. 1. Типичные размеры некоторых биологических объектов и наночастиц (использованы материалы из [3, 4])
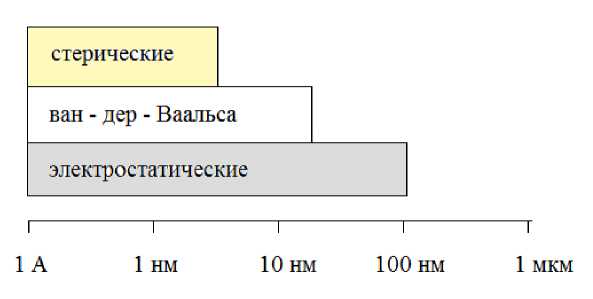
Рис. 2. Примерный диапазон действия межмолекулярных сил в жидких растворах (данные из [5])
На наноуровне множество различных сил, воздействующих на молекулу (или частицу) на разных расстояниях (рис. 2), определяют ее поведение в наноразмерных структурах. Изучение взаимодействия частиц и молекул, явлений переноса в наноразмерных системах проводится достаточно давно в различных областях физики и химии, но с развитием современных нанотехнологий появились новые возможности не только для исследований, но и практического применения наноразмер-ных элементов и устройств во многих сферах деятельности человека.
В общем случае транспорт частиц в нанофлюи-дике разделяют [5] на две группы в зависимости от характерного масштаба длины. Если размер каналов (пор) лежит в диапазоне от 5 до ~100 нм, то электростатические взаимодействия являются доминирующими и ионы в жидкости могут быть рассмотрены в рамках гипотезы сплошной среды, что дает хорошие результаты и позволяет создавать различные, в том числе и коммерческие, устройства для разделения молекул на наноуровне (например, системы очистки воды). Если размер каналов составляет менее 5 нм, то стерические взаимодействия и гидратация влияет на ионы в жидкости, и в этом случае для адекватного описания взаимодействий необходимо применять другие подходы, в частности методы молекулярной динамики.
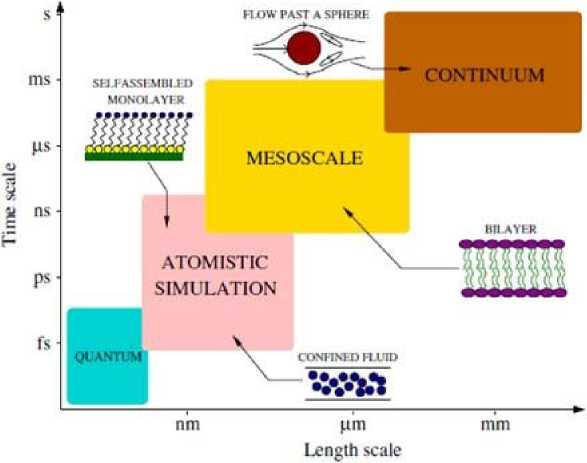
Рис. 3. Схематическое изображение различных методов моделирования и соответствующих им размерных значений и временн ы х масштабов [6]
В критическом обзоре [7] рассматриваются явления капиллярности в наноразмерных системах. Особое внимание уделяется эффектам эластока-пиллярности и электрокапиллярности. Обсуждаются результаты измерений кинетики наполнения наноканалов водой и водными растворами солей. Эти эксперименты могут быть использованы для характеристики вязкости жидкости в наноразмер-ных системах.
Существенное внимание уделяется методам моделирования процессов и взаимодействий в нанометровом диапазоне размеров. Так, обзор [6] посвящен роли, которую играют методы молекулярного моделирования в понимании процессов, происходящих на уровне от нано- до мезомас-штабных размеров. Эти методы помогают интерпретировать экспериментальные данные и в существенной мере влияют на развитие различных технологий, в том числе на технологии разделения молекул, микроэлектромеханические системы (МЭМС), нанофлюидные технологии. Все методы моделирования разделены на четыре группы, в соответствии с интервалами моделируемых размеров и временн ы х масштабов (рис. 3).
В другом обзоре [8] рассматриваются явления, наблюдаемые в жидкости на наноразмерном уровне, изучаются различные подходы, используемые при исследовании наноразмерных эффектов, уделяется внимание мотивации прикладных разработок. Также обсуждаются границы применения гидродинамических моделей. Особое внимание уделяется явлениям, происходящим в диффузионном слое при движении жидкости.
Основы, необходимые при изучении сил, действующих на заряженные объекты в растворе при внешнем электрическом поле, рассмотрены в работе [9]. Здесь делается акцент на простые, идеализированные случаи и концептуальное понимание процессов, обсуждаются эксперименты, в которых измеряются электрофоретическые силы, действующие на ДНК.
В работе [10] проведено численное исследование электрокинетических явлений транспорта (электроосмоса и электрофореза) в трехмерном наноканале круглого сечения. Из-за нанометровых размеров канала оказываются неприменимыми обычные теории электрокинетического потока (уравнения Пуассона, Больцмана, Гельмгольца— Смолуховского и т. д.). В исследовании рассматривается система связанных дифференциальных уравнений в частных производных (Пуассона— Нернста—Планка, Навье—Стокса) для потенциала электрического поля, ионных концентраций, поля скоростей в наноканале. Показано, что скорость потока в наноканале выше при высоком поверхностном заряде или если радиус наноканала больше.
НАНОРАЗМЕРНЫЕ СТРУКТУРЫ В МИКРО- И НАНОФЛЮИДИКЕ
К наноразмерным структурам, обычно используемым в микрофлюидике, относятся: нанораз-мерные пленки и слои (в том числе пленки Ленгмюра—Блоджетт (ЛБ), Ленгмюра—Шеффера (ЛШ) и др.), нанопроволоки ("нановискеры"), на- норазмерные кристаллические структуры, нанопо-ристые мембраны и схожие структуры, квантовые точки, наночастицы и т. д. Эти структуры могут быть применены в качестве
— элементов детектирующих устройств [11-17];
— сенсорных элементов [13, 16, 18, 19];
-
— элементов устройств управления движением молекул и частиц [20–21];
-
— элементов и устройств синтеза и формирования частиц [22];
-
— устройств концентрирования и разделения частиц [15, 23–28];
— других функциональных устройств (смесителей, реакторов, клапанов, затворов, теплообменников и т. п.) [7, 15, 27, 29].
Особое место занимают наночастицы, которые могут быть использованы как
-
— специфические метки при детектировании (квантовые точки, оптические, флуоресцентные, электрохимические и т. д.) [19, 30–32];
-
— транспортные частицы для массо- и тепло-переноса [33] (в том числе переноса иммобилизованных объектов и др.);
-
— среды для разделения, фильтрации, концентрирования и извлечения аналита;
— элементы для локального воздействия на объект (нагрев пробы и т. д.).
Достаточно часто для высокочувствительного и высокоразрешающего обнаружения биологических молекул применяются наночастицы с иммобилизованными на них реагентами, позволяющими осуществить специфическую реакцию с определяемым объектом. Регистрация таких частиц осуществляется различными способами с учетом особенностей наночастиц.
Значительное внимание в последнее время уделяется развитию технологий получения и применения наножидкостей [4], которые являются перспективными теплоносителями с улучшенными теплофизическими свойствами и могут быть использованы во многих устройствах (для обмена энергией, передачи тепла и др.). Выделяют следующие важные сферы их использования: охлаждение технических устройств и приборов, теплообмен с другими жидкостями, солнечный нагрев и перенос тепла. Кроме того, наножидкости рассматриваются в качестве многообещающей основы для применения в ядерных и атомных технологиях, в космических исследованиях.
Нанофлюидные системы, по мнению экспертов, являются перспективной платформой для исследования конформационных, динамических и энтропийных свойств молекул ДНК и для их разделения. Это подтверждается экспериментами в микрофлюидных системах с наноканалами, нано-размерными щелями, нанопорами и т. п. [26].
Одним из направлений практического внедрения тонких пленок, полученных по методу ЛБ, является применение в биосенсорных элементах с включением в пленки таких биологических структур, как антитела, аминокислоты, ферменты, белки и ДНК [34–36]. В работе [37] показано, что биомолекулы, иммобилизованные в пленки ЛБ и ЛШ, в значительной степени сохраняют свои функциональные характеристики.
Плодотворными являются работы по использованию нанопористых материалов для создания управляемых стабильных электроосмотических потоков жидкости. К очевидным преимуществам электроосмотических насосов следует отнести отсутствие механических движущихся частей, удобство управления потоком, малые габариты и возможность интегрирования на любом участке мик-рофлюидного чипа. В основе таких устройств лежит явление электроосмоса, наблюдающееся в пористых материалах с отрицательно заряженной поверхностью при внешнем электрическом поле [38–40]. Электроосмотические насосы первоначально были созданы для охлаждения электронных схем, а спонсорами проекта выступали организация DARPA, Intel, AMD, Apple. В настоящее время некоторые фирмы производят коммерческие микроэлектроосмотические насосы для применения в микрофлюидике. Например, The Dolomite Centre Ltd [41] выпускает насосы, обеспечивающие скорость потока рабочей жидкости (деионизованная вода или метанол) от 6 до 190 мкл/мин и максимальное давление до 2000 кПа. Электроосмотические насосы имеют хорошие перспективы применения при их интеграции в микрофлюидные чипы [20, 21, 42].
Важными функциональными устройствами в микрофлюидике являются смесители и реакторы, т. к. смешивание и проведение реакций являются ключевыми стадиями в анализе. В обзоре [43] представлены различные средства и механизмы для перемешивания в микрофлюидике. Разумеется, каждая конструкция имеет свои достоинства и недостатки, и наиболее подходящее средство смешивания должно быть выбрано в зависимости от конкретного приложения. Авторы [44] считают, что не существует единого подхода при выборе смесителей, удовлетворяющих всем требованиям и пригодными для всех приложений. Однако с точки зрения производительности и стоимости изготовления можно охарактеризовать разные технологии и концепции смешивания. Микрофлюид-ные смесители могут быть классифицированы, как "активные", в которых для смешивания используется внешняя энергия, или "пассивные", где смешивание происходит за счет геометрии микро-флюидного устройства или использования функциональных структур определенной конфигурации. В работе [45] приведен обзор микрофлюид- ных смесительных устройств, предложенных за последние 10 лет, для наиболее значимых приложений в микрофлюидике. В исследовании [46] рассмотрен вариант нанофлюидного смесителя, полученного с помощью экспериментальной установки ближнего поля. Особенностями такого смесителя является то, что он — пространственный (3D), имеет множество (более 2000) структур на которых осуществляется смешивание (шириной 50–300 нм), что обеспечивает высокую эффективность перемешивания при низких числах Рейнольдса. В работе [47] пространственный (3D) смеситель из взаимосвязанных пор сформирован внутри микрофлюидного кагала путем сочетания голографической литографии и фотолитографии. Расщепление и слияние потоков в пространственно взаимосвязанных пористых структурах увеличивает эффективность перемешивания за счет уменьшения диффузионного пути и увеличения поверхности контакта потоков жидкости. Смеситель показал высокую эффективность перемешивания (> 0.60) при малых числах Рейнольдса (Re < < 0.05) и Пекле. К варианту активного смесителя следует отнести конструкцию смесителя на основе неравновесной электрокинетики [48]. Смешивание достигается за счет сильных вихревых структур, формируемых вблизи микро/нано интерфейса канала. Авторы ожидают, что предлагаемое устройство будет широко применяться в микроаналитических системах из-за простоты конструкции и технологии изготовления.
Важное применение наноструктур — извлечение и концентрирование искомых компонентов. Методы для разделения и обнаружения аналита с использованием наноканалов играют важную роль в аналитической химии и имеют перспективы для широкого применения в медицине, фармакологии, биотехнологии и т. д. [27, 49]. Так, например, применение наноразмерных каналов и нанопор в микрофлюидных устройствах позволяет значительно улучшить аналитические характеристики при разделении биологической пробы [50]. Одиночные наноканалы и нанопоры дают возможность изучать отдельные молекулы, а множество параллельных наноструктур — оперировать с множеством молекул одновременно, получать более полную информацию об образце. Нанофлюид-ные устройства могут использоваться для исследований конформационных, динамических и других свойств молекул ДНК в различных средах, для определения генетической информации по длине молекулы ДНК и т. д. [26].
Диффузия является ключевым механизмом разделения молекул и частиц, применяемым в лабораторной и клинической практике. Возможность создания новых тонких нанопористых мембран может улучшить скорость и качество разделения. В работах [51–52] проведены исследования по разделению белков и молекул на тонкой (толщиной 15 нм) нанопористой кремниевой мембране. Молекулярно тонкие мембраны, как ожидается, позволят получить лучшее разделение по сравнению с толстыми мембранами с идентичными характеристиками (диаметром пор и пористостью). В этих работах также изучалось влияние таких параметров, как пористость, распределение пор, время диффузии, на характеристики разделения. Было выявлено, что ряд факторов, не вошедших в модели (форма молекул и частиц, электростатическое отталкивание, адсорбция на стенках пор), является помехой при экспериментальных исследованиях и оказывает существенное влияние на разделение. В работе [52] авторы показали, что нано-пористые кремниевые мембраны могут успешно применяться для фракционирования наночастиц золота и белка с разрешением менее 5 нм, незначительной потерей образца и с малым разбавлением фильтрата. Эти же авторы отмечают важность исследований и выбора технологических режимов для получения требуемых характеристик нанопо-ристых мембран, и их другая работа [53] посвящена изучению влияния осаждения тонких пленок и тепловых параметров обработки на размер и плотность пор.
Интеграция пористых структур в микроканалы, как известно, позволяет получить высокоэффективную систему для разделения компонентов пробы методами электрофореза или хроматографии. Электрофорез в наноканалах характеризуется доминирующим наличием двойного электрического слоя (ДЭС), который формируется спонтанно на границе раздела твердой фазы и электролита. Поверхностный заряд экранируется контр-ионами электролита. Часть из них, как полагают, конденсируется на поверхности (что приводит к снижению эффективной поверхностной плотности заряда), а другая часть остается солюбилизированной и диффузной. Характерная толщина диффузного слоя дебаевской длины определяется локальным балансом электромиграции к поверхности и диффузии от поверхности [54]. Движение жидкости в нанокалах при электроосмосе создается перемещением ионов под действием тангенциального электрического поля, которое приводит в движение диффузные противоионы. При этом также осуществляется электрофорез всех подвижных ионов в системе. Нанометровый масштаб каналов требует нового взгляда на электрофоретическое движение даже в тех случаях, когда можно предположить гипотезу сплошной среды. Наблюдаемые движения ионов в наноканалах объясняются не только взаимодействием внешнего аксиального поля и растворителя (и линейной суперпозиции скорости равномерного движения растворителя), но являются результатом комплексной связи между этими ионами и ДЭС [54]. ДЭС, помимо дви- жения объемов нейтрального растворителя, создает неоднородные поперечные электрические поля. В случае макромолекул в каналах с размерами порядка 10 нм наблюдаемые движения также могут быть связаны со стерическими взаимодействиями со стенками канала. Еще одной уникальной особенностью наноканалов является наличие соответствующих режимов тейлоровской дисперсии (т. е. дисперсии за счет градиентов скорости) разбавленных аналитов, которые не взаимодействуют (адсорбция или десорбция) со стенками. В наноканалах, изготовленных с высоким аспектным соотношением сторон сечения (W / H, где H и W — глубина и ширина канала соответственно) в диапазоне значений от 5 до 250, время диффузии нейтрального аналита по глубине значительно меньше, чем по ширине (τh ~ Н2 / D, τw ~ W2 / D). Градиенты концентраций в канале по глубине быстро достигают равновесия в потоке. Следствием этого является то, что дисперсии в каналах с глубиной порядка 10 нм не обязательно тривиальны, если их ширина порядка 10 мкм и более. В микроразмер-ных каналах при электрофорезе преобладают эффекты, наблюдаемые вне ДЭС, поэтому они слабо влияют на качество разделения компонентов. Иначе дело обстоит в наноканалах, где практически все ионы так или иначе взаимодействуют с ДЭС. Т. е. должны проявляться неоднородные свойства материала. Было показано [54], что в микронных каналах кинетика адсорбции/де-сорбции на стенках может иметь пагубное влияние на наблюдаемую дисперсию. Можно также представить, что шероховатость поверхности и/или изменение глубины канала будут влиять на разрешение при электрофорезе в наноканалах. Хотя эти эффекты недостаточно хорошо изучены, но имеется предположение, что шероховатая поверхность или изменение профиля канала приводит к более существенному взаимодействию ионов со стенкой канала даже при низкой напряженности поля. Таким образом, можно ожидать ухудшения эффективности разделения.
Кроме электрокинетических эффектов в наноканалах для разделения молекул и частиц применяются и другие явления. Схематическое изображение двух режимов управляемого транспорта биополимеров при формировании потока давлением (или разряжением) приведено на рис. 4 [55].
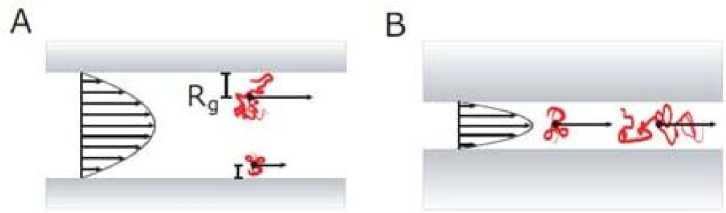
Рис. 4. Формирование профиля скорости движения молекул для двух режимов транспорта биополимеров: A — размер канала больше, чем радиус инерции полимера; B — размер канала соизмерим с размерами молекулы [55]
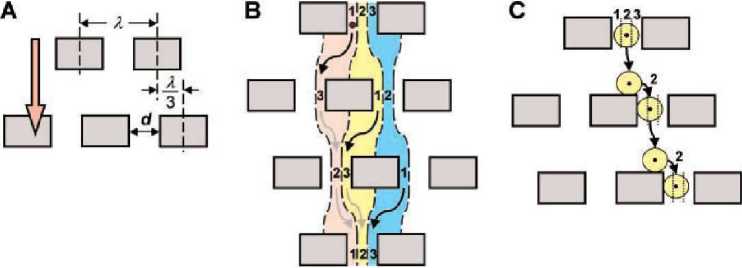
Рис. 5. Принцип сортировки частиц, основанной на разной траектории движения через препятствия [56]
Если размер канала больше, чем радиус инерции полимера Rg, то скорость движения молекул в центре канала выше, чем у стенки; в случае узких каналов, соизмеримых с размерами молекулы, движение существенно зависит от длины полимера.
Иной подход для разделения наночастиц в жидкости представлен в [56] (рис. 5) и заключается в том, что через массив столбцов, определенным образом смещенных относительно друг друга, прокачивается смесь частиц. Траектории движения мелких и крупных частиц отличаются: большие частицы имеют возможность пройти через препятствия, огибая их, в то время как малые двигаются по более короткой траектории. Это приводит к тому, что осуществляется разделение частиц в соответствии с их размерами.
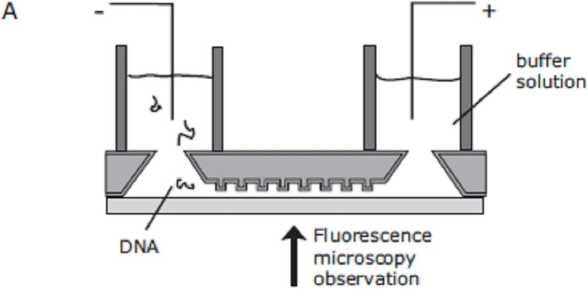
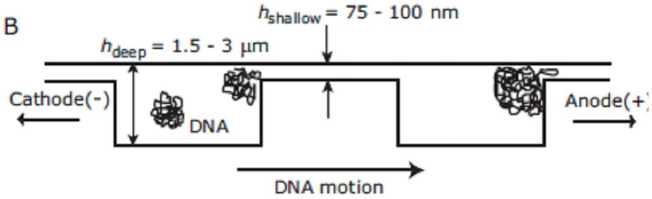
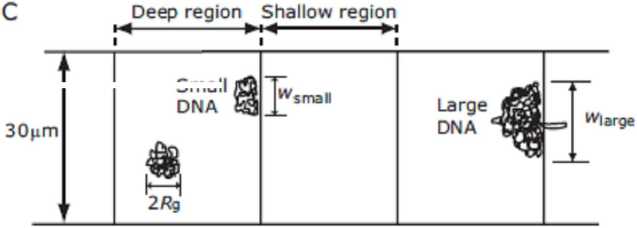
Существует принцип разделения с использованием энтропийных сил. Когда полимер находится на границе мелких (< Rg) и глубоких (> Rg) областей канала, он испытывает энтропийную силу по отношению к глубокой области, т. к. полимер стремится сохранить свое конформационное равновесие [57, 58]. Еще один способ эффективного использования энтропийных сил представил Тернер и др. [59]. Смесь полимеров ДНК с различной длиной в достаточно глубоком канале (при глубине hdeep > Rg) под действием электрофоретических сил "протаскивали" через систему наноразмерных щелей, заставляя их растягиваться. Через определенный интервал времени электрическое поле было выключено. Короткие молекулы полностью загнанные в узкие щели, оставались там, в то время как длинные молекулы, частично находящиеся в глубокой области канала, начинали движение в исходное конформационное равновесие (рис. 6). Такой процесс включения и выключения поля может быть неоднократно повторен, причем при первом включении на короткое время отделяются самые короткие молекулы, затем более длинные и т. д.
Sma
Рис. 6. Использование энтропийных сил при разделении молекул биополимеров (ДНК) [59]
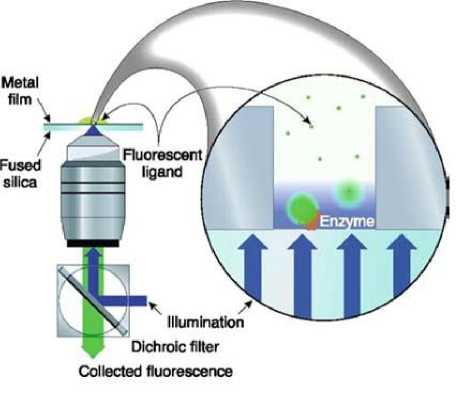
Рис. 7. Устройство для флуоресцентного детектирования результатов амплификации с применением стеклянного микрочипа с тонкопленочной маской с нанопорой [60]
time passage
V) 0) V)
С E c
of DNA
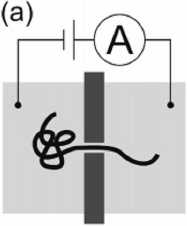
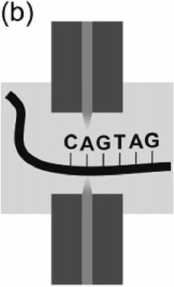
Рис. 8. Сканирование одной молекулы ДНК с помощью нанопоры.
При приложении напряжения ДНК протягивается через поры, измеряемый ток уменьшается на время прохождения молекулы, которое пропорционально ее длине. [15]
Используется множество способов детектирования аналита с помощью наноразмерных структур. На рис. 7 приведен пример устройства для флуоресцентного детектирования фермента полимеразы в стеклянном микрочипе с металлической тонкопленочной маской, в которой изготовлены нанопоры [60]. Световое излучение проникает через нанопоры на небольшую глубину и на таком расстоянии может возбуждать флуоресценцию. При амплификации регистрируются вспышки люминесценции, связанные с синтезом новых копий.
Нанопоры успешно применяются и при электрохимическом детектировании. При невысоких концентрациях, транспорт молекул через нанораз-мерные каналы (нанопоры) может регистрироваться электрохимическим способом с разрешением на уровне отдельных частиц, что позволяет создать новые типы биосенсоров. Основной проблемой при таком методе обнаружения является быстрое "забивание" нанопор — требуется предварительная очистка пробы и контроль за текущим состоянием нанопор. Этот метод реализован в микрофлюидном устройстве для анализа биологических проб (молекул ДНК) [61]. В ПДМС микро-флюидный чип встроена мембрана из нитрида кремния с отверстием диаметром около 4 нм. По обе стороны отверстия расположены резервуары и электроды, к которым приложено внешнее напряжение. Перемещение молекулы ДНК через это отверстие (нанопору) под действием электрического поля вызывает изменение тока в цепи. Длительность регистрируемого сигнала зависит от длины молекулы. Таким образом, измеряя параметры электрического сигнала можно получить информацию о размерах молекулы ДНК. Подобный принцип описан в [15] и поясняется рис. 8.
Возможность получения отпечатков наноструктур в полимерных материалах, которые затем можно использовать в качестве платформы для системы разделения, вызывает значительный интерес исследователей и разработчиков. В работе [62] представлен метод получения трехмерных нано- и микроразмерных структур в канале из ПДМС. Метод позволяет встраивать в канал различные конструкции из широкого ассортимента материалов. Таким способом было изготовлено устройство из вертикально расположенных цилиндров, на котором получено разделение 6/10/20 тыс. пар и 10/48 тыс. пар оснований ДНК.
В работе [22] представлен новый и простой метод локального синтеза и интеграции нанопроволок ZnO в микрофлюидные устройства. Изменяя параметры синтеза легко можно менять и контролировать морфологию и расположение синтезированных нанопроволок. Было продемонстрировано применение изготовленных и интегрированных в микрофлюидный чип наноструктур для улавливания частиц.
Обзор [12] посвящен анализу использования одномерных наноструктур (1D) на чипе для обнаружения биомолекул. В качестве материала наноструктур применяются углеродные нанотрубки, металлические и полупроводниковые нановискеры и наноканалы. Хотя нанотрубки и нановискеры преимущественно используются в качестве электрических детекторов, такие структуры, как наноканалы, перспективны и для оптического детектирования при разделении, концентрировании и регистрации ДНК. Все эти наноструктуры, как ожидается, позволят осуществлять детектирование аналита на уровне отдельных молекул. В обзоре рассматриваются преимущества использования 1D-наноструктур и обсуждаются фундаментальные физические аспекты, такие как влияние эффектов ДЭС, а также методологические особенности измерений. Уделено внимание углубленному анализу современных достижений и освещены основные проблемы, которые необходимо преодолеть для широкого использования наноструктур в системах "лаборатория-на-чипе".
В другом обзоре [13] обсуждаются технологии роста, синтеза и функционализации биосовмести-мых материалов, с акцентом на 1D наноматерилы (нанотрубки, неорганические нановискеры, полимерные проводящие нанопроволоки). В этом обзоре исследуются принципы измерений и особенности нанобиосенсоров с использованием вышеуказанных материалов, обсуждаются будущие перспективные цели и направления научных исследований в области нанотехнологий.
Применение пересекающихся микрофлюидных каналов, разделенных мембраной с нанопорами, позволяет осуществлять извлечение компонентов и последующее их концентрирование. Если между каналами существует электрический потенциал, то включаются дополнительные эффективные механизмы переноса частиц [63].
Сокращение поперечного сечения микрофлю-идных каналов к масштабу наноразмеров является привлекательным для обнаружения, транспортировки и сортировки отдельных биологических молекул. В обзоре [64] рассматриваются явления, которые могут быть использованы для анализа биомолекул в нанофлюидных устройствах. При нанометровом масштабе длин определяющими во взаимодействиях между молекулами являются "слабые взаимодействия", которые могут применяться для организации транспорта молекул, управления скоростью движения ионов, обеспечения взаимодействием на молекулярном уровне и т. п. Такой подход позволяет создавать новые устройства секвенирования ДНК, детектирования биомолекул и т. д. Наноразмерные системы вызывают повышенный интерес в связи с их фундаментальным и прикладным значением в различных областях химии и физики [65–67]. Однако высокая стоимость изготовления, дорогое оборудование, сложный процесс изготовления, контроля и испытаний наноструктур препятствуют широким исследованиям в этой области.
Несколько десятилетий назад физики впервые наблюдали, как полупроводниковые частицы диаметром менее 10 нанометров вели себя, как одиночные атомы, несмотря на то, что состояли из тысяч атомов. Эти структуры получили название квантовых точек (КТ). Позднее было показано, что КТ могут применяться для разных целей, в том числе для визуализации биологических структур (окраска клеток), использоваться в качестве замены флуоресцентных красителей и т. д. для обнаружения искомых объектов. Американская военно-морская научно-исследовательская лаборатория (The U.S. Naval Research Laboratory, NRL) развивает методы на основе полупроводниковых нанокристаллов, или КТ (CdSe или CdTe), которые обладают привлекательными свойствами для оптического обнаружения в видимой области спектра — широкой полосой возбуждения и узкой полосой фотолюминесценции. При этом возможным является одновременное возбуждение несколько частиц. К тому же КТ обладают исключительной фотохимической стабильностью и высоким квантовым выходом. Многие исследователи уделяют внимание разработке детектирующих систем на основе КТ [68–71]. Резко возросло использование люминесцентных коллоидных квантовых точек в биологических исследованиях в связи с их уникальными оптическими свойствами (в зависимости от размера структур) и последними достижениями в области иммобилизации. В статье [72] сообщается о разработке микрофлю-идного устройства для быстрого обнаружения жизнеспособных и нежизнеспособных микробных клеток методом флуоресцентной гибридизации и с использованием квантовых точек.
Другими перспективными наноразмерными структурами являются "нановискеры" (НВ) — проволокоподобные структуры диаметром от нескольких до десятков и сотен нанометров, которые могут быть изготовлены из разных материалов (например, полупроводников или металлов). Полупроводниковые нанокристаллы имеют узкую полосу флуоресценции, характеристики которой зависят от размера кристалла, более высокую фотостабильность, чем органические флуорофоры, и другие полезные свойства. Область возможного применения НВ чрезвычайно широка. Здесь мы остановимся на некоторых наиболее интересных исследованиях.
Группа C.M. Lieber развивает технологии и методы дизайна и синтеза наноразмерных компонентов, которые могут быть применены для создания практически любой функциональной структуры или наносистемы — от ультрачувствительных датчиков до наноинтерфейсных устройств для изучения живых клеток и тканей [73]. Так, например, предложенные устройства, в которых использованы нитевидные нанокристаллы, позволяют создавать новые ультрачувствительные электрические датчики для прямого обнаружения биологических и химических молекул [74–80]. Механизм "нанови-скерных" датчиков основан на полевом эффекте, используемом в транзисторах. Полупроводник p-типа (или n-типа), на котором мобилизованы антитела (или иные рецепторы), связан с металлической поверхностью и электродами, через которые подается потенциал (рис. 9). В такой цепи измеряется изменение проводимости полупроводника при специфическом взаимодействии рецепторов с определяемым компонентом (антигеном, белком). Применение линейки электродов с различными рецепторами, интегрированной в канал микро-флюидного чипа, позволяет осуществлять комплексный анализ пробы. Подобный метод предложен для обнаружения белков, вирусов и ДНК.
Наночастицы уже достаточно давно находят широкое применение в различных областях медицины и биологии. В этой статье мы не будем затрагивать это обширное поле исследований, а только коснемся отдельных случаев применения наночастиц в микрофлюидике. Оригинальным применением наночастиц является управление движением жидкости в открытых и закрытых микрофлюидных каналах. Принцип управления заключается в следующем: сфокусированное оптическое излучение на границе жидкость— поверхность локально увеличивает температуру жидкости и ведет к испарению воды. Затем пар в относительно холодном воздухе уплотняется в капельки перед жидко-воздушным интерфейсом. Капельки соединяются с первоначальной жидкостью. Периодическое сканирование светового потока позволяет управлять движением массы жидкости. Во многих работах представлено использование наночастиц как носителей иммобилизованных объектов. Обычно используются наночастицы с явно выраженными магнитными или электрическими свойствами, которыми достаточно легко
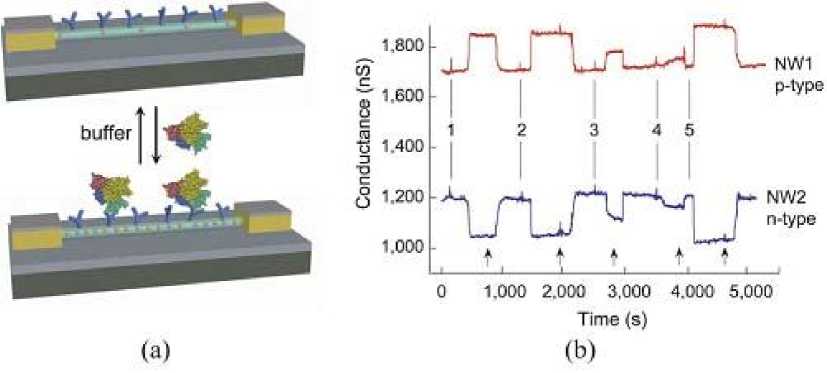
Рис. 9. Применение нановискеров для обнаружения белка.
а) на поверхность вискера нанесены антитела, реагирующие с антигеном в пробе; б) изменение проводимости детектора при использовании различных материалов вискера (полупроводников n- и p-типа). Точки (1–5) соответствуют различной концентрации PSA: 1, 2 — 0.9 нг / мл, 3 — 9 пг / мл, 4 — 0.9 пг / мл и 5 — 5 нг / мл [76]
управлять. Эта область еще только находит применение в микрофлюидике, хотя и имеет хорошие перспективы. Следует также отметить, что полимерные наночастицы, обладая своими специфическими характеристиками, рассматриваются как достойная альтернатива кремниевых и металлических наночастиц. Подробные сведения по применению полимерных частиц, их синтезу и модификации поверхности можно найти в монографии [81].
Появление и развитие новых приложений с использованием наноразмерных структур, разработка и создание новых инновационных методов изготовления наноструктур создают благоприятную почву для патентования в нанофлюидике. В обзоре [82] рассмотрены некоторые из наиболее представительных патентов, относящихся к нанофлю-идным устройствам и методам на их основе. Обзор сосредоточен на нанофлюидных устройствах для разделения, детектирования и манипуляции с биопробой и присутствующими молекулами. Рассмотрены некоторые патенты, связанные с методами изготовления микро- и наноразмерных структур. Большинство патентов по нанофлюиди-ке ориентировано на применение в биоинженерии и биотехнологии. На сегодняшний день число патентов весьма ограничено, хотя ожидается их рост в ближайшем будущем.
ЗАКЛЮЧЕНИЕ
Современные нанотехнологии позволяют формировать воспроизводимые наноразмерные структуры с заданными характеристиками из различных материалов. Интеграция этих структур в микро-флюидные устройства делает возможным создание приборов и систем, в которых реализуются уникальные свойства наноматериалов, особенности нанофлюидики и разнообразные функциональные возможности микрофлюидики.
Разработке, созданию и исследованию функциональных наноразмерных структур для аналитических целей уделяется повышенное внимание, о чем свидетельствует множество публикаций в научных журналах, регулярные конференции, симпозиумы и научные школы.
Среди востребованных функций наноразмер-ных структур можно выделить следующие: детектирование и обнаружение искомого объекта (аналита); транспортные (управление движением молекул и частиц); синтетические (синтез молекул и наночастиц); фильтрующие и разделительные (фильтрация, концентрирование и сепарация частиц); управляющие (клапаны, затворы) и другие (теплообменники, смесители, реакторы и т. п.). Интеграция наноструктур в микрофлюидные уст- ройства позволяет создавать системы, обеспечивающие проведение манипуляций и обнаружение как отдельных частиц и молекул, так и множества частиц. Наиболее разработанными и исследованными наноразмерными структурами, применяемыми в микрофлюидных устройствах, являются нанопоры (в том числе пористые мембраны), нанопроволоки (нановискеры), пленки Ленгмюра—Блоджетт и Ленгмюра—Шеффера, квантовые точки и наночастицы.
Разработка наноразмерных структур для мик-рофлюидных устройств является логическим развитием технологий для современных приборов — "лаборатория-на-чипе" и микроаналитических систем полного анализа.
Работа проведена при поддержке АВЦП "Развитие научного потенциала высшей школы (2009– 2011)", проект "Исследования и диагностика клеточных структур: новые методические подходы и инструментальные решения на основе сканирующей зондовой микроскопии и микрочиповых технологий" РНП 2.1.2/9501, и программы фундаментальных исследований Президиума РАН "Создание и совершенствование методов химического анализа и исследование структуры веществ и материалов", проект "Микрофлюидные чипы для анализа биополимеров".


