Направленное культивирование Chlorella sorokiniana с целью увеличения синтеза каротиноидов
Автор: Кузнецова Т.А., Никитина М.С., Севастьянова А.Д.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (82), 2019 года.
Бесплатный доступ
Резюме: Chlorella sorokiniana - перспективный вид для культивирования как в лабораторном культиваторе, так и в промышленных масштабах. Ее биомасса является источником многих ценных компонентов, включая пластидные пигменты, которые обладают высокой антиоксидантной активностью. Метаболизм Chlorella sorokiniana подвержен изменениям под влиянием различных условий культивирования. При дозированном ультрафиолетовой облучении возможно компенсаторное увеличение синтеза каротиноидов, которые предотвращают окислительный стресс. Проведено культивирование C. sorokiniana (штамм 211-8k) в различных условиях освещенности: контрольный вариант - освещенность лампой дневного света; вариант 1 - дозированное периодическое ультрафиолетовое воздействие каждые сутки в течение 15 мин (спектральная область светового потока 280-315 нм (УФ-В), интенсивность 1300 Лк) и дальнейшее освещение лампой дневного света; вариант 2 - ультрафиолетовое облучение в течение 30 мин (спектральная область светового потока 280-315 нм (УФ-В), интенсивность 1300 Лк) в фазу стабилизации...
Направленное культивирование, уф-освещенность, каротиноиды
Короткий адрес: https://sciup.org/140248341
IDR: 140248341 | УДК: 581.6 | DOI: 10.20914/2310-1202-2019-4-34-39
Текст научной статьи Направленное культивирование Chlorella sorokiniana с целью увеличения синтеза каротиноидов
Микроводоросль Сhlorella sorokiniana – перспективный продуцент ценных компонентов, успешно культивируемый в лабораторных и производственных условиях [1]. В биомассе С. sorokiniana обнаружено высокое содержание ценных компонентов: белков, углеводов, липидов и биологически активных веществ [2].
Содержание пластидных пигментов, хлорофиллов и каротиноидов (3,5% в сухой биомассе) превышает содержание их у наземных растений. Известно, что хлорофиллы и каротиноиды обладают антиоксидантными свойствами [3]. Поэтому биомассу Chlorella можно использовать в получении концентратов пигментного комплекса для пищевого производства.
Ряд факторов, влияющих на обмен веществ (в том числе каротиногенез) в клетках микроводорослей в период культивирования, позволяют увеличить синтез метаболитов, что является основой направленного культивирования.
Дозированное ультрафиолетовое излучение (УФ), по мнению ряда авторов, может оказывать и стимулирующее, и угнетающее влияние [4]. Малые дозы УФ в сочетании с фотосинтетически активной радиацией (ФАР) во время роста популяции клеток С. sorokiniana могут активизировать компенсаторные фотозащитные механизмы автотрофных одноклеточных водорослей, что предполагает интенсивный синтез каротиноидов [4].
Цель работы – описание влияния дозированного УФ-излучения на процесс культивирования одноклеточных водорослей С. sorokiniana , морфофизиологическое состояние популяции микроводорослей и содержание каротиноидов в полученной биомассе.
Материалы и методы
Для исследования использовали С. sorokiniana (штамм 211–8k) из коллекции водорослей университета Гёттингена (Culture Collection of Algae at Göttingen University, international acronym SAG). Культивирование проводили в лабораторном биореакторе цилиндрической формы объемом 0,5 л [5, 6] c использованием универсальной питательной среды, содержащей все необходимые макро- и микроэлементы [7].
Перемешивание осуществляли барботированием воздухом с помощью компрессора Хilon AP-001, в режиме 1,5 л/мин. Температурный диапазон культивирования 20–23 °С. Режимы освещенности «день-ночь» (16–8 ч.):
-
• вариант 1 – контроль, лампа дневного света (ФАР), интенсивность – 2500±200 Лк, Т(К) – 400;
-
• вариант 2 – УФ1, периодическое УФ-облучение в течение 15 мин в сутки ртутной газоразрядной лампой со спектральной областью светового потока 280–315 нм (УФ-В), интенсивность 1300 Лк. Дальнейшее освещение лампой дневного света (интенсивность – 2500±200 Лк, Т(К) – 400);
-
• вариант 3 – УФ2, освещенность лампой дневного света (интенсивность – 2500±200 Лк, Т(К) – 400),
ультрафиолетовое облучение в течение 30 мин (со спектральной областью светового потока 280–315 нм (УФ-В), интенсивность 1300 Лк) на завершающей фазе культивирования (стабилизации).
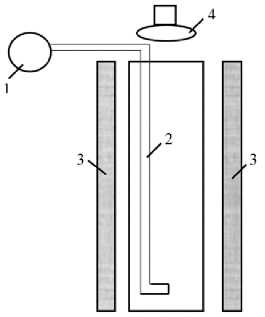
Рисунок 1. Лабораторный фотобиореактор для культивирования микроводоросли С. sorokiniana : 1 – насос-аэратор; 2 – трубка подачи воздуха; 3 – лампа дневного света; 4 – источник УФ-излучения Figure 1. Laboratory photobioreactor for the cultivation of microalgae C. sorokiniana : 1 – pump-aerator; 2 – air supply tube; 3 – fluorescent lamp; 4 – UV radiation source
Культивирование проводили в двукратной повторности. Для определения концентрации клеток в суспензии во время культивирования водорослей была найдена линейная зависимость между значениями оптической плотности (при 750 нм, в кювете сравнения – питательная среда) и концентрацией клеток в суспензии. Концентрация клеток в суспензии была определена с помощью камеры Горяева, а оптическая плотность – на спектрофотометре Юнико 1201.
Для определения выхода сухой биомассы отделение жидкой фазы от биомассы проводили центрифугированием в режиме 5000 мин -1 в течение 5 мин. с дальнейшим декантированием надосадочной жидкости. Биомасса в дальнейшем высушивалась на воздухе при 20–23 °С в темном месте. Содержание влаги в воздушно-сухой биомассе не превышало 2%.
Микроскопирование прижизненных препаратов суспензии микроводорослей проводили с помощью микроскопа МИКМЕД-6 с системой визуализации (АО «ЛОМО», Санкт-Петербург). Для обработки микрофотографий использовали программу микроанализ FOTO (АО «ЛОМО», Санкт-Петербург) и Levenguk (производитель «Levenhuk LabZZ»).
Для количественного анализа пигментов (хлорофиллов и каротиноидов) в экстрактах биомассы использовали полосы поглощения пигментов в области 440, 649 и 664 нм и методику авторов [8, 9]. Характеристики состава пигментного комплекса в полученных экстрактах определяли по сумме пигментов и содержанию хлорофиллов и каротиноидов, соотношению хлорофиллов а и b .
Результаты и обсуждение
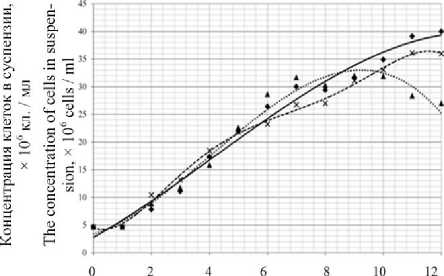
На начало культивирования концентрация клеток в культуральной среде – 4,6 млн кл./мл (рисунок 2). Лаг-фаза не выражена или составляет не более 1 сут во всех вариантах эксперимента.
Сутки Day
♦контроль ‘УФ1 «УФ2
. control * UV1 . UV2
Рисунок 2. Кривые культивирования С. sorokiniana в различных условиях освещенности: контроль – освещение лампами дневного света; УФ1 – периодическое воздействие ультрафиолетовым излучением; УФ2 – воздействие ультрафиолетом в фазу стабилизации
Figure 2. Curves of cultivation of C. sorokiniana in various lighting conditions: control – fluorescent lighting; UV1 – periodic exposure to ultraviolet radiation; UV2 – exposure to ultraviolet light in the depletion phase)
В контрольном и УФ2 вариантах фаза интенсивного роста составляет 10–11 сут, и сокращена до 8–9 сут в варианте УФ1. Отмечено изменение цвета суспензии водорослей в фазе стабилизации в варианте УФ2, она приобретает желтый оттенок.
На рисунке 3 изображен выход сухой биомассы, полученной в ходе культивирования при разных условиях освещенности.
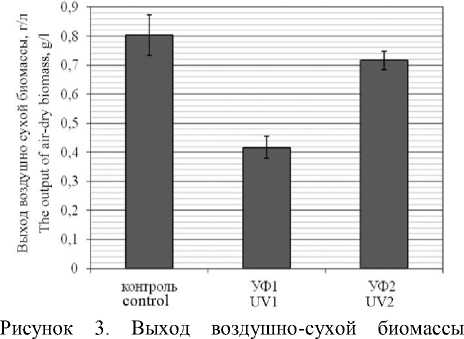
C. sorokiniana , полученной при культивировании в различных условиях освещенности: УФ1 – периодическое ультрафиолетовое воздействие; УФ2 – воздействие ультрафиолетом в фазу стабилизации Figure 3. The yield of air-dry biomass obtained during cultivation under various lighting conditions: UV1 – periodic ultraviolet exposure; UV2 – exposure to ultraviolet in the stabilization phase
При однократном воздействии УФ-облучения (вариант УФ2) выход биомассы достоверно не отличается от контрольного варианта, а при периодическом УФ-облучении (вариант УФ1) приводит к существенному снижению выхода биомассы в среднем на 48%. Анализ кривой культивирования показал, что уменьшение содержания биомассы происходит в заключительную фазу культивирования после 9 сут.
На рисунке 4 представлен спектр поглощения пигментного комплекса, экстрагированного 96%-ным этанолом (ГОСТ 5962–2013). При анализе спектров поглощения отмечено две полосы поглощения в сине-фиолетовой области 380–500 нм и в красной области 640–670 нм. Пики при 420 (1) и 664 нм (5) соответствуют хлорофиллу а [10]. Хлорофиллу b соответствуют пики 453, 649 нм, плечо (4) при 420 нм описано для протохлорофилла [11]. Для каротиноидов отмечена полоса поглощения в области 420–480 нм, пики 440,5 (2) и 470 нм (3) описаны для каротиноидов.
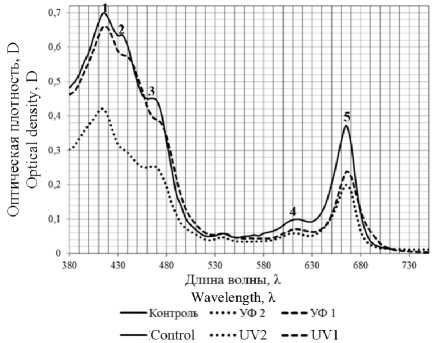
Рисунок 4. Спектр поглощения этанольных экстрактов пигментов из воздушно-сухой биомассы C. sorokiniana , полученной при культивировании в различных условиях освещенности: контроль; УФ1 – периодическое ультрафиолетовое воздействие; УФ2 – воздействие ультрафиолетом в фазу стабилизации Figure 4. Absorption spectrum of ethanol extracts of pigments from air-dry biomass C. sorokiniana obtained by cultivation under various lighting conditions: control; UV1 – periodic ultraviolet exposure; UV2 – exposure to ultraviolet light in the stabilization phase.
В таблице 1 представлены данные по содержанию пластидных пигментов в воздушносухой биомассе полученных образцов в различных условиях освещенности при культивировании микроводорослей C. sorokiniana .
Наибольшее содержание суммы пигментов отмечено для контрольного варианта, в вариантах с УФ-облучением отмечено уменьшение содержания суммы пигментов в среднем на 26,9% (вариант УФ1) и на 8,5% (вариант УФ2). В вариантах с УФ-облучением отмечено наиболее существенное снижение содержания вспомогательного хлорофилла b , соответственно увеличивалось соотношение Ch a / Ch b .
Таблица 1.
Содержание пластидных пигментов в образцах воздушно-сухой биомассы C. sorokiniana
Table 1.
Plastid pigment content in air-dried biomass samples of C. sorokiniana
|
Содержание пигментов, мг/г сухой биомассы The pigment content, mg/g dry biomass |
Образцы биомассы, полученные в различных условиях культивирования Biomass samples obtained under various cultivation conditions |
||
|
Контроль Control |
УФ 1 UV 1 |
УФ 2 UV 2 |
|
|
Хлорофилл а | Chlorophyll a |
14,78±0,21 |
9,94±0,23 ** |
13,89±0,45** |
|
Хлорофилл b | Chlorophyll b |
7,73±0,17 |
4,13±0,11 ** |
6,79±0,35** |
|
Сумма каротиноидов | Sum of carotenoids |
4,24±0,14 |
5,49±0,10 ** |
3,80±0,12** |
|
Сумма пигментов | Pigment amount |
26,76±0,31 |
19,56±0,37** |
24,48±0,85** |
|
Доля каротиноидов от суммы пигментов, % The proportion of carotenoids from the amount of pigments, % |
15,84±0,44 |
28,10±0,37** |
15,60±0,42** |
|
Соотношение хлорофиллов а / b The ratio of chlorophyll a / b |
1,92±0,05 |
2,42±0,05** |
2,06±0,05 |
Примечание: УФ1 – периодическое ультрафиолетовое воздействие; УФ2 – воздействие ультрафиолетом в фазу стабилизации, ** – достоверные отличия при уровне вероятности 0,99.
Note: UV1 – periodic ultraviolet exposure; UV2 – exposure to ultraviolet light in the stabilization phase, ** – significant differences at a probability level of 0.99.
Длительное УФ-облучение вызывает фотоповреждение белков и фосфолипидов плазматических мембран: окисление липидов мембран по свободнорадикальному механизму с образованием гидропероксидов с последующим их фотохимическим расщеплением и получением стабильных конечных продуктов. Ранее было показано, что влияние острых доз УФ-излучения на клетки водорослей сопровождается повышением уровня защитной антиоксидантной активности водорослей [12].
В большинстве случаев фотоповреждения являются следствием генерации избытка три-плетно возбужденного Хл, способного взаимодействовать с О 2 – продуктом оксигенного фотосинтеза. В результате образуются химически реактивные формы синглетного О2. Фотопро-текторная роль Хл зависит от функции ПБК. Другой способ заключается в эффективном переносе энергии от триплетно возбужденного Хл на каротиноиды, которые рассеивают энергию в виде тепла [3].
Каротиноиды в ряде случаев являются важным структурным элементом трансмембранных комплексов, которые наряду с другими компонентами обеспечивают стабильность их структуры и эффективное выполнение комплексами их основной функции при фотосинтезе [14].
Фотозащитная функция каротиноидов связана со способностью их гасить энергию возбуждения электрона за счет делокализации электрона сопряженной системой связей [14].
Периодическое УФ-облучение приводит к усилению каротиногенеза. В биомассе возрастало содержание суммы каротиноидов по сравнению с контролем в среднем на 29,5%, при более длительном однократном воздействии УФ-облучения в фазу стабилизации наблюдается уменьшение содержания суммы каротиноидов в среднем на 10,4%.
На рисунке 5 представлена микроскопическая картина популяции клеток C. sorokiniana в фазу стабилизации, полученных при периодическом (УФ1) и однократном длительном УФ-облучении (УФ2).
При исследовании прижизненных препаратов (в 10 полях зрения) в вариантах УФ1 (рисунок 5 b) и УФ2 (рисунок 5 c) отмечали появление обесцвеченных клеток с большой вакуолью и ядром с конденсированным хроматином, морфологически измененные клетки были крупнее остальных. Также отмечали образование флоков, способствующих седиментации клеток.
По литературным данным появление морфологически измененных клеток с крупными вакуолями, разрушенным хлорофиллом характерно для клеток при воздействии температурного и осмотического стрессового фактора, а также при УФ-облучении, что характерно для апоптоза [15, 16].
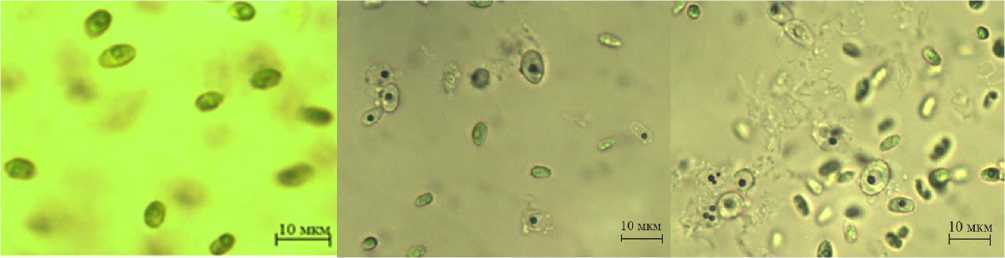
а b с
Рисунок 5. Микроскопическая картина популяций C. sorokiniana в фазу стабилизации, полученных в разных условиях культивирования: a – контроль; b – периодическое ультрафиолетовое воздействие; с – воздействие ультрафиолетом в фазу стабилизации
Figure 5. Microscopic picture of C. sorokiniana populations in the stabilization phase obtained under different cultivation conditions: a – control; b – periodic ultraviolet exposure; c – exposure to ultraviolet light in the stabilization phase
Заключение
Таким образом, при периодическом УФ-облучении наблюдается снижение количества клеток водорослей в суспензии на 9-е сут, соответственно и выход биомассы существенно снижается по сравнению с контролем. Однократное УФ-облучение в течение 30 мин приводит к незначительному снижению выхода воздушносухой биомассы, что при дальнейшем росте популяции может быть скомпенсировано.
Периодическое УФ-облучение приводит к активации каротиногенеза, выход суммы каротиноидов в пересчете на сухую биомассу превышает контрольный вариант в среднем на 30%.
Однократное ультрафиолетовое облучение в течение 30 мин в фазу стабилизации приводит к снижению содержания в биомассе как хлорофилла, так и каротиноидов.
Микроскопическое исследование популяций микроводоросли показало, что УФ-облучение приводит к появлению клеток с признаками апоптоза: крупные клетки с большими вакуолями, конденсированным ядром, обесцвеченным хлоропластом.
Дальнейшим направлением исследования является подбор условий, позволяющих увеличить выход каротиноидов при минимальных потерях биомассы микроводорослей.
Список литературы Направленное культивирование Chlorella sorokiniana с целью увеличения синтеза каротиноидов
- Lizzul А.М., Lekuona-Amundarain А., Purton S., Cintra L. Campos Characterization of Chlorella sorokiniana, UTEX 1230 // Biology. 2018. № 7 (25). URL: www.mdpi.com/journal/ href='contents.asp?titleid=51694' title='Biology'>Biology
- Belkoura М., Benider А., Dauta А. Influence de la temp?rature, de l'intensit? lumineuse et du stade de croissance sur la composition biochimique de Chlorella sorokiniana Shihira & Krauss // Annls Limnol. 1997. № 33 (1). Р. 3-11.
- Дымова О.В., Головко Т.К. Фотосинтетические пигменты: функционирование, экология, биологическая активность // Известия Уфимского научного центра ран. 2018. № 3 (4). С. 5-16.
- Gracia L., Cianca K., Montero L. et al. Carotenoids production of the microalgae Сhlorella sorokiniana response to stress induced by uv-a radiation // Sociedad Latinoamericana de biotecnologia ambiental y algal. 2015. P. 1-5.
- Politaeva N., Smyatskaya Y., Trukhina E., Ovchinnikov F. Impact of various physical exposures on Chlorella Sorokiniana microalgae cultivation // International Journal of Applied Engineering Research. 2017. № 12 (21). P. 11488-11492.
- Пат. № 2668162, RU, C12N 1/12, A01G 33/00, C12M 1/02, C12M 1/36, Способ культивирования микроводоросли Chlorella / Политаева Н.А., Базарнова Ю.Г., Кузнецова Т.А., Трухина Е.В., Смятская Ю.А. Патентообладатель: ФГАОУ ВО "СПбПУ". № 2017142638; Заявл. 06.12.2017; Опубл. 26.09.2018, Бюл. № 27.
- Crofcheck C., Shea A. et al. Influence of media composition on the growth rate of Chlorella vulgaris and Scenedesmus acutus utilized for CO2 mitigation // J Biochem Tech. 2012. № 4 (2). P. 589-594.
- Nayek S. Haque C.I., Nishika J., Suprakash R. Spectrophotometric Analysis of Chlorophylls and Carotenoids from Commonly Grown Fern Species by Using Various Extracting Solvents // Research Journal of Chemical Sciences. 2014. V. 4 (9). Р. 63-69.
- Пат. № 2695879, RU, A23J 3/20. Способ получения пигментного комплекса из биомассы одноклеточных водорослей рода Chlorella / Базарнова Ю.Г., Кузнецова Т.А., Смятская Ю.А. № 2018142406; Заявл. 01.12.2018; Опубл. 29.07.2019, Бюл. № 22.
- Tarchevskiy A. The main principles of photosynthesis. Edition of the Kazan State University. 150 р.
- Булда О.В., Рассадина В.В., Алексейчук Г.Н., Ламан Н.А. Спектрофотометрический метод определения содержания каротинов, ксантофиллов и хлорофиллов в экстрактах семян растений // Физиология растений. 2008. Т. 55. № 4. С. 604-611.
- Али-заде Г.И. Влияние УФ-C и УФ-В излучений на первичные процессы фотосинтеза и каталазную активность в клетках Dunaliella // Cовременные проблемы науки и образования. 2009. № 4. С. 18-25.
- Москаленко А.А., Барышников В.В., Журавлева З.А. и др. Cтруктурная роль каротиноидов в фотосинтезе // Информационный бюллетень РФФИ. Науки о земле. 1995. № 3.
- Шашкина М.Я., Шашкин П.Н., Сергеев А.В. Каротиноиды как основа для создания лечебно-профилактических средств // Российский биотерапевтический журнал. 2009. Т. 8. № 4. С. 91-98.
- Jime?nez С., Capasso J.M., Charles L. Edelstein C.L. et al. Different ways to die: cell death modes of the unicellular chlorophyte Dunaliella viridis exposed to various environmental stresses are mediated by the caspase-like activity DEVDase // Journal of Experimental Botany. 2009. V. 60. № 3. P. 815-828.
- DOI: 10.1093/jxb/ern330
- Zuppini A., Gerotto C., Baldan B. Programmed Cell Death and Adaptation: Two Different Types of Abiotic Stress Response in a Unicellular Chlorophyte // Plant Cell Physiol. 2010. V. 51. № 6. P. 884-895.
- DOI: 10.1093/pcp/pcq069


