Нарушение меланопсинового эффекта сужения зрачка - фактор риска заболевания глаз
Автор: Капцов В.А., Дейнего В.Н.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Научные обзоры
Статья в выпуске: 1 (17), 2017 года.
Бесплатный доступ
Риск поражения глаз и ухудшения качества зрения в значительной степени зависит от эффективной работы биомеханической системы глаза в условиях энергосберегающего освещения. Эффективность этой системы определяется адекватностью управления зрачком глаза и ресничной мышцей. Проведен анализ математических моделей изменения диаметра зрачка глаза от светотехнических параметров световой среды (уровня освещенности, яркости). Показана значимость и роль ганглиозных клеток в управлении диаметром зрачка глаза на сужение (миозис) при их облучении синим светом 480 нм. На основе оценки реакции зрачка на сужение при воздействии разных стимулов света (синего, красного и зеленого) сформулировано понятие меланопсинового эффекта удержания зрачка при миозисе и показано, что при воздействии импульса синего света определенных длин волн он может служить диагностическим признаком ряда заболеваний (возрастной макулярной дегенерации сетчатки, сахарного диабета). Под воздействием синего (480 нм) света ганглиозные клетки формируют управляющий сигнал для сфинктера зрачка и цилиарной мышцы, которая обеспечивает аккомодацию (по Гельмгольцу) и регулирует поток водянистой влаги в Шлеммовом канале. Все современные энергосберегающие источники света имеют низкий уровень энергии на длине волны 480 нм из-за провала в их спектре по сравнению со спектром солнечного света той же цветовой температуры и уровня освещенности. Неадекватное управление диаметром зрачка в условиях искусственного освещения приводит к нарушению условий меланопсинового эффекта и вносит дисгармонизацию в управление оттоком водянистой влаги. Все это в совокупности при длительной зрительной нагрузке увеличивает риски возникновения глазных заболеваний в условиях современной световой среды. Выявлено, что современные математические модели флюктуаций диаметра зрачка глаза нуждаются в уточнении с учетом новых знаний о функциональных особенностях клеток сетчатки и спектра энергосберегающих источников света.
Биомеханическая система глаза, светодиодное освещение, синий свет, сужение зрачка, ганглиозные клетоки, меланопсиновый эффект, риск развития миопии
Короткий адрес: https://sciup.org/14237987
IDR: 14237987 | УДК: 614/5: | DOI: 10.21668/health.risk/2017.1.15
Текст обзорной статьи Нарушение меланопсинового эффекта сужения зрачка - фактор риска заболевания глаз
В современной световой среде тесно переплелись вопросы ее гигиены и возрастающие риски заболевания глаз от воздействия света от искусственных источников. Воздействие света на глаза зависит от величины диаметра зрачка и качества спектра света, который является программой управления функциональными структурами зрительного анализатора. Неадекватное программное управление биомеханической системой зрения человека повышает риски заболевания глаз.
В настоящее время световую среду обитания человека определяют энергосберегающие источники и устройства отображения информации.
Офтальмологи и гигиенисты, оценив итоги массового внедрения компактных люминесцентных ламп и светодиодов в Южной Корее, Японии, Китае, показали, что во всех странах выявлена сходная тенденция – постоянный и уверенный рост миопии. Актуальность проблемы подчеркивают недавние исследования, проведенные в Южной Корее (в которой массово
применяются компактные люминесцентные и светодиодные лампы), показавшие почти сюрреалистический результат – практически 96,5 % от всех 19-летних мужчин призывного возраста близоруки [41]. Исторически биомеханическая система зрения человека формировалась в среде солнечного света и неограниченном зрительном пространстве. «Глаз нельзя понять, не зная Солнца. Вот почему глаз – солнечен, по словам поэта», – такими словами свою замечательную книгу «Глаз и Солнце» заканчивает Сергей Иванович Вавилов. Солнечный свет попадает на сетчатку через зрачок и управляет его размером через соответствующие ганглиозные клетки и разделы головного мозга.
Человек обычно негативно реагирует на ярко-голубые источники света. «Зрачковый рефлекс находится в синей части спектра. От синего света приходит самый сильный сигнал к мышцам в радужной оболочке глаза, чтобы закрыть зрачок», – говорит доктор David H. Sliney, эксперт армии США по физиологическим эффектам светодиодов, лазеров и других ярких источников света из Центра по укреплению здоровья и профилактической медицины армии США. В работе Ensuring safety in LED lighting [29] отмечается, что для защиты глаз очень важны ганглиозные клетки, которые могут удержать зрачок маленьким. Палочки и колбочки могут сужать зрачок только кратковременно, затем он снова увеличивается в большую сторону в течение примерно 10 секунд. David H. Sliney отмечает, что размер зрачка на улице равен примерно 2 мм и поддерживается фоточувствительными ганглиозными клетками, а верхнее веко защищает расположенную ниже часть сетчатки [43].
В классической светотехнике ключевым моментом для зрачка глаза является его реакция на величину, пропорциональную количеству белого света, попадающего на сетчатку. Диаметр зрачка человека может изменяться от 1,1 до 8,0 мм.
Одними из первых на изучение закономерностей изменения диаметра зрачка от освещенности глаза обратили внимание проектировщики оптических приборов различного назначения. При их использовании взгляд человека максимально ограничен в зрительном пространстве. Без понимания этих закономерностей трудно спроектировать качественный оптический прибор. В своих работах исследователи исходили из того, что зрачковый рефлекс может вызываться различными причинами, но прежде всего – изменением яркости фона. По мере увели- чения яркости фона происходит уменьшение диаметра зрачка. В общем виде эта зависимость выражается формулой В.В. Машкова [11]:
Dp = 5 – 3 th (0,4lg L ), (1)
где Dp – диаметр зрачка глаза, мм; L – яркость фона, кд/м2; th – гиперболический тангенс.
Зависимость диаметра зрачка от яркости, рассчитанная по формуле (1), приведена на рис. 1 (кривая 1 ).
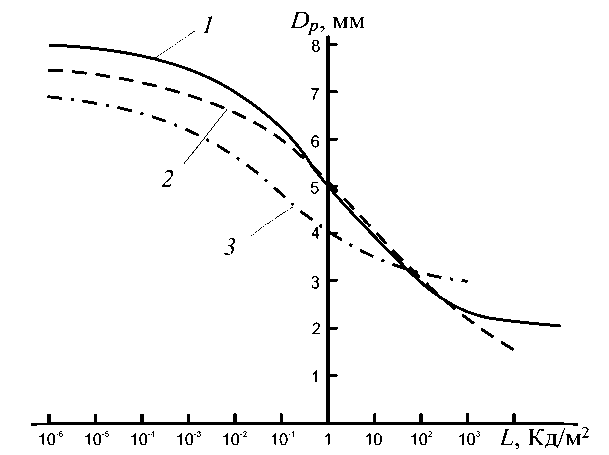
Рис. 1. Зависимость диаметра зрачка глаза от яркости фона. Штриховой линией обозначены зависимости, полученные Р. Ривсом (кривая 2 ) и Н.И. Пинегиным (кривая 3 ) [20]
В результате проведенных исследований Н.И. Пинегин установил, что уменьшение углового размера поля при постоянной яркости приводит к увеличению зрачка [13, 20]. В работе Т.Н. Хацевича исследована зависимость диаметра зрачка глаза при наблюдении изображения на экране электронно-оптического преобразователя (ЭОП) в приборах ночного видения [20]. Особенности поля адаптации (экрана ЭОП), связанные с излучением люминофора, флуктуациями яркости на экране, наличием сцинтилляций, вызывают некоторое изменение зрачковой реакции в сторону увеличения зрачка. При этом зависимость диаметра зрачка от яркости экрана ЭОП выражается формулой
Dp = 5,5 – 1,5 th [0,5lg (0,06 L )]. (2)
Формула справедлива при 10–4 кд/м < L < 102 кд/м., т.е. при реальных яркостях экрана ЭОП, который светится, как правило, зеленым светом [22].
Из анализа приведенных данных видно, что при люминесцентном освещении сетчатки меняются формулы подсчета диаметра зрачка глаза в сторону его увеличения [20].
На увеличение диаметра зрачка влияют не только вышеперечисленные факторы, но и наличие заболеваний глаз (рис. 2)
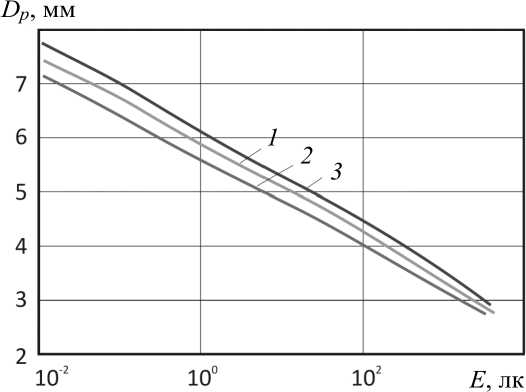
Рис. 2. Зависимость диаметра зрачка глаза от освещенности на зрачке:
1 – эмметропический глаз; 2 – гиперметропический глаз; 3 – миопический глаз
При миопии диаметр зрачка глаза больше, чем при нормальном зрении . Также диаметр зрачка зависит от состояния аккомодации и конвергенции, усиление которых влечет за собой сужение зрачка, их ослабление – расширение. Изменение возможно также при изменении только аккомодации или конвергенции [20].
По мере развития техники к специалистам по телескопам, светотехникам и разработчикам специальных оптических приборов подключились специалисты в области лазерной техники, отвечающие за фотобиологическую безопасность. Математические модели изменения диаметра зрачка глаза человека интересовали отечественных светотехников при решении прикладных задач. А вопросы фотобиологической безопасности стали интересовать их только в настоящее время после массового внедрения светодиодного освещения. В основе нормативной документации по фотобиологической безопасности источников света лежат зарубежные работы по лазерной безопасности, в которых используются математические модели зависимости диаметра зрачка глаза от уровня освещенности, яркости, потока фотонов. Джон Маршалл, профессор офтальмологии Университетского колледжа г. Лондона, занимался проблемами зрения с 1965 г., когда он получил грант Королевских ВВС, изучая разрушительные эффекты воздействия лазеров на сетчатку. Он говорил , что в то время им нужно было иметь гораздо лучшее понимание того, как свет взаимодействует с сетчаткой, и какие механизмы могут потенциально привести к повреждению глаза. Совмест- но с немецкими и американскими учеными он разработал базу данных, которая легла в основу международных кодексов практики для защиты людей от возможных разрушительных последствий лазеров. Результаты своих работ исследователи распространили на потенциальное губительное воздействие некогерентного света. Достижения авторов были включены в кодексы практики, используемые крупными международными организациями, такими как Всемирная организация здравоохранения (ВОЗ), экологические программы Организации Объединенных Наций и Международного Красного Креста [31].
Первые работы по лазерной безопасности позволили построить наглядные номограммы для сравнения различных источников света и областей безопасности (по доктору David H. Sliney). В этих номограммах особое место занимает диаметр зрачка, который полностью определяет проекцию предмета на сетчатку глаза. Также на представленной номограмме указаны области «синей опасности». Но время идет, наполняясь новыми открытиями и рождая новые определения норм в области фотобиологической безопасности. Например, в соответствии с ГОСТ IEC/TR 60825-9-2013 по безопасности лазерной аппаратуры , было введено понятие «максимально допустимая экспозиция» (МДЭ) (maximum permissible exposure (MPE)), которая при нормальных условиях не противоречит результатам появления биологических эффектов. Значение МДЭ зависит от длины волны излучения, длительности экспозиции, состояния ткани и размера места экспозиции. Для видимого и ближнего инфракрасного излучения в диапазоне от 380 до 1400 нм угловой размер источника определяет размер изображения на сетчатке, которое в значительной степени зависит от диаметра зрачка глаза. В данном ГОСТе определена «синяя опасность», максимально допустимая экспозиция которой оценивается применительно к глазу в диапазоне длин волн от 380 до 1400 нм и базируется на стандартном диаметре зрачка 7 мм для времени менее 0,5 с и 3 мм для времени более 0,5 с. В зависимости от яркости наблюдаемого светового поля диаметр зрачка варьируется между значением меньше, чем 2 мм, и больше, чем 7 мм, в зависимости от индивидуальных особенностей человека, предмета наблюдения, возраста. Формула (3) может быть использована для расчета диаметра зрачка d зр (мм) от значения яркости L (кд/м) объекта наблюдения.
d зр = 1,29 мм +
1 +
6,62мм
L 8,24 кд/м 2
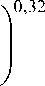
Данная формула сложна для вычислений. Более наглядная зависимость диаметра зрачка от яркости приведена в ГОСТ IEC/TR 60825-9-2013 [4] (рис. 3).
Корректировка значений МДЭ в диапазоне длин волн от 380 до 1400 нм для времени <0,5 с в отношении к стандартному диаметру зрачка производится в пропорциональной зависимости от его площади. В случаях, когда источник излучения используется при разных условиях освещения (например, в течение дня, ночью), наиболее верным расчет безопасности излучения будет при диаметре зрачка 7 мм [4].
Диаметр зрачка, мм
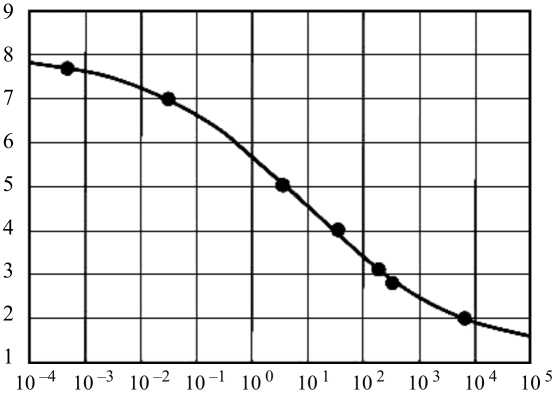
Яркость окружающего освещения, кд/м2
Рис. 3. Зависимость диаметра зрачка от яркости наблюдаемого поля в соответствии с ГОСТ IEC/TR 60825-9-2013 [4]
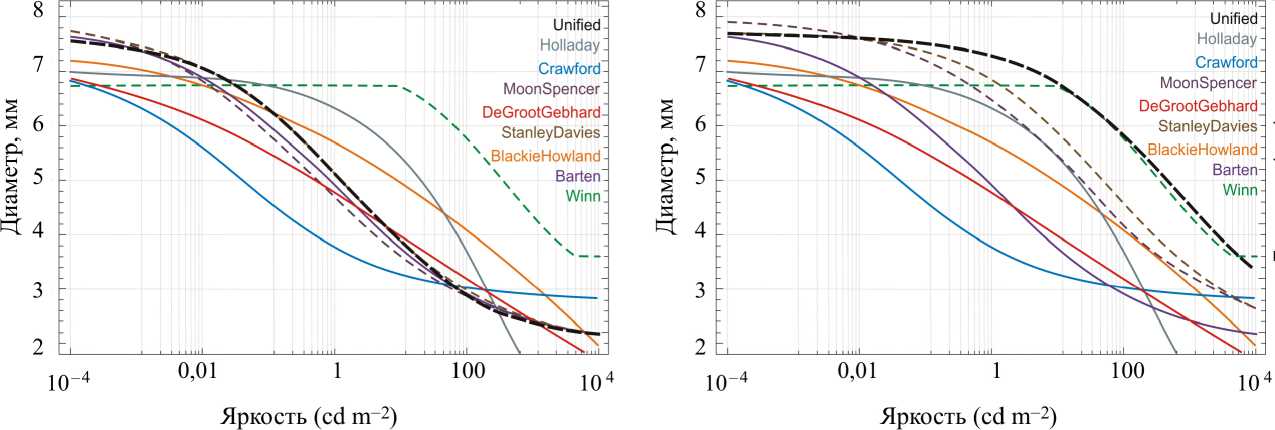
Во вновь разработанном ГОСТ Р МЭК 62471-2013 «Лампы и ламповые системы. Светобиологическая безопасность» [5] такого примечания нет. При этом следует отметить, что в нормативном документе ГОСТ IEC/TR 60825-9-2013 применяется математическая модель зависимости диаметра зрачка от яркости наблюдаемого поля в соответствии с P. Reeves, JOSA 4, 35–43 (1920), а это модели диаметра зрачка, разработанные до 1920 г. В работе A.B. Watson и J.I. Yellott – специалисты Исследовательского центра NASA и Отдела когнитивных наук Университета Калифорнии – для своих целей обобщили ранее разработанные математические модели зависимостей диаметра зрачка от яркости [46]. Они разработали новую единую формулу, которая включала в себя эффекты яркости, размер адаптирующего поля, возраст наблюдателя. Эти исследователи рассмотрели следующие модели: Holladay (1926); Crawford (1936); Moon and Spencer (1944); De Groot and Gebhard (1952); Winn, Whitaker, Elliott, and Phillips (1994); Stanley and Davies (1995); Barten (1999) и Blackie and Howland (1999). Обобщенные результаты приведены на рис. 4.
Такое многообразие математических моделей зависимостей диаметра зрачка от яркости и других факторов говорит о том, что модели построены в условиях высокой степени неопределенности знаний о функционировании биомеханической системы управления зрачком глаза в условиях современной световой среды .
Степень неопределенности уменьшается по мере появления новых открытий в области функционирования клеток глаза и их увязки
а
б
Рис. 4. Диаметр зрачка по нескольким формулам: а – диаметр поля 60°, бинокулярный просмотр; б – диаметр поля 10°, просмотр монокуляр. Пунктирные кривые показывают формулы, которые зависят от размера поля адаптации, возраста наблюдателя или бинокулярности.
Для обеих фигур, возраст волонтеров – 30 лет
в биомеханическую систему управления диаметром зрачка глаза. Эта система действует по законам функциональной системы П.К. Анохина. Он говорил: «…поиски “системы” как более высокого и общего для многих явлений принципа функционирования могут дать значительно больше, чем только одни аналитические методы при изучении частных процессов». В 1964 г. основатель кибернетики Н. Винер утверждал: «Главные проблемы биологии …связаны с системами и их организацией во времени и пространстве». Эти положения явились методической основой нашего анализа работы зрительного анализатора в условиях современной световой среды, которая по форме спектра отличается от солнечного света при заданном уровне освещенности.
Более 150 лет ученые считали, что в глазу человека находятся только клетки фоторецепторов, палочки и колбочки, которые через зрительную кору головного мозга, взаимодействуя между собой, позволяют человеку накапливать визуальный опыт. Считалось, что только эти клетки, которые преобразуют спектр света в кодовые послания управляющих сигналов, обеспечивают информацией биомеханическую систему глаза для поддержания качества зрения в световой среде обитания.
В 1991 г. были открыты особые светочувствительные ганглионарные клетки типа ipRGC (intrinsically photosensitive retinal ganglion cells), или mRGC (melanopsin-containing retinal ganglion cells) [3].
Они, в отличие от ранее известных ганглионарных клеток, содержат светочувствительный пигмент меланопсин, отличающийся от других фоточувствительных пигментов глаза: родопсина палочек и йодопсина колбочек, которые не умеют реагировать непосредственно на синий свет в области 480 нм. Эти светочувствительные ганглионарные клетки – новый, третий тип фоторецепторов сетчатки глаза. В отличие от известных уже в течение 200 лет палочек и колбочек, они напрямую возбуждаются под действием света даже при блокировании «классических» фоторецепторов глаза [34].
В результате исследований, проведенных в различных медицинских центрах и университетах США и Англии , было установлено, что ме-ланопсины имеют разные подтипы, обладающие индивидуальной световой чувствительностью. Фотоганглиозные клетки типа М являются предметом наиболее интенсивных исследований. Светочувствительным веществом этих клеток является меланопсин, который вступает в реакцию в широком диапазоне цветов – от 480 до 460 нм. Меланопсин подтипа М1 имеет два пика максимальной фоточувствительности к синему свету:
– М1 Brn3b- на 460 нм;
– М1 Brn3b+ на 480 нм.
По мере накопления информации уточняется общая форма кривых спектральной чувствительности меланопсина типа М1. Выявлено, что эффективность управления диаметром зрачка глаза на закрытие меланопсином М1 Brn3b+ определяется по форме кривой для зрячего и слепого человека [34]. Проведены также исследования изменений диаметра зрачка от степени возбуждения меланопсина [26].
У зрячих участников только высокая облученность светом 480 нм (более > 11 log фотоны см-2 с-1) вызывала значительно более устойчивую реакцию сужения зрачка во времени [34].
В настоящее время в мировых центрах развернуты широкомасштабные исследования по оценке влияния реакции зрительного анализатора человека и позвоночных на световые стимулы (синего, зеленого и красного света) [23, 24]. Для анализа реакции принят стандартный отклик (рис. 5).
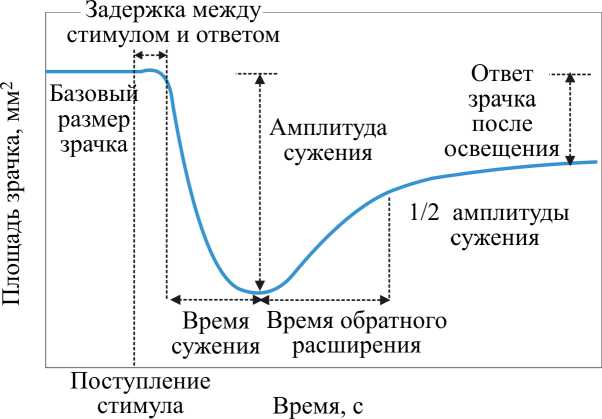
Рис. 5. Зависимость реакции зрачка на суживающий световой импульс [23]
Стандартный отклик характеризуется базовым размером зрачка (без светового стимула), амплитудой максимального сужения зрачка (при воздействии светового стимула) и ответом зрачка после освещения (post-illumination pupil response) PIPR. Именно показатель PIPR несет информацию об эффективности управления зрачком на сужение.
Исследования светового рефлекса зрачка мышей, на которых обычно проводится масштабное изучение роли ганглиозных клеток в управле- нии зрачком при разных световых стимулах, показали, что при синем свете 480 нм зрачок сужается значительно больше, чем при красном световом стимуле [24].
Аналогичные исследования были проведены на двух группах волонтеров. В одной группе волонтеры имели хорошее зрение, а во второй – были слепыми [34].
Доказано, что при люминесцентном освещении 4000 К, при освещенности на роговице 135 люмен 1,14·1014 (photons/cm2/s) и вычисленной облученности световых раздражителей сетчатки глаза – 0,54 mw/cm2, диаметр зрачка равен 4,19 мм. Это свидетельствует о том, что освещение люминесцентной лампой при провале в спектре в области 480 нм оказывает комплексное воздействие. Эффект воздействия световых стимулов (синего 470 нм и зеленого 532 нм) и отдельно синего света на глаза волонтеров описывает в своей работе Soomin Lee et al. [28]. Результирующие отклики PIPR представлены на рис. 6.
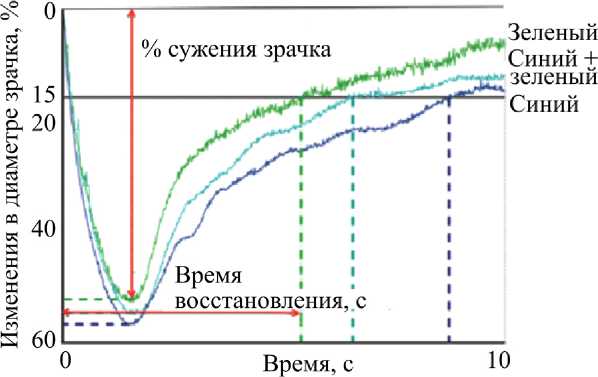
Рис. 6. Изменения диаметра зрачка японских волонтеров при раздельном и одновременном воздействии импульсами синего (470 нм) и зеленого (532 нм) света (источник света – матрица с отдельными светодиодами с провалом в области 480 нм)
Приведенная зависимость наглядно иллюстрирует, почему в фотооптических приборах ЭОП происходит увеличение диаметра зрачка, которое учитывает формула (2).
В настоящее время в исследованиях по оценке значения показателя PIPR используются источники синего и красного светов с разными длинами волн, с учетом лекарственной стимуляции глаз. Так, для оценки показателя PIPR D.H. McDougal и P.D.R. Gamlin в своей работе применяли источники красного света длиной 613 нм и синего света длиной 493 нм (рис. 7).
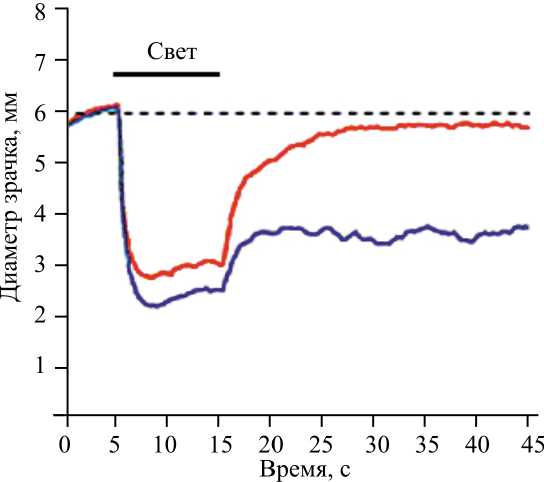
Рис. 7. Сужение зрачка, индуцированное 10 с световым стимулом 493 нм длины волны при 14.0 log quanta cm-2 s-1 облученности (синяя кривая) и 613 нм длины волны при 14.0 log quanta cm-2 s-1 облученности (красная кривая)
В другой работе для оценки показателя PIPR использовались световые стимулы 660 и 470 нм при применении лекарственной стимуляции глаз [38]. Возбуждение происходило постоянным и непрерывным стимулом 300 кд/м2 от 0 до 20-й секунды. Когда световой раздражитель прекращался, довольно быстро наступало расширение зрачка. Во всех проведенных исследованиях показатель PIPR при стимуляции синим светом имел большие значения, чем при стимуляции красным. Это важно учитывать при оценке диаметра зрачка глаза в световой среде искусственных источников света. Исследования по критерию показателя PIPR распространяются не только на здоровых волонтеров различных национальностей, но и на волонтеров, имеющих те или иные заболевания.
Также было проиллюстрировано, что на показатель PIPR глаза влияет возрастная макулярная дегенерация – прогрессирующее заболевание , характеризующееся поражением макулярной зоны (центральной зоны сетчатки в заднем полюсе глазного яблока), где находится всего три слоя ганглиозных клеток [32]. Поражение части клеток снижает эффективность управления диаметром зрачка на сжатие под воздействия синего света. Синий свет является хорошим стимулом для выявления людей с диагнозом ВМД (АВD) по реакции зрачка на сжатие. Исследователи отмечают, что меланопсин, управляющий величиной PIPR, дисфункционален (неэффективен) при наличии у волонтера начальной стадии возрастной макулярной дегенерации (AMD) [32].
Специалисты Института здоровья и биомедицинских инноваций, Технологического университета Квинсленда (Австралия) изучили клиническую полезность меланопсина ганглиозных клеток (ipRGC), контролирующих реакции postillumination зрачка (PIPR), в качестве нового метода для документирования внутренней функции сетчатки у пациентов с диабетом типа II, не имеющих ретинопатии [45]. PIPR измеряли у двух групп людей: 1) пациенты с сахарным диабетом II типа с нормальной толщиной сетчатки глаза и без диабетической ретинопатии; 2) здоровые волонтеры. В обоих случаях стимуляция проводилась синим светом (длиной волны 488 нм) и красным светом (длиной волны 610 нм). В результате исследований установлено, что у волонтеров с диабетом значения показателя PIPR резко падали и не удерживали зрачок в суженном состоянии.
Приведенные выше зависимости эффективности управления диаметром зрачка глаза на сужение по величине показателя PIPR иллюстрируют следующее:
– метод оценки по критерию «отклик зрачка после освещения» PIPR применим для всех световых стимулов (синего, красного, зеленого и их комбинации);
– зрачок наиболее эффективно откликается на стимул синего света с длиной волны 480 нм и имеет максимальную величину сужения зрачка, которая, как и показатель PIPR, зависит от величины фотонного потока;
– показатели критерия PIPR имеют наибольшие значения при воздействии синего света, чем при красном и зеленом световых стимулах;
– при стимуляции зрачка синим светом показатели критерия PIPR неадекватно зависели от лекарственных препаратов и уменьшались при наличии у человека возрастной макулярной дегенерации, начальных стадий сахарного диабета, не имеющего ретинопатии.
При облучении постоянным светом величина показателя PIPR совпадает с величиной максимального сужения зрачка и удерживатся на этой величине.
Слияние двух этапов работы зрачка мы определим как меланопсиновый эффект удержания зрачка при его сужении в световой среде. Из этого следует, что для эффективного поддержания зрачка в суженном состоянии в спектре света должна присутствовать необходимая доза синего света 480 нм. Такой оптимальный уровень дозы синего света 480 нм имеет солнечный свет, а все искусственные источники света имеют в спектре света провал в области 480 нм [6, 15]. Последствия этой особенности люминесцентного и светодиодного освещения можно оценить только с позиции общесистемного подхода к работе зрительного анализатора и качеству зрения человека в целом. Ухудшение зрения хорошо коррелирует с массовым внедрением энергосберегающего освещения в государствах с устойчивыми национальными предпочтениями в питании и образе жизни. К таким странам относятся Южная Корея, Япония, Китай. Жизнь, на всех ступенях ее развития, – «постоянное приспособление … к условиям существования» (И.М. Сеченов, 1863), то есть жизнь – непрекра-щающийся процесс адаптации к постоянно меняющимся условиям среды. Многие авторы считают, что и миопия является адаптационным откликом глаза на световую нагрузку [7, 9].
Рассмотрим эти адаптационные механизмы при отсутствии меланопсинового эффекта удержания зрачка при его сужении в современной искусственной световой среде. Согласно анатомо-физиологической схеме, существуют два взаимоувязанных канала управления зрачком глаза на уменьшение его диаметра.
Первый канал – ганглионарные клетки типа ipRGC. Воспринимая синий свет, они формируют сигнал, который поступает в средний мозг к ядру Эдингер–Вестфаля для управления сфинктером зрачка. При этом указано, что сигнал от ганглиозных клеток, объединяющих RGB-колбочки, поступает только в латеральное коленчатое тело.
Второй канал – зрительные фоточувстви-тельные клетки (палочки и колбочки, объединенные ганглиозными клетками, составляют 80 % от общего количества клеток). Они формируют сигналы для латерального коленчатого тела и полей зрительной коры. В поле 9-й коры больших полушарий головного мозга формируются корректирующие сигналы, которые, проходя через претектальный район, попадают в ядро Эдингер–Вестфаля. Структуры ядра Эдингер– Вестфаля интегрируют: а) сигналы от ганглиозных клеток с подтипом меланопсина ipRGC, которые управляют сфинктером зрачка; б) сигналы ганглиозных клеток (интегрирующих сигнал от палочек и колбочек), которые управляют цилиарной мышцей и регулируют поток водянистой влаги в Шлеммовом канале.
В цилиарной мышце различают четыре типа мышечных волокон. К первому типу относятся меридиональные мышечные волокна (мышца Брюкке). Они находятся в наружной части и развиты особенно хорошо. Эти волокна начинаются от склеральной шпоры, внутренней поверхности склеры, тотчас кзади от шпоры, иногда от корнеосклеральной трабекулы; идут компактным пучком меридионально кзади и, постепенно истончаясь, заканчиваются в экваториальной области хориоидеи и супрахориои-деи. Задние концы более глубоко расположенных меридиональных волокон ресничной мышцы переходят в эластические фибриллы собственно сосудистой оболочки и мембраны Бруха. Сокращение продольных волокон приводит также к растяжению трабекулярной мембраны и расширению Шлеммова канала, что увеличивает резорбтивную контактную поверхность трабекулярной ленты и улучшает отток водянистой влаги из глаза.
Ко второму типу относят радиальные или косые мышечные волокна (мышца Иванова). Они имеют менее правильное и более рыхлое строение. Волокна лежат в строме цилиарного тела, внутри от меридиональной мышцы, начавшись от угла передней камеры и частично от увеальной трабекулы.
Третий тип – циркулярные мышечные волокна (мышца Мюллера). Состоят из отдельных пучков волокон, не образующих компактной мышечной массы и имеющих циркулярное направление. Они расположены в передневнутреннем отделе цилиарного тела, у внутреннего ребра. Эти волокна рассматриваются как часть радиальной мышцы. Сокращение радиальной и циркулярной порций цилиарной мышцы уменьшает просвет кольца, образуемого цилиарным телом ЦТ, и тем самым приближает место фиксации цинновой связки к экватору хрусталика, что приводит к увеличению его кривизны.
К четвертому типу относятся иридальные мышечные волокна (мышца Калазанса), расположенные у места соединения корня радужки и цилиарной мышцы. Представлены тонким пучком мышечных волокон, идущих к корню радужки. Очевидно, регулируют зазор между хрусталиком и радужкой, обеспечивая минимальное динамическое сопротивление для оттока водянистой влаги из задней камеры в переднюю.
Совместная работа перечисленных мышц обеспечивает акт аккомодации. При напряжении цилиарной мышцы связки расслабляются, снижая напряжение капсулы хрусталика. При этом форма хрусталика становится округлой, а сам он передвигается по оптической оси в сторону радужки. Общая схема таких перемещений изложена в работах биомеханика И.Н. Ко- шица. Но модели перемещений хорошо изучены у взрослых людей, а не у детей. Цилиарное тело богато нервными окончаниями, однако у новорожденных оно развито недостаточно, поэтому многие заболевания протекают безболезненно. Только к 7–10-летнему возрасту цилиарное тело становится функционально полноценным [2, 12, 21]. С учетом этого факта очень важно, чтобы спектр искусственной световой среды был адекватен солнечному свету.
В любом возрасте рассматривание предмета, располагающегося на близком расстоянии, сопровождается аккомодацией, конвергенцией и сужением зрачка. С помощью этих трех физиологических механизмов осуществляется возможность лучшего восприятия, лучшего видения рассматриваемого предмета. По существу все три явления представляют собой слагаемые одного акта – установки глаз на близкое расстояние. Раньше было много споров насчет того, с чем связано сужение зрачков при рассматривании предмета на близком расстоянии – с аккомодацией или с конвергенцией. Оказалось – и с тем, и с другим. Сужение зрачков при установке глаз на близкое расстояние осуществляется только тогда, когда предмет находится на расстоянии 40 см от глаз и ближе. Наиболее резко проявляется сужение зрачков при расстоянии предмета от глаз 15–20 см. На рис. 8 приведена зависимость изменения диаметра зрачка от уровня аккомодации.
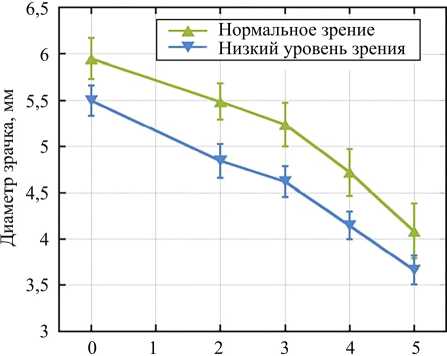
Вергенция стимула (D)
Рис. 8. Зависимость изменения диаметра зрачка от уровня аккомодация [44]
Наиболее признанной теорией аккомодации является теория Гельмгольца, который показал, что при ее максимальном напряжении переднезадний размер хрусталика увеличивает- ся с 3,6 до 4,0 мм, радиус кривизны передней поверхности хрусталика изменяется с 10 до 6 мм, задней поверхности – с 6,0 до 5,6 мм [19]. Чем больше уровень аккомодации, тем меньше передний радиус хрусталика, который имеет свои физические и возрастные ограничения [37].
Уменьшение кривизны хрусталика и продвижение его к радужке приводит к дополнительному напряжению мышцы Калазанса для обеспечения адекватного зазора между хрусталиком и радужкой, то есть равенство притока и оттока водянистой влаги. В 2010 г. Janice Tarrant et al. исследовал вопросы взаимосвязи кривизны хрусталика, четкости изображения, аберраций волнового фронта и процессов аккомодации [44]. В своих работах они применяли анализатор волнового фронта для измерения глазной аберрации у 13 волонтеров с хорошим зрением (emmetropes) и 17 волонтеров с миопией для рассмотрения 4 предметов на разных расстояниях. При приближении рассматриваемого предмета сужение зрачков проявляется сначала в очень небольшой степени, затем они суживаются резко и быстро. При усилении аккомодации и конвергенции, которые действуют синергично, происходит дополнительное сужение зрачка. Диапазон сужения зрачков при установке глаз на близкое расстояние бывает самый разнообразный [16, 37, 39]. Это говорит о том, что при миопии цилиарная мышца напряжена, больше, чем при эмметропии. В этом случае хрусталик более выпукл, и происходит первоначальное нарушение равенства между притоком и оттоком водянистой влаги.
Механизм сужения и удержания зрачка глаза при аккомодации и конвергенции привлекает исследователей для решения прикладных задач [25, 27]. В своих работах для формирования зрительных образов авторы применяли ЖК-мониторы, OLED-микродисплей и лист белой бумаги с буквами, подсвеченными лампой накаливания. Ученых более всего интересовало влияние синего света 480 нм на управление диаметром зрачка при его освещении светом, отличным от солнечного. Некоторые авторы в качестве зрительного стимула использовали буквы на экране ЖК-монитора и OLED-микродисплея (eMagin, США) [25]. Уровень освещенности составлял порядка 15 кд/м2. Исследовалось две ситуации: далеко (ЖК-монитор) – 2,75 м; близко (OLED-микродисплей) – 30 см. Исследования проводились при участии волонтеров – молодых людей в возрасте 27,8 ± 2,4 г.
Другие исследователи в качестве зрительного стимула использовали ЖК-монитор для просмотра фильмов, а в качестве волонтеров у них выступали дети (что очень актуально) в возрасте от 6 до 16 лет [27]: 76 – были типично развивающиеся дети и 41 ребенок – с синдромом Дауна (DS). В ходе проведения исследования получена зависимость изменения диаметра зрачка от уровня аккомодация (рис. 9).
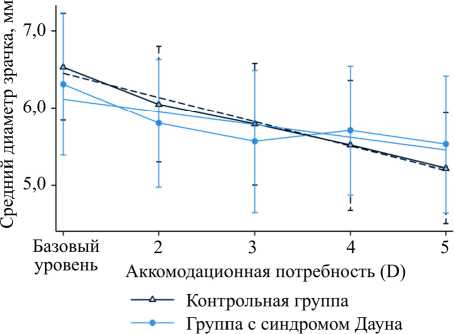
Рис. 9. Зависимость изменения диаметра зрачка от уровня аккомодация
В работе S. Plainis в качестве предмета наблюдения была буква «Е», напечатанная на белой бумаге, освещенной лампой накаливания [40]. Яркость фона – 5 кд/м2. Тем не менее освещенность сетчатки глаза не была постоянной для каждого предмета и размещения уровня из-за различий в размерах зрачка. Все измерения проводились с естественными зрачками, без введения каких-либо препаратов (мидриатиче-ского или циклоплегического). В исследованиях приняли участие семь волонтеров в возрасте от 23 до 33 лет (средний возраст – 28 лет). Четыре волонтера имели нормальное зрение (emmetropes), а три волонтера – низкий уровень зрения (мyopes) (диапазон: от –2,00 до –2,50 D), скорректированный очками [40]. Чем выше был адаптивный ответ, тем больше была степень миоза, и это отношение носило линейный характер. Каждая диоптрия аккомодации индуцирует 0,18 мм сужения зрачка. Линейный характер зависимости хорошо коррелирует с зависимостью, представленной на рис. 9.
Исходя из взаимного расположения хрусталика, радужной оболочки, ресничной мышцы и высокой чувствительности системы управления диаметром зрачка, можно составить математическую модель (формула 4) фактического значения диаметра зрачка при его закры- тии в условиях световой среды при выполнении определенной зрительной работы.
D ф = D н (E, λ) – ΔD(A) – ΔD(K), (4)
где D н (E, λ) – начальный диаметр зрачка при уровне освещенности и спектре света среды обитания;
ΔD(A) – изменение диаметра зрачка при аккомодации, которая индуцирована степенью напряженности цилиарной мышцы (мышца Брюк-ке, Иванова, Мюллера и Калазанса);
ΔD(K) – изменение диаметра зрачка при конвергенции.
С методической точки зрения очень важно, к какому значению стремится текущее значение диаметра зрачка при выполнении зрительной работы.
Качество зрительного восприятия зависит от разрешающей способности сетчатки, дифракции света в области зрачка и свойств оптических сред глаз. Одной из особенностей человеческого глаза является наличие глубины фокусной области, в пределах которой может не происходить изменения качества изображения. Значит, существует оптимально достаточное значение диаметра зрачка, которое обеспечивает такую фокусную настройку.
Зрительное восприятие регулируется не только физиологической оптикой, но и корковыми структурами центральной нервной системы. Улучшая оптику глаза путем снижения аберрации, можно повысить зрительное разрешение от обычного уровня к более высокому.
Различают хроматическую, дифракционную и сферическую аберрации.
Хроматическая аберрация – искажение изображения, связанное с тем, что лучи видимого света, имея разную длину волны и падая на линзу параллельным пучком, преломляясь, фокусируются не в одной точке. Коротковолновые лучи (сине-зеленые) фокусируются дальше от сетчатки, чем длинноволновые (красные). Это явление называется хроматизмом положения. В результате изображение размывается, и края его окрашиваются. Если фокус синих лучей совместить с сетчаткой, изображение точки будет окружено красным ореолом, и наоборот. Очертания воспринимаемых предметов могут окрашиваться при гиперметропии – красным, при миопии – синим цветом. В условиях освещения белым светом человек не различает цветные каемки вокруг наблюдаемых предметов. Это объясняется наложением цветных ореолов один на другой и малыми угловыми раз- мерами цветных каемок. Хроматические аберрации не оказывают существенного влияния на центральное зрение.
Дифракционная аберрация связана с нарушением прямолинейности, отклонением световой волны при ее распространении мимо резких краев непрозрачных или прозрачных структур, формирующих отверстия. Такой структурой в глазу является зрачок. В результате дифракции света на границе зрачка, где согласно законам геометрической оптики должен быть четкий переход от тени к свету, возникает ряд светлых и темных дифракционных колец, проецируемых на сетчатку. С уменьшением диаметра зрачка диаметр дифракционного круга светорассеяния увеличивается. Но при этом сферическая аберрация уменьшается.
Сферическая аберрация характеризует состояние, при котором есть различие в преломлении светового луча между центром сферической оптической поверхности и ее периферией. В основе сферической аберрации лежит кривизна роговицы и хрусталика. Влияние сферической аберрации на качество изображения зависит от величины зрачка. При малых размерах зрачка – от 2 до 4 мм – сферическая аберрация минимальна, но резко возрастает при расширении зрачка. Для поддержания качества изображения на максимальном уровне при обеспечении минимального уровня дифракционной и сферической аберраций необходимо обеспечить оптимально достаточную величину диаметра зрачка (D од ) не только для обеспечения минимального уровня аберрации, но и для обеспечения процесса аккомодации (5) [1].
D од = D н (E, λ) – ΔD (A) – ΔD (K) = const. (5)
D н (E, λ) – формирует уровень освещенности и спектр света среды обитания.
Все современные энергосберегающие источники света имеют низкий уровень энергии на длине волны 480 нм из-за провала в этой области по сравнению со спектром солнечного света при той же цветовой температуре и уровне освещенности. Неадекватная работа канала управления диаметром зрачка в условиях искусственного освещения приводит к нарушению условий меланопсино-вого эффекта удержания зрачка при его сужении. Что в свою очередь провоцирует на дополнительную работу ресничную мышцу для поддержания качественного зрения. Все это в совокупности при длительной зрительной нагрузке в условиях современной световой среды увеличивает риски возникновения глазных болезней.
При остаточном напряжении ресничной мышцы и ее сильном перенапряжении происходит нарушение соотношения притока и оттока водянистой влаги (ВВ). Роль и значимость этих нарушений в развитии миопии подробно изложены в работах И.Н. Кошица и соавт. [17, 18]. В результате этих исследований и из описания механизмов регуляции увеосклерального пути оттока (УСПО) стала более понятной роль радиальной и циркулярной порций ресничных мышц (мышц Иванова и Мюллера) в активной регуляции увеосклерального пути оттока в глазу.
Средняя скорость продуцирования водянистой влаги у человека в норме составляет около 2 мм3/мин, диапазон изменения в норме – 1,5–4,5 мм3/мин. Период полного обновления ВВ в глазу составляет 90 мин, т.е. через передний отдел глаза в сутки протекает примерно 3 мл (3 см3) водянистой влаги при среднем объеме глаза менее 7,5 мм3. Небольшие вариации в производстве или оттоке внутриглазной жидкости будут иметь большое влияние на внутриглазное давление [14].
Для обеспечения такой производительности и четкой работы мышц по управлению потоками необходимо: 1) чтобы сигналы, поступающие на вход ядра Эдингер–Вестфаля, формировались при воздействии солнечного спектра света на клетки сетчатки; 2) чтобы солнечный спектр света адаптировал структуру зрительного анализатора под адекватные алгоритмы работы функциональных элементов для обеспечения качества зрения при минимизации рисков заболеваний. Спектр солнечного света с учетом гигиенических ограничений адекватно управляет состоянием мышцы Брюкке, Мюллера и Иванова, а также состоянием клапанов оттока водянистой жидкости, которые рассмотрены в работе И.Н. Кошица и соавт. [17]. Дополнительно нами рассмотрено состояние мышцы Калазанса, которая управляет размером зазора между радужкой и хрусталиком при аккомодации. Роли и работе клапана «ирис – хрусталик» в рассмотренных моделях управления потоком водянистой влаги не уделялось достаточного внимания [17]. Хотя в моделях развития глаукомы активно обсуждается роль этого зазора, но без учета состояния (деградации) мышц Кала-занса. В частности, специалисты кафедры биомедицинской инженерии и факультета химической технологии и материаловедения Университета Миннесоты провели математическое моделирование процессов аккомодационных микрофлюктуаций и контура радужки [30]. Исследования продолжаются, но их математические модели не учитывают работу мышцы Калазанса.
На медикаментозных моделях различных тонических состояний цилиарной мышцы было установлено, что работа аккомодационного аппарата имеет непосредственное отношение к гидродинамике глаза, причем направление перемещения и объемы жидкости зависят от амплитуды флюктуаций аккомодации. Спектр света, не адекватный солнечному спектру, порождает дисгармонизацию в работе функциональных элементов зрительного анализатора и это проявляется в виде:
– расширенного зрачка при отсутствии в спектре света 480 нм, что характерно для энергосберегающего освещения и подсветки мониторов;
-
– нарушения синтеза родопсина из витамина А – провал в спектре 380 и 480 нм;
-
– синдрома сухих глаз при работе за мониторами, что свидетельствует о нарушении управления водянистой влагой;
– тенденции увеличения внутриглазного давления при длительном нахождении (5 часов) в условиях светодиодного освещения [8]. Так, внутриглазное давление, измеренное методом бесконтактной тонометрии (Tn), составляло до начала исследования 17,35 ± 1,1 мм рт. ст. и после его завершения 17,67 ± 1,1 мм рт. ст. (5 дней) при уровне освещенности 400 лк и коррелированной цветовой температуре 4000–4500 К [30].
Для истинного внутриглазного давления зона низкой нормы (9–12 мм рт. ст.), зона средней нормы (13–16 мм рт. ст.) и зона высокой нормы (17–22 мм рт. ст.) зависят как от анатомических особенностей расположения венозного синуса, так и от особенностей прикрепления ресничной мышцы к склеральной шпоре. Все это иллюстрирует, что в условиях искусственного освещения имеет место дисгармонизация в управлении потоками водянистой влаги из-за дополнительной компенсации мышцами ресничного тела неэффективного управления сужением зрачка при рассмотрении предмета вблизи. Накопленное напряжение в мышцах, управляющих потоками водяной влаги, увеличивает риски повышения неопределенности в управлении состоянием «клапанов» трабекулярного и увеосклерального путей. При этом нарушение равенства «притока и оттока» водянистой влаги приводит к формированию избыточного ее количества, создавая предпосылки к ускоренному удлинению оптической оси глаза.
Средний размер глаза человека в длину от роговицы до центра сетчатки составляет 23,5 мм. Каждый прирост глаза на 1 мм в длину добавляет 3,0 диоптрии миопии.
Нарушение оттока водянистой влаги на протяжении времени является предпосылкой для развития глаукомы, хориоидальной неоваскуляризации и макулярной дегенерации [8, 28, 33]. Что касается катаракты, существуют различные исследования ее связи с миопией высокой степени [36].
При нарушении условий меланопсиново-го эффекта удержания зрачка при его сужении происходят системные деструктивные изменения в функциональных элементах глаза. В современной системе освещения и устройствах отображения информации таким системным раздражителем является неадекватное управление диаметром зрачка в течение длительного времени, что дополнительно нагружает механизм аккомодации и конвергенции.
Выводы:
-
1. Современные математические модели флюктуаций диаметра зрачка глаза нуждаются в уточнении с учетом новых знаний о функциональных особенностях клеток сетчатки и спектра энергосберегающих источников света.
-
2. Сформулированы условия меланопси-нового эффекта удержания зрачка при его сужении в световой среде, заключающееся в том, что в спектре любого искусственного источника должна присутствовать необходимая доза синего света 480 нм.
-
3. Неадекватное управление диаметром зрачка в условиях искусственного освещения приводит к нарушению условий меланопсино-вого эффекта удержания зрачка при его сужении и дополнительной работе ресничной мышцы для поддержания качественного зрения и соблюдения соотношения притока и оттока водянистой влаги. Все это в совокупности при длительной зрительной нагрузке увеличивает риски возникновения глазных болезней в условиях современной световой среды.
Список литературы Нарушение меланопсинового эффекта сужения зрачка - фактор риска заболевания глаз
- Аветисов С.Э., Шелудченко В.М. Нужно ли нам супер-зрение? Аберрации глаза //Клиническая физиология глаза. -2006. -C. 488-501. -URL: http://miroft.org.ua/origunalarts/315.html (дата обращения: 13.10.2016)
- Бакуткин В.В., Киричук В.Ф., Кузнецова Э.В. Влияние динамической электронейростимуляции на аккомодационные способности глаза человека//Проблемы оптической физики и биофотоники: материалы XIII Междунар. молодежной научной школы по оптике, лазерной физике и биофотонике. -Саратов: Новый ветер, 2009. -219 с.
- Берман С.М., Клиер Р.Д. Недавно открытый фоторецептор человека и предыдущие исследования в области зрения//Светотехника. -2008. -№ 3. -С. 49-53.
- ГОСТ IEC/TR 60825-9-2013. Безопасность лазерной аппаратуры. Ч. 9. Компиляция максимально допустимой экспозиции некогерентного оптического излучения . -М.: Стандартинформ, 2014. -36 с. -URL: http://gostpdf.ru/cont/files/60825-9-2013/gost-60825-9-2013.13333.pdf (дата обращения: 02.10.2016).
- ГОСТ Р МЭК 62471-2013. Лампы и ламповые системы. Светобиологическая безопасность. -М., 2013. -URL: http://docs.cntd.ru/document/1200104817 (дата обращения: 10.10.2016).
- Дейнего В.Н., Капцов В.А. Свет энергосберегающих и светодиодных ламп и здоровье человека//Гигиена и санитария. -2013. -№ 6. -С. 81-84.
- Дорошева Е.А. Эволюционный подход к вопросам формирования близорукости: перестройка зрительного анализатора как адаптация к социокультурным условиям//Экспериментальная психология. -2014. -T. 7, № 3. -С. 83-96.
- Исследование эффективности и безопасности для здоровья светодиодных источников света/М.В. Осико, О.А. Гизингер, Л.Ф. Телешева, И.И. Долгушин, О.И. Огнева, А.А. Федосов, А.В. Кудряшов, М.Г. Вахитов, А.С. Калинина//Современные проблемы науки и образования. -2013. -№ 6. -C. 566.
- Классификация исполнительных механизмов «предметной» аккомодации у человека/И.Н. Кошиц, О.В. Светлова, Ф.Н. Макаров, Г.А. Шилкин//Российская детская офтальмология. -2012. -№ 4. -С. 28-36.
- Клиническая анатомия органа зрения: части цилиарного тела //StudFiles: файловый архив студентов. -URL: http://www.studfiles.ru/preview/2243441/page:7/(дата обращения: 15.10.2016).
- Мешков В.В. Основа светотехники. -М.; Л.: Госэнергоиздат, 1961. -416 с.
- Николаенко Г.А. Цилиарное тело глаза человека в онтогенезе: дис. … канд. мед. наук. -Владивосток: Владивостокский государственный медицинский университет, 2005. -140 c.
- Пенегин Н.И. Влияние яркости и размера поля зрения на диаметр зрачка//Труды I конф. по физиол. оптике. -М.; Л., 1936. -396 с.
- Першин Б.С. Гидродинамический баланс глазного яблока при интравитреальном введении дополнительного объема жидкости (экспериментально-клиническое исследование): дис.. канд. мед. наук. -М., 2012. -124 с.
- Профилактика глазных заболеваний у детей и подростков в учебных помещениях со светодиодными источниками света первого поколения/В.Н. Дейнего, В.А. Капцов, Л.И. Балашевич, О.В. Светлова, Ф.Н. Макаров, М.Г. Гусева, И.Н. Кошиц//Российская детская офтальмология. -2016. -№ 2. -С. 57-72.
- Реакция зрачков при установке глаз на близкое расстояние //Современная офтальмология: информационный портал. -URL: http://zrenue.com/nejrooftalmologija/51-normalnye-reakcii-suzhenija-zrachkov/387-reakcija-zrachka-pri-ustanovke-glaz-na-blizkoe-rasstojanie.html (дата обращения: 15.10.2016).
- Светлова О.В., Кошиц И.Н. Взаимодействие основных путей оттока внутриглазной жидкости с механизмом аккомодации: учебное пособие. -СПб.: Издат. дом СПб. МАПО, 2002. -50 с.
- Светлова О.В., Кошиц И.Н., Дроздова Г.А. Взаимодействие механизмов оттока водянистой влаги и аккомодации при миопии и глаукоме. Патологическая физиология глаза: монография. -2-е изд., испр. и доп. -СПб.: Изд-во СЗГМУ им. И. И. Мечникова, 2016. -160 с.
- Федоров С.Н., Ярцева Н.С., Исманкулов А.О. Рефракция и аккомодация. Глазные болезни. -2-е изд., перераб. и доп. -М., 2005. -440 с.
- Хацевич Т.Н. Медицинские оптические приборы: Физиологическая оптика: учебное пособие. -Новосибирск: СГГА, 1998. -Ч.1. -98 с.
- Цилиарное тело //Все новости офтальмологии: национальный офтальмологический проект. -URL: http://www.eyenews.ru/12/13/112 (дата обращения: 15.10.2016).
- Электронно-оптический преобразователь (ЭОП) . -URL: http://go-radio.ru/electronno-opticheskiy-preobrazovatel.html (дата обращения: 10.10.2016).
- Adhikari P., Zele A.J., Feigl B. Post-Illumination Pupil Response//Investigative Ophthalmology & Visual Science. -2015. -Vol. 56. -P. 3838-3849 DOI: 10.1167/iovs.14-16233
- Characterization of structure and function of the mouse retina using pattern electroretinography, pupil light reflex, and optical coherence tomography/K. Mohan, M.M. Harper, H. Kecova, E.A. Ye, T. Lazic, D.S. Sakaguchi, R.H. Kardon, S.D. Grozdanic//Vet. Ophthalmol. -2012. -Vol. 15, № 2. -P. 94-104 DOI: 10.1111/j.1463-5224.2012.01034.x
- Chirre E., Prieto P.M., Artal P. Dynamics of the near response under natural viewing conditions with an open-view sensor//Biomed Opt Express. -2015. -Vol. 6, № 10. -P. 4200-4211 DOI: 10.1364/BOE.6.004200
- Contribution of human melanopsin retinal ganglion cells to steady-state pupil responses/Sei-ichi Tsujimura, K. Ukai, D. Ohama, A. Nuruki, K. Yunokuchi//Proc. R. Soc. B. -2010. -Vol. 277. -P. 2485-2492 DOI: 10.1098/rspb.2010.0330
- Doyle L., Saunders K.J., Little J.-A. Trying to see, failing to focus: near visual impairment in Down syndrome //Scientific Reports. -2016. -URL: http://www.nature.com/articles/srep20444 (дата обращения: 15.10.2016) DOI: 10.1038/srep20444
- Effect of simultaneous exposure to extremely short pulses of blue and green light on human pupillary constriction/S. Lee, S. Ishibashi, Y. Shimomura, T. Katsuura//Journal of Physiological Anthropology. -2016. -Vol.35. -P. 20 DOI: 10.1186/s40101-016-0109-3
- Ensuring safety in LED lighting //Electronics Weekly.com. -2012. -URL: http://www.electronicsweekly.com/news/products/led/ensuring-safety-in-led-lighting-2012-11 (дата обращения: 02.10.2016).
- Huang E.C., Barocas V.H. Accommodative microfluctuations and iris contour//Journal of Vision. -2006. -Vol. 6, № 5. -P. 653-660.
- Marshall J. Understanding risks of phototoxicity on the eye //Points de Vue, International Review of Ophthalmic Optics. -2014. -№ 71. -URL: http://www.pointsdevue.com/article/understanding-risks-phototoxicity-eye (дата обращения: 10.10.2016).
- Maynard M.L., Zele A.J., Feigl B. Melanopsin-Mediated Post-Illumination Pupil Response in Early Age-Related Macular Degeneration//Investigative Ophthalmology & Visual Science October. -2015. -Vol.56. -P. 6906-6913 DOI: 10.1167/iovs.15-17357
- McDougal D.H., Gamlin P.D.R. Pupillary Control Pathways//The Senses: A Comprehensive Reference. -2008. -Vol. 1. -P. 521-536.
- Melanopsin and Rod-Cone Photoreceptors Play Different Roles in Mediating Pupillary Light Responses during Exposure to Continuous Light in Humans Меланопсин и Род-Cone Humans/J.J. Gooley, I.H. Mien, M.A.St. Hilaire, S.-C. Yeo, E. Chern-Pin Chua, E. van Reen, C.J. Hanley, J.T. Hull, C.A. Czeisler, S.W. Lockley//Journal of Neuroscience. -2012. -Vol. 32, № 41. -P. 14242-14253 DOI: 10.1523/JNEUROSCI.1321-12.2012
- Morgan I.G., Ohno-Matsui K., Saw S.M. Myopia//Lancet. -2012. -Vol.379, № 9827. -P. 1739-1748.
- Myopia and age-related cataract: a systematic review and meta-analysis/C.W. Pan, C.Y. Cheng, S.M. Saw, J.J. Wang, T.Y. Wong//Am. J. Ophthalmol. -2013. -Vol. 156, № 5. -P. 1021-1033.
- Navarro R., Santamaría J., Bescós J. Accommodation-dependent model of the human eye with aspherics//Journal of the Optical Society of America A. -1985. -Vol. 2, № 8. -P. 1273-1280 DOI: 10.1364/JOSAA.2.001273
- Nissen C., Sander B., Lund-Andersen H. The Effect of Pupil Size on Stimulation of the Melanopsin Containing Retinal Ganglion Cells, as Evaluated by Monochromatic Pupillometry//Frontiers in Neurology. -2011. -Vol. 2. -P. 92 DOI: 10.3389/fneur.2011.00092
- Plainis S. Accommodative response: Physiology and Behaviouг //10th Aegean Summer School in Visnal Optics Hevsnisos Crete 02.10-04.10, 2011. -URL: http://publicana.ru/files/mehanizm-akkommodacii-glaza.pdf (дата обращения: 24.10.2016).
- Plainis S., Ginis H.S., Pallikaris A. The effect of ocular aberrations on steady-state errors of accommodative response//J.Vis. -2005. -Vol.5, № 7. -Р. 466-477.
- Prevalence of Myopia and its Association with Body Stature and Educational Level in 19-Year-Old Male Conscripts in Seoul, South Korea/S.K. Jung, J.H. Lee, H. Kakizaki, D. Jee//Invest. Ophthalmol. Vis. Sci. -2012. -Vol. 53, № 9. -P. 5579-5583 DOI: 10.1167/iovs.12-10106
- Short wavelength enrichment of polychromatic light enhances human melatonin suppression potency/G.C. Brainard, J.P. Hanifin, B Warfield., M. Stone, M. James, M. Ayers, A. Kubey, B. Byrne, M. Rollag//J. Pineal Res. -2015. -Vol. 58. -P. 352-361.
- Sliney D.H. Health and safety implications of new lighting technologies//Light and Engineering. -2010. -Vol. 18, № 4. -P. 20-22.
- Tarrant J., Roorda A., Wildsoet C.F. Determining the accommodative response from wavefront aberrations//Journal of Vision. -2010. -Vol. 10, № 5. -P. 4.
- The post-illumination pupil response of melanopsin-expressing intrinsically photosensitive retinal ganglion cells in diabetes/B.L. Feigl, A.J. Zele, S.M. Fader, A.N. Howes, C.E. Hughes, K.A. Jones, R. Jones//Acta Ophthalmol. -2012. -Vol. 90, № 3. -P. 230-234 DOI: 10.1111/j.1755-3768.2011.02226.x
- Watson A.B., Yellott J.I. A unified formula for light-adapted pupil size//Journal of Vision. -2012. -Vol.12, № 12. -P. 1-16 DOI: 10.1167/12.10.12


