Нарушение митохондриального биогенеза является причиной развития радиационно-индуцированное оксидативного стресса в клетках линии К562
Автор: Саенко Юрий Владимирович, Столбовская Ольга Виниаминовна, Семенова Марина Анатольевна, Викторов Денис Александрович, Мастиленко Андрей Владимирович, Остаточников Владимир Александрович, Глущенко Евгения Сергеевна, Антонова Анастасия Владимировна, Живодерников Иван Владимирович, Свеколкин Виктор Павлович, Белогубов Павел Васильевич
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика и электроника
Статья в выпуске: 4-3 т.15, 2013 года.
Бесплатный доступ
В настоящей работе предпринята попытка изучить динамику и причины возникновения и развития радиационно-индуцированного оксидативного стресса в раковых клетках и оценить роль митохондрий составляющей в этом процессе. Показано, что радиационно-индуцированная генерация АФК в клетках К562 имеет два временных максимума и различные источники. Причиной увеличения радиационно-индуцированной концентрации АФК через 24-48 часов можно назвать рост митохондриального потенциала связанный с увеличением внутриклеточной митохондриальной массы. Радиационное воздействие стимулирует в клетках линии К562 увеличение экспрессии генов продукты, которых участвуют в процессе катаболизма ацетильных групп и окислительного фосфорилирования, но снижает экспрессию генов кодирующих белки участвующих в митохондриальном биогенезе.
Рак, лейкемия, активные формы кислорода, митохондриальный потенциал, митохондриальная масса, митохондриальный биогенез, экспрессия генов, рентгеновское излучение
Короткий адрес: https://sciup.org/148202369
IDR: 148202369 | УДК: 577.34-
Текст научной статьи Нарушение митохондриального биогенеза является причиной развития радиационно-индуцированное оксидативного стресса в клетках линии К562
Остаточников Владимир Александрович, младший научный сотрудник, аспирант.
Антонова Анастасия Владимировна, младший научный сотрудник.
Живодерников Иван Владимирович, стажер-исследователь, студент 4 курса специальности «Биология».
Свеколкин Виктор Павлович, стажер-исследователь, студент 3 курса специальности «Биология».
Белогубов Павел Васильевич, студент 3 курса специальности «Лечебное дело».
кислорода, митохондриальный потенциал, мито-экспрессия генов, рентгеновское излучение.
непосредственного взаимодействия фотонов высокой энергии с водой [14]. К АФК относят короткоживущие радикалы - гидроксильный радикал и супероксид анион радикал, а также перекись водорода. Из трех представителей АФК, только гидроксильный радикал является непосредственным продуктом радиолиза воды [7]. Супероксид анион радикал и перекись водорода называют вторичными АФК. Они генерируются в результате протекания цепных радикальных реакций инициируемых гидроксильным радикалом. Теоретические расчёты продемонстрировали, что количество вторичных радикалов возникающих после радиационного воздействия соответствует количеству АФК генерируемых в процессе нормального метаболизма клетки[21]. Вторичные АФК могут генерироваться в результате ряда внутриклеточных процессов, среди которых процессы дыхания, НАДФ оксидаза, ксан-тиноксидаза и ряд других процессов [8]. Основным поставщиком супероксид анион радикала и перекиси водорода являются митохондрии [9]. При нормальных условиях от 1 до 4 процентов кислорода, поглощаемых клеткой превращается при участии дыхательной цепи в вторичные АФК [10]. Наиболее вероятным местом утечки АФК из дыхательной цепи является убисемихинон – продукт одноэлектронного восстановления убихинона. Активные формы кислорода, генерируемые в процессе патологического клеточного метаболизма, могут выступать в качестве повреждающих агентов и инициировать клеточное повреждение и смерть [15]. Ионизирующее излучение может также вызывать повреждения биологических молекул путем разрыва химических связей. ДНК наиболее чувствительная к воздействию ионизирующего излучения [17]. Процессы свободно-радикального повреждения ДНК несомненно служат причиной мутаций и возникновения генетической нестабильности приводящим к формированию радиорезистентных клеточных клонов. [1]. ДНК содержащаяся в митохондриях является менее защищённой от стрессовых воздействий, по сравнению с ядерной ДНК [2,23]. Радиация может оказывать существенное влияние на митохондрии, что проявляется через нарушение проницаемости митохондриальных мембран, нарушение синтеза АТФ, проникновением Ca2+ в митохондриальный матрикс и снижением митохондриального потенциала [20]. Таким образом, повреждённые митохондрии могут стать причиной увеличения внутриклеточной концентрации АФК и вызвать отсроченное во времени повреждение ДНК и возникновение генетической нестабильности [11,12].
В настоящей работе нами предпринята попытка изучить динамику и причины возникновения и развития радиационно-индуцированного оксидативного стресса в раковых клетках и оценить роль митохондрий составляющей в этом процессе.
МАТЕРИАЛЫ И МЕТОДЫ
В экспериментах использовали клеточную линию миелогенной лейкемии человека К562. Клетки культивировали при 37 о С, во влажной атмосфере содержащей 5% СО2. Для культивирования использовали среду RPMI-1649 содержащей L-глутамин, 15% фетальной коровьей сыворотки и 0,04% гентамицина. Клетки облучали рентгеновским излучением генерируемым терапевтическим акселератором Clinac 600 при комнатной температуре в дозах 4 и 12 Грэй одноразово. Мощность дозы составляла 0,03 Гр/с, при фокусном расстоянии 104 см, поле облучения 30 см. Высота водяного столба над клетками составляла 1 см. Клетки облучались в 24 луночных планшетах (объём лунки 2,5 мл.). Параметры оксидативного стресса и повреждения ДНК анализировались через 15, 30 минут, 1, 4, 8, 12, 24, 48 часов.
Внутриклеточную концентрацию активных форм кислорода определяли с использованием 22 ,72 —дихлородигидрофлуоресцеин диацетата (DCFH-DA).Это вещество быстро проникает в цитоплазму и взаимодействуя с АФК окисляется до флуоресцирующего дихлорофлуоресцеина [16]. DCFH-DA добавляли в среду с клетками в конечной концентрации 30 мкМ за 30 мин до ана- лиза и держали в СО2-инкубаторе при 37оС в темноте. После инкубации среду удаляли, добавляли равный объём фосфатного буферного раствора рН 7,4 и оставляли на льду на 15 минут в темноте. Интенсивность флуоресценции дихлорофлуоресцеина измеряли с использованием проточного цитометра Becton Dickinson FACS Canto (лазер 488 нм., LP зеркало – 503, BP фильтр – 530/30). Для исследования роли митохондрий в процессах генерации АФК мы использовали ротенон, который является ингибитором комплекса I дыхательной цепи [13]. Ротенон добавляли в среду за 20 минут до начала определения АФК в конечной концентрации 1мкМ.
Митохондриальный потенциал определяли с использованием флуоресцентного красителя этилового эфира тетрародоминперхлората (TMRE) [6]. TMRE добавляли в среду с клетками в конечной концентрации 200 мкМ за 20 мин до анализа и держали в СО2-инкубаторе при 37оС. После инкубации среду удаляли, добавляли равный объём фосфатного буферного раствора рН 7,4 и определяли интенсивность красной флуоресценции с использованием проточного цитометра Becton Dickinson FACS Canto (лазер 488 нм., LP зеркало – 556, BP фильтр – 585/42).
Митохондриальную массу в клетках оценивали с использованием флуоресцентного красителя 10-нонил акридинового оранжевого (NAO)[5]. NAO добавляли в среду с клетками в конечной концентрации 500 наноМоль за 20 мин до анализа и держали в СО2-инкубаторе при 37оС. Интенсивность флуоресценции NAO измеряли с использованием проточного цитометра Becton Dickinson FACS Canto (лазер 488 нм, LP зеркало – 503, BP фильтр – 530/30).
Внутриклеточную концентрацию восстановленного глутатиона изучали с использованием флуоресцентного красителя монохлоробимана. В инкубационную среду с клетками добавлялся монохлоробимане в конечной концентрации 5 мкМ и оставляли в СО2-инкубаторе при 37оС течении 10 минут. Затем 10 мкл клеточной суспензии переносили на предметное стекло и оценивали величину флуоресценции с использованием флуоресцентного микроскопа при Л ex ~390 нм и Л em ~480 нм.
Профили экспрессии генов изучались с использованием гибридизационных ДНК-микроматриц высокой плотности серии HGU133A (Human Genome U133A) фирмы Affymetrix (Санта-Клара, Калифорния, США) через 15 мин,12 и 24 часа после радиационного воздействия. РНК выделялось с использованием набора RNeasy Mini (Qiagen, США). Качество выделенной РНК оценивалось по целостности 18S и 28S рибосомальной РНК с использованием с помощью элек- трофореза в 1% агарозном геле. Библиотеку клонированных ДНК готовилась с использованием набора GeneChip Expression 3'-Amplification One-Cycle cDNA Synthesis Kit (Affymetrix). Мечение биотином антисмысловых библиотек клонированных РНК и очистка проводилась с использованием набора GeneChip Expression 3'-Amplification Reagents for IVT Labeling (Affymetrix. Матрица окрашивалась стрептовидин-фикоэрит-рином и сканировалась на сканере GeneAtlas System (Affymetrix ,Санта-Клара, Калифорния, США) [3]. Обработка данных полученных после сканирования ДНК-микроматриц проводилась с использованием алгоритма MAS5.
Все эксперименты и определения параметров были выполнены как минимум с трёхкратных повторением. Результаты выражались как средние значение ± стандартное отклонение (М±SD). Результаты обработаны статистически с использованием критерия t Стьюдента для парных переменных. Различия между группами считали достоверными при р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
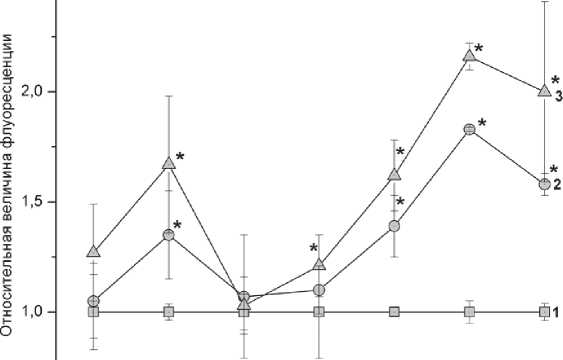
Динамика изменения внутриклеточной концентрации АФК в клетках К562 после облучения в дозах 4 и 12 Грэй представлена на рис. 1. Как видно, концентрация АФК и имеет два максимума. Первый максимум наблюдается через 30 минут после облучения и превосходит концентрацию АФК контрольных клеток в 1,35 и 1,67 раза при облучении клеток дозами 4 и 12 Грей соот- ветственно. При определении концентрации АФК через 4 после облучения, оказалось, что она практически не отличается от таковой в контрольных клетках. Через 8 часов концентрация АФК в клетках подвергшихся облучению была в 1,1 и 1,21 раза больше, но статистически достоверно не отличалась от таковой в контрольных клетках. Далее, мы наблюдали рост концентрации АФК. Через 24 часа после облучения мы наблюдали второй максимум внутриклеточной концентрации АФК, который превосходил по своим значениям первый максимум, наблюдавшейся через 30 минут после облучения. При облучении клеток дозой в 4 Грея концентрация АФК в 1,83 раза превосходила аналогичный параметр в культуре клеток не подвергавшихся облучению, и в 2,16 раза если клетки подвергались облучению в дозе 12 Гр. Далее, через 48 часов после облучения, происходило некоторое снижение внутриклеточной концентрации АФК. Дальнейший мониторинг концентрации АФК в культурах клеток подвергшихся облучению нами был признан нецелесообразным в связи со старением среды и накоплением большого количества погибших клеток, что препятствовало точному определению концентрации АФК в клеточных культурах старше 48 часов.
Для оценки вклада митохондрий в генерацию АФК после облучения мы использовали ротенон, который является ингибитором комплекса I дыхательной цепи [13]. На рис. 2 представлены данные отражающие влияние ротенона на концентрацию АФК. Ротенон добавлялся за 20
2,5 -|
—i----------'----------1----------■----------1----------1----------1----------'----------1----------'---------- 1----------'----------
15 мин 30 мин 4ч 8ч 12ч 24ч 48ч
Время прошедшее после облучения
1 - —Q— Контроль 2-—О—4 Гр 3 - —Д—12 Гр
Рис. 1. Динамика изменения активных форм кислорода после облучения клеток линии К562 рентгеновским излучением в дозах 4 и 12 Грэй.
Данные представлены как отношение величины флуоресценции DCFH-DA в клетках, подвергшихся рентгеновскому облучению, к контрольной группе. (* - p < 0,05 в сравнении с контрольной группой)
Время прошедшее после облучения
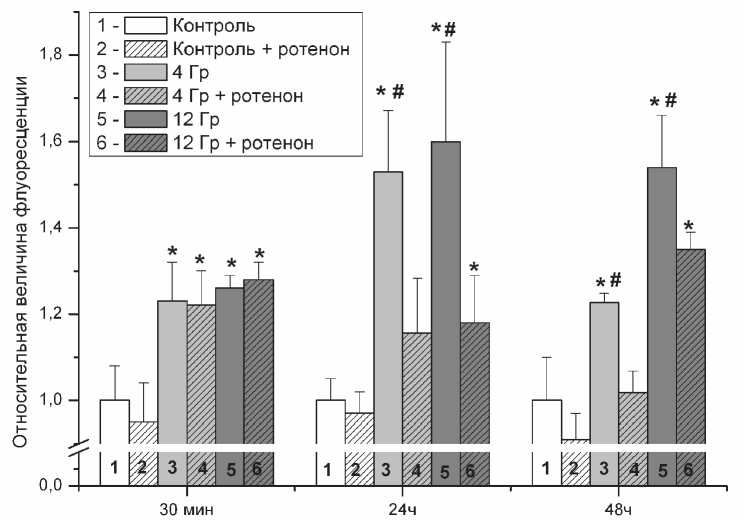
Рис. 2. Влияние ротенона на концентрацию АФК в клетках К562.
Данные представлены как отношение величины флуоресценции DCFH-DA в клетках, подвергшихся рентгеновскому облучению, к контрольной группе в присутствии ротенона и без него.
(*- p < 0,05 в сравнении с контрольной группой, #- р<0,05 в сравнении с аналогичной группой без добавления ротенона)
минут перед добавлением DCFH-DA. Как видно из графика ротенон не влиял на концентрацию АФК если он добавлялся через 30 минут после облучения. Ротенон снижал концентрацию АФК если его добавляли к клеточной культуре через 24 и 48 часов после облучения (рис. 2). В точке 24 часа после добавления ротенона концентрация АФК в клетках облучавшихся дозами 4 и 12 Гр была всего лишь в 1,14 и 1,18 раз выше, чем в контрольной группе, тогда как без добавления ротенона она была соответственно в 1,52 и 1,61 раз выше чем в контроле. В группе 4 Гр при добавлении ротенона она статистически достоверно не отличалась от таковой в контрольной группе (рис.2). При проведении аналогичного эксперимента по прошествии 48 часов после облучения нами наблюдалась схожая картина. Ротенон вызывал статистически достоверное снижение концентрации АФК в клетках подвергшихся облучению дозами 4 и 12 Гр в сравнении с облучёнными клетками, но без добавления ротенона (Рис.2). В группе клеток не подвергавшихся облучению ротенон не вызывал статистически достоверного снижения концентрации АФК.
Таким образом, нами было установлено, что после облучения в дозах 4 и 12 Гр в клетках К562 активный формы кислорода генерируются циклически с двумя максимумами через 30 минут и 24 часа после облучения. Источником
АФК в облученных клетках через 24 и 48 часов является митохондрии, тогда как через 30 минут после облучения АФК генерируются не зависимо от митохондрий.
Митохондриальный мембранный потенциал является важным показателем метаболической активности клеток, кроме этого он отражает способность митохондрий генерировать АФК. На графике 4 представлены данные отражающие изменение митохондриального мембранного потенциала после облучения клеток в дозах 4 и 12 Грэй. Если клетки облучались разовой дозой в 4 Гр, то статистически достоверное повышение мембранного потенциала митохондрий мы могли наблюдать только через 12 часов после облучения. В этот момент времени мембранный митохондриальный потенциал был в 1,12 раз больше чем в контроле. Через 24 и 48 часов этот показатель составлял 1,22 и 1,14 от аналогичного показателя контрольной группы. В группе клеток подвергшихся облучению мощностью 12 Гр рост митохондриального мембранного потенциала был более существенным и наблюдался в более ранние сроки. Так уже через 4 часа нами было зафиксировано статистически достоверное различие в сравнении с контрольной группой (рис. 4). В дальнейшем увеличении мембранного потенциала митохондрий в группе клеток подвергшихся облучению в дозе 12 Гр был ещё более
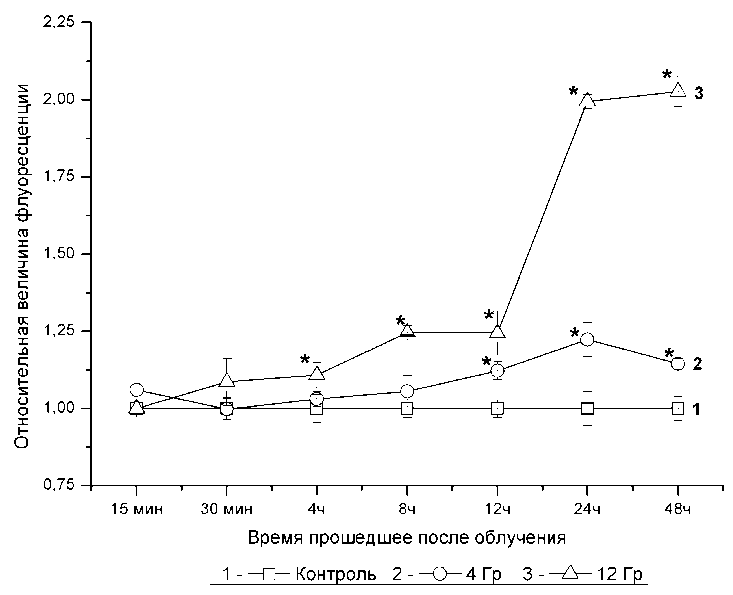
Рис. 3 . Динамика изменения митохондриального потенциала после облучения клеток линии К562 рентгеновским излучением в дозе 4 и 12 Грэй. Данные представлены как отношение величины флуоресценции TMRE в клетках, подвергшихся рентгеновскому облучению, к аналогичному показателю клеток контрольной группы. (* - p < 0,05 в сравнении с контрольной группой)
существенным с максимальным значением в точке 48 часов, в которой он был в 2,03 раза выше, чем в клетках контрольной группы (Рис.4). Таким образом, нами было сделано заключение, что радиационное облучение клеток К562 в дозах 4 и 12 Гр вызывает зависимый от дозы рост митохондриального мембранного потенциала.
Мембранный митохондриальный потенциал может возрастать из-за разных причин, но наиболее важными из них являются нарушение процессов окислительного фосфорилирования и увеличение митохондриальной массы [11, 18, 19]. Увеличение митохондриальной массы в облученных клетках нами было зафиксировано через 8 часов после облучения, и в дальнейшем масса митохондрий продолжала увеличиваться (Рис 5). Через 12 часов митохондриальная масса облученных клетках дозами 4 и 12 Гр была соответственно в 1,18 и 1,17 раз выше, чем в контрольной группе клеточных культур. Через 24 часа митохондриальная масса была соответственно в 1,3 и 1,5 раза выше, а через 48 часов в 1,39 и 1,66 раза выше, чем в контроле (рис. 4). Увеличение митохондриальной массы после рентгеновского облучения свидетельствует о нарушениях в биогенезе митохондрий [4]. Причиной такого нарушения могут быть мутации митохондриальной ДНК [19].
В табл. 1 представлены данные анализа экспрессии генов, продукты которых участвуют в ре- гуляции митохондриального биогенеза или связаны с процессами производства энергии и дыхания. Из таблицы видно, что через 24 часа после радиационного воздействия экспрессия генов митохондриальной глицерол-3-фосфатдегидро-геназы, пируватдегидрогеназы, альфа-кетоглу-тарат дегидрогеназы и изоцитрат дегидрогеназы увеличивается. В этот же момент времени нами зафиксирован рост совокупного клеточного митохондриального потенциала и митохондриальной массы (рис. 3, 4). Вышеперечисленные гены участвуют в функционировании цикла Кребса и увеличение экспрессии этих генов свидетельствует об активации обменных процессов в клетках линии К562 после радиационного облучения.
Митохондрии содержат свою собственную генетическую систему, состоящую из кольцевой ДНК. Деление митохондрий и передача митохондриальной наследственной информации происходит независимо от общего клеточного цикла. В каждой митохондрии есть несколько копий кольцевой ДНК. Митохондриальна ДНК кодирует 13 белков, которые являются частью дыхательной цепи. При этом большинство белков входящих в состав митохондрии кодируются ядерными генами. Транскрипция мтДНК требует небольшого количества белков кодируемых ядерными генами, в том числе одной РНК-полимеразы (POLRMT), ряд вспомогательных факторов
Таблица 1. Изменение экспрессии генов в клетках линии К562, продукты которых участвуют в регуляции митохондриального биогенеза. Данные представлены как отношение уровня экспрессии гена в облученных клетках к уровню экспрессии гена в контроле
|
Название белка |
Ген |
1ч |
12ч |
24ч |
|
Глицерол-3-фосфатдегидрогеназа (цитоплазматическая) |
GPD2 |
0,98 |
1,02 |
1,31 |
|
Глицерол-3-фосфатдегидрогеназа (митохондриальная) |
GPD1 |
0,93 |
0,98 |
0,92 |
|
Пируватдегидрогеназа субед. А |
pdha1 |
1,01 |
0,96 |
0,94 |
|
Пируватдегидрогеназа субед.Б |
pdhb |
1,05 |
1,04 |
1,11 |
|
Аль фа-кетоглутарат дегидр огеназа |
OGDH |
0,90 |
1,14 |
1,07 |
|
Изоцитрат дегидрогеназа |
IDH2 |
0,98 |
1,01 |
1,10 |
|
Аконитаза (митохондриальная) |
ACO2 |
0,97 |
1,01 |
1,02 |
|
Убихинон связывающий белок |
UQCRQ |
1,01 |
1,02 |
0,97 |
|
Fe-S протеин комплекса 1 |
NDUFS7 |
1,00 |
0,98 |
0,92 |
|
НАДФН 2 дегидрогеназа 1 |
NDUFA5 |
1,27 |
1,09 |
1,06 |
|
Респираторный фактор транскрипции |
NRF1 |
1,12 |
0,89 |
0,80 |
|
Митохондриальный фактор транскрипции |
TFAM |
0,99 |
0,95 |
0,93 |
|
Рецептор активатора пролиферации пероксисом |
PPARA |
0,96 |
0,96 |
1,01 |
|
Митохондриальная РНК-полимераза |
POLRMT |
1,02 |
1,02 |
0,85 |
|
Митихондриаль ный фактор транскрипции В1 |
TFB1M |
1,04 |
1,04 |
1,04 |
|
Митихондриаль ный фактор транскрипции В2 |
TFB2M |
0,97 |
0,95 |
0,90 |
|
Э строген связывающий рецептор - альфа |
ESRRA |
0,96 |
0,96 |
0,91 |
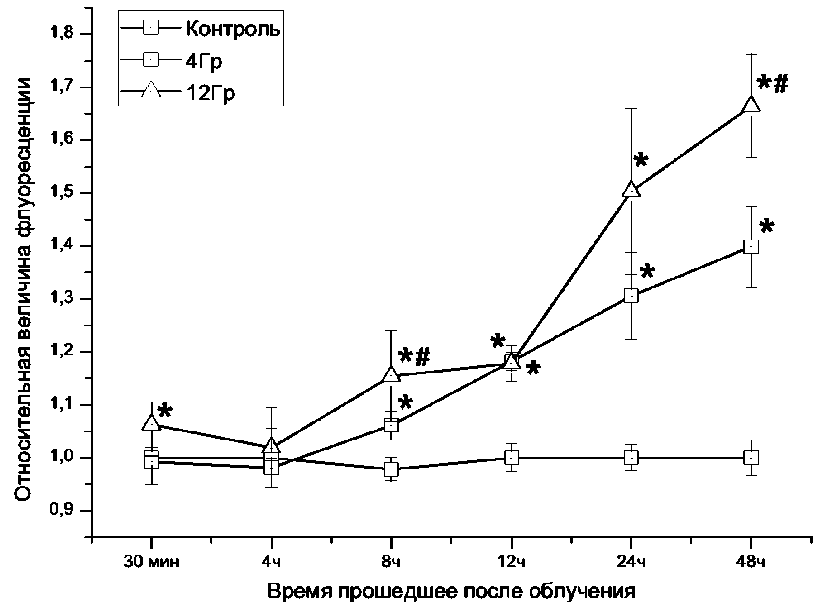
Рис. 4 . Динамика изменения митохондриальной после облучения клеток линии К562 рентгеновским излучением в дозе 4 и 12 Грэй. Данные представлены как отношение величины флуоресценции NAO в клетках подвергшихся рентгеновскому облучению к аналогичному показателю клеток контрольной группы. (* - p < 0,05 в сравнении с контрольной группой)
транскрипции, необходимых для распознавания промоутеров (TFB1M, TFB2M) и активации транскрипции (Tfam), а также терминирующем факторе транскрипции (mTERF). Взаимодействие между ядерной и митохондриальной ДНК зависит от взаимодействия между факторами транскрипции гены NRF1,PPAR1, ESRRA) и членов семейства белков PGC-1 (ген PPRC1) [18]. Радиационное воздействие на клетки линии К562 вызывает снижение экспрессии генов NRF1, TFAM, PPRC1, ESRRA, POLRMT, TFB2M и не влияет на экспрессию генов PPARA и TFB1M.
Таким образом, можно сделать заключение, что радиационно-индуцированная генерация АФК в клетках К562 имеет два временных максимума и различные источники. Причиной увеличения радиационно-индуцированной концентрации АФК через 24-48 часов можно назвать рост митохондриального потенциала связанный с увеличением внутриклеточной митохондриальной массы. Радиационное воздействие стимулирует в клетках линии К562 увеличение экспрессии генов продукты которых участвуют в процессе катаболизма ацетильных групп и окислительного фосфорилирования, но снижает экспрессию генов кодирующих белки участвующих в митохондриальном биогенезе.
Работа выполнена при поддержке федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007—2013 годы» ГК № 14.512.11.0058.
Список литературы Нарушение митохондриального биогенеза является причиной развития радиационно-индуцированное оксидативного стресса в клетках линии К562
- Нестабильность генома, индуцированная ионизирующим излучением в клетках линии СНО, приводит к селекции радиорезистентных клеточных клонов/Д.В. Гурьев, А.Н. Осипов, Е.Ю. Лизунова, Н.Ю. Воробьева, О.В. Боева//Бюллетень экспериментальной биологии и медицины. 2009. Т. 147, № 5. С. 525-527.
- Элиминация мтДНК из митохондрий и активация её репликации в клетках тканей облученных мышей/М.В. Патрушев, В.Е. Патрушева, В.А. Касымов, Э.В. Евдокимовский, Т.Е. Ушакова, А.И. Газиев//Цитология. 2006. Т. 48, № 8. С. 684-691.
- Expression analysis with oligonucleotide microarrays reveals that MYC regulates genes involved in growth, cell cycle, signaling, and adhesion./H.A. Coller, C. Grandori, P. Tamayo, T. Colbert, E.S. Lander, R.N. Eisenman, T.R. Golub//Proc. Natl. Acad. Sci. U S A. 2000. Vol.97, № 7. P.3260-3265.
- Mitochondria are morphologically and functionally heterogeneous within cells./T. J. Collins, M. J. Berridge, P. Lipp, M. D. Bootman//EMBO J. 2002. Vol. 21. P.1616-1627.
- Cossarizza A., Mitochondrial modifications during rat thymocyte apoptosis: a study at the single cell level//Exp. Cell Res. 1994. Vol. 214. P.323-329
- Membrane potential can be determined in individual cells from the nernstian distribution of cationic dyes./B. Ehrenberg, V. Montana, M.D. Wei, J.P. Wuskell, L.M. Loew//Biophys. J. 1988. V.53.P.785-794
- Haliwell B. and Gutteridge J.M.C.//Free Radicals in Biology and Medicine/, 2 ed., Oxford: Clarendon Press, 1986. P. 1-81
- Radical-free biology of oxidative stress/D.P. Jones//Am. J. Physiol.Cell Physiol. 2008. Vol.295. P.849-868.
- Mitochondria and reactive oxygen species./A. J. Kowaltowski, N.C. Souza-Pinto, R.F. Castilho, A.E. Verces//Free Radic. Bio.l Med. 2009. V. 47 P. 333-343.
- Kadenbach B. Intrinsic and extrinsic uncoupling of oxidative phosphorylation//Biochim. Biophys. Acta. 2003. V. 1604. P. 77-94.
- Role for Mitochondrial Dysfunction in Perpetuating Radiation-Induced Genomic Instability/G.J. Kim, G.M. Fiskum, W.F. Morgan//Cancer Res. 2006. Vol. 66. P. 10377 -10383.
- Mitochondrial DNA mutations, oxidative stress, and apoptosis in mammalian aging/G.C. Kujoth, A. Hiona, T.D. Pugh, S. Someya, K. Panzer//Science. 2005.Vol. 309. P.481-484.
- Analysis of mitochondrial function in situ in permeabilized muscle fibers, tissues and cells./A.V. Kuznetsov, V. Veksler, F.N. Gellerich, V. Saks, R. Margreiter, W.S. Kunz//Nat. Protoc. 2008. V.3. № 6. P. 965-976.
- Le Caer S. Water Radiolysis: Influence of Oxide Surfaces on H2O2 Production under Ionizing Radiation//Water. 2011. Vol. 3. P. 235-253
- Attenuation of radiation-induced genomic instability by free radical scavengers and cellular proliferation./C.L. Limoli, M.I. Kaplan, E. Giedzinski, W.F. Morgan//Free Radic. Bio.l Med. 2001. V.31, №1. P. 10-19.
- Characterization of 2',7'-dichlorofluorescin fluorescence in dissociated mammalian brain neurons: estimation on intracellular content of hydrogen peroxide/Y. Oyama, A. Hayashi, T. Ueha, K. Maekawa//Brain Res. 1994. Vol. 635, № 1-2. P.113-117.
- On the chemical yield of base lesions, strand breaks, and clustered damage generated in plasmid DNA by the direct effect of X rays./S. Purkayastha, J.R. Milligan, W.A. Bernhard//Radiat. Res. 2007. Vol.168 P.357-66.
- Scarpulla R.C. Transcriptional Paradigms in Mammalian Mitochondrial Biogenesis and Function//Physiological Reviews. 2008. Vol. 88. Pp. 611-638.
- Schon E.A. Mitochondrial genetics and disease//Trends Biochem. Sci. 2000. Vol.25. P. 555-560.
- Radiation-induced cell signaling: inside-out and outside-in/K. Valerie A. Yacoub, M.P. Hagan, D.T. Curiel, P.B. Fisher, S. Grant, P. Dent//Mol. Cancer Ther. 2007. Vol. 6. P. 789 -801.
- Ward J. DNA damage as the cause of ionizing radiation-induced gene activation//Radiation Research. 1994. V. 138. № 1s. P. S85-S88.
- Wardman P. The importance of radiation chemistry to radiation and free radical biology//The British Journal of Radiology. 2009, Vol. 82. P. 89-104
- Yakes F.M., Houten B. Mitochondrial DNA damage is more extensive and persists longer than nuclear DNA damage in human cells following oxidative stress//Proc. Natl Acad. Sci. USA. 1997. Vol. 94 P. 514-519.


