Нарушение репродуктивного потенциала самцов белых крыс при воздействии дыма природного пожара
Автор: Вокина В.А., Капустина Е.А., Новиков М.А., Андреева Е.С.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Экология
Статья в выпуске: 1, 2021 года.
Бесплатный доступ
Проведена оценка показателей репродуктивного потенциала самцов белых крыс, подвергавшихся воздействию дыма в течение 1 месяца. Обследование экспонированных животных включало в себя определение индекса сперматогенеза и уровня фрагментации и метилирования ДНК в семенниках и крови. Выявлено статистически значимое повышение уровня полногеномного метилирования ДНК в крови крыс, подвергавшихся воздействию дыма. При морфометрическом исследовании ткани семенников выявлено нарушение показателей сперматогенеза у экспонированных крыс.
Сперматогенез, метилирование днк, фрагментация днкй, дым природного пожара, крысы
Короткий адрес: https://sciup.org/147235445
IDR: 147235445 | УДК: 615.9:57.044:502.08 | DOI: 10.17072/1994-9952-2021-1-70-76
Текст научной статьи Нарушение репродуктивного потенциала самцов белых крыс при воздействии дыма природного пожара
На современном этапе особую актуальность приобретает проблема неуклонного снижения показателей мужской фертильности [Rolland et al., 2013], обусловленная влиянием множества факторов, особое место среди которых занимают негативное воздействие окружающей среды и различные факторы образа жизни [Kulikauskas, Blaustein, Ablin, 1985; Kiziler et al., 2007].
Продолжительные и масштабные природные пожары являются мощными источниками выброса в атмосферный воздух многокомпонентной смеси твердых частиц и газов, значительная часть из которых являются канцерогенными, генотоксичными или мутагенными, что обосновывает необходимость изучения токсического воздействия дыма природных пожаров на мужскую репродуктивную функцию. Несмотря на то, что последствия лесных и торфяных пожаров в последнее время приобрели мировой масштаб, данный аспект токсического воздействия дыма природных пожаров в современной литературе освещен недостаточно. Много- численные клинические и экспериментальные исследования посвящены изучению взаимосвязи уровня загрязнения атмосферного воздуха твердыми частицами (PM2,5) и показателями функционального состояния мужской репродуктивной системы [Hansen et al., 2010; Deng et al., 2016; Radwan et al., 2016; Chen et al., 2019; Huang et al., 2019], которые свидетельствуют об усилении митохондриальной дисфункции и повышения уровня фрагментации ДНК сперматозоидов.
Особый интерес представляют исследования, направленные на оценку воздействия табачного дыма на мужской репродуктивный потенциал. Так, эпидемиологические исследования убедительно доказывают, что курение изменяет уровень метилирования ДНК и экспрессию генов в клетках периферической крови, клетках буккального эпителия и легочной ткани у лиц, подвергавшихся воздействию табачного дыма [Kohli et al., 2012; Bosse et al., 2012; Ambatipudi et al., 2016]. В исследованиях T.G. Jenkins с соавторами показано, что у курящих мужчин выявлено изменение метилирования ДНК сперматозоидов [Jenkins et al., 2017].
Использование экспериментальных моделей дает широкие возможности для исследования механизмов развития патологии репродуктивной системы при экспозиции дымом природных пожаров, условия которой могут варьировать в широких пределах. Ранее нами была разработана экспериментальная модель низового ландшафтного пожара, в процессе которого длительное время горят лесная подстилка, валежник и гнилые пни с выделением сильного дыма, при этом основным является беспламенное горение [Вокина и др., 2019]. Основным критерием достижения необходимого уровня загрязнения воздушной среды являлось содержание в воздухе экспозиционной камеры оксида углерода (СО). Согласно данным инструментальных замеров в некоторых городах РФ во время задымления от природных пожаров уровень СО составлял 3.6‒30 мг/м3 [Air quality …, 2010; Звягинцев и др., 2011; Панов и др., 2018]. Цель исследования – оценка показателей репродуктивного потенциала самцов белых крыс, подвергавшихся воздействию дыма.
Материал и методы исследования
Опыты поставлены на 20 беспородных белых крысах-самцах, массой 180‒240 г. Все экспериментальные животные получены путем собственного воспроизводства в виварии ФГБНУ Восточно-Сибирского института медико-экологических исследований и содержались на стандартном рационе. Работа выполнена с соблюдением правил гуманного отношения к животным в соответствии с требованиями «Международных рекомендаций по проведению медико-биологических исследований с использованием животных» (ВОЗ, Женева, 1985) и «Правилами лабораторной практики» (Приказ Минздравсоцразвития России от 23 августа 2010 г., № 708н).
Животных опытных групп (n = 10) подвергали динамическому ингаляционному воздействию дыма в затравочных камерах объемом 200 л, 4 ч. в день, 5 дней в неделю, в течение 4 недель [Вокина и др., 2019]. Крысам контрольной группы (n = 10) в камеру подавался чистый воздух. Средние концентрации оксида углерода и РМ2,5 в экспозиционной камере составили 28.7±5.3 мг/м3 и 1.9±0.5 мг/м3, соответственно. Температуру воздуха в экспозиционных камерах поддерживали на уровне +24…+25ºС, относительную влажность 40–50%.
Сразу после окончания воздействия половину животных контрольной и опытной групп умерщвляли путем декапитации под легким эфирным наркозом для проведения исследования морфофункционального состояния репродуктивной системы и анализа уровня фрагментации и метилирования ДНК в ткани семенников и крови. По общепринятой методике производился забор гисто- логического материала (ткань семенников), их фиксация в 15%-ном растворе нейтрального формалина. После гистологической проводки материал заливали в парафин. Срезы толщиной 6–7 мкм окрашивали гематоксилином и эозином. При обзорной микроскопии изучали следующие морфометрические параметры: общее количество спер-матогоний, количества клеток Лейдига, число канальцев со слущенным эпителием. На основе количественных данных, полученных при цитологическом исследовании семенников, рассчитывали индекс сперматогенеза как отношение суммы всех подсчитанных слоев клеток в одном канальце к количеству всех просчитанных канальцев [Ухов, Астраханцев, 1983]. Исследование фрагментации ДНК проводили методом ДНК-комет [Дурнев и др., 2010]. Уровень полногеномного метилирования, являющегося одним из главных эпигенетических факторов, также оценивали методом ДНК-комет в модификации с использованием рестрик-таз MspI и с HpaII («СибЭнзим»), Россия [Wentzel et al., 2010]. Суспензии клеток (55 мкл) добавляли к 1%-ному раствору легкоплавкой агарозы (500 мкл) в фосфатно-солевой буфер (ФСБ) и наносили на предварительно покрытые 1%-ной универсальной агарозой стекла, инкубировали с покровным стеклом на льду 10 мин. После затвердевания агарозы стекла помещали в лизирующий буфер (10 мM трисHCl pH 10, 2.5 M NaCl, 100 мM ЭДТАNa2, 1% Тритон Х100, 10% DMSO) и инкубировали не менее 1 ч. при 4оС. После инкубации стекла 3 раза отмывали раствором 10 мM ЭДТА с 5%-ным DMSO в ФСБ в течение 10 мин., после чего на стекло наносили 100 мкл раствора, содержавшего 1 Ед. HpaII или 1.5 Ед. MspI с реакционным буфером («СибЭнзим», Россия), и инкубировали во влажной камере 1 ч. при 37оС. Затем проводили щелочной электрофорез в растворе (0.3М NaOH и 1мМ ЭДТА-Na, рН13) в течение 20 мин. при напряженности поля 1 В/см, затем стекла фиксировали в 70%-ном этаноле (20 мин.), высушивали и хранили при комнатной температуре. Для одного и того же исследуемого образца ДНК в опыт брали три варианта: с MspI, с HpaII и без добавления ферментов. Последний вариант служил контролем сохранности ДНК в реакционном буфере. Окраска препаратов осуществлялась SYBR GreenI, регистрацию проводили на микроскопе «OLYMPUS ВХ-52», совмещенном с цифровой камерой «OLYMPUSRХ-420» при увеличении «х100». Изображения ДНК-комет (по 100 клеток от каждого животного) анализировали с помощью программы «CASP 1.2.2». В качестве показателя поврежденности ДНК использовали процентное содержание фрагментов ДНК в хвосте комет («%ДНК в хвосте»). Для каждого стекла анализировали около 100 ядер. Уровень полногеномного метилирования рассчитывали по формуле 100 - (HpaII/MspI *100), где HpaII и MspI – средний процент ДНК в хвосте кометы в 100 ядрах на препаратах, обработанных HpaII и MspI соответственно. В качестве показателя фрагментации ДНК использовали процентное содержание фрагментов ДНК в хвосте комет («% ДНК в хвосте») без дополнительного этапа рестрикции ферментами HpaII и MspI.
Статистический анализ результатов исследования проводился с использованием пакета прикладных программ Statistiсa 6.1. (StatSoft) (лиц № AXXR004E642326FA). Для принятия решения о виде распределения признаков использовали W-критерий Шапиро-Уилка. Для сравнения групп применяли U-критерий Манна-Уитни. Нулевые гипотезы об отсутствии различий между группами отвергали при достигнутом уровне значимости р≤0.05. Результаты представлены в виде медианы и интерквартильного размаха (Me (LQ;UQ)).
Результаты и их обсуждение
По результатам морфометрического исследования основных функциональных показателей деятельности семенников белых крыс, подвергавшихся воздействию дыма, выявлено снижение индекса сперматогенеза более чем на 20% при сравнении с группой контроля (U = 21, Z = ‒2.57, p = 0.010; рис. 1). Кроме того, у самцов опытной группы наблюдалось статистически значимое снижение количества сперматогоний и клеток Лейдига (U = 13.5, Z = ‒2.53, p = 0.011 и U = 7.5, Z = ‒3.17, p = 0.001, соответственно). При оценке состояния се-мяродного эпителия на препаратах гонад у крыс-самцов опытной группы не зафиксировано существенных изменений по количеству канальцев со слущенным эпителием.
Результаты проведенного исследования показали, что исследованные образцы крови и семенников имеют разный уровень фрагментации и метилирования ДНК как в норме, так и после воздействия продуктов горения. Уровень ДНК-фрагментации в половых клетках и крови животных опытной группы не имел статистически значимых отличий по сравнению с соответствующими показателями группы контроля и составлял 0.03(0.02; 0.21)% и 3.25(2.08; 5.47)% против 0.05(0.03; 0.32)% и 3.05(1.93; 7.72)% в контроле, соответственно. Статистически значимых отличий по уровню полногеномного метилирования ДНК в ткани семенников экспонированных животных при сравнении с контрольной группой не выявлено (рис. 2). Вместе с тем выявлено статистически значимое повышение уровня полногеномного метилирования ДНК в крови самцов белых крыс, подвергавшихся воздействию дыма (U = 9, Z = 2.36, p = 0.018; рис. 2).
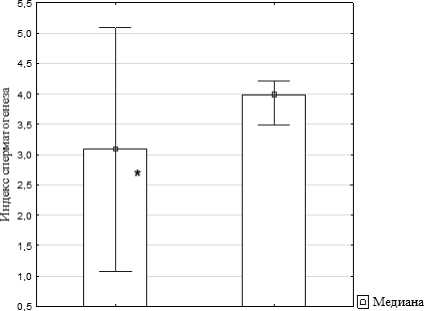
самцы опыт самцы контроль ^Мин.-Макс.
Рис. 1 . Индекс сперматогенеза белых крыс при воздействии дыма лесного пожара.
* - различия статистически значимы по сравнению с контролем при р < 0.05
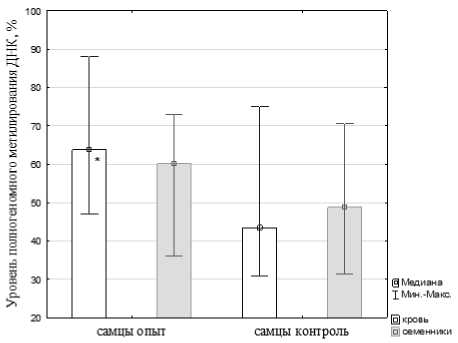
Рис. 2 . Уровень полногеномного метилирования ДНК в крови и половых клетках белых крыс при воздействии дыма лесного пожара.
* - различия статистически значимы по сравнению с контролем при р < 0.05
В результате проведенных экспериментальных исследований выявлено нарушение процесса сперматогенеза и изменение уровня метилирования ДНК в крови экспонированных дымом животных. Несмотря на то, что дым лесных пожаров является многокомпонентной смесью из газов и частиц с доказанными мутагенными или генотоксическими свойствами [Ewa, Danuta, 2017; Kopp, Zalko,
Audebert, 2018; Liu et al., 2018; Muthusamy, Peng, Ng, 2018], уровень повреждения ДНК в клетках крови и семенниках не имел статистически значимых отличий при сравнении с контролем. Отсутствие изменений по уровню повреждения и полногеномного метилирования ДНК в семенниках у экспериментальных животных, вероятно, связано с тем, что поступающие в организм генотоксические соединения не достигли половых желез в достаточной концентрации, в то время как их концентрация в крови оказалась достаточной для появле- ния эпигенетических модификаций. В данном случае можно говорить о сохранении активности ге-матотестикулярного барьера, играющего главную роль в снижении проникновения токсичных веществ в гонады [Miller, Cherrington, 2018].
В исследованиях S. Ambatipudi et al. [2016] показано, что воздействие табачного дыма обратимо изменяет уровень метилирования ДНК и экспрессию генов в ДНК в периферической крови. Эти данные согласуются с результатами экспериментальных исследований Tsaprouni и Zeilinger, свидетельствующих о том, что воздействие табачного дыма значительно влияет на уровень метилирования ДНК в цельной крови, причем данные изменения в значительной степени корректируются после прекращения курения [Zeilinger et al., 2013; Tsaprouni et al., 2014]. Результаты исследования Murphy с соавторами [Murphy et al., 2019] показали, что оксидативный стресс является основным фактором, влияющим на изменение уровня метилирования ДНК сперматозоидов и последующие эффекты у потомства.
Заключение
Таким образом, в результате проведенных исследований установлено, что длительное воздействие дыма природных пожаров на крыс-самцов приводит к нарушению процесса сперматогенеза и повышению уровня метилирования ДНК в клетках крови. Высокий окислительный потенциал твердых частиц в дыме природных пожаров [Verma et al., 2009] и присутствие в нем потенциальных газообразных генотоксикантов могут, по нашему мнению, вызывать патологические состояния, ведущие к повреждению и фрагментации ДНК, а также к апоптозу сперматозоидов. Вследствие этого возрастает вероятность риска развития нарушений здоровья у потомства отцов, подвергшихся воздействию дыма, что ставит задачу по более углубленному исследованию выявленных фактов.
Финансирование осуществлялось за счёт средств, выделяемых для выполнения государственного задания
Список литературы Нарушение репродуктивного потенциала самцов белых крыс при воздействии дыма природного пожара
- Вокина В.А. и др. Исследование воздействия эмиссии от лесных пожаров на морфофункциональное состояние центральной нервной системы белых крыс // Гигиена и санитария. 2019. № 98(11). С. 1245-1250.
- Дурнев А.Д и др. Оценка генотоксических свойств методом ДНК-комет in vitro МР 4.2.0014-10: метод. рекомендации. М., 2010. 15 с.
- Звягинцев А.М. и др. Загрязнение воздуха на европейской части России и Украине в условиях жаркого лета 2010 г. // Известия РАН. Физика атмосферы и океана. 2011. № 47(6). С. 757766.
- Панов А.В. и др. Комплексный подход в оценке эмиссии углеродсодержащих газов от лесных пожаров в Сибири // Метеорология и гидрология. 2018. № 5. С. 30-39.
- Ухов Ю. И., Астраханцев А. Ф. Морфометрические методы в оценке функционального состояния семенников // Архив анатомии, гистологии и эмбриологии. 1983. № 84(3). С. 66-72.
- Air quality monitoring in Moscow, 2010. Newsletter WHO collaborating centre for quality management and air pollution control at the Federal Environment Agency. Germany, 2010. № 46. P. 9-14.
- Ambatipudi S. et al. Tobacco smoking-associated genome-wide DNA methylation changes in the EPIC study // Epigenomics. 2016. Vol. 8, № 5. P. 599-618.
- Bosse Y. et al. Molecular signature of smoking in human lung tissues // Cancer research. 2012. Vol. 72. P. 3753-3763.
- Chen Y. et al. The impact of the fine ambient particle on infertile male's sperm quality // Urological Science. 2019. Vol. 30, № 4. P. 177-183.
- Deng Z. et al. Association between air pollution and sperm quality: A systematic review and meta-analysis // Environ. Pollut. 2016. Vol. 208 (Pt B). P. 663-669.
- Ewa B., Danuta M.S. Polycyclic aromatic hydrocarbons and PAH-related DNA adducts // Journal of applied genetics. 2017. Vol. 58, № 3. P. 321-330.
- Hansen C. et al. The effect of ambient air pollution on sperm quality // Environ Health Perspect. 2010. Vol 118, № 2. P. 203-209.
- Huang X. et al. Association of exposure to ambient fine particulate matter constituents with semen quality among men attending a fertility center in China // Environ Sci. Technol. 2019. Vol. 53, № 10. P. 5957-5965.
- Jenkins T. G. et al. Cigarette smoking significantly alters sperm DNA methylation patterns // Androlo-gy. 2017. Vol. 5, № 6. P. 1089-1099.
- Kiziler A.R. et al. High levels of cadmium and lead in seminal fluid and blood of smoking men are associated with high oxidative stress and damage in infertile subjects // Biological trace element research. 2007. Vol. 120. P. 82-91.
- Kohli A. et al. Secondhand smoke in combination with ambient air pollution exposure is associated with increasedx CpG methylation and decreased expression of IFN-gamma in T effector cells and Foxp3 in T regulatory cells in children // Clinical epigenetics. 2012. Vol. 4. P. 17.
- Kopp B., Zalko D., Audebert M. Genotoxicity of 11 heavy metals detected as food contaminants in two human cell lines // Environmental and molecular
- mutagenesis. 2018. Vol. 59, № 3. P. 202-210.
- Kulikauskas V., Blaustein D., Ablin R. J. Cigarette smoking and its possible effects on sperm // Fertility and sterility. 1985. Vol. 44. P. 526-534.
- Liu X. et al. Lead induces genotoxicity via oxidative stress and promoter methylation of DNA repair genes in human lymphoblastoid TK6 cells // Medical science monitor. 2018. Vol. 22, № 24. P. 4295-4304.
- Miller S.R., Cherrington N.J. Transepithelial transport across the blood-testis barrier // Reproduction. 2018. Vol. 56, № 6. P. 187-194.
- Murphy P.J. et al. Paternal cigarette smoke alters DNA methylation in sperm and gene expression in offspring brain // BioRxiv. 2019. 750638. doi: https://doi.org/10.1101/750638
- Muthusamy S., Peng C., Ng J.C. Genotoxicity evaluation of multi-component mixtures of polyaromatic hydrocarbons (PAHs), arsenic, cadmium, and lead using flow cytometry based micronucleus test in HepG2 cells // Mutation research. Genetic toxicology and environmental mutagenesis. 2018. Vol. 827. P. 9-18.
- Radwan M. et al. Exposure to ambient air pollution-does it affect semen quality and the level of reproductive hormones? // Ann. Hum. Biol. 2016. Vol. 43. P. 50-56.
- Rolland M. et al. Decline in semen concentration and morphology in a sample of 26 609 men close to general population between 1989 and 2005 in France // Hum. Reprod. 2013. Vol. 28, № 2. P. 462-470.
- Tsaprouni L. G. et al. Cigarette smoking reduces DNA methylation levels at multiple genomic loci but the effect is partially reversible upon cessation // Epigenetics. 2014. Vol. 9. P. 1382-1396.
- Verma V. et al. Physicochemical and toxicological profiles of particulate matter in Los Angeles during the October 2007 southern California wildfires // Environ Sci. Technol. 2009. Vol. 43. P. 954960.
- Wentzel J.F. et al. Assessing the DNA methylation status of single cells with the comet assay // Analytical Biochemistry. 2010. Vol. 400, № 2. P. 190-194.
- Zeilinger S. et al. Tobacco smoking leads to extensive genome-wide changes in DNA methylation // PLoS One. 2013. Vol. 8, e63812.


