Нарушения церебральной перфузии как патогенетическое звено когнитивной дисфункции у больных эссенциальной гипертонией и пациентов с метаболическим синдромом
Автор: Лишманов Ю.Б., Ефимова Н.Ю., Чернов В.И., Ефимова И.Ю., Идрисова Е.М.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.25, 2010 года.
Бесплатный доступ
Цель исследования - изучить состояние церебрального кровотока у больных эссенциальной гипертонией и па циентов с метаболическим синдром (МС). В исследование включены 23 пациента с гипертонической болезнью (ГБ) и 50 с МС, которым были проведены перфузионная ОЭКТ головного мозга и нейропсихологическое тести рование. Результаты ОЭКТ показали статистически значимо более низкие значения регионарного мозгового кро вотока (рМК) у пациентов с МС по сравнению с больными ГБ. Снижение рМК у пациентов с метаболическим синдромом было выявлено в левой задней теменной доле на 6,3% (p=0,004), в правой и левой височных областях на 5,5% (p=0,009) и 7,1% (p=0,001) соответственно, а также в левой и правой затылочных долях на 9,2% (p=0,00001) и 8,1% (p=0,00007) по сравнению с церебральным кровотоком у больных ГБ. При проведении регрессионного анализа определена тесная взаимосвязь между рМК и когнитивным статусом. Таким образом, у больных метабо лическим синдромом наблюдается более выраженное снижение мозгового кровотока и когнитивной функции, чем при ГБ.
Однофотонная эмиссионная компьютерная томография, церебральная перфузия, артериальная гипертония, метаболический синдром, когнитивная функция
Короткий адрес: https://sciup.org/14919193
IDR: 14919193 | УДК: 616-073:616.12
Текст научной статьи Нарушения церебральной перфузии как патогенетическое звено когнитивной дисфункции у больных эссенциальной гипертонией и пациентов с метаболическим синдромом
В последние годы проблема метаболического синдрома (МС) и артериальной гипертонии (АГ), как факторов риска развития сердечно-сосудистых заболеваний, приобрела особое значение. Метаболический синдром, по признанию ВОЗ, представляет собой новую пандемию
XX века, распространенность которой в 2 раза превышает частоту встречаемости сахарного диабета. В ближайшие 25 лет ожидается увеличение темпов роста МС на 50% [1]. В проспективном исследовании ARIC (Atherosclerosis Risk in Communities) [2] было показано, что у лиц с МС случаи развития ишемического инсульта наблюда- ются в 2 раза чаще по сравнению с группой контроля. Актуальность обсуждаемой проблемы определяется появлением все большего числа доказательств тесной взаимосвязи между артериальной АГ и другими компонентами МС. Так, при проведении ряда крупных многоцентровых исследований Фрамингемское, MRFIT (Multiple Risk factor Intervention Trial) [3, 4] обнаружено, что гипертоническая болезнь (ГБ) часто сочетается с нарушениями липидного и углеводного видов обмена, которые также являются факторами риска сердечно-сосудистых осложнений. Вероятность развития АГ среди лиц с избыточной массой тела на 50% выше, чем у лиц с нормальным весом (Фрамингемское исследование) [3]. В патогенезе метаболического синдрома артериальная гипертония может быть пусковой в развитии инсулинорезистентно-сти, которая, в свою очередь, приводит к нарушению углеводного обмена и гиперинсулинемии [5].
В литературе также обсуждается проблема взаимосвязи метаболического синдрома, когнитивной дисфункции и развития сосудистой деменции [6, 7]. Однако до настоящего времени вопрос, каким образом МС влияет на когнитивную функцию, остается предметом дискуссий.
Целью настоящей работы явилось изучение состояния мозгового кровотока у больных метаболическим синдромом и пациентов с гипертонической болезнью, а также исследование взаимосвязи церебральной перфузии и когнитивной функции.
Материал и методы
В исследование включены 73 пациента: из них 50 (средний возраст 51,6±5,5 года, 6 мужчин и 44 женщины) больных метаболическим синдромом и 23 (средний возраст 46,5±10 лет, 15 мужчин и 8 женщин) пациента с ранее не леченной или неэффективно леченной ГБ II степени. Критериями исключения больных из группы ГБ II ст. явились наличие трех и более признаков: окружность талии более 102 см у мужчин и 88 см у женщин; повышение уровня триглицеридов до 1,7 ммоль/л и выше; уровень липопротеидов высокой плотности менее 1,0 ммоль/л у мужчин и 1,2 ммоль/л у женщин; уровень глюкозы натощак выше 6,1 ммоль/л.
Все больные прошли тщательное клинико-инструментальное обследование, включавшее сбор анамнеза, клиническое наблюдение, ЭКГ, биохимическое и морфологическое исследование крови, рентгенографию, эхокардиографию, допплер-исследование экстракраниальных сосудов, суточное мониторирование АД.
Критериями включения в исследование пациентов с МС явилось наличие у них 3 из 5 нижеперечисленных симптомов (АСЕ):
-
1) окружность талии более 102 см у мужчин и более 88 см у женщин;
-
2) повышение уровня триглицеридов до 1,7 ммоль/л и выше;
-
3) снижение липопротеидов высокой плотности менее 1 ммоль/л у мужчин и 1,2 ммоль/л у женщин;
-
4) повышение уровня АД выше 130/85 мм рт. ст.;
-
5) гликемия натощак выше или равна 6,1 ммоль/л и/или гликемия крови больше 7,8 и меньше 11,1 ммоль/л
через 2 ч после проведения перорального глюкозотолерантного теста.
Медицинскими критериями исключения пациентов из исследования явились: операции на открытом сердце с использованием ИК, применение общей анестезии в течение предшествующих 2 лет, тяжелые неврологические расстройства (в том числе инсульт), психические заболевания (включая наркотическую зависимость и хронический алкоголизм) в анамнезе, инфаркт миокарда, cтенозирующий атеросклероз коронарных и сонных артерий, симптоматические и злокачественные артериальные гипертонии (АД 200/110 мм рт. ст. и выше); нарушения сердечного ритма и проводимости, хроническая почечная недостаточность, эндокринологическая патология, в том числе сахарный диабет, серьезный дефицит зрения и слуха, возраст больных, превышающий 75 лет, а также тяжелые сопутствующие заболевания, которые могли бы повлиять на проявления основного заболевания.
Всем обследуемым были выполнены однофотонная эмиссионная компьютерная томография головного мозга с 99mТс-ГМПАО, оценка неврологического статуса и когнитивной функции.
Перфузионная томосцинтиграфия головного мозга. Однофотонную эмиссионную компьютерную томографию головного мозга выполняли на двудетекторной гамма-камере “Forte” (Philips) после введения 740 МБк 99mТс-гексаметилпропиленаминоксима (ГМПАО).
Расчет значений объемного регионарного мозгового кровотока (рМК) в передней теменной, задней теменной, лобной верхней, лобной нижней, височной и затылочной областях, а также полушариях мозжечка производили с использованием трехкомпонентной модели кинетики 99mТс-ГМПАО, представленной N.Lassen с соавт., в модификации Y. Yonekura с соавт. [8].
Оценка неврологического статуса и когнитивной функции. Всем пациентам проводили стандартное неврологическое обследование. Когнитивную функцию оценивали, используя нейропсихологические тесты по схеме А.Р. Лурия и методики Векслера [9]: оценка слухоречевой краткосрочной памяти, продуктивности запоминания и долговременной памяти (запоминание 10 слов, воспроизведение рядов цифр в прямом и обратном порядке), оптико-пространственный гнозис (проба Равена), конструктивно-пространственный праксис (проба Хэда), мышление (толкование пословиц и поговорок, “сходство”), исследование пространственного мышления (проба Иеркса), динамика психической деятельности и внимания (таблицы Шульте, корректурная проба, “шифровка”).
Проведение данной работы было одобрено Этическим комитетом НИИ кардиологии СО РАМН. У каждого пациента было получено информированное согласие на проведение исследований.
Статистическую обработку полученных данных проводили с применением пакета программ STATISTICA компании StatSoft.Inc, версия 6.0, с использованием t-критерия Стьюдента для сравнения средних. Для определения взаимосвязи между признаками использовали одно- или многофакторный регрессионный анализ с дисперсион- ным анализом регрессии по F-критерию Фишера. Качество регрессионной модели оценивалось по величине квадрата множественного коэффициента корреляции (коэффициента детерминации) R2. Во всех процедурах статистического анализа критический уровень значимости p принимался равным 0,05. Результаты представлены как М±s, где М – среднее арифметическое, σ – стандартное отклонение.
Результаты и обсуждение
Результаты ОЭКТ с 99mТс-ГМПАО показали статистически значимо более низкие значения церебральной перфузии у больных метаболическим синдромом по сравнению с пациентами с ГБ. При этом более низкие значения рМК у лиц с МС наблюдались в задних отделах левой теменной доли (на 6,3%, p=0,004), в правой и левой височных областях (на 5,5%, p=0,009 и 7,1%, p=0,001, соответственно), а также в левой и правой затылочных долях (на 9,2%, p=0,00001 и 8,1%, p=0,00007) по сравнению с церебральным кровотоком у пациентов с ГБ (рис. 1).
По данным стандартного неврологического обследования ни у одного пациента не отмечалось очаговой симптоматики.
Результаты нейропсихологического тестирования показали более выраженное нарушение кратковременной памяти у пациентов с МС на 16% (p=0,003) по сравнению с больными ГБ. Статистически значимых межгрупповых различий по показателям зрительной памяти, внимания, психомоторной скорости, а также оптико-пространственного гнозиса и конструктивно-пространственного прак-сиса у данных пациентов не отмечалось.
При проведении регрессионного анализа определена тесная взаимосвязь между рМК и когнитивным статусом пациентов. Так, и у больных ГБ и пациентов с МС показатели кратковременной памяти прямо зависели от уровня рМК в задних отделах левой теменной области (R2=0,225; р=0,035, R2=0,3; р=0,0002, соответственно), правой и левой височных долях (R2=0,20; р=0,048, R2=0,22; р=0,002, R2=0,262; р=0,021, R2=0,13; р=0,020, соответственно), а также от состояния церебрального кровото- ка в левой затылочной области (R2=0,216; р=0,002, R2=0,94; р=0,043, соответственно).
У пациентов с МС снижение показателей кратковременной памяти было взаимосвязано с обеднением церебральной перфузии в передних отделах правой и левой теменных долей (R2=0,216; р=0,002, R2=0,94; р=0,043, соответственно) и правой затылочной области (R2=0,125; р=0,021). Кроме того, по данным многофакторного регрессионного анализа, у пациентов с МС мы отмечали тесную связь между снижением показателей конструктивнопространственного гнозиса (по данным пробы Равена) и ухудшением церебрального кровотока в левой затылочной доле (R2=0,251; р=0,0007), в передних отделах правой и левой теменных долей (R2=0,149; р=0,011, R2=0,139; р=0,014, соответственно), а также задних регионах правой и левой теменных областей (R2=0,203; р=0,003, R2=0,243; р=0,0009, соответственно).
У больных ГБ показатели внимания (по результатам корректурной пробы) тесно коррелировали с уровнем кровотока в задней части правой теменной области (R2=0,27; р=0,022), верхнем отделе левой лобной доли (R2=0,33; р=0,011), правой височной доле (R2=0,346; р=0,008), правой и левой затылочных областях (R2=0,279; р=0,02, R2=0,24; р=0,033, соответственно). Наряду с этим у данных пациентов была обнаружена статистически значимая зависимость между психомоторной скоростью (по показателям теста Шульте) и церебральной перфузией в правой височной области (R2=0,21; р=0,042), нижней части левой лобной доли (R2=0,201; р=0,047), правой передней теменной области (R2=0,352; р=0,015), а показатели конструктивно-пространственного гнозиса были взаимосвязаны с уровнем рМК в правой затылочной доле (R2=0,206; р=0,043).
Все вышеперечисленные факты свидетельствуют в пользу предположения о том, что в основе нейрокогни-тивной дисфункции как при МС, так и при ГБ лежит снижение интенсивности церебральной перфузии. Наблюдаемые патологические изменения микроциркуляции у таких пациентов могут быть вызваны нарушением механизмов регуляции сосудистого тонуса, морфологическими изменениями прекапиллярных резистивных сосудов, а также разрежением микрососудистой сети [10].
Рядом исследователей нарушения цереброваскулярной ауторегуляции и перфузии головного мозга предположительно рассматриваются в качестве одного из звеньев патогенеза нейрокогнитивной дисфункции при повышенном артериальном давлении [11]. Ранее опубликованные нами данные [12, 13, 14] и результаты, полученные в настоящем исследовании, позволяют утверждать, что именно нарушение церебральной перфузии являет-
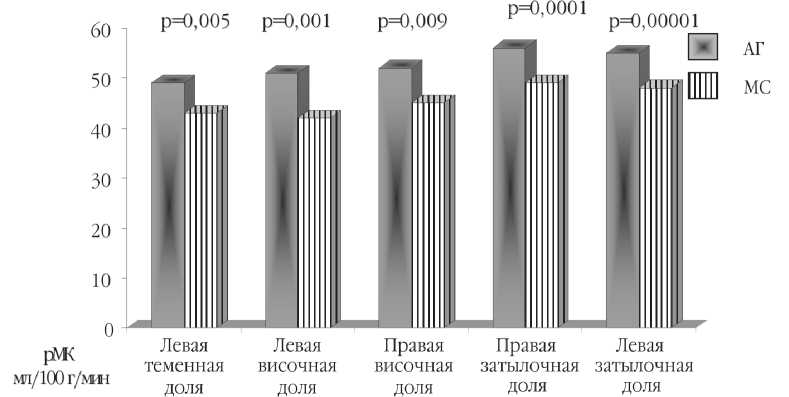
Рис. 1. Результаты ОЭКТ у пациентов с метаболическим синдромом по сравнению с показателями регионарного мозгового кровотока (рМК) у больных АГ
ся одной из важнейших причин развития нейрокогни-тивного дефицита у больных ГБ и МС.
По данным E. Ferranini, A. Natali [15], у 80% лиц ГБ сопровождается метаболическими нарушениями, что, безусловно, отягощает прогноз заболевания. Примерно у половины из числа больных ГБ наблюдаются инсулино-резистентность и гиперинсулинемия [16]. С другой стороны, у лиц, страдающих ожирением, ГБ встречается в 3 раза чаще, а гипертриглицеридемия в 2 раза чаще, чем у лиц с нормальной массой тела [17].
Отдельные составляющие метаболического синдрома сами по себе могут оказывать негативное влияние на церебральную перфузию и, как следствие, на когнитивную функцию. Так, артериальная гипертензия [18], дислипидемия [19] и гиперинсулинемия [20] увеличивают риск развития деменции и когнитивных нарушений. Более того, у больных МС выявляется повышенная склонность к тромбообразованию [21]. Данный факт обусловлен увеличением содержания фибриногена и повышением активности ингибитора тканевого плазминогена (PAI-1), синтезируемого в основном адипоцитами висцеральной жировой ткани, который ингибирует тканевый активатор плазминогена, что приводит к замедлению расщепления фибрина [22]. Нарушение гемореологических свойств крови, в сочетании с гиперлипидемией способствует тромбообразованию и нарушению микроциркуляции жизненно важных органов. Этим обусловлено более раннее и тяжелое поражение органов-мишеней, в частности головного мозга у пациентов с МС, по сравнению с больными ГБ. Ожирение у лиц, страдающих ГБ, в 7 раз чаще приводит к развитию инсульта по сравнению с общей популяцией [23].
Таким образом, у пациентов с метаболическим синдромом наблюдается более выраженное снижение мозгового кровотока и когнитивной функции, чем при ГБ. Нарушение церебральной перфузии является важным патогенетическим звеном развития нейрокогнитивного дефицита у таких пациентов.
Список литературы Нарушения церебральной перфузии как патогенетическое звено когнитивной дисфункции у больных эссенциальной гипертонией и пациентов с метаболическим синдромом
- Zimmet P., Alberti G. The metabolic syndrome: progress towards one definition for an epidemic of our time//Nat. Clin. Pract. Endocrinol. Metab. -2008. -Vol.4, №5. -P. 239.
- The ARIC Investigators. The Atherosclerosis Risk in Communities (ARIC) Study: design and objectives//Am. J. Epidemiol. -1989. -Vol.129. -P. 687-702.
- Kannel W., Cuppels L., Ramaswami R. et al. Higgis m regional obesity and risk of cardivascular disease; the Framingham study//J. Clin. Epidemiol. -1991. -Vol.44, №2. -P. 183-190.
- Multiple Risk Factor Intervention Trial Research Group. MRFIT: Risk factor changes and mortality results//J. Am. Med. Ass. -1982. -Vol.248. -P. 1465-1477.
- Ferrari P, Weidmann P Insulin, insulin sensitivity and hypertension//J. Hypertens. -1990. -Vol.8, №6. -P. 491-500. -(Review).
- Van den Berg E., Biessels G., de Craen A. et al. The metabolic syndrome is associated with decelerated cognitive decline in the oldest old//Neurology. -2007, Sep. 4. -Vol.69, №10. -P. 979-985.
- Yaffe K., Kanaya A., Lindquist K. et al. The metabolic syndrome, inflammation, and risk of cognitive decline.//J.A.M.A. -2004. -Vol.292, №18. -P. 2237-2242.
- Yonecura Y., Nishizawa S., Mukai T. SPECT with 99m Tc d, l hexamethyl propylene amine oxime (HM PAO) compared with regional cerebral blood flow measured by PET. Effects of linearization//J. Cerebral Blood Flow & Metab. -1988. -Vol.8. -P. 82-89.
- Wechsler D. Wechsler Memory Scale Revised: Manual. -New York: Psychological Corporation, 1987.
- Levy B., Ambrosio G., Pries A., Struijker Boudier H. Microcirculation in hypertension: a new target for treatment?//Circulation. -2001. -Vol.104, №6. -P. 735-740.
- Nobili F., Rodriguez G., Marenco S. et al. Regional cerebral blood flow in chronic hypertension. A correlative study//Stroke. -1993. -Vol.24, №8. -P. 1148-1153.
- Ефимова Н.Ю., Чернов В.И., Ефимова И.Ю. и др. Состояние церебральной гемодинамики и когнитивной функции у больных ИБС после аортокоронарного шунтирования//Ангиология и сосудистая хирургия. -2004. -Т.10, №3. -С. 114-124.
- Ефимова Н.Ю., Чернов В.И, Ефимова И.Ю. и др. Когнитив ная дисфункция и состояние мозгового кровообращения у больных артериальной гипертонией, возможности меди каментозной коррекции//Неврологии и психиатрии. -2008. -№11. -С. 10-15.
- Chernov V., Efimova N., Efimova I., Ahmedov S.H., Lishmanov Yu. Short term and long term cognitive function and cerebral perfusion in off pump and on pump coronary artery bypass patients//Eur. J. Cardio Thorac. Surg. -2006. -№29. -P. 74-81.
- Ferrannini E., Natali A. Essential hypertension, metabolic disorders and insulin resistance//Am. Heart. J. -1991. -Vol.121. -P. 1274-1462.
- Lind L., Berne Ch., Lithell H. Prevalence of insulin resistance in essential hypertension//J. Hypertens. -1995. -Vol.13, Pt.1. -P. 1457-1462.
- Kaplan N. The deadly quartet. The upper body obesity, glucose intolerance, hypertriglyceridemia and hypertension//Arch. Int. Med. -1989. -Vol.149. -P. 1514-1520.
- Knopman D., Boland L.L., Mosley T. et al. Cardiovascular risk factors and cognitive decline in middle aged adults//Neurology. -2001. -Vol.56. -P. 42-48.
- Evans R.M., Emsley C.L., Gao S. et al. Serum cholesterol, APOE genotype, and the risk of Alzheimer's disease: a population based study of African//Am. Neurology. -2000. -Vol.54. -P. 240-242.
- Kanaya A., Barrett Connor E., Gildengorin G., Yaffe K. Change in cognitive function by glucose tolerance status among older adults: a 4 year prospective study of the Rancho Bernardo study cohort//Arch. Intern. Med. -2004. -Vol.164. -P. 1327-1333.
- Juhan Vague I., Thompson S.G., Jespercen J. Involvment of the hemjstatic system in the insulin resistance syndrome. A study of 1500 patients with angina pectoris//Arterioscl. Thromb. -1993. -Vol.13. -P. 1865-1873.
- Weigle D. Leptin and other secretory products of adypocites modulate multiple physiological functions//Ann. Endocrinol. (Paris) 1997. -Vol.58. -P. 132-136.
- Castelli W. Cardivascular disease and multifactorial risk: challenge of the 1980s//Am. Heart J. -1983. -Vol.106. -P. 1191-1200.


