Наследование цитогенетических и молекулярно-клеточных эффектов в клетках костного мозга животных при хроническом воздействии ионизирующего излучения
Автор: Башлыкова Людмила Анатольевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 2-3 т.19, 2017 года.
Бесплатный доступ
В экспериментах на лабораторных мышах исследованы эффекты хронического воздействия гамма-излучения в диапазоне доз от 10 до 64 сГр. Показано немонотонное изменение повреждений ДНК, оцененное на молекулярном (ДНК-кометный тест) и цитогенетическом уровнях (микроядерный тест, митотический индекс). У первого поколения мышей, родители которых были облучены в дозах 10, 20 и 30 сГр, отмечен достоверно более высокий уровень двунитевых разрывов ДНК, клеток с микроядрами, понижение митотической активности и усиление апоптоза по сравнению с контролем. У второго-третьего поколений, рожденных от родителей, облученных в дозе 30 сГр, по сравнению с контролем достоверно более низкий уровень двунитевых разрывов ДНК и клеток с микроядрами на фоне снижения митотического индекса и апоптоза. У пятого поколения различия с контролем нивелируются.
Хроническое облучение, доза, мыши линии af, наследование, геном
Короткий адрес: https://sciup.org/148205157
IDR: 148205157 | УДК: 575.1:539.16.04:611.018.41:59
Текст научной статьи Наследование цитогенетических и молекулярно-клеточных эффектов в клетках костного мозга животных при хроническом воздействии ионизирующего излучения
Актуальной проблемой современности является не только изучение изменения стабильности генома соматических клеток, выяснение механизмов его дестабилизации в условиях действия комплекса факторов окружающей среды, в том числе и радиационных, но и исследование возможности наследственной передачи этих изменений. К настоящему времени накоплен ряд экспериментальных и эпидемиологических данных, свидетельствующих о возможности повышения нестабильности генома у потомства облученных родителей [1, 5, 7, 10, 13, 22, 23]. Изучение состояния животных при хроническом облучении в диапазоне малых доз ионизирующей радиации (до 50 сГр) выявило неоднозначность геномного ответа [1, 10].
Цель исследования: с помощью цитогенетических и молекулярных методов изучить стабильность генома лабораторных мышей при хроническом воздействии ионизирующего излучения (ИИ) в диапазоне малых доз и их необлученных потомков, что позволит выявить возможность наследования радиационно-индуцированной нестабильности в ряду поколений этих животных.
Материалы и методы. Эксперименты были проведены на мышах линии Af, которые с двухмесячного возраста содержались в условиях хронического γ-излучения. Использована γ-уста-новка с двумя источниками 226Ra, содержащих 0,474 х 106 и 0,451 х 106 кБк 226Ra. Облучение животных проводили в течение от 1 до 7 месяцев при мощности экспозиционной дозы 150 мкГр/ч. Суммарные дозы облучения животных составили 10, 20, 30, 37, 45, 52 и 64 сГр, которую определяли с помощью дозиметров экспозиционной дозы ДТУ-1 на базе детекторов ДТГ-4. Для получения потомства (F 1 ) от облученных животных были использованы самцы и
самки мышей, которые подвергались облучению в течение 1, 2 и 3 мес., наколенная доза у которых составила 10, 20 и 30 сГр . От мышей, облученных в дозе 30 сГр, получены потомки до пятого поколения. Контрольные пары животных формировались одновременно с опытными парами.
Методы исследования. Изучение генетических эффектов хронического излучения на молекулярном уровне проведены на клетках костного мозга с использованием ДНК-кометного теста, который основан на электрофорезе иммобилизованных в агарозу отдельных клеток. Для анализа уровня повреждения ДНК был использован «нейтральный» вариант метода ДНК-комет, детектирующий двунитевые разрывы (ДР) ДНК [26]. Препараты анализировали на микроскопе AxioSсopе А1 (Carl Zeiss, Германия) с видеосистемой на основе цифровой камеры AxioCam с программой «AxioVision, Release 4.8.2» (Carl Zeiss). На каждом слайде регистрировали по 100 комет. Для анализа и обработки микрофотоизображений ДНК-комет использовали программу СometScore Pro. Количество дву-нитевых разрывов ДНК оценивали по количеству поврежденной ДНК в хвосте кометы, выраженной в процентах (% ТDNA) [25]. Для цитогенетических исследований использован микроядерный тест клеток костного мозга, который является одним из информативных и быстрых способов индикации генотоксичности различных факторов химической и физической природы, основанный на подсчете интерфазных клеток с микроядрами [20]. Препараты КМ для подсчета микроядер (МЯ) готовили из той же взвеси клеток, которую использовали для ДНК-кометного теста. Гипотонию проводили 0,56% раствором KCL (+370C, 10 мин) и фиксировали метанол-уксусным (3:1) фиксатором [16]. Анализ клеток проведен с использованием флуоресцентной микроскопии, что позволило оценить не только частоту клеток с микроядрами, но и митотический индекс (МИ), и долю элиминирующих клеток по типу программированной гибели - апоптозу [17]. Для учета всех типов клеток в 1000 просмотренных (интерфазных, делящихся, с микроядрами, апоптоз-ных) использован лабораторный счетчик «Стимул Плюс С5». Статистическую обработку экспериментального материала проводили с использованием критерия Стьюдента, критерия малых долей, U-критерия Манна-Уитни [11].
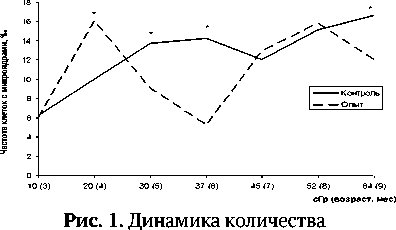
Результаты и обсуждение. В эксперименте с хроническим облучением было задействовано 135 животных. Результаты микроядерного теста, представленные на рис. 1, свидетельствуют о том, что у контрольных животных количество аберрантных клеток с возрастом (от 3 до 5 мес.) увеличивается от 6 до 14‰ и продолжительное время остается на одном уровне (14±2%о). У мышей, испытывающих хроническое облучение, отмечены периоды резкого увеличения и уменьшения количества клеток с микроядрами (от 5,2 до16,2%о), что достоверно выше (при дозе 20 сГр) или ниже (при дозах 30, 37 и 64 сГр) физиологической нормы. То есть у животных в условиях хронического низкодозового воздействия ионизирующего излучения мы наблюдаем немонотонное изменение количества повреждений ДНК, которое свидетельствует о гиперчувствительности при меньших дозах (20 сГр) и радиорезистентности при более высоких дозах (30, 37 и 64 сГр).
Оценка количества двунитевых разрывов ДНК у животных, облученных в дозах 10, 20 и 30 сГр проведена через 4 месяца после окончания облучения (животные использовались для получения потомства). Сравнение количества поврежденной ДНК (в процентах, % TDNA), содержащейся в «хвосте» кометы, показало, что у животных, облученных в дозах 10 и 20 сГр, различий с контролем по количеству ДР не обнаружено (табл. 1). Животные, облученные в большей дозе (30 сГр), имели достоверно меньше ДР, чем контрольные. Сравнение ранжированных данных (табл. 1) по процентному содержанию ДНК в хвосте кометы показало, что у животных, облученных в дозе 10 сГр, по сравнению с контролем понижено количество клеток с неповрежденной ДНК (р<0,001), а у облученных в дозе 30 сГр этот показатель достоверно выше, чем в контроле (5,6 и 2,1%, соответственно, р<0,01). Таким образом снижение количества ДР ДНК у животных облученных в дозе 30 сГр связано с достоверно более высоким содержанием неповрежденных клее-ток (рис. 4), что может свидетельствовать об активации систем репарации ДНК. У мышей, подвергнутых облучению в дозах 10 и 20 сГр, меньше клеток с большим количеством поврежденной ДНК (>50%): у облученных в дозе 20 сГр различие с контролем достоверно (р<0,001), у облученных в дозе 10 сГр -имеет только тенденцию (р=0,06). Клетки с большой долей поврежденной ДНК относят к апоптозным [10, 17]. Поэтому можно предположить, что снижение количества клеток с высокофрагменти-рованной ДНК связано со снижением чувствительности клеток к апоптозу. Несмотря на отсутствие отличий по средним значениям ДР ДНК у животных, облученных в дозах 10 и 20 сГр, по сравнению с контролем, мы наблюдаем различия по уровню клеток с неповрежденной и высоко фрагментированной ДНК.
микронуклеированных клеток костного мозга в зависимости от дозы Y-излучения и возраста лабораторных мышей.* - различия с контролем достоверны при р^ 0,05
Таблица 1. Уровень двунитевых разрывов ДНК по результатам ДНК-кометного теста клеток костного мозга мышей линии Af, подвергнутых хроническому облучению в разных дозах, и их необлученных потомков
|
Покол ения |
Варианты облучения |
N |
% TDNA |
Клетки с неповрежд енной ДНК, % |
Клетки с высоко-фрагментир ованной (>50%) ДНК, % |
|
Fо |
0 |
10 |
23,3±0,3 |
2,1±0,3 |
1,7±0,3 |
|
10 сГр |
5 |
24,6±0,4 |
0,4±0,2*** |
0,7±0,4 |
|
|
20 сГр |
6 |
23,2±0,4 |
1,4±0,5 |
0,5±0,3*** |
|
|
30 сГр |
6 |
19,6±0,5* |
5,6±1,0** |
1,2±0,5 |
|
|
F 1 |
0 |
5 |
15,6±0,6 |
10,2±1,6 |
1,9±0,07 |
|
10 сГр |
9 |
19,3±0,4* |
1,0±0,3** |
2,1±0,04* |
|
|
20 сГр |
8 |
24,7±0,8* |
1,2±0,3*** |
10,9±0,9*** |
|
|
30 сГр |
9 |
25,6±0,5* |
2,1±0,5*** |
4,6±0,7* |
Примечание : * - достоверность отличий от контроля (0) при p<0,05; ** - p<0,01; *** -p<0,001.
Митотическая активность клеток костного мозга контрольных животных с возрастом увеличилась от 1,0 до 4,8%о, а к 8-9 мес. снизилась до 3^ (рис. 2), что соответствует физиологической норме возрастного изменения пролиферативной активности. У мышей, подвергнутых хроническому низкодозовому облучению, данный показатель имел фазовый характер изменений (отмечено два пика и два минимума митотической активности), и амплитуда колебаний была больше, чем у животных из контрольной группы - от 0,8 до 5,4%о. Отметим, что достоверное повышение митотического индекса (в точке 20 сГр) сопровождается увеличением количества клеток с микроядрами, а при снижении этого показателя в точках 37 и 64 сГр наблюдается достоверное снижение доли клеток с МЯ (рис. 1). Снижение пролиферации связывают с остановкой клеточного цикла, необходимой для успешной репарации ДНК и активацией систем контрольных точек клеточного цикла (сверочных точек) [6]. Замедление деления клеток способствует увеличению времени, необходимому для репарации хромосомных аберраций, что в последующем приводит к снижению повреждений ДНК, зарегистрированных нами на клеточном (снижение клеток с микроядрами в точках 37 сГр и 64 сГр) и молекулярном (ДР ДНК) уровнях. То есть, исследуемые показатели - частота клеток с МЯ и митотический индекс клеток костного мозга у облучаемых животных в течение времени резко меняют свои величины вплоть до изменения знака биологического эффекта малых доз ИИ. Это указывает на отсутствие линейной зависимости между дозой хронического низкодозового облучения и его эффектом в клетках костного мозга. Наблюдаемые эффекты свидетельствуют об изменении чувствительности животных в процессе облучения, которая меняется от гиперчувствительности (достоверное повышение частоты МЯ, точка 20 сГр), до радиорезистентности (достоверно более низкая частота клеток с МЯ при дозах 30, 37, и 64 сГр, достоверно более низкий уровень ДР ДНК при дозе 30 сГр).
К настоящему времени известно, что при «слабых» радиационных воздействиях может происходить не только повышение, но и снижение выхода генетических нарушений [4, 18, 19]. Подобные эффекты малых доз ИИ отмечены в натурных исследованиях и экспериментах на разных объектах -клеточных культурах, млекопитающих, у работников атомной промышленности, у пострадавших от инцидентов на объектах ядерной промышленности. В работе [12] отмечено, что у сотрудников Сибирского химического комбината, которые в процессе профессиональной деятельности подвергались хроническому радиационному воздействию, дозовая зависимость частоты хромосомных аберраций (ХА) имела нелинейный характер. При облучении в дозе до 10 мЗв наблюдали достоверное уменьшение частоты ХА по сравнению с контролем, что соответствует известному явлению радиационного гормезиса. Проявление волнообразных изменений генетических эффектов у животных (кур), испытавших воздействие хронического облучения в течение 30 сут., отмечены в работе В.А. Будакова [2]. Установлено, что воспроизводительная способность после введения курам 131I в количестве 0,11 МБк/кг существенно не изменялась, при воздействии 1,1 МБк/кг - повышалась, при 2,1 МБк/кг - после кратковременного повышения отмечено снижение, при 4,6 МБк/кг - угнетение вплоть до необратимого прекращения. Снижение выраженности радиационного эффекта и изменение знака эффекта малых доз ИИ может быть связано с изменением в системе защиты генома - повышение эффективности системы детоксикации свободных радикалов, активации процессов репарации ДНК, апоптоза клеток [3, 6,9].
Проявление радиационно-индуцированных эффектов у потомков облученных животных. Анализ клеток костного мозга показал, что у потомков F 1 , родителей облученных в дозах 10, 20 и 30 сГр, доля клеток с МЯ достоверно выше контроля (рис. 3).
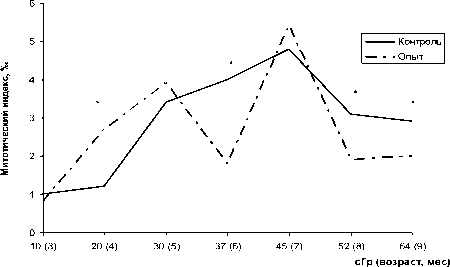
Рис. 2. Изменение митотической активности клеток костного мозга при хроническом низкодозовом облучении лабораторных мышей. * - различия с контролем достоверны при р^ 0,05
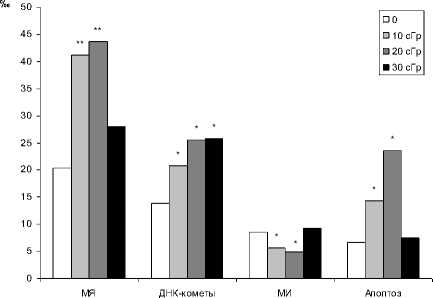
Рис. 3. Результаты исследования эффектов нестабильности генома клеток костного мозга потомков F 1 животных, испытавших воздействие хронического Y-излучения в разных дозах
Более выраженный эффект в отношении нестабильности генома в условиях проведенного эксперимента прослежен у потомков родителей, облученных в меньших дозах (10 и 20 сГр): частота клеток с МЯ в костном мозге в этих группах превышала норму в 2 раза (р<0,01), у потомков родителей, получивших дозу 30 сГр - в 1,3 раза (р<0,05). Исследования на молекулярном уровне показали, что у всех потомков F1 облученных животных наблюдается достоверно более высокий уровень ДР ДНК (рис. 3). По сравнению с контролем у F1 облученных животных происходит снижение в 5-10 раз количества клеток с неповрежденной ДНК и повышение в 2-4 раза клеток с высоко фрагментированной ДНК (табл. 1). Следует отметить, что у потомства облученных родителей в дозах 10 и 20 сГр наблюдается достоверное снижение МИ, что может свидетельствовать об активации репарации ДНК (рис. 3). У первого поколения мышей, облученных в дозах 10 и 20 сГр, отмечен достоверно более высокий уровень апоптоза, обнаруженный на клеточном (рис. 3) и молекулярном уровнях (увеличение клеток с высоко фрагментированной ДНК, табл. 1). C одной стороны, у первого пост-облученного поколения наблюдается повышенный уровень повреждений ядерного материала, определенный на цитогенетическом (МЯ) и молекулярном (ДР ДНК) уровнях, а с другой стороны – усиление защиты генома путем активации процесссов репарации ДНК (замедление пролиферации) и повышение апоптоза (элиминации клеток с нере-парируемыми повреждениями ДНК) [15]. Но их активация недостаточна для поддержания спонтанного уровня повреждений у первого поколения облученных животных. На основе данных литературы и полученных нами результатов можно предположить, что постоянное формирование МЯ и двунитевых разрывов ДНК является следствием состояния повышенного уровня нестабильности генома соматических клеток потомков первого поколения облученных родителей [7, 13, 27]. Предполагают, что повышенный уровень нестабильности генома в соматических клетках потомства является следствием нерепарированных или ошибочно репарированных повреждений генома половых клеток родителей в некий тип изменений, стимулирующих повышенную вариабельность в целом [7, 27].
Оценка нестабильности генома у отдаленных потомков была проведена у второго-пятого поколения (F 2 -F 5 ) мышей, родители которых были облучены в дозе 30 сГр. Обращает на себя внимание то, что выявленный у F 1 достоверно более высокий уровень аберрантных клеток с МЯ и ДР ДНК (рис. 3), в последующих поколениях становится ниже контрольного уровня (табл. 2). У потомков F 2 – F 4 обнаружено достоверное понижение частоты двунитевых разрывов ДНК (%TDNA, табл. 2).
Таблица 2. Цитогенетические и молекулярно-клеточные эффекты в клетках костного мозга потомков (F 2 -F 5 ) мышей линии Af, облученных в дозе 30 сГр
|
Поколения |
N |
МЯ, ‰ |
Апоптоз, ‰ |
МИ, ‰ |
%ТDNA |
|
|
F 2 |
контроль |
9 |
33,7±2,2 |
8,3±1,1 |
2,6±0,6 |
14,3±1,1 |
|
опыт |
10 |
20,1±1,4* |
3,8±0,6* |
1,3±0,4* |
10,9±0,9* |
|
|
F 3 |
контроль |
13 |
40,3±2,5 |
7,2±0,11 |
2,3±0,6 |
16,3±1,3 |
|
опыт |
12 |
34,8±2,9* |
4,8±0,12* |
0,1±0,1* |
12,6±0,9* |
|
|
F 4 |
контроль |
10 |
53,9±2,3 |
12,7±1,1 |
6±0,77 |
20,1±1,2 |
|
опыт |
10 |
51,8±2,26 |
11±1,0 |
8,5±0,91* |
16,4±1,2* |
|
|
F 5 |
контроль |
5 |
16,6±1,8 |
1,4±0,53 |
3,2±0,8 |
14,9±1,4 |
|
опыт |
6 |
15,3±1,6 |
1,3±0,46 |
3,3±0,74 |
14,2±1,4 |
|
Примечание: * - достоверность различий от контроля при p<0,05.
Снижение средних значений, характеризующих величину двунитевых разрывов ДНК, обусловлено достоверным повышением количества клеток с малоповрежденной ДНК, у которых в хвосте кометы фрагментов ДНК меньше 10% (рис. 4). При цитогенетическом исследовании клеток костного мозга F 2 –F 3 выявлено снижение количества клеток с микроядрами и митотического индекса, что может быть обусловлено усиленной репарацией ДНК на фоне снижения пролиферации [3, 6, 9]. По принципу обратной связи снижение повреждений ДНК (ДР ДНК и МЯ в F 2 –F 3 ) приводит к понижению количества клеток, подверженных элиминации (апоптозу) (табл. 2). У пятого поколения мы не обнаружили различий ни на клеточном, ни на молекулярном уровнях исследований.
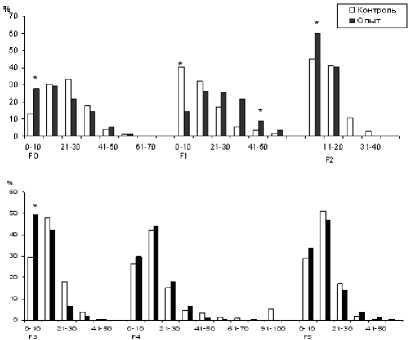
Рис. 4. Гистограмма распределения ДНК в хвосте «кометы» (%ТDNA) клеток костного мозга мышей линии Af после хронического γ-облучения в дозе 30 сГр и их необлученных потомков (F 1 -F 5 )
Выводы: можно сделать заключение об эффективности хронического воздействия ИИ в малых дозах. Наблюдаемые в области низких доз генетические эффекты обусловлены не столько повреждающим действием ионизирующего излучения, сколько особенностями реализации ответной реакции клетки на слабые внешние воздействия [8]. В условиях хронического низкодозового воздействия ионизирующего излучения наблюдается немонотонные изменения количества повреждений ДНК в виде двунитевых разрывов ДНК и клеток с микроядрами, а также непостоянство пролиферативной активности (митотический индекс). Это свидетельствует об отсутствии линейной зависимости между дозой хронического низкодозового излучения и его эффектом в клетках костного мозга. Обнаруженные эффекты свидетельствуют об изменении чувствии-тельности животных к ИИ в процессе облучения, которая меняется от гиперчувствительности до радиорезистентности. Изменение знака эффекта малых доз ИИ может быть связано с изменением в системе защиты генома - повышение эффективности системы детоксикации свободных радикалов, активации процессов репарации ДНК, апоптоза клеток [3, 6, 9]. У потомков F1 облученных родителей выявлено наследование нестабильности генома, о чем свидетельствует увеличение числа клеток с МЯ и ДР ДНК. Зависимость эффектов радиационно-индуцированной нестабильности генома (РИНГ) от дозы облучения на клеточном и молекулярном уровнях имеют нелинейный вид - большую эффективность в первом поколении проявили более низкие дозы (10 и 20 сГр по сравнению с 30 сГр). Полагают, что феномен РИНГ является следствием неточной репарации повреждений структуры генома [7, 27]. Особенностью этого эффекта являя-ется эпигенетический характер их наследования, то есть наследование измененного состояния генной экспрессии [9, 21]. Изменение таких показателей клеточного гомеостаза как митотический индекс и апоптоз направлены на поддержание целостности генома. В отличие от первого поколения, у отдаленных потомков облученных мышей отмечено снижение частоты ДР ДНК (F2-F4) и клеток с микроядрами (F2-F3) ниже спонтанного уровня. У этих животных понижены также показатели, свидетельствующие об изменении пролиферативной активности и элиминации клеток, что может свидетельствовать о перестройке работы системы защиты клеток, которая к тому же передается последующим поколениям. Вероятно, переданная по наследству нестабильность генома потомкам облученных животных, выражается в активации механизмов защиты генома – процессов репарации и апоптоза.
Работа выполнена при поддержке проекта Президиума УрО РАН (№ 15-4-4-20).
Список литературы Наследование цитогенетических и молекулярно-клеточных эффектов в клетках костного мозга животных при хроническом воздействии ионизирующего излучения
- Ахматулина, Н.Б. Отдаленные последствия радиации и индуцированная нестабильность генома//Радиационная биология. Радиоэкология. 2005. Т. 45, №6. С. 680-687.
- Будаков, В.А. Оценка репродуктивного здоровья кур и их потомков при хроническом действии 131I, введенного в организм родителей//Радиационная биология. Радиоэкология. 2015. Т. 55, №3. С. 267-281.
- Бурлакова, Е.Б. Особенности действия сверхмалых доз биологически активных веществ и физических факторов низкой интенсивности//Российский химический журнал. 1999. Т. 43, №5. С. 3-11.
- Бычковская, И.Б. Немутагенные немишенные радиационные эффекты. Наследуемое снижение жизнеспособности клеток, индуцированное лучевыми воздействиями в малых дозах//Радиационная биология. Радиоэкология. 2013. Т. 53, №3. С. 246-258.
- Воробцова, И.Е. Трансгенерационная передача радиационно-индуцированной нестабильности генома//Радиационная биология. Радиоэкология. 2006. Т. 46, №4. С. 441-446.
- Газиев, А.И. Низкая эффективность репарации критических повреждений ДНК вызываемых малыми дозами радиации//Радиационная биология. Радиоэкология. 2011. Т. 51, №5. С. 512-529.
- Дуброва, Ю.Е. Нестабильность генома среди потомков, облученных родителей. Факты и интерпретация//Генетика. 2006. Т. 42, №10. С. 1335-1347.
- Евсеева, Т.И. Сочетанное действие факторов радиационной и нерадиационной природы на традесканцию. Монография/Т.И. Дуброва, С.А. Гераськин. -Екатеринбург: УрО РАН, 2001. 156 с.
- Жижина, Г.П. Влияние малых доз низкоинтенсивной ионизирующей радиации на структуру и функции ДНК//Радиационная биология. Радиоэкология. 2011. Т. 51, №2. С. 218-228.
- Кузнецова, E.А. Индукция редко-и плотноионизирующими излучениями повреждений ДНК в лейкоцитах крови и цитогенетических повреждений в полихроматофильных эритроцитах костного мозга мышей и их потомков/Е.А. Кузнецова, С.И. Заичкина, Н.П. Сирота и др.//Радиационная биология. Радиоэкология. 2014. Т. 54, №4. С. 341-349.
- Лакин, Г. Ф. Биометрия. 3-е изд. -М.: Высшая школа, 1980. 352 с.
- Литвяков, Н.В. Частота и спектр цитогенетических нарушений у работников сибирского химического комбината/Н.В. Литвяков, М.Б. Фрейдин, М.В. Халюзова и др.//Радиационная биология. Радиоэкология. 2014. Т. 54, №3. С. 283-296.
- Ломаева, М.Г. Влияние ионизирующей радиации на уровень полиморфизма ДНК в разных тканях у потомства облученных мышей. Автореф. дисс… к.б.н. -М.: 2008. 24 с.
- Ломаева, М.Г. Повышенная вариабельность генома в соматических клетках у потомства самок мышей, подвергнутых острому рентгеновскому облучению в преконцептивный период/М.Г. Ломаева, Г.В. Васильева, Л.А. Фоменко и др.//Генетика. 2011. Т. 47, №10. С. 1371-1377.
- Михайлов, B.Ф. Молекулярные проявления радиационно-индуцированной нестабильности генома: возможность химической модификации/В.Ф. Михайлов, В.К. Мазурик, Е.Б. Бурлакова и др.//Радиационная биология. Радиоэкология. 2005. Т. 45, №5. С. 561-570.
- Орлов, В.Н. Сравнительная цитогенетика и карио-систематика млекопитающих/В.Н. Орлов, Н.Ш. Булатова. -М.: Наука, 1983. С. 21-28.
- Тронов, В.А. Спонтанная гибель мононуклеарных клеток, полученных от здоровых доноров и больных системной красной волчанкой/В.А. Тронов, Т.А. Никольская, М.А. Конопляников и др.//Цитология. 1999. Т. 41, №5. С. 400-404.
- Шмакова, Н.Л. Индукция хромосомных аберраций и микроядер в лимфоцитах периферической крови человека при действии малых доз облучения/Н.Л. Шмакова, Е.А.Насонова, Е.А. Красавин и др.//Радиационная биология. Радиоэкология. 2006. Т. 46, №4. С. 480-487.
- Grigorkina, E. Radioadaptation of rodents in the zone of local radioactive contamination (Kyshtim Accident, Russia): 50 years on/E. Grigorkina, G. Olenev//Radioprotection. 2009. V. 44, No 5. P. 129-134.
- Hedlle, J.A. A rapid in vivo test for chromosomal damage//Mutation Research. 1973. V. 18. Р. 187-190.
- Lorimore, S. A. Radiation-induced genomic instability and bystander effects: inter-related nontargeted effects of exposure to ionizing radiation/S.A. Lorimore, P.J. Coates, E.G. Wright//Oncogene. 2003. V. 22. P. 7058-7069.
- Maxwell, С.А. Targeted and nontargeted effects of ionizing radiation that impact genomic instability/S.A. Maxwell, M.C. Fleisch, S.V. Costes et al.//Cancer Res. 2008. V. 68, №20. P. 8304-8311.
- Mohr, U. Possible carcinogenic effect of γ-rays in a transgenerational study СВА mice/U. Mohr, T. Tillmann, K. Kamino et al.//Carcinogenesis. 1999. V. 20, №2. С. 325-332.
- Mothersill, C. Radiation_induced bystander effects: do they provide evidence for an adaptive response?/C. Mothersill, C. Seymour//Int. J. Low Radiat. 2006. V.2. №1/2. P. 119-127.
- Olive, P.L. Induction and rejoining of radiation induced DNA single-strand breaks: «tail moment» as a function of position in the cell cycle/P.L. Olive, J.P. Banath//Mutat Res. (DNA Repair). 1993. V. 294. P. 275-283.
- Singh, N.P. A simple technique for quantitation of low levels of DNA damage in individual cell/N.P. Singh, M.T. McCoy, E.L. Schneider//Exp. Cell Res. 1988. V. 175. P. 184-191.
- Skinner, M.K. What is an epigenetic transgenerational phenotype? F3 or F2//Reproductive Toxicology. 2008. V. 25. P. 2-6.


