Наследственные заболевания в практике врача-патологоанатома
Автор: Герасимов Виктор Николаевич, Яковлева Яна Сергеевна, Уренева Регина Валерьевна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Медико-биологические науки
Статья в выпуске: 3, 2017 года.
Бесплатный доступ
В последние годы отмечаются быстрые темпы развития генетики человека и медицинской генетики: в настоящее время изучены более 4 тыс. наследственных заболеваний. Доля наследственной патологии составляет значительную часть в структуре детской заболеваемости, смертности и инвалидности, но имеет место и в зрелом возрасте. Распространенность наследственных заболеваний во многом зависит от географических параметров. Цель - провести анализ случаев наследственных заболеваний, встретившихся в практической работе врача-патологоанатома за последние 10 лет, по материалам аутопсий Ульяновской областной клинической больницы (ГУЗ УОКБ). Материалы и методы. В представленной работе рассмотрены генетические аспекты, распространенность наследственных заболеваний, макро- и микроскопическая картины проявлений наследственной патологии на примере аутопсийных и биопсийных случаев десятилетнего периода работы патологоанатомического отделения Ульяновской областной клинической больницы. Объектом исследования послужил операционный, биопсийный, секционный материал, забранный у больных и умерших в ГУЗ УОКБ в 2005-2015 гг. После рутинной гистологической проводки изготавливались парафиновые срезы, которые окрашивались гематоксилином и эозином. Проведен морфологический анализ гистологических препаратов и протоколов вскрытий из архивных данных патологоанатомического отделения ГУЗ УОКБ. Результаты. Анализируя частоту встречаемости наследственных заболеваний, можно заключить, что в структуре заболеваемости нашего региона наследственная патология представлена весьма обширным рядом болезней, в т.ч. редкими и атипично текущими хромосомными По-видимому, это обусловлено значительной этнической разнородностью Поволжского региона и общероссийской тенденцией к увеличению наследственной патологии в общей структуре заболеваемости.
Наследственные заболевания, ретинобластома, опухоль вильмса, "тритон"-опухоль, болезнь гоше, синдром альпорта
Короткий адрес: https://sciup.org/14113288
IDR: 14113288 | УДК: 616-006.85; | DOI: 10.23648/UMBJ.2017.27.7084
Текст научной статьи Наследственные заболевания в практике врача-патологоанатома
Введение. Наследственные заболевания - это болезни, появление и развитие которых связано со сложными нарушениями в наследственном аппарате репродуктивных клеток. Возникновение таких недугов обусловлено нарушениями в процессах хранения, реализации и передачи генетической информации. Нередко термины «наследственная болезнь» и «врожденная болезнь» ошибочно употребляются как синонимы, однако врожденными болезнями называют те заболевания, которые имеются уже при рождении ребенка и могут быть обусловлены как наследственными, так и экзогенными факторами. Однако далеко не все наследственные болезни относят к врожденным, поскольку многие из них проявляются только после периода новорожденности [1].
Наследственная патология составляет значительную часть в структуре детской заболеваемости, смертности и инвалидности, но имеет место и в зрелом возрасте [2]. Распространенность наследственных заболеваний во многом зависит от географических параметров. Так, согласно исследованиям А.Р. Магжановой наследственных мутаций населения Волго-Уральского региона, неоднородность этнического состава определяет и частоту встречаемости наследственной патологии. На территории Волго-Уральского региона проживают представители тюркской ветви алтайской языковой семьи (башкиры, татары, чуваши), финно-угорской ветви уральской языковой семьи (марийцы, мордва, удмурты, коми) и славянской ветви индоевропейской языковой семьи (русские). Поэтому здесь встречаются мутации различного происхождения, а их частота и спектр у больных разных этнических групп довольно своеобразны и отличаются от других регионов России [3, 4]. По стране в целом в 2015 г. количество новорожденных с наследственной патологией зарегистрировано: с хромосомными болезнями – 5–8 на 1000 новорожденных, с моноген-ными заболеваниями – 7–17 на 1000 [5].
Цель исследования. Провести анализ случаев наследственных заболеваний, встретившихся в практической работе врача-патологоанатома за последние 10 лет, по материалам аутопсий Ульяновской областной клинической больницы (ГУЗ УОКБ).
Материалы и методы. Объектом исследования послужил операционный, биопсийный, секционный материал, забранный у больных и умерших в ГУЗ УОКБ в 2005– 2015 гг. После рутинной гистологической проводки изготавливались парафиновые срезы, которые окрашивались гематоксилином и эозином. Проведен морфологический анализ гистологических препаратов и протоколов вскрытий из архивных данных патологоанатомического отделения ГУЗ УОКБ. При морфоскопии использованы исследовательский бинокулярный микроскоп Carl Zeiss, увеличение 100 и 400, и цифровая камера MMC-31M-12C.
Результаты и обсуждение. Одним из тяжелых наследственных заболеваний является опухоль глаза – ретинобластома. Чаще всего ретинобластома обусловлена генетически. Как правило, речь идет о делеции участка длинного плеча одной из хромосом 13-й пары с повреждением гена Rb1. Случаи, когда у родителей, болевших ретинобластомой, рождаются здоровые дети, встречаются довольно редко [6].
Пример из практики. У мужчины 67 лет проведена энуклеация глаза, материал прислан на исследование с диагнозом «терминальная болящая глаукома». Макроскопически: глазное яблоко 4,0×4,5 см, роговица тусклая, в области сетчатки образование 1,0×0,6 см, на разрезе ткань бледно-серого цвета с кровоизлияниями. При микроскопии в сетчатке глаза наблюдался рост недифференцированной ретинобластомы, которая представлена мелкими мономорфными клетками с крупным ядром (рис. 1).
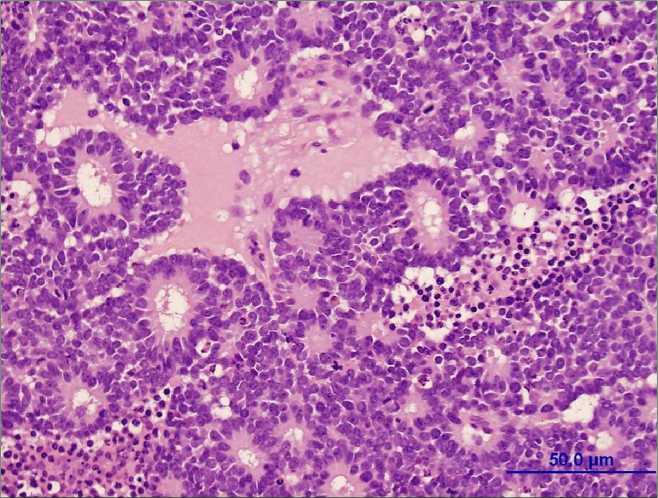
Рис. 1. Ретинобластома.
Окраска гематоксилином и эозином, ув. ×40
Ретинобластома – это опухоль детского возраста: на ее долю приходится 2,5–4,5 % случаев всех злокачественных новообразований у детей до 15 лет. В большинстве случаев ретинобластома развивается в возрасте до 5 лет, пик заболеваемости приходится на 2–3 года [7]. В приведенном выше случае опухоль глаза диагностирована у мужчины 67 лет, что свидетельствует о нетипичном развитии данной патологии.
Другой опухолью, передающейся по наследству, является опухоль Вильмса. Опухоль Вильмса (ОВ) составляет примерно 20–25 % всех злокачественных новообразований у детей, её обнаруживают у детей разного возраста, однако чаще – от 2 до 5 лет. Очень редко опухоль Вильмса встречается у взрослых: только у 0,9 % всех пациентов с опухолью почки. Установлено, что ОВ связана с нарушением эмбриогенеза почки и ключевая роль отведена генетическим нарушениям. За развитие ОВ ответственны нарушения в нескольких генах: WT1, WT2 и WT3. Первым из них был идентифицирован в 1989 г. ген WT1. Он локализован на коротком плече 11-й хромосомы и отвечает за образование специфических белков, участвующих в регу- ляции развития первичного нефрона. В норме продукты гена WT1 выступают в качестве регулятора развития почки и супрессора опухолевого роста. Помимо гена WT1, на хромосоме 11р идентифицирован ген WT2, а на хромосоме 16q – ген WT3. Предполагают нарушения 1р, 7р, 17р, 19q. Кроме выявленных нарушений в определенных генах, в последние годы важная роль в развитии ОВ отводится дисрегуляции фетальных митогенов – повышению экспрессии гена инсулиноподобного фактора роста [8] .
Пример из практики. У женщины 39 лет была удалена почка с опухолевидным образованием. Макроскопически: почка в капсуле размером 8,5×6,5 см. Капсула тонкая, снимается легко. Поверхность почки крупнобугристая. У наружного края почки под капсулой обнаружен узел размером 3×4 см, на разрезе – бледно-серого цвета с наличием множества мелких кист. На отдельных участках узел связан с чашечками и лоханками. Паренхима почки красно-коричневая, границы слоев различимы. Микроскопическая картина соответствовала мезенхимальной нефробла-стоме (опухоль Вильмса) (рис. 2).
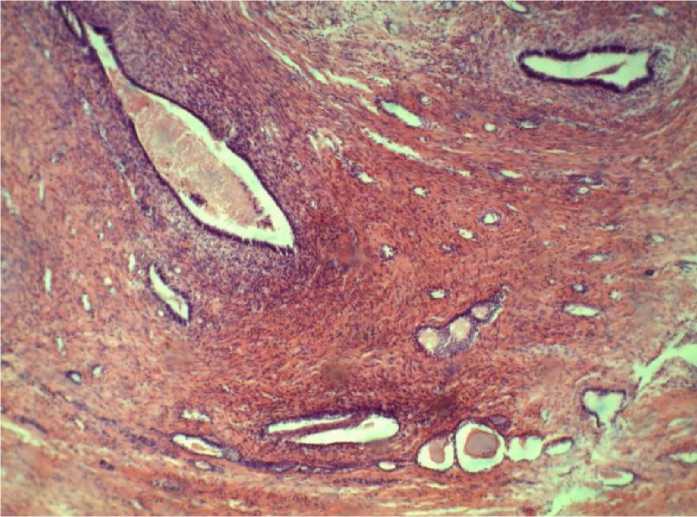
Рис. 2. Мезенхимальная нефробластома (опухоль Вильмса). Окраска гематоксилином и эозином, ув. ×40
Вопреки тому, что опухоль Вильмса развивается преимущественно у маленьких детей, в медицинской практике встречаются единичные случаи этого заболевания у пациентов, возраст которых вписывается в диапазон от 6 до 65 лет [9]. Учитывая крайнюю редкость этой патологии у взрослых пациентов, необходимо отметить отсутствие систематизированных сведений об особенностях ее клинического течения, лечения и прогнозе у данной категории больных.
Крайне редко встречающейся наследственной опухолью является «тритон»-опухоль. Это злокачественная опухоль оболочек, на долю которой приходится до 10 % всех мягкотканных сарком. Она может развиваться de novo или путем озлокачествления таких опухолей, как шваннома и ганглионеврома, нередко ассоциируется с нейрофиброматозом Реклингхаузена. Опухоль имеет дифферен- цировку рабдомиосаркомы и может включать в себя участки хондросаркомы, остеосаркомы, а также эпителиальные железистые структуры [10].
Пример из практики. У мужчины 45 лет обнаружена опухоль правой теменной доли, которая удалена оперативным путем. Макроскопическая картина: узел неправильной формы 3×3 см с бугристой поверхностью, белесовато-желтого цвета. На разрезе ткань плотная, бледно-серая, слоистая с участками бледно-желтого цвета. При микроскопическом исследовании можно было предположить метастазирование остеогенной саркомы в ткань головного мозга. После проведения консилиума выставлен диагноз «опухоль мозга состоит из участков типа рабдомиосаркомы и остеогенной саркомы, что может иметь место при «тритон»-опухоли» (рис. 3).
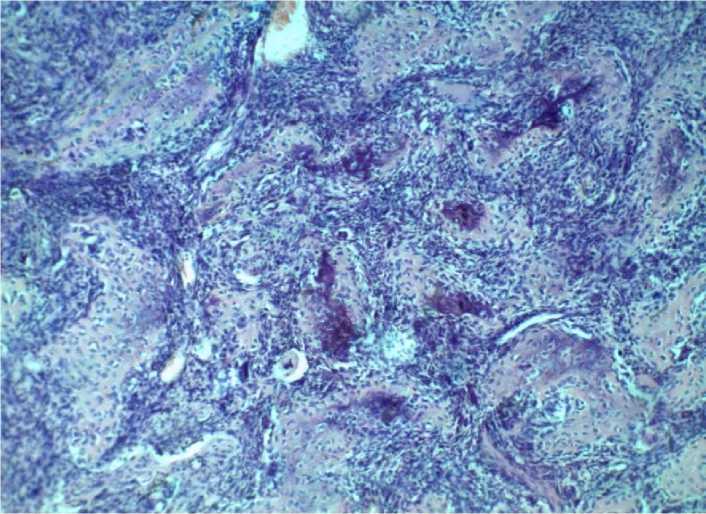
Рис. 3. «Тритон»-опухоль. Окраска гематоксилином и эозином, ув. х40
«Тритон»-опухоль обладает высоким злокачественным потенциалом и представляет собой классический пример морфологически сложного образования, сочетающего в себе два начала. Биологический феномен данной опухоли является в какой-то мере моделью для изучения подобных опухолей. Данные обстоятельства заставляют по-осо- бому взглянуть на это заболевание и являются важной посылкой к их рассмотрению.
Кроме опухолей с наследственной предрасположенностью, в 10-летней практике нашего отделения встречались и случаи наследственных синдромов, одним из которых является нарушение обмена веществ в клетке - болезнь Гоше. Заболевание описал в
1882 г. француз Филипп Шарль Эрнст Гоше. В основе болезни Гоше лежит наследственный дефицит активности фермента (глюко-цереброзидазы), участвующего в переработке продуктов в-фермента клеточного метаболизма. В результате недостаточной активности этого фермента в макрофагах накапливаются непереработанные «отходы» метаболизма жиров, которые располагаются сначала в селезенке, затем в печени, костях, костном мозге, легких. Болезнь Гоше встречается с частотой от 1:60 000 до 1:40 000 у представителей всех этносов; в популяции евреев Ашкенази частота достигает 1:450 [11].
Пример из практики. У мужчины 49 лет клинически диагностирован цирроз печени с гепатоспленомегалией. Оперативным путем удалена селезенка, взят участок печени на гистологическое исследование. Макроскопическая картина: селезенка 17,0×11,5 см, капсула тонкая. На разрезе паренхима селезенки мягко-эластичная, бледно-вишневая, однородная. При поскабливании обушком ножа соскоба не дает. Кусочек печени 0,5×0,4 см, паренхима бледно-коричневого цвета. При исследовании гистологических препаратов селезенки в красной пульпе имеются инфильтраты и диффузные скопления крупных светлых клеток с бледно-розовой цитоплазмой и эксцентрически расположенным ядром типа клеток Гоше. Лимфоидные фолликулы сохранены, синусы расширены. В паренхиме печени - очаговая жировая дистрофия гепатоцитов без признаков цирроза. Описанная морфологическая картина соответствует диагнозу «сфинголипидоз (болезнь Гоше)» (рис. 4). Болезнь Гоше можно диагностировать с помощью молекулярного анализа гена глюкоцереброзидазы [12]. Однако такой метод крайне сложный и дорогостоящий, поэтому к нему прибегают в редких случаях, когда диагностика заболевания затруднена. Наиболее часто диагноз ставят при обнаружении клеток Гоше в пункции костного мозга или увеличенной селезенки при проведении биопсии.
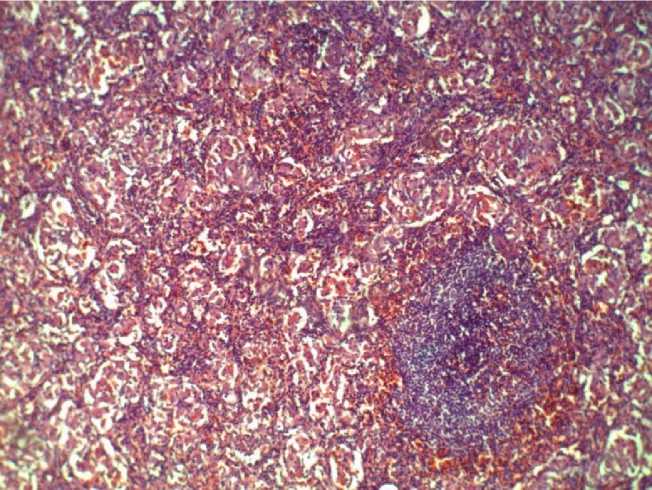
Рис. 4. Селезенка при болезни Гоше. Окраска гематоксилином и эозином, ув. х40
Другим примером наследственного синдрома является синдром Альпорта. Синдром Альпорта (СА) представляет собой заболевание, вызываемое мутациями в генах, кодирующих различные а-субъединицы коллагена IV типа. Причиной заболевания служит му- тация одного из генов: COL4A5, COL4A4, COL4A3. При классическом варианте СА мутация происходит в гене COL4A5, расположенном на длинном плече Х-хромосомы (Xq22.2), который кодирует а5-цепь коллагена IV типа. Аутосомно-рецессивная форма синдрома Альпорта обусловлена мутацией генов CОL4A3 и COL4A4, расположенных на хромосоме 2 и кодирующих соответственно а3- и а4-цепи коллагена этого типа. Аутосомно-доминантная форма СА сцеплена с генным локусом COL4A3–COL4A4. Распространенность заболевания составляет 1 на 5000 случаев [13].
Пример из практики . Умерший больной М., 19 лет. С возраста 10 лет состоял на учете в детской больнице с диагнозом «наследственный нефрит; тугоухость». Из анамнеза: у дяди больного был синдром Альпорта. Больной неоднократно лечился стационарно, в последнюю госпитализацию уровень мочевины составлял 44,6 ммоль/л, креатинина –
1678 мкмоль/л. В рамках лечения проводились сеансы гемодиализа. По результатам вскрытия – почки гипоплазированны. Общая масса почек 100 г, левая – 40 г, правая – 60 г, капсула снялась с трудом, поверхность почек мелкозернистая. На разрезе паренхима анемичная, пирамидки темно-синюшные, корковый слой истончен, границы между слоями четкие. Лоханки не расширены, мочеточники диаметром 0,4 см, проходимы. При микроскопическом исследовании почек – клубочки с утолщенной фиброзной капсулой, в некоторых капсула заращена, с очагами лимфоги-стиоцитарной инфильтрации, переходящей в очаговый фиброз и атрофию. Сосуды – с фиброзом стенки и ее гомогенизацией (рис. 5).
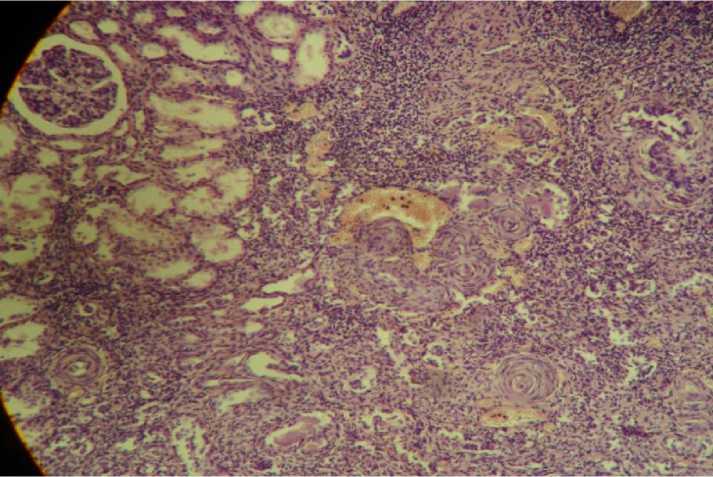
Рис. 5. Почки при синдроме Альпорта. Окраска гематоксилином и эозином, ув. ×40
У лиц мужского пола с Х-сцепленным доминантным вариантом СА заболевание имеет прогрессирующее течение: терминальная ХПН развивается у 50 % больных в возрасте до 25 лет [14]. При делеции или нонсенс-мутации COL4A5 риск развития терминальной ХПН в возрасте до 30 лет составляет 90 %. В большинстве случаев сроки развития терминальной ХПН у мальчиков с Х-сцеп-ленным доминантным вариантом СА схожи с другими членами семьи мужского пола, что позволяет прогнозировать время наступления терминальной ХПН даже без определения ге- нотипа, что и наблюдалось в приведенном выше случае [15].
Заключение. В последние годы отмечаются быстрые темпы развития генетики человека и медицинской генетики: в настоящее время изучены более 4 тыс. наследственных заболеваний. Это объясняется многими причинами и прежде всего резким увеличении-ем доли наследственной патологии в структуре заболеваемости и смертности населения. Анализируя частоту встречаемости наследственных заболеваний по результатам 10-летней практики патологоанатомичес- кого отделения Ульяновской областной клинической больницы, можно заключить, что в структуре заболеваемости нашего региона наследственная патология представлена весьма обширным рядом заболеваний, в т.ч. редкими и атипично текущими хромосомны- ми болезнями. По-видимому, это обусловлено значительной этнической разнородностью Поволжского региона и общероссийской тенденцией к увеличению наследственной патологии в общей структуре заболеваемости.
Список литературы Наследственные заболевания в практике врача-патологоанатома
- Бочкова Н.П. Медицинская генетика. М.: Мастерство; 2002. 656.
- Иванов В.И. Генетика: учебник для вузов. М.: Академкнига; 2006: 359-360.
- Кириллов А.Г. Наследственные болезни в Чувашской Республике: автореф. дис.. д-ра мед. наук. М.; 2008. 52.
- Кулешов Н.П., Мутовин Г.Р., Марченко Л.Ф. Организационные и методические основы пренатальной диагностики в профилактике наследственных и врожденных болезней. М.; 2004. 112.
- Потапова О.Н. Медико-социологическая характеристика феномена детской инвалидности. Социология медицины. 2010; 1: 11-17.
- Мякова Н.С. Ретинобластома. В кн.: Румянцев А.Г., Самочатова Е.В., ред. Гематология, онкология детского возраста. М.: Медпрактика; 2004. 679-684.
- Аксель Е.М., Горбачева И.А. Заболеваемость детей злокачественными новообразованиями и смертность от них в России и странах СНГ. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2007; 2: 136-154.
- Дурнов Л.А. Нефробластома. Опухоль Вильмса в свете проблем детской онкологии. Российский вестник перинатологии и педиатрии.1995; 4: 10-13.
- Аксель Е.М., Двойрин В.В., Дурнов Л.А. Статистика злокачественных новообразований детей в России. Вопросы онкологии. 1997; 4: 371-384.
- Петровичев Н.Н., Еремина Л.А., Хмелев О.Н., Касумов Н.В. Низкодифференцированная (дедиф-ференцированная) хондросаркома. Вопросы онкологии. 1984; 1: 8-13.
- Краснопольская К.Д. Наследственные болезни обмена веществ. М.: Центр социальной адаптации и реабилитации детей «Фохат»; 2005. 364.
- Sardi S.P., Viel C., Clarke J., Treleaven C.M. Glucosylceramide synthase inhibition alleviates aberrations in synucleinopathy models. Proc. Natl. Acad. Sci. USA; 2017. pii: 201616152.
- Игнатова М.С. Детская нефрология: руководство для врачей. М.: ООО «Медицинское информационное агентство»; 2011. 696.
- Phelan P.J., Fletcher E., Carroll N., Metcalfe W., Turner A.N. Simultaneous adult polycystic kidney disease and Alport syndrome. Nephrology (Carlton). 2016; 8: 722-723.
- Вельтищев Ю.Е., Игнатова М.С. Профилактическая и превентивная нефрология. М.; 1996. 61.


