Наследуемость толерантности к патогенным грибам Alternaria dauci и Fusarium oxysporum при создании гибридов моркови
Автор: Соколова Любовь Михайловна, Балашова Ирина Тимофеевна
Журнал: Овощи России @vegetables
Рубрика: Агрохимия, агропочвоведение, защита и карантин растений
Статья в выпуске: 3 (71), 2023 года.
Бесплатный доступ
Актуальность. Alternaria dauci, Alternaria radicina и Fusarium oxysporum - наиболее распространённые и вредоносные грибные патогены моркови столовой (Daucus carota L.) в Российской Федерации и в мире. Потери урожая корнеплодов от этих болезней составляют от 35 до 70%. Создание устойчивых к патогенам сортов и гибридов осложняется фактом полигенного контроля признаков устойчивости моркови столовой к грибам родов Alternaria и Fusarium. Взаимодействие с факторами внешней среды обусловливает плавный характер изменчивости полигенных признаков: изменены эффекты межаллельных и межгенных взаимодействий, ослаблена доминантность, усилена роль аддитивности генов. Поэтому в данном случае мы можем говорить не об устойчивости, как таковой, а о толерантности к комплексу патогенов. Цель исследований: определить наследуемость толерантности к патогенным грибам Alternaria dauci и Fusarium oxysporum у перспективных гибридов моркови столовой. Материалы и методы. Материалом исследования служили 7 исходных линий моркови столовой с различным типом корнеплода, 7 перспективных гибриды Fi, спороносящий мицелий Alternaria dauci и Fusarium oxysporum (для заражения). Методы исследования включали: оценку сеянцев, взрослых растений и корнеплодов на инфекционных фонах, дисперсионный и корреляционный анализы. 7 исходных линий моркови столовой оценили на устойчивость к грибам родов Alternaria и Fusarium поэтапно на нескольких типах инфекционных фонов, исходя из эпидемиологии возбудителей. Отобрали 1 толерантный и 6 слабовосприимчивых образцов, которые использовали в скрещиваниях. Получили гибридное потомство F1, которое также оценили на искусственном и естественном инфекционных фонах. Результаты: 1. Отобраны одна толерантная отцовская исходная форма 1268 и 6 слабовосприимчивых материнских исходных форм, которые были использованы в скрещиваниях. Получены гибриды F1. 2. Проведён анализ наследуемости толерантности моркови столовой к патогенным грибам Alternaria dauci и Fusarium oxysporum, который выявил, что толерантность к данным фитопатогенам наследуется по отцовскому типу. 3. Использование в скрещиваниях толерантной линии моркови 1268 в качестве отцовской формы и слабовосприимчивых материнских форм обеспечило стабильный рост доли образцов, обладающих устойчивостью к Alternaria dauci и Fusarium oxysporum в трёх F1 гибридных популяциях моркови столовой, оценённых на провокационном инфекционном фоне.
Морковь столовая (daucus carota), устойчивость, толерантность, комплексная оценка, линии, гибриды f1, наследуемость
Короткий адрес: https://sciup.org/140300110
IDR: 140300110 | УДК: 635.132:631.526.325:632.4 | DOI: 10.18619/2072-9146-2023-3-79-87
Текст научной статьи Наследуемость толерантности к патогенным грибам Alternaria dauci и Fusarium oxysporum при создании гибридов моркови
пространения альтернариоза к концу вегетации достигает 90–100%, а развитие болезни - до 15% [4]. И, наконец, при хранении корнеплоды поражаются чёрной гнилью (возбудитель Alternaria radicina Meier, Drechsler & Eddy), в результате чего утрачивается 50-70% урожая корнеплодов [2].
Указанные болезни моркови являются наиболее распространёнными и вредоносными в
Российской Федерации [4-6] и в мире [7-9].
Создание новых высокопродуктивных и устойчивых к патогенам сортов и гибридов моркови осложняется тем фактом, что признаки устойчивости к грибам родов Alternaria и Fusarium у моркови столовой контролируются полигенно. Идентифицировано 11 локусов количественной устойчивости (ЛКУ) у Daucus carota к Alternaria dauci, но если 4 из них проявлялись регулярно на протяжении 4-х лет при испытании в разных погодных условиях, то 7 из них проявлялись только в одном году.Кроме того,наблюдались значительные различия между аллельными эффектами у 4-х из пяти наиболее благоприятных аллелей, поступивших из 2-х устойчивых родительских линий, а 2 другие благоприятные аллели вообще поступили из восприимчивой линии [10]. Мы полагаем, что постоянное взаимодействие с факторами внешней среды обусловливает плавный характер изменчивости полигенных признаков: в этом случае изменяются эффекты межаллельных и межгенных взаимодействий, ослаблена доминантность, усилена роль аддитивности генов.Поэтому в данном случае мы можем говорить не об устойчивости, как таковой, а о толерантности к комплексу патогенов. Несмотря на значительный прогресс в области генетики устойчивости, определение наследуемости толерантности, столь необходимое селекционеру при планировании гибридизации, до сих пор остаётся существенным пробелом в исследованиях генетических основ устойчивости к данным патогенам.
Цель исследований: Определить наследуемость толерантности к патогенным грибам Alternaria dauci и Fusarium oxysporum у перспективных гибридов моркови столовой.
Материалы и методы исследований
Материалом исследований служили:
-
• Вегетирующие растения и корнеплоды 7 линий моркови столовой, относящихся к разным сортоти-пам: а) сортотип Берликум/Нанская – селекции ВНИИО – 1268, 225В и зарубежной селекции – №22, К 45, МС 1-1, №45, б) сортотип Нантская – 1238В и 661В.
-
• Вегетирующие растения и корнеплоды F i - гибридного материала моркови столовой (сортотип Берликум/Нанская). Всего изучена восприимчивость к патогенам 7 гибридных комбинаций, которые были получены нами в результате скрещиваний толерантных и слабовосприимчивых родительских линий: К45 х 225В, №45 х 225В, №22 х 1268В, К45 х 1238В, №22 х 661В, МС 1-1 х 1268, К45х1268.
-
• Спороносящий мицелий, необходимый для заражения, выделенный из популяций грибов Alternaria dauci, Alternaria radicina и Fusarium oxysporum , паразитирующих на моркови в условиях Московской области. Родовую и видовую принадлежность патогенов определяли по морфологии воздушного и субстратного мицелия, а также с помощью видоспецифичных праймеров в ПЦР-анализе [11, 12, 13, 14].
Методы исследований. Линейный материал моркови оценивали на 2-х инфекционных фонах (F usarium oxysporum , Alternaria dauci) в боксах селекционного центра ВНИИО площадью 48 м2. Посев семян проводили вручную. Площадь одной делянки составляла 0,25 м2 (длина – 1 м, ширина междурядья – 0,25 м), норма высева семян на делянке – 100 штук. Использование инфекционных фонов осуществляли поэтапно - таким образом, как это происходит в естественных условиях: первоначально заражали сеянцы, затем взрослые растения, затем корнеплоды. Заражение Fusarium oxysporum и Alternaria radicina осуществляли двумя способами: выращиванием сеянцев из семян на фильтрате культуральной жидкости и путём внесения в почву мицелия. Заражение Alternaria dauci – путём опрыскивания суспензией спор [15]. Распространённость и интенсивность развития болезней определяли по известной методике [16]. Устойчивость линейного материала к A. dauci оценивали, исходя из интенсивности развития болезни на листовых пластинках каждого образца:
-
• 0 - 0,8 - толерантный
-
• 0,9-1,5 - слабовосприимчивый
-
• 1,6-2,4 - средневосприимчивый
-
• 2,5-3,2 - восприимчивый
-
• 3,3-4,0 - сильновосприимчивый.
Контролем при определении устойчивости служило поражение растений на естественном инфекционном фоне полей селекционного севооборота [17]. На естественном фоне посев проводили ручной сеялкой. Площадь одной делянки составляла 7 м2 (длина – 10 м, ширина междурядья 0,7 м) с нормой высева семян на делянку 1 г. Распространённость, интенсивность развития болезней и устойчивость определяли теми же методами, что и на искусственном инфекционном фоне [16].
Устойчивость линейного материала к A. radicina и F. oxysporum оценивали во время уборки корнеплодов по пятибалльной шкале:
-
• 0-0,8 балла - поражено менее 20% поверхности корнеплода – толерантный;
-
• 1-1,5 балла - поражено 21^40% поверхности -слабовосприимчивый;
-
• 2-2,5 балла - поражено 41...60% поверхности -средневосприимчивый;
-
• 3-3,5 балла - поражено 61...80% поверхности -восприимчивый;
-
• 4 балла - поражено от 81...100% поверхности корнеплода - сильновосприимчивый.
Для оценки поражённости корнеплодов A. radicina и F. oxysporum после окончания периода хранения маточников использовали модифицированную нами шкалу ВИР:
-
• 0 - поражение отсутствует - устойчивый генотип;
-
• 1 балл - поражено менее 10% поверхности корнеплода –слабовосприимчивый генотип;
-
• 2 балла - поражено 10...25% поверхности корнеплода, симптомы поражения типичные – средневосприимчивый генотип;
-
• 3 балла - поражено 25...50% поверхности корнеплода, симптомы ярко выражены, спороношение типичное – восприимчивый генотип;
-
• 4 балла - поражено более 50% поверхности корнеплода, симптомы четко выражены, частичное разрушение тканей, гниение, усыхание – сильновосприимчивый генотип.
Посадку F1 гибридного материала проводили в поле селекционного центра на площади 175 м2 по схеме: ширина междурядья – 0,7 м, расстояние в ряду между корнеплодами – 0,25 м. Для успешного заражения соз- давали провокационный инфекционный фон в полевых условиях известным способом [15]. Оценку устойчивости к патогенам проводили описанными выше способами.
Статистическую обработку данных осуществили методами дисперсионного и корреляционного анализов и с помощью пакета прикладных программ Microsoft Excel 2010. Вычисление коэффициента наследуемости h 2 проводили с помощью корреляционного и дисперсионного анализов по методике Доспехова Б.А. [18].
Результаты исследований
Первоначально провели подробный анализ уровня восприимчивости линейного материала к исследуемым патогенам. Выделение патогенных штаммов для приготовления инокулюма [19], способы инфицирования и создания инфекционных фонов [15] описаны нами ранее. В этой работе мы сосредоточили свои усилия на оценке устойчивости линейного, а затем и гибридного материала моркови, с целью определения наследуемости устойчивости к Alternaria dauci и Fusarium oxysporum. Для того чтобы наиболее полно оценить устойчивость линий, мы постарались воспроизвести все возможные пути их заражения в естественных условиях:
-
1. Вырастили семена на фильтрате культуральной жидкости F. oxysporum и A. radicina (ФкЖ), имитируя заражение семян при занесении спор патогена на поверхность семени с потоком влаги, и отобрали устойчивые сеянцы.
-
2. Оценили устойчивость сеянцев при искусственном заражении F. oxysporum, A. radicina, внося патогены в почву (ИИФ-1), и A. dauci - путём опрыскивания
Таблица 1. Устойчивость к альтернариозу и фузариозу линейного материала моркови столовой, оценённая на разных типах инфекционных фонов, 2011-2012 годы
Table 1. Results of resistance evaluation to Alternaria dauci, A.radicina and Fusarium oxysporum of carrot lines, estimated at different types of infection backgrounds, 2011-2012
Линии
Группы устойчивости по годам вегетации
1 год
2 год
сеянцы
листья
корнеплоды
листья
ФкЖ*
ИИФ-1
ПИФ-1
ПИФ-2
ЕИФ
ИИФ-2
ЕИФ
ПИФ-2
ЕИФ
1268
Т**
Т
У
Т
Т
Т
Т
У
У
690П
Т
СВ
Т
Т
СВ
Т
Т
СВ
Т
1238В
СВ
СВ
Т
СВ
СВ
Т
Т
Т
Т
661В
СВ
СВ
Т
Т
СВ
СВ
Т
Т
СВ
22
Т
СВ
Т
Т
Т
Т
Т
СВ
Т
К45
СВ
СВ
Т
СВ
Т
Т
Т
СВ
Т
МС 1-1
СВ
СВ
Т
Т
Т
СВ
Т
Т
Т
Обозначения - результаты оценки:
-
* ФкЖ – сеянцев на фильтрате культуральной жидкости A. radicina и F. oxysporum; ИИФ–1 - сеянцев при искусственном заражении A. radicina и F. oxysporum; ПИФ –1 - сеянцев на провокационном инфекционном фоне A. dauci; ПИФ –2 - взрослых растений на полевом провокационном инфекционном фоне A. dauci; ИИФ-2 – корнеплодов после хранения и искусственного заражения F. oxysporum и A. radicina; ЕИФ – взрослых растений на естественном инфекционном фоне в открытом грунте.
-
* * Группы устойчивости: У – устойчивый, Т – толерантный, СВ – слабовосприимчивый.
-
-
3. Определили устойчивость взрослых растений после заражения A. dauci путём опрыскивания суспензией спор и создания провокационного инфекционного фона (ПИФ-2).
-
4. Оценили устойчивость взрослых растений на естественном инфекционном фоне (ЕИФ).
-
5. Определили устойчивость корнеплодов после выращивания растений на искусственном инфекционном фоне F. oxysporum и A. radicina и после хранения (ИИФ-2).
-
6. Оценили устойчивость корнеплодов, отобранных на естественном инфекционном фоне (ЕИФ).
-
7. Определили устойчивость взрослых растений второго года на провокационном инфекционном фоне A. dauci (ПИФ-2).
-
8. Оценили устойчивость взрослых растений на естественном инфекционном фоне (ЕИФ).
суспензией спор и создания провокационного инфекционного фона (ПИФ-1).
Результаты данной комплексной оценки представлены в сводной таблице 1.
Анализ результатов оценки свидетельствует о том, что наиболее устойчивым образцом из представленного материала является линия 1268, которая проявляет, тем не менее, только толерантность к исследуемым патогенам. Остальные линии демонстрируют слабую восприимчивость. Некоторые из них (22, К45, МС 1-1) проявляют толерантность на естественном инфекционном фоне (табл.1).
Проведя серию скрещиваний и получив гибридный материал моркови, мы оценили его восприимчивость на провокационных инфекционных фонах Alternaria dauci и Fusarium oxysporum в течение ряда лет – с 2014 по 2019 годы. В качестве стандарта толерантности использовали отцовскую форму – линию 1268. Оценка уровня восприимчивости к A. dauci семи F1 гибридных комбинаций позволила отобрать 3 гибридных комбинации с определённым уровнем устойчивости к патогенам рода Alternaria: К45 х 1268; К45 х 225В и МС 1-1 х 1268 (табл.2).
Комбинацию К45 х 1268 можно охарактеризовать, как толерантную к A. dauci (степень поражения листьев по годам – норма реакции – 0-0,9), так как она проявляла степень поражения листьев на уровне стандарта толерантности. Комбинации К45 х 225В и МС 1-1 х 1268 были оценены как слабовосприимчивые к A. dauci (степень поражения листьев по годам – норма реакции – 0,9-1,6).
Что же касается восприимчивости к Fusarium oxysporum, оценка, проведённая в 2014-2019 годах на провокационном инфекционном фоне,выявила четыре гибридные комбинации: К45 х 1268; №22 х 1268; МС 11 х 1268 и К45 х 225В, которые характеризовались как толерантные и слабовосприимчивые к патогенам рода Fusarium. Причём комбинация К45 х 1268 снова проявила толерантность к фитопатогену: степень поражения корнеплодов по годам – норма реакции – 0,8-1,1, уровень отклонения от стандарта – в пределах НСР05, а комбинации №22 х 1268; МС 1-1 х 1268 и К45 х 225В показали слабую восприимчивость: степень поражения корнеплодов по годам – норма реакции – 0,9-1,5 (табл.3).
Таблица 2. Степень восприимчивости к Alternaria dauci семи гибридных комбинаций моркови столовой, оценённая на провокационном инфекционном фоне. ВНИИО, 2014-2019 годы
Table 2. Degree of sensitivity to Alternaria dauci 7 hybrid combinations of carrot at provocative infection background. 2014-2019
|
Гибридная комбинация |
Степень поражения листьев по годам,средний балл |
Σ v |
Среднее |
Отклонени е от St |
|||||
|
2014 |
2015 |
2016 |
2017 |
2018 |
2019 |
||||
|
1268 – St тол.* |
0,5 |
0,7 |
0,7 |
0,5 |
0,5 |
0,7 |
3,6 |
0,60 |
St |
|
№22 х 1268 |
1,4 |
1,4 |
1,3 |
1,1 |
1,1 |
0,9 |
7,2 |
1,20 |
0,60 |
|
К45 х 1238В |
1,2 |
1,5 |
1,5 |
1,4 |
1,5 |
1,4 |
8,5 |
1,42 |
0,82 |
|
№22 х 661В |
1,2 |
1,7 |
1,6 |
1,2 |
1,1 |
1,1 |
7,9 |
1,32 |
0,72 |
|
МС1-1 х 1268 |
1,6 |
1,4 |
1,3 |
1,1 |
0,8 |
0,8 |
7,0 |
1,17 |
0,57 |
|
К45 х 1268 |
0,9 |
0,8 |
0,9 |
0,7 |
0,9 |
0,9 |
5,1 |
0,85 |
0,25 |
|
К45 х 225В |
1,2 |
1,4 |
1,3 |
1,1 |
1,1 |
1,0 |
7,1 |
1,18 |
0,58 |
|
№45 х 225В |
1,5 |
1,3 |
1,4 |
1,5 |
1,2 |
1,1 |
8,0 |
1,33 |
0,73 |
|
Σ р |
9,5 |
10,2 |
10,0 |
8,6 |
8,2 |
7,9 |
54,4 |
НСР05 |
0,34 |
St тол. – стандарт толерантности
Таблица 3. Степень восприимчивости к Fusarium oxysporum семи гибридных комбинаций моркови столовой. ВНИИО, 2014-2019 годы Table 3. Degree of sensitivity to Fusarium oxysporum 7 hybrid combinations of carrot at provocative infection background. 2014-2019
|
Гибридная комбинация |
Степень поражения корнеплодов по годам,средний балл |
Σv |
Среднее |
Отклонение от St |
|||||
|
2014 |
2015 |
2016 |
2017 |
2018 |
2019 |
||||
|
1268 – St тол.* |
0,7 |
0,8 |
0,7 |
0,7 |
0,8 |
0,7 |
4,4 |
0,73 |
St |
|
№22 х 1268 |
1,5 |
1,4 |
1,2 |
1,0 |
1,0 |
0,9 |
7,0 |
1,16 |
0,43 |
|
К45 х 1238В |
1,5 |
1,5 |
1,4 |
1,2 |
1,1 |
1,0 |
7,7 |
1,28 |
0,55 |
|
№22 х 661В |
1,4 |
1,3 |
1,2 |
1,2 |
1,0 |
1,0 |
7,1 |
1,18 |
0,45 |
|
МС1-1 х 1268 |
1,5 |
1,3 |
1,3 |
1,1 |
0,9 |
0,8 |
6,9 |
1,15 |
0,42 |
|
К45 х 1268 |
1,1 |
1,1 |
1,0 |
0,9 |
0,8 |
0,8 |
5,7 |
0,95 |
0,22 |
|
К45 х 225В |
1,2 |
1,2 |
1,3 |
1,1 |
1,0 |
0,8 |
6,6 |
1,1 |
0,37 |
|
№45 х 225В |
1,5 |
1,4 |
1,3 |
1,4 |
1,2 |
1,1 |
7,9 |
1,32 |
0,59 |
|
Σ р |
10,4 |
10,0 |
9,4 |
8,6 |
7,8 |
7,1 |
53,3 |
НСР05 |
0,22 |
St тол. – стандарт толерантности
Успех селекционного процесса при отборе устойчивых комбинаций в процессе гибридизации перекрёстно опыляющихся двулетних культур в значительной степени обусловлен корректным подбором родительских пар. При этом очень важно установить, каким образом наследуется изучаемый признак. Поскольку признаки устойчивости к грибам родов Alternaria и Fusarium у моркови столовой контролируется полигенно, единственным способом определить такую закономерность, является вычисление коэффициента наследуемости, который можно определить, как с помощью корреляционного анализа – при оценке материнских форм,так и с помощью дисперсионного анализа – при оценке отцовского компонента скрещивания [18]. Мы обратили внимание на то, что и в случае оценки устойчивости к A. dauci, и в случае оценки устойчивости к F. oxysporum наибольший уровень устойчивости выявлялся в комбинациях с отцовской формой 1268. В связи с этим был проведен эксперимент по определению наследуемости толерантности к возбудителям родов Alternaria и Fusarium гибридов F1. Для того чтобы выяснить, влияет ли материнская форма на проявление признака устойчивости/толерантности к исследуемым патогенам, провели корреляционный анализ, используя результаты оценки на искусственном инфекционном фоне материнских форм и гибридов, полученных от скрещивания с единственной отцовской формой –1268 – с целью соблюдения принципа единственного логического различия. Всего было исследовано 22 ковариационных пары. В результате было установлено, что материнский компонент скрещивания не влияет на проявление признака толерантности к Alternaria dauci и Fusarium oxysporum у гибридов F1 гибридов моркови столовой. В первом случае коэффициент корреляции составил 0,07. Ошибка и существенность коэффициента корреляции: tr=0,07; t05=2,09; t05>tr - корреляция не значима. Следовательно, устойчивость (толерантность) к Alternaria dauci по материнскому типу не наследуется, и отбор материнских форм по данному признаку будет неэффективным. Во втором случае коэффициент корреляции составил 0,23. Ошибка и существенность коэффициента корреляции: tr=1,05; t05=2,09; t05>tr – корреляция не значима, следовательно, нулевая гипотеза принимается. Устойчивость (толерантность) к Fusarium oxysporum по материнскому типу не наследуется. Можно ожидать, что она будет наследоваться по отцовскому типу. Таким образом, в экспериментах с участием материнских форм и гибридов F1 моркови столовой было установлено, что проявление групповой устойчивости у гибридов F1 не зависит от материнской формы. Было выдвинуто предположение, что данный признак может определяться отцовской формой.
Для того, чтобы это доказать, мы применили дисперсионный анализ, используя результаты оценки устой-
Таблица 4. Анализ наследуемости устойчивости/восприимчивости к Alternaria dauci гибридами F 1 моркови столовой. ВНИИО, 2014-2019 годы Table 4. Analysis the heritability of resistance/sensitivity to Alternaria dauci by hybrids F 1 of carrot. 2014-2019
|
Материнска я форма |
Отцовская форма |
Степень поражения листьев по годам,средний балл |
Σv |
Среднее |
|||||
|
2014 |
2015 |
2016 |
2017 |
2018 |
2019 |
||||
|
К45 |
1238В |
1,2 |
1,5 |
1,5 |
1,4 |
1,5 |
1,4 |
8,5 |
1,42 |
|
К45 |
1268 |
0,9 |
0,8 |
0,9 |
0,7 |
0,9 |
0,9 |
5,1 |
0,85 |
|
К45 |
225В |
1,2 |
1,4 |
1,3 |
1,1 |
1,1 |
1,0 |
7,1 |
1,18 |
|
Σ р |
3,3 |
3,7 |
3,7 |
3,2 |
3,5 |
3,3 |
20,7 |
- |
|
чивости трёх F 1 гибридов моркови, полученных с участием одной материнской формы – К45 и трёх отцовских форм (для соблюдения принципа единственного логического различия). Результаты анализа представлены в таблицах 4-7.
Таблица 5. Результаты дисперсионного анализа Table 5. Results of dispersion analysis
|
Дисперсии |
Суммы квадратов |
Степени свободы |
Средний квадрат |
F ф |
F 05 |
|
Общая |
1,18 |
17 |
- |
- |
- |
|
Повторений |
0,07 |
5 |
- |
- |
- |
|
Отцовских форм |
0,97 |
2 |
0,485 |
34,64 |
4,10 |
|
Остаток (ошибки) |
0,14 |
10 |
0,014 |
- |
- |
При вычислении генотипической и фенотипической изменчивости и коэффициента наследуемости по результатам дисперсионного анализа были получены следующие результаты: s г 2 =0,0785; s ф 2 =0,0925; h 2 =0,85 или 85%. Таким образом, коэффициент наследуемости равен 85%, и, следовательно, отбор отцовских форм по этому признаку должен быть эффективным.
Аналогичный анализ был проведен в отношении устойчивости/восприимчивости к Fusarium oxysporum (таблицы 6,7).
Анализируя при вычислении генотипической и фенотипической изменчивости, а также коэффициент насле- дуемости по результатам дисперсионного анализа получили данные: sг2=0,0277; sф2=0,0317; h2=0,87 или 87%. Таким образом, коэффициент наследуемости равен 87%, и, следовательно, отбор отцовских форм по этому признаку должен быть эффективным.
Необходимо отметить, что высокий уровень наследуемости признака устойчивости моркови столовой к Alternaria dauci (77%) отмечали и другие исследователи [10], но в своей публикации они не уточняли, какой компонент скрещивания нужно использовать в качестве донора данного признака. Мы это сделали впервые. Кроме того, считаем необходимым подчеркнуть, что поскольку устойчивость к Alternaria dauci и устойчивость к Fusarium oxysporum контролируется полигенно, степень проявления признака (норма реакции) будет зависеть от факторов окружающей среды. Поэтому мы и провели свои исследования в разные годы, используя данный фактор в качестве повторности.
Используя устойчивую линию моркови 1268 в качестве отцовской формы и слабовосприимчивые материнские формы в скрещиваниях, мы получили стабильный рост доли устойчивых образцов в гибридных популяциях моркови столовой (объём выборки – 100 растений) с 2011 по 2019 год. Причём, рост этот наблюдался и в случае заражения Alternaria dauci, и в случае заражения Fusarium oxysporum в трёх гибридных популяциях, отобранных нами: толерантной – К45 х 1268 и слабовосприимчивых – №22 х 1268 и МС1-1 х 1268 (рис.1-3). Незначительное отклонение мы наблюдали в комбинации МС 1-1 в случае заражения Alternaria dauci в 2017 году, но процент устойчивых образцов в 2019 году восстанавливался (рис.3).
Таблица 6. Анализ наследуемости устойчивости/восприимчивости к Fusarium oxysporum гибридами F1– гибридами моркови столовой. ВНИИО, 2014-2019 годы
Table 6. Analysis the heritability of resistance/sensitivity to Fusarium oxysporum by hybrids F1 carrot. 2014-2019
|
Материнская форма |
Отцовская форма |
Степень поражения корнеплодов по годам,средний балл |
Σ v |
ф ф т ч: ф о. О |
|||||
|
2014 |
2015 |
2016 |
2017 |
2018 |
2019 |
||||
|
К45 |
1238В |
1,5 |
1,5 |
1,4 |
1,2 |
1,1 |
1,0 |
7,7 |
1,28 |
|
К45 |
1268 |
1,1 |
1,1 |
1,0 |
0,9 |
0,8 |
0,8 |
5,7 |
0,95 |
|
К45 |
225В |
1,2 |
1,2 |
1,3 |
1,1 |
1,0 |
0,8 |
6,6 |
1,1 |
|
Σ р |
3,8 |
3,8 |
3,7 |
3,2 |
2,9 |
2,6 |
20,0 |
- |
|
Таблица 7. Результаты дисперсионного анализа Table 7. Results of dispersion analysis
|
Дисперсии |
Суммы квадратов |
Степени свободы |
Средний квадрат |
F ф |
F 05 |
|
Общая |
0,82 |
17 |
- |
- |
- |
|
Повторений |
0,44 |
5 |
- |
- |
- |
|
Отцовских форм |
0,34 |
2 |
0,17 |
42,5 |
4,10 |
|
Остаток (ошибки) |
0,04 |
10 |
0,004 |
- |
- |
К45х 1268 % устойчивых генотипов к Altemaria
К45 х 1268% устойчивых генотипов к Fusarium
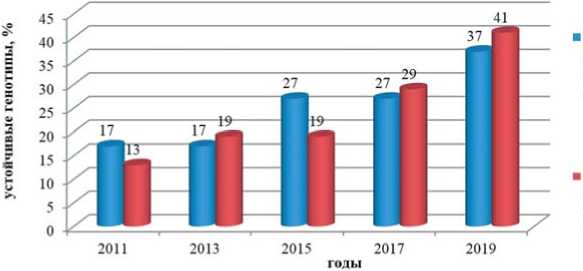
Рис.1. Повышение доли устойчивых образцов в F 1 гибридной популяции моркови столовой К-45 х 1268 (выборка – 100 растений)на провокационных инфекционных фонах Alternaria dauciи Fusarium oxysporum, 2011-2019 годы
Fig.1. Increasing % of resistantplantsin F 1 hybrid population ofcarrotК-45 х 1268 (from 100 of freechoosing plants) atprovocativeinfection backgroundsof Alternaria dauciand
Fusarium oxysporum, 2011-2019
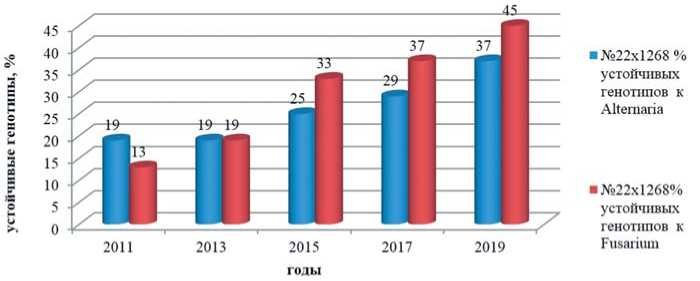
Рис.2.Повышение доли устойчивых образцов в F 1 гибридной популяции моркови столовой №22 х 1268 (выборка – 100 растений)на провокационных инфекционных фонах Alternaria dauciи Fusarium oxysporum, 2011-2019 годы
Fig.2.Increasing % of resistantplantsin F 1 hybrid population ofcarrot#22 х 1268 (from 100 of freechoosing plants) atprovocativeinfection backgroundsof Alternaria dauciand
Fusarium oxysporum, 2011-2019
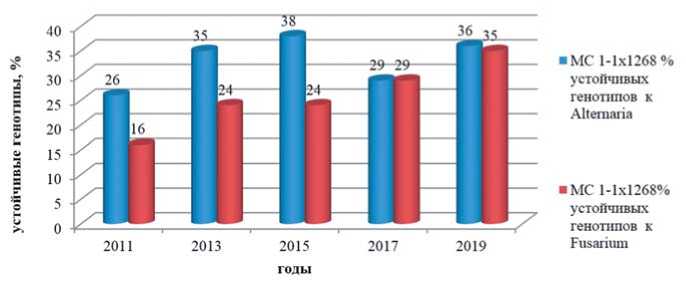
Рис. 3.Повышение доли устойчивых образцов в F 1 гибридной популяции моркови столовой МС1-1 х 1268 (выборка – 100 растений) на провокационных инфекционных фонах Alternaria dauci и Fusarium oxysporum, 2011-2019 годы Fig.3.Increasing % of resistantplantsin F 1 hybrid population ofcarrotMC1-1 х 1268 (from 100 of freechoosing plants) at provocativeinfection backgroundsof Alternaria dauciand Fusarium oxysporum, 2011-2019
Обсуждение
Селекция образцов, устойчивых к фитопатогенам, у перекрёстноопы-ляющихся культур в значительной степени осложняется фактом поли-генного контроля признака устойчивости. Характер изменчивости полигенных признаков обусловлен постоянным взаимодействием с факторами внешней среды. Дополнительное присутствие пато- гена накладывает свои ограничения на проявление признака. Тем более, когда речь идёт об устойчивости к группе патогенов, относящихся к разным видам и родам. В результате осложняется определение стабильных ЛКУ, связанных с признаком устойчивости к фитопатогену [9, 10, 23], не говоря уже о том, чтобы определить наследуемость данного признака. Определение наследуемости целевого признака при создании гибридов является ключевой позицией любого селекционера. Поэтому мы придерживаемся мнения академика Жученко А.А., который писал, что «наследуются не признаки ..., а их норма реакции, т.е. генетически обусловленная способность определенным образом реагировать на варьирующие условия окружающей среды» [20]. Спектр генов, детерминирующих среднюю величину и генетическую дисперсию количе- ственного признака, постоянно меняется в результате смены лимитирующего фактора внешней среды [21, 22]. Особенно это заметно в настоящее время – в условиях глобального изменения климата. В таких условиях наиболее прагматичным для селекции нами и рядом других исследователей [23-26] считается системный подход, обеспечивающий в равной степени оценку в проявлении признака генотипической и фенотипической изменчивости. Кроме того, необходимо учитывать эпидемиологические особенности фитопатогенов и возможности их эпигенетического контроля.
Вот почему в настоящее время
Возрастание процента устойчивых образцов в гибридных популяциях было постепенным, но устойчивым, что свидетельствовало о правильно выбранной стратегии селекции. Необходимо отметить, что возрастание процента устойчивых образцов наблюдалось на провокационных фонах.
исследователи ищут другие подходы к селекции устойчивых образцов. Разрабатываются целевые комплексные программы, включающие системный подход к генетическому разнообразию патогенов, их эпидемиологии, физиологии растения-хозяина и механизмам устойчивости. Оценивается совместимость различных механизмов контроля пато- генов и целевых подходов к решению проблем производства продукции [24]. Использование гибридов, на которое ранее делали ставку наиболее продвинутые производители, приводит к единообразию геномов, что отрицательно сказывается не только на вкусовых качествах продукции, но и на устойчивости к патогенам [25]. Поэтому селекционеры в настоящее время склонны уделять больше внимания разработке сортов, которые лучше адаптированы к изменениям климата, и могут выращиваться, например, в условиях засухи [26].
Изучается вариабельность устойчивости диких форм Daucus carota L., которые ранее считались несомненными источниками устойчивости к патогенам, и выясняется, что далеко не все из них обладают системной устойчивостью [27, 28].
Учитывая современные тенденции в селекции Daucus carota L., предлагаем следующий подход:
-
1. Особое внимание уделить оценке линейного материала на первых этапах селекции. Моделировать все эпидемиологические ситуации, которые возможны в условиях естественного заражения, отбирая толерантный и слабовосприимчивый линейный материал на жёстких инфекционных фонах в инфекционных боксах. В качестве материала для заражения использовать чистые культуры грибов, выделенные из популяций, паразитирующих на моркови в данной местности.
-
2. При анализе устойчивости гибридов обязательно использовать коэффициент наследуемости, который до сих пор остаётся единственным показателем, определяющим вклад генетической составляющей в общую вариабельность признака [29-32].
-
3. При гибридизации использовать устойчивую/толе-рантную линию моркови в качестве отцовской форм, а слабовосприимчивые линии – в качестве материнских форм.
-
4. Гибридный материал оценивать на провокационном инфекционном фоне в полевых условиях.
Данный подход позволил нам существенно увеличить долю устойчивых образцов в F 1 – гибридных популяциях моркови столовой (рис.1-3).
Выводы
В результате комплексной оценки устойчивости исходных родительских форм к наиболее распространённым и вредоносным грибным заболеваниям, а также анализа наследуемости данной устойчивости F 1 гибридным потомством моркови столовой были сделаны следующие выводы:
-
1. Оценка линейного исходного материала на жёстких инфекционных фонах должна быть эпидемиологически обоснованной, т.е. предусматривать все возможные сценарии заражения патогенами. Для создания искусственного инфекционного фона следует отбирать изоляты из местных популяций патогенов и получать из них чистые культуры гри-бов,которые использовать для заражения.
-
2. При полигенном контроле устойчивости проявление признака происходит в границах нормы реакции,поэтому в данном случае нужно говорить не об устойчивости,а о толерантности к патогену.
-
3. Толерантность моркови столовой к Alternaria dauci и Fusarium oxysporum наследуется по отцовскому типу,следовательно,при создании толерантных F1–гибридов толерантные линии нужно использовать в качестве отцовского компонента скрещивания.
-
4. Обеспечить стабильный рост доли непоражае-мых Alternaria dauci и Fusarium oxysporum генотипов в F 1 гибридных популяциях моркови столовой помогло использование в скрещиваниях толерантной линии моркови 1268 в качестве отцовской формы и слабовосприимчивых линий – в качестве материнских форм.
Об авторах:
Aboutthe Authors:
Lyubov M. Sokolova– Doc. Sci. (Agriculture), the leader researcher the laboratory of breeding root and Alliaceae crops, ,
Irina T. Balashova – Doc. Sci. (Biology),
Leader Researcher of Green,
Aromatic and Decorative Breeding Laboratory,
,
Список литературы Наследуемость толерантности к патогенным грибам Alternaria dauci и Fusarium oxysporum при создании гибридов моркови
- Hussain F., Usman F. Abiotic and Biotic Stress in Plants /IntechOpen, London, UK, 2019. doi: 10.5772/intechopen.83406.
- Nazarov P.A., Baleev D.N., Ivanova M.I., Sokolova L.M., Karakozova M.V. Infection diseases of plants: etiology, modern status, problems and prospects of plant protection. Acta Nature. 2020;12,3(46):46-59. doi: 10.32607/actanature.11026.
- Иванюк В.Г., Сидунова Е.В. Бурая пятнистость листьев моркови и пути снижения ее вредоносности. Овощеводство. Сборник научных трудов Белорусского НИИ овощеводства. Минск. 1998;(10):85-93.
- Ганнибал Ф.Б., Орина А.С., Левитин М.М. Альтернариозы сельскохозяйственных культур на территории России. Защита и карантин растений. 2010;(5):30–32.
- Ахатов А.К., Ганнибал Ф.Б., Мешков Ю.И., Джалилов Ф.С., Чижов В.Н., Игнатов А.Н., Полищук В.П., Шевченко Т.П., Борисов Б.А., Стройков, Ю.М., Белошапкина, О.О. Болезни и вредители овощных культур и картофеля. Товарищество научных изданий КМК, Москва, 2013, 463 с.
- Тимина Л.Т., Енгалычева И.А. Комплекс патогенов на овощных культурах в условиях центрального региона РФ. Овощи России. 2015;(3-4):123-129. https://doi.org/10.18619/2072-9146-2015-3-4-123-129. EDN UGKXKZ.
- Boiteux L. Heritability estimate for resistance to Alternaria dauci in carrot /Delia Vecchia P. and Reifschieder F. (eds). Plant Breeding. 1993;(110): 65–167.
- Налобова В.Л. Бурая пятнистость листьев (возбудитель-гриб Alternaria dauci) моркови столовой. Овощеводство. Сборник научных трудов Белорусского НИИ овощеводства. Минск, 2009;(16):231-237.
- Koutouan, C., Le Clerc, V., Baltenweck, R., Claudel, P., Halter, D., Hugueney, Ph., Hamama, L., Suel, A., Huet, S., Bouvet, Merlet, MH., Briard, M. Link between carrot leaf secondary metabolites and resistance to Alternaria dauci. Science Reports. 2018;13,8(1):13746. https://doi: 10.1038/s41598-018-31700-2.
- Le Clerc V., Marques S., Suel A., Huet S., Hamama L., Viosine L., Auperpin E., Jourdan M., Barrot L., Prieur R., Briard M. QTL mapping of carrot resistance to leaf blight with connected populations: stability across years and consequences for breeding. Theoretical and Applied Genetics. 2015;128(11):2177-2187. doi: 10.1007/s00122-015-2576-z.
- Семёнов А.Н., Дивашук М.Г., Карлов Г.И., Терешонкова Т.А., Соколова Л.М., Егорова А.А., Ховрин А.Н., Леунов В.И., Алексеева К.Л. Идентификация грибов рода Fusarium. Картофель и овощи. 2016;(2):18-20.
- Семёнов А.Н., Дивашук, М.Г., Баженов М.С., Карлов Г.И., Леунов В.И., Ховрин А.Н., Егорова А.А., Соколова Л.М., Терешонкова Т.А. Сравнительный анализ полиморфизма микросателлитных маркеров у ряда видов рода Fusarium. Известия Тимирязевской сельскохозяйственной академии. 2016;(1):40-50.
- Соколова Л.М. Анализ видового разнообразия грибов рода Fusarium. Аграрная наука. 2019;(S1):118-122.
- Соколова Л.М., Егорова А.А., Ховрин А.Н. Определение видовой принадлежности грибов рода Fusarium молекулярным методом. Аграрная наука. 2021;(S9):118-124.
- Леунов В.И., Ховрин А.Н., Терешонкова Т.А., Соколова Л.М., Горшкова Н.С., Алексеева К.Л. Методы ускоренной селекции моркови столовой на комплексную устойчивость к грибным болезням (Alternaria и Fusarium). Методические рекомендации, Москва, 2011. 61 c.
- Методика опытного дела в овощеводстве и бахчеводстве / Белик В.Ф. (ред.), Агропромиздат, Москва, 1992. 318 с. ISBN 5-10-002507-7.
- Монахос Г.Ф., Джалилов Ф.С., Монахос С.Г. Оценка устойчивости капустных растений к киле (возбудитель Plasmodiophora brassicae Wor.). РГАУ – МСХА имени К.А.Тимирязева, Москва, 2009. 24 с.
- Доспехов Б.А. Методика полевого опыта (с основами статистической обработки результатов исследований). Агропромиздат, Москва, 1985. 351 с.
- Егрова А.А., Соколова Л.М. Приготовление постоянных препаратов патогенных штаммов из родов Alternaria и Fusarium для селекции моркови столовой на устойчивость. Вестник Алтайского государственного аграрного университета. 2016;5(139):20-25.
- Жученко, А.А. Роль репродуктивного направления селекции культурных растений. /Балашова Н.Н., Козарь Е.Г. (ред.). Методические указания по гаметной селекции сельскохозяйственных растений, ВНИИССОК, Москва, 2001. С. 7-46.
- Жученко А.А., Король А.Б. Рекомбинация в эволюции и селекции. Наука, Москва, 1985. 400 с.
- Драгавцев В.А. Новый метод генетического анализ полигенных и количественных признаков растений. Эколого-генетический скрининг генофонда. Санкт-Петербург.1998. С. 180-252.
- Le Clerc V., Aubert C., Cottet V., Yovanopulos C., Piquet M., Suel A., Huet S., Koutouan C., Hamama L., Chalot G., Jost M., Pumo B., Briard M. Resistance carrots to Alternaria dauci or tasty carrots: should we choose? Acta Horticulture. 2019;(1264):199-204. doi: 10.17660/ActaHortic.2019.1264.24.
- Briard M. Carrot biotic stresses: challengers and research priorities. Acta Horticulture. 2019;(1264):113-122. doi: 10.17660/ActaHortic.2019.1264.13.
- Shibaya T., Kuroda C., Fujii T., Nakayama S., Minami C., Shirasawa K. and Isobe S. Genomic diversity in old and recent carrot cultivars and breeding populations at a Japanese seed company. Acta Horticulture. 2019;(1264):249-254. doi: 10.17660/ActaHortic.2019.1264.30.
- Simon P.W. Beyond the genome: carrot production trends, research advances and future crop improvement. Acta Horticulture. 2019;(1264):1-8. doi: 10.17660/ActaHortic.2019.1264.1.
- Соколова Л.М., Иванова М.И. Дикие виды Daucus L. в селекции и сохранение их ex situ в условиях Московской области. Вестник Ульяновской государственной сельскохозяйственной академии. 2021;2(54):130-140. https://doi: 10.18286/1816-4501-2021-2-130-140.
- Geoffriau E., Charpentier T., Huet S., Hägnefelt A., Lopes V., Nothnagel T., Lohwasser U., Mallor Gimenez C., Allender C. CarrotDiverse: understanding variation in a wild relative of carrot. Acta Horticulture. 2019;(1264):151-156. doi: 10.17660/ActaHortic.2019.1264.18.
- Visscher P.M., Hill W.G., Wray N.R. Heritability in the genomic era – concepts and misconceptions. Nature Reviews Genetics. 2008;(9):255-266. doi: 10.1038/nrg2322.
- Đorđević R., Zečević B., Zdravković J., Živanović T., Todorović G. Inheritance of yield components in tomato. Genetika. 2010;3(42):575-583. doi: 10.2298/GENSR1003575D.
- Jevtić G., Andelković B., Lugić Z., Radović Ja., Dinić B. Heritabilnost proizvodnih osobina regionalnih populacija medonosne pćele iz Serbije. Genetika, Beograd. 2012;44(1):47-54.
- Пивоваров В.Ф., Балашова И.Т., Сирота С.М., Козарь Е.Г., Пинчук Е.В. Анализ эффективности гибридизации по степени проявления целевых признаков в поколениях F2, F3 при селекции новых форм томата для многоярусной узкостеллажной гидропоники. Сельскохозяйственная биология. 2017;52(5):1-6. https://doi: 10.15389/agrobiology. 2017.5.1049 rus.


