Нативное Т1- и Т2-картирование времен релаксации миокарда при магнитно-резонансной томографии сердца: области применения
Автор: Мершина Е.А., Рыжкова Е.В., Лисицкая М.В., Харлап М.С., Синицын В.Е.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 3 т.38, 2023 года.
Бесплатный доступ
Магнитно-резонансная томография (МРТ) сердца широко применяется в диагностике сердечно-сосудистых заболеваний, так как позволяет неинвазивно оценить характер поражения тканей сердца. В последние годы в рутинную практику активно внедряются методы нативного картирования Т1- и Т2-времен релаксации миокарда. Нативное Т1-и Т2-картирование дает возможность количественного анализа состояния миокарда. Данная методика может быть использована для выявления и оценки широкого спектра поражений миокарда на различных этапах патологического процесса без необходимости контрастирования гадолиний-содержащими препаратами. В настоящем обзоре мы рассмотрим применение нативного Т1- и Т2-картрирования миокарда при различных заболеваниях сердца.
Магнитно-резонансная томография сердца, картирование миокарда, заболевания сердца, ишемическая болезнь сердца, кардиомиопатия, амилоидоз, болезни накопления, миокардит
Короткий адрес: https://sciup.org/149143648
IDR: 149143648 | УДК: 616.127-073.86 | DOI: 10.29001/2073-8552-2023-39-3-49-57
Текст обзорной статьи Нативное Т1- и Т2-картирование времен релаксации миокарда при магнитно-резонансной томографии сердца: области применения
Магнитно-резонансная томография (МРТ) сердца в настоящее время широко применяется в диагностике сердечно-сосудистых заболеваний, так как позволяет неинвазивно оценить характер поражения тканей сердца. Например, отличить воспалительное поражение от рубцовых изменений миокарда. Рутинно используемые качественные методы оценки состояния миокарда, такие как Т2-последовательности при диагностике отека миокарда или отсроченное контрастирование гадолиний-содержащими препаратами для выявления фиброза, имеют свои ограничения. Данные методы основываются на выявлении «нездоровых» участков на фоне «здорового» миокарда. Если имеет место диффузное поражение, особенно на ранних, потенциально обратимых стадиях патологического процесса, миокард может выглядеть одинаково «здоровым» во всех сегментах, как в случае отложения гликосфинголипидов в миокарде при болезни Андерсона–Фабри (БАФ), диффузного поражения миокарда при амилоидозе или миокардите [1].
Главным преимуществом Т1- и Т2-картирования является возможность количественного анализа состояния миокарда. Учитывая, что патологические процессы в миокарде приводят к изменению молекулярного состава миокарда, а следовательно, могут изменить продольное (Т1) и поперечное (Т2) время релаксации, методики Т1- и Т2-картирования позволяют сравнить полученные количественные параметры миокарда с референсными значениями и определить наличие или отсутствие поражения миокарда. Диапазон референсных значений определяется для каждого конкретного МР-томографа и МР-протоко-ла с учетом применяемой последовательности нативного картирования, времени сканирования и т. д. Сравнение параметров картирования с референсным диапазоном возможно только в том случае, если исследование выполнено при одинаковых условиях сканирования [2–4].
Другим преимуществом Т1- и Т2-картирования является простота выполнения и обработки данных. Для проведения картирования могут использоваться последовательности, выполненные на одной задержке дыхания [5–7].
В основе большинства используемых последовательностей для Т1- картирования применяется техника инверсии-восстановления Look-Locker inversion recovery (MOLLI) [8]. Также была разработана и адаптирована для этих целей последовательность Saturation recovery single-shot acquisition (SASHA), позволяющая преодолеть недооценку Т1-времени при MOLLI и уменьшающая влияние на результат таких факторов, как перенос намагниченности, частота сердечных сокращений. Недавно были предложены гибридные схемы, которые включали оба метода: инверсию-восстановление и сатурацию-восстановление (saturation pulse prepared heart rate independent inversion-recovery [SAPPHIRE]) [9].
Для Т2-картирования разработаны различные методики, каждая из которых имеет свои преимущества и лучше всего подходит для тех или иных клинических и исследовательских целей. В настоящее время чаще всего используются следующие последовательности: однократного считывания сбалансированного установившегося состояния свободной прецессии, мульти-эхо быстрый спин-эхо, градиентное спин-эхо [10].
Рассмотрим применение нативного Т1- и Т2-картиро-вания при различных поражениях миокарда.
Ишемическая болезнь сердца
В ходе ранних исследований ишемии миокарда вследствие прекращения кровотока по коронарным артериям у собак было выявлено, что окклюзия артерии приводит к перераспределению жидкости из интерстиция во внутриклеточное пространство, наиболее вероятно, из-за нарушения АТФ-зависимого трансмембранного транспорта ионов. Ишемия с реперфузией в дальнейшем еще более изменяет баланс жидкости между интерстицием и внутриклеточным пространством, так как при реперфузии увеличивается количество жидкости в интерстиции. Таким образом, происходит прогрессирование отека миокарда [11, 12].
Отек миокарда сопровождается удлинением нативного Т1- и Т2-времен релаксации. Метод Т1-картирования чувствителен для выявления отека миокарда, однако Т2-картирование обладает большей специфичностью, так как удлинение Т1-времени релаксации может происходить при наличии крови или фиброзных изменений миокарда. В клинических исследованиях и в исследованиях на животных была показана достоверная корреляция результатов Т1- и Т2-картирования с выявлением зоны риска при инфаркте миокарда [13–15]. Кроме того, Т2-картирование может быть использовано для наблюдения за процессом разрешения отека миокарда. Наличие кровоизлияния или хронических рубцовых изменений в зоне инфаркта, снижающих время Т2-релаксации, может усложнить анализ Т2-взвешенных изображений и Т2-кар-тирования при оценке отека миокарда [16, 17].
Непосредственно в зоне острого инфаркта миокарда (вне зависимости от типа инфаркта – с подъемом сегмента SТ или без подъема сегмента ST) отмечается значимое увеличение Т2-времени по сравнению с непораженными сегментами сердца. Снижение по данным картирования времени T2-релаксации до нормальных значений продолжается в течение 6 мес. после реперфузии и позволяет отдифференцировать острый инфаркт миокарда от хронического с более высокой диагностической точностью, чем полуколичественные Т2-взвешенные методики (рис. 1). Стоит отметить, что Т2-картирование может помочь в оценке таких реперфузионных осложнений, как микрососудистая обструкция и кровоизлияние в миокард. Оба осложнения характеризуются укорочением Т2-вре-мени в зоне инфаркта у пациентов после реперфузии и коррелируют с ремоделированием левого желудочка (ЛЖ) и снижением фракции выброса ЛЖ через 6 мес. после инфаркта миокарда [18, 19].
Новым направлением в диагностике ишемической болезни сердца является стресс-МРТ с нативным Т1-картированием. Метод основывается на возможности нативного Т1-картирования выявлять изменения в миокардиальном объеме крови. Т1-картирование, полученное до и во время вазодилататорного стресс-теста, демонстрирует изменение в Т1-времени вследствие изменения объема крови в миокарде. В нескольких иссле- дованиях применялась стресс-МРТ с Т1-картированием для дифференциальной диагностики ишемизированного и здорового миокарда, отличия инфарктной зоны от удаленной зоны миокарда у пациентов с окклюзирующим поражением коронарных артерий. Также данная методика исследовалась для оценки нарушения вазодилататорно-го резерва у пациентов с неокклюзирующим поражением коронарных артерий.
Так, было продемонстрировано, что при отсутствии поражения коронарных артерий и здоровом миокарде во время вазодилататорного стресс-теста отмечался 6% прирост Т1-времени при нативном Т1-картировании. В случае рубцовых изменений после перенесенного инфаркта миокарда в покое Т1-время было значительно повышено, однако во время стресс-теста изменений Т1-времени не регистрировалось. При наличии ишемии миокарда на фоне значимого стенотического поражения коронарных артерий и при отсутствии рубцовых изменений миокарда отмечалась компенсаторная вазодилатация коронарных артерий уже в покое, что вызывало умеренное повышение нативного Т1-времени в покое без развития дальнейшей вазодилатации во время стресс-теста и, как следствие, без повышения Т1-време-ни. Таким образом, стресс-МРТ с нативным Т1-картиро-ванием позволяет дифференцировать здоровый миокард от ишемизированного миокарда и рубцовых изменений миокарда и может быть использован в качестве альтернативы стресс-МРТ с контрастированием гадолиний-содержащими препаратами в случае противопоказаний к введению контрастного препарата [20, 21].
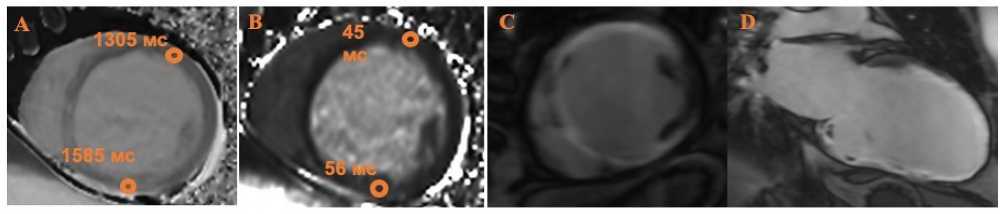
Рис. 1. Случай из клинической практики: Магнитно-резонансная томография сердца пациента, 41 года, в анамнезе постинфарктный кардиосклероз (~14 месяцев назад) и острый инфаркт миокарда 2-недельной давности. На коронароангиографии: многососудистое поражение коронарных артерий в бассейне передней межжелудочковой артерии и правой коронарной артерии. При нативном Т1-картировании отмечается повышение Т1-времени релаксации миокарда как в бассейне передней межжелудочковой артерии, так и правой коронарной артерии. Однако повышение Т2-времени релаксации миокарда выявлено только по нижней стенке левого желудочка (бассейн правой коронарной артерии). Учитывая наличие признаков отека миокарда нижней стенки левого желудочка, по данным Т2-картирования, острый инфаркт миокарда развился именно в бассейне правой коронарной артерии, а рубцовые изменения по передней и перегородочной стенкам обусловлены инфарктом миокарда 14-месячной давности. Магнитно-резонансное исследование выполнено на томографе SIEMENS Нealthineers MAGNETOM VIDA с напряженностью магнитного поля 3Tл (Германия).
А – повышение времени Т1-релаксации при нативном Т1-картировании по передней стенке (бассейн передней межжелудочковой артерии) до 1305 мс и по нижней стенке (бассейн правой коронарной артерии) до 1585 мс (референсные значения для данного типа томографа, полученные на базе наших наблюдений, 1105–1287 мс). B – повышение Т2-времени релаксации при нативном Т2-картировании по нижней стенке левого желудочка до 56 мс (референсные значения для данного типа томографа, полученные на базе наших наблюдений, 38–46 мс). С, D – проекция левого желудочка по короткой оси на уровне средних сегментов и 2-камерная проекция левого желудочка, соответственно, демонстрируют трансмуральное накопление контрастного препарата в миокарде передней, перегородочной и нижней стенок левого желудочка в отсроченную фазу.
Fig. 1. Clinical case: cardiovascular magnetic resonance images of 41-year old male patient with 2 myocardial infarctions (14 months ago and 2 weeks ago) and multivessel coronary disease (left anterior descending artery and right coronary artery). Native myocardial relaxation T1-time was increased in both anterior and inferior walls of left ventricle. However, native myocardial relaxation T2-time was increased only in the inferior wall of left ventricle (perfusion territory of right coronary artery). According to native T2-mapping, edema was present in perfusion territory of right coronary artery. So right coronary artery was the culprit artery in acute myocardial infarction. Cardiovascular magnetic resonance was performed with 3T scanner (Siemens Magnetom Vida 3T, Germany)
A – Native T1-mapping showing increased T1 value in both anterior and inferior walls of left ventricle up to 1305 ms and 1585 ms, respectively (reference range for this type of scanner, according to our data, 1105-1287 ms). B – Native T2-mapping showing increased T2 value only in the inferior wall of left ventricle up to 56 ms (reference range for this type of scanner, according to our data, 38-46 ms). C, D – short-axis view and 2-chamber view of left ventricle, respectively, demonstrating transmural late-gadolinium enhancement of – interventricular septum, anterior and inferior walls.
Дилатационная кардиомиопатия
Неишемическая дилатационная кардиомиопатия (ДКМП) является полиэтиологичным заболеванием и одной из распространенных причин развития сердечной недостаточности. ДКМП характеризуется расширением камер сердца и нарушением систолической функции.
Важную роль в ремоделировании миокарда и прогрессировании сердечной недостаточности при ДКМП играет развитие диффузного миокардиального фиброза. Выявление интрамиокардиального фиброза при отсроченном контрастировании гадолиний-содержащими препаратами является неблагоприятным прогностическим фактором. Часто отсроченное контрастирование при ДКМП не позволяет достоверно оценить диффузные фиброзные изменения вследствие отсутствия «здорового» миокарда для сравнения [22], поэтому у многих пациентов с ДКМП будет отсутствовать накопление контрастного препарата при контрастировании в отсроченную фазу. Проведение параметрического картирования миокарда может позволить преодолеть недостатки метода отсроченного контрастирования и обеспечить более детальную оценку состояния миокарда при ДКМП.
Например, у пациентов с ДКМП при картировании нативное Т1- и Т2- время релаксации было достоверно повышено по сравнению с группой контроля даже на начальных этапах ДКМП [23].
Повышение Т2-времени релаксации у пациентов с хроническим течением ДКМП отмечалось вне зависимости от выраженности дисфункции ЛЖ [24]. Повышение Т2-времени может быть объяснено наличием отека миокарда и являться следствием воспалительных процессов в патогенезе кардиомиопатии [25]. Удлинение Т2-време-ни при картировании у пациентов с ДКМП коррелировало с наличием воспалительных клеток в эндомиокардиальном биоптате [26].
Говоря о прогностическом значении нативного картирования, было отмечено, что более низкие показатели Т2-времени релаксации в начале медикаментозного лечения ДКМП могут являться одним из благоприятных прогностических факторов обратного ремоделирования ЛЖ. Кро- ме того, Т1-время релаксации достоверно уменьшалось в динамике у пациентов с обратным ремоделированием ЛЖ на фоне оптимальной медикаментозной терапии [27].
Миокардит
Миокардит – это острое или хроническое воспаление миокарда, вызванное инфекцией, токсинами или аутои-мунными процессами. К осложнениям миокардита относятся сердечная недостаточность и внезапная сердечная смерть. К сожалению, до сих пор диагностика миокардита представляет трудности. Золотым стандартом диагностики является эндомиокардиальная биопсия. Однако эта инвазивная процедура имеет свои ограничения. Так, в случае очагового поражения миокарда при миокардите повышается вероятность получения ложноотрицательного результата, если биоптат получен из области, не затронутой воспалением. Принимая во внимание все риски и ограничения эндомиокардиальной биопсии, МРТ сердца при диагностике миокардита стала играть ключевую роль. Применение Т1- и Т2-картирования в совокупности с общепринятыми критериями МР-диагностики миокардита позволяет повысить точность исследования [28–32].
При Т1- и Т2-картировании вследствие отека и воспаления миокарда отмечается повышение времени как Т1-, так и Т2-релаксации. По имеющимся данным, нативное Т1- и Т2-картирование при миокардите обладает более высокой диагностической точностью и предсказательной способностью, чем отсроченное контрастирование с гадолиний-содержащими препаратами (рис. 2). Кроме того, Т1- и Т2-картирование позволяет отличить острую стадию миокардита от стадии реконвалесценции. Увеличение же Т2-времени релаксации коррелирует с наличием отека и воспаления в эндомиокардиальных биоптатах [33–37]. На фоне разрешения острой фазы миокардита отмечалось снижение Т2-времени, несмотря на наличие отсроченного контрастирования гадолиний-содержащими препаратами. Сохранение удлиненного Т2-времени релаксации после острой фазы коррелировало с повышенным риском сердечно-сосудистых событий, развитием дисфункции ЛЖ и увеличением частоты госпитализаций [36].
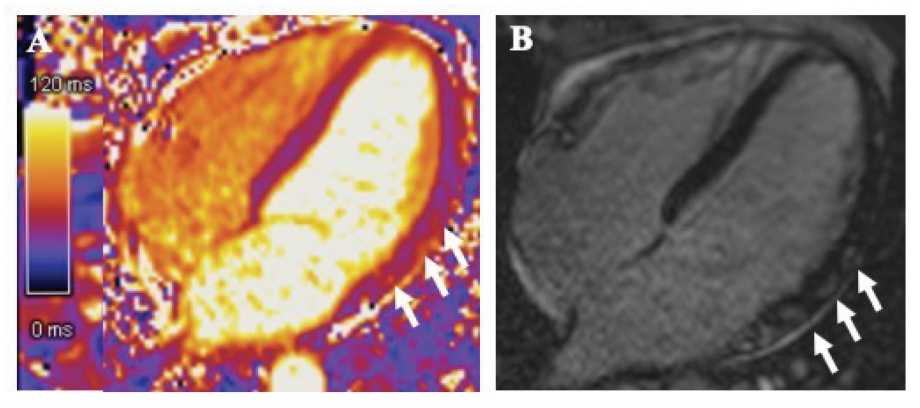
Рис. 2. Случай из клинической практики: магнитно-резонансная томография сердца пациента, 53 лет, с жалобами на дискомфорт за грудиной. Тропониновый тест положительный. За 4 дня до госпитализации перенес ротавирусную инфекцию. По данным коронароангиографии: стенотического поражения коронарных артерий не выявлено. Магнитно-резонансное исследование выполнено на томографе SIEMENS Нealthineers MAGNETOM VIDA с напряженностью магнитного поля 3Tл (Германия)
А – Очаговое повышение времени Т2-релаксации при нативном Т2-картировании по боковой стенке левого желудочка (отмечено стрелками). В – Субэпикардиальное накопление контрастного препарата миокардом боковой стенки левого желудочка в отсроченную фазу (отмечено стрелками).
Fig. 2. Clinical case: cardiovascular magnetic resonance images of 53-year old male patient with chest discomfort and positive troponin test. 4 days earlier he had rotavirus infection. cardiovascular magnetic resonance was performed with 3T scanner (Siemens Magnetom Vida 3T, Germany)
A – Native T2-mapping showing locally increased T2 value in the lateral wall of left ventricle (arrows). B – Subepicardial late-gadolinium enhancement of the lateral wall of left ventricle (arrows).
Гипертрофическая кардиомиопатия
Гипертрофическая кардиомиопатия (ГКМП) обусловлена развитием мутаций в генах, кодирующих белки саркомера. Опасным осложнением ГКМП является внезапная сердечная смерть. МРТ сердца играет важную роль в диагностике и стратификации риска осложнений при ГКМП [38]. Выявление фиброзных изменений в гипертрофированных сегментах при отсроченном контрастировании гадолиний-содержащими препаратами носит неблагоприятный прогноз. Как альтернатива отсроченному контрастированию в выявлении фиброзных изменений гипертрофированного миокарда может быть использовано нативное Т1-картирование [39, 40] (рис. 3). Использование параметрического картирования при ГКМП расширяет возможности оценки состояния миокарда вне зависимости от результатов отсроченного контрастирования гадо- линий-содержащими препаратами. Например, при сравнении с группой контроля повышение Т1- и Т2-времен релаксации при картировании было выявлено как в гипертрофированных, так и в негипертрофированных сегментах. Кроме того, по мере прогрессирования гипертрофии при ГКМП отмечалось увеличение и Т1-, и Т2-времени релаксации. Повышение Т2-времени при ГКМП может быть обусловлено отложением коллагена, ишемией миокарда или микроваскулярной дисфункции вследствие гипертрофии миокарда и эндотелиальной дисфункции [41].
В недавнем исследовании при анализе Т2-картиро-вания у 148 пациентов с ГКМП было выявлено, что у пациентов с повышением Т2 времени релаксации чаще регистрировались пароксизмы неустойчивой желудочковой тахикардии. Таким образом, повышение Т2-вре-мени может быть фактором риска нарушений ритма сердца [42].
гкмп
. Болезнь
Амилоидоз , . ,
Андерсона-Фабри
МРТ в кино-режиме 4-камерная проекция
МРТ в кино-режиме проекция по короткой оси
Отсроченное контрастирование с гадолинием
Нативное Т1-картирование
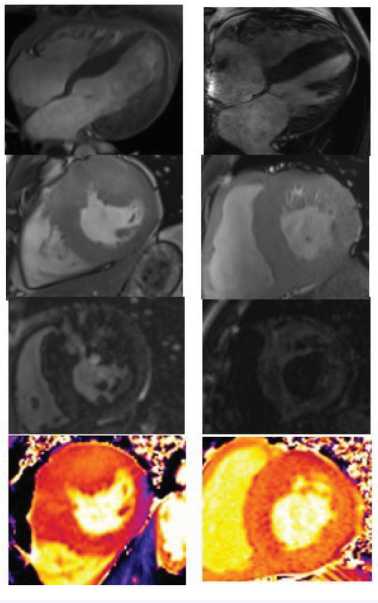


Рис. 3. Случаи из клинической практики. У представленных 3 пациентов имеет место гипертрофия миокарда левого желудочка, обусловленная различными причинами. Применение нативного Т1-картирования в ходе магнитно-резонансной томографии позволяет провести первоначальную дифференциальную диагностику поражения миокарда еще до введения контрастного препарата. Так, при амилоидозе отмечается значимое диффузное повышение Т1-времени релаксации. Для болезни Андерсона-Фабри характерно диффузное снижение Т1-времени релаксации. При гипертрофической кардиомиопатии имеет место повышение Т1-времени релаксации в наиболее гипертрофированных сегментах левого желудочка. Магнитно-резонансное исследование выполнено на томографе SIEMENS Нealthineers MAGNETOM VIDA с напряженностью магнитного поля 3Tл (Германия).
Fig. 3. Clinical case: cardiovascular magnetic resonance images of 3 patients with myocardial hypertrophy of different origin. Native T1-mapping enables to perform myocardial characterization before contrast medium administration. In amyloidosis native T1-time is increased. In case of Anderson–Fabry disease native T1-time is decreased. In hypertrophic cardiomyopathy native T1-time is increased in the most thickened segments. cardiovascular magnetic resonance was performed with 3T scanner (Siemens Magnetom Vida 3T, Germany)
Амилоидоз
При амилоидозе сердца происходит отложение амилоида в тканях сердца, что приводит к прогрессирующему утолщению стенок сердца с последующим развитием диастолической дисфункции и рестриктивной кардиомиопатии. Поражение сердца при системном амилоидозе носит неблагоприятный прогноз вследствие прогрессирующей сердечной недостаточности [43].
Учитывая, что нативное Т1- и Т2-картирование осуществляется без использования контрастных препаратов, эти методики имеют важное значение в случае почечной недостаточности при амилоидозе, когда применение контрастных препаратов противопоказано.
При амилоидозе сердца отмечается повышение нативного Т1- и Т2-времени релаксации. Повышение нативного Т1-времени при картировании обладает такой же чувствительностью и специфичностью, что определение объема внеклеточного матрикса и отсроченное контрастирование гадолиний-содержащими препаратами [44] (см. рис. 3).
Повышение Т2-времени релаксации при картировании может иметь значение также в дифференциальной диагностике AL- и ATTR-амилоидоза. Так, было продемонстрировано, что Т2-время релаксации больше повышается при AL-амилоидозе, чем при ATTR-амилоидозе. Несмотря на более благоприятный прогноз, было показано, что при ATTR-амилоидозе выше масса миокарда ЛЖ, больше размер правого желудочка (ПЖ), ниже фракция выброса ЛЖ и ПЖ, более выражено отсроченное контрастирование гадолиний-содержащими препаратами, а также выше объем внеклеточного матрикса. Однако время Т2-релаксации достоверно выше при AL-амилоидозе. Была разработана модель дифференциальной диагностики этих типов амилоидоза, которая включает оценку нативного Т2-картирования, возраста пациента и функции ПЖ. Кроме того, повышение Т2-времени релаксации при AL-амилоидозе свидетельствовало о высоком риске смертности. На фоне терапии AL-амилоидоза показатели Т2-картирования снижались. Аналогичных закономерностей по Т2-картированию и ATTR-амилоидозу в отношении прогноза и лечения получено не было [43, 45–47].
Болезнь Андерсона–Фабри
БАФ – это наследственная Х-сцепленная лизосомальная болезнь накопления. Поражение сердца при БАФ отмечается у 40–60% пациентов и характеризуется развитием гипертрофии миокарда ЛЖ, миокардиальным фиброзом, брадиаритмиями или тахиаритмиями, нарушением функции клапанного аппарата и микрососудистой дисфункцией.
Частой причиной смерти пациентов с БАФ являются именно сердечно-сосудистые осложнения, такие как сердечная недостаточность и жизнеугрожающие нарушения ритма сердца [48–51].
В настоящее время разработана и применяется БАФ– специфическая терапия – энзим-заместительная терапия (ЭЗТ) альфа-галактозидазой и бета- галактозидазой, а также терапия шаперонами. При незначительной или умеренно выраженной гипертрофии ЛЖ назначение ЭЗТ позволяет уменьшить гипертрофию, а в случае выраженной гипертрофии ЛЖ дает возможность стабилизировать процесс [52–54]. Ранняя диагностика поражения сердца при БАФ со своевременным назначением ЭЗТ позволяет улучшить прогноз заболевания. Однако нередко гипертрофия миокарда ЛЖ при БАФ сперва может быть ошибочно расценена как ГКМП, что приводит к более позднему началу ЭЗТ и ухудшению прогноза.
Таким образом, дифференциальная диагностика гипертрофии при БАФ имеет важное клиническое значение. В настоящее время при диагностике поражения сердца при БАФ широко применяется МРТ. До 50% пациентов с БАФ при МРТ будут иметь признаки контрастирования миокарда базального сегмента заднебоковой стенки ЛЖ в отсроченную фазу [55]. Кроме оценки отсроченного контрастирования гадолиний-содержащими препаратами, в диагностике поражений сердца при БАФ важную роль приобретает нативное Т1-картирование. В случае БАФ отмечается значимое снижение глобального Т1-времени релаксации, что обусловлено накоплением гликосфинголипидов в кардиомиоцитах (см. рис. 3).
При Т2-картировании повышение Т2-времени релаксации отмечалось изолированно в заднебоковом сегменте ЛЖ, где чаще всего при БАФ выявлялось отсроченное накопление гадолиний-содержащего контрастного препарата [56, 57].
Перегрузка миокарда железом
Перегрузка миокарда железом может развиться вследствие гемохроматоза или частых переливаний крови. Осложнениями данного состояния являются жизнеугрожающие нарушения ритма сердца и сердечная недостаточность. МРТ с нативным картированием помогает в диагностике перегрузки миокарда железом. Наиболее специфично в этом случае Т2-картирование. Кроме того, картирование помогает в оценке эффективности терапии. При Т1- и Т2-картировании отмечается уменьшение Т1- и Т2-времени релаксации [58–60].
Выводы
Нативное Т1- и Т2-картирование миокарда в протоколе МРТ является простой и удобной техникой количественного анализа состояния миокарда, не требующей введения контрастного препарата. Диапазон референсных значений определяется для каждого конкретного МР-томографа и МР-протокола с учетом применяемой последовательности сканирования.
Нативное Т1- и Т2-картирование позволяет выявить и оценить поражение миокарда сердца на различных этапах патологического процесса, улучшить процесс дифференциальной диагностики и, как следствие, в определенных случаях дает возможность скорректировать лечение в ранние сроки.
Список литературы Нативное Т1- и Т2-картирование времен релаксации миокарда при магнитно-резонансной томографии сердца: области применения
- Kim P.K., Hong Y.J., Im D.J., Suh Y.J., Park C.H., Kim J.Y. et al. Myocardial T1 and T2 mapping: techniques and clinical applications. Korean J. Radiol. 2017;18(1):113–131. DOI: 10.3348/kjr.2017.18.1.113.
- Piechnik S.K., Ferreira V.M., Lewandowski A.J., Ntusi N.A., Banerjee R., Holloway C. et al. Normal variation of magnetic resonance T1 relaxation times in the human population at 1.5 T using ShMOLLI. J. Cardiovasc. Magn. Reson. 2013;15(1):13. DOI: 10.1186/1532-429X-15-13.
- Mewton N., Liu C.Y., Croisille P., Bluemke D., Lima J.A. Assessment of myocardial fi brosis with cardiovascular magnetic resonance. J. Am. Coll. Cardiol. 2011;57:891–903. DOI: 10.1016/j.jacc.2010.11.013.
- Radunski U.K., Lund G.K., Stehning C., Schnackenburg B., Bohnen S., Adam G. et al. CMR in patients with severe myocarditis: diagnostic value of quantitative tissue markers including extracellular volume imaging. JACC Cardiovasc. Imaging. 2014;7(7):667–675. DOI: 10.1016/j.jcmg.2014.02.005.
- Piechnik S.K., Ferreira V.M., Dall’Armellina E., Cochlin L.E., Greiser A., Neubauer S. et al. Shortened Modifi ed Look-Locker Inversion recovery (ShMOLLI) for clinical myocardial T1- mapping at 1.5 and 3 T within a 9 heartbeat breathhold. J. Cardiovasc. Magn. Reson. 2010;12(1):69. DOI: 10.1186/1532-429X-12-69.
- Chow K., Flewitt J.A., Green J.D., Pagano J.J., Friedrich M.G., Thompson R.B. Saturation recovery single-shot acquisition (SASHA) for myocardial T(1) mapping. Magn. Reson. Med. 2014;71(6):2082–2095. DOI: 10.1002/mrm.24878.
- Messroghli D.R., Greiser A., Frö hlich M., Dietz R., Schulz-Menger J. Optimization and validation of a fully-integrated pulse sequence for modified Look-Locker inversion-recovery (MOLLI) T1 mapping of the heart. J. Magn. Reson. Imaging. 2007;26(4):1081–1086. DOI: 10.1002/jmri.21119.
- Messroghli D.R., Radjenovic A., Kozerke S., Higgins D.M., Sivananthan M.U., Ridgway J.P. Modified Look-Locker inversion recovery (MOLLI) for high-resolution T1 mapping of the heart. Magn. Reson. Med. 2004;52(1):141–146. DOI: 10.1002/mrm.20110.
- Weingärtner S., Akçakaya M., Basha T., Kissinger K.V., Goddu B., Berg S. et al. Combined saturation / inversion recovery sequences for improved evaluation of scar and diffuse fibrosis in patients with arrhythmia or heart rate variability. Magn. Reson. Med. 2014;71(3):1024–1034. DOI: 10.1002/mrm.24761.
- O’Brien A.T., Gil K.E., Varghese J., Simonetti O.P., Zareba K.M. T2 mapping in myocardial disease: a comprehensive review. J. Cardiovasc. Magn. Reson. 2022;24(1):33. DOI: 10.1186/s12968-022-00866-0.
- Willerson J.T., Scales F., Mukherjee A., Platt M., Templeton G.H., Fink G.S. et al. Abnormal myocardial fluid retention as an early manifestation of ischemic injury. Am. J. Pathol. 1977;87(1):159–188.
- Wisenberg G., Prato F.S., Carroll S.E., Turner K.L., Marshall T. Serial nuclear magnetic resonance imaging of acute myocardial infarction with and without reperfusion. Am. Heart J. 1988;115(3):510–518. DOI: 10.1016/0002-8703(88)90798-3.
- Ugander M., Bagi P.S., Oki A.J., Chen B., Hsu L.Y., Aletras A., et al. Myocardial edema as detected by pre-contrast T1 and T2 CMR delineates area at risk associated with acute myocardial infarction. JACC Cardiovasc. Imaging. 2012;5(6):596–603. DOI: 10.1016/j.jcmg.2012.01.016.
- Goldfarb J.W., Arnold S., Han J. Recent myocardial infarction: assessment with unenhanced T1-weighted MR imaging. Radiology. 2007;245(1):245–250. DOI: 10.1148/radiol.2451061590.
- Bulluck H., White S.K., Rosmini S., Bhuva A., Treibel T.A., Fontana M. et al. T1 mapping and T2 mapping at 3T for quantifying the area-atrisk in reperfused STEMI patients. J. Cardiovasc. Magn. Reson. 2015;12;17(1):73. DOI: 10.1186/s12968-015-0173-6.
- Zia M.I., Ghugre N.R., Connelly K.A., Strauss B.H., Sparkes J.D., Dick A.J. et al. Characterizing myocardial edema and hemorrhage using quantitative T2 and T2* mapping at multiple time intervals post ST-segment elevation myocardial infarction. Circ. Cardiovasc. Imaging. 2012;5(5):566–572. DOI: 10.1161/CIRCIMAGING.112.973222.
- Suranyi P., Elgavish G.A., Schoepf U.J., Ruzsics B., Kiss P., van Assen M. et al. Myocardial tissue characterization by combining late gadolinium enhancement imaging and percent edema mapping: a novel T2 mapbased MRI method in canine myocardial infarction. Eur. Radiol. Exp. 2018;2(1):6. DOI: 10.1186/s41747-018-0037-6.
- Tahir E., Sinn M., Bohnen S., Avanesov M., Säring D., Stehning C. et al. Acute versus chronic myocardial infarction: diagnostic accuracy of quantitative native T1 and T2 mapping versus assessment of edema on standard T2-weighted cardiovascular MR images for differentiation. Radiology. 2017;285(1):83–91. DOI: 10.1148/radiol.2017162338.
- Carrick D., Haig C., Ahmed N., McEntegart M., Petrie M.C., Eteiba H. et al. Myocardial hemorrhage after acute reperfused ST-segment-elevation myocardial infarction: relation to microvascular obstruction and prognostic significance. Circ. Cardiovasc. Imaging. 2016;9(1):e004148. DOI: 10.1161/CIRCIMAGING.115.004148.
- Liu A., Wijesurendra R.S., Francis J.M., Robson M.D., Neubauer S., Piechnik S.K., Ferreira V.M. Adenosine stress and rest T1 mapping can differentiate between ischemic, infarcted, remote, and normal myocardium without the need for gadolinium contrast fgents. JACC Cardiovasc. Imaging. 2016;9(1):27–36. DOI: 10.1016/j.jcmg.2015.08.018.
- Burrage M.K., Shanmuganathan M., Zhang, Q., Hann E., Popescu I.A., Soundarajan R. et al. Cardiac stress T1-mapping response and extracellular volume stability of MOLLI-based T1-mapping methods. Sci. Rep. 2021;11(1):13568. DOI: 10.1038/s41598-021-92923-4.
- Mewton N., Liu C.Y., Croisille P., Bluemke D., Lima J.A. Assessment of myocardial fibrosis with cardiovascular magnetic resonance. J. Am. Coll. Cardiol. 2011;57(8):891–903. DOI: 10.1016/j.jacc.2010.11.013.
- Mordi I., Carrick D., Bezerra H., Tzemos N. T1 and T2 mapping for early diagnosis of dilated non-ischaemic cardiomyopathy in middle-aged patients and differentiation from normal physiological adaptation. Eur. Heart J. Cardiovasc. Imaging. 2016;17(7):797–803. DOI: 10.1093/ehjci/jev216.
- Nishii T., Kono A.K., Shigeru M., Takamine S., Fujiwara S., Kyotani K. et al. Cardiovascular magnetic resonance T2 mapping can detect myocardial edema in idiopathic dilated cardiomyopathy. Int. J. Cardiovasc. Imaging. 2014;30 Suppl. 1:65–72. DOI: 10.1007/s10554-014-0414-z.
- Jeserich M., Föll D., Olschewski M. Kimmel S., Friedrich M.G., Bode C. et al. Evidence of myocardial edema in patients with nonischemic dilated cardiomyopathy. Clin. Cardiol. 2012;35(6):371–376. DOI: 10.1002/clc.21979.
- Spieker M., Katsianos E., Gastl M., Behm P., Horn P., Jacoby C. et al. T2 mapping cardiovascular magnetic resonance identifies the presence of myocardial inflammation in patients with dilated cardiomyopathy as compared to endomyocardial biopsy. Eur. Heart J. Cardiovasc. Imaging. 2018;19(5):574–582. DOI: 10.1093/ehjci/jex230.
- Xu Y., Li W., Wan K., Liang Y., Jiang X., Wang J. et al. Myocardial tissue reverse remodeling after guideline-directed medical therapy in idiopathic dilated cardiomyopathy. Circ. Heart Fail. 2021;14(1):e007944. DOI: 10.1161/CIRCHEARTFAILURE.120.007944.
- Caforio A.L., Pankuweit S., Arbustini E., Basso C., Gimeno-Blanes J., Felix S.B. et al.; European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur. Heart J. 2013;34(33):2636–2648, 2648a–2648d. DOI: 10.1093/eurheartj/eht210.
- Spieker M., Haberkorn S., Gastl M., Behm P., Katsianos S., Horn P. et al. Abnormal T2 mapping cardiovascular magnetic resonance correlates with adverse clinical outcome in patients with suspected acute myocarditis. J. Cardiovasc. Magn. Reson. 2017;19(1):38. DOI: 10.1186/s12968-017-0350-x.
- Lurz P., Luecke C., Eitel I., Föhrenbach F., Frank C., Grothoff M. et al. Comprehensive cardiac magnetic resonance imaging in patients with suspected myocarditis: the myoracer-trial. J. Am. Coll. Cardiol. 2016;67(15):1800–1811. DOI: 10.1016/j.jacc.2016.02.013.
- Tschöpe C., Ammirati E., Bozkurt B., Caforio A.L.P., Cooper L.T., Felix S.B. et al. Myocarditis and inflammatory cardiomyopathy: current evidence and future directions. Nat. Rev. Cardiol. 2021;18(3):169–193. DOI: 10.1038/s41569-020-00435-x.
- Bönner F., Spieker M., Haberkorn S., Jacoby C., Flögel U., Schnackenburg B. et al. Myocardial T2 mapping increases noninvasive diagnostic accuracy for biopsy-proven myocarditis. JACC Cardiovasc. Imaging. 2016;9(12):1467–1469. DOI: 10.1016/j.jcmg.2015.11.014.
- Hinojar R., Foote L., Arroyo Ucar E., Jackson T., Jabbour A., Yu C.Y. et al. Native T1 in discrimination of acute and convalescent stages in patients with clinical diagnosis of myocarditis: a proposed diagnostic algorithm using CMR. JACC Cardiovasc. Imaging. 2015;8(1):37–46. DOI: 10.1016/j.jcmg.2014.07.016.
- Ferreira V.M., Piechnik S.K., Dall’Armellina E., Karamitsos T.D., Francis J.M., Ntusi N. et al. T(1) mapping for the diagnosis of acute myocarditis using CMR: comparison to T2-weighted and late gadolinium enhanced imaging. JACC Cardiovasc. Imaging. 2013;6(10):1048–1058. DOI: 10.1016/j.jcmg.2013.03.008.
- Ferreira V.M., Piechnik S.K., Dall’Armellina E., Karamitsos T.D., Francis J.M., Ntusi N. et al. Native T1-mapping detects the location, extent and patterns of acute myocarditis without the need for gadolinium contrast agents. J. Cardiovasc. Magn. Reson. 2014;16(1):36. DOI: 10.1186/1532-429X-16-36.
- Spieker M., Haberkorn S., Gastl M., Behm P., Katsianos S., Horn P. et al. Abnormal T2 mapping cardiovascular magnetic resonance correlates with adverse clinical outcome in patients with suspected acute myocarditis. J. Cardiovasc. Magn. Reson. 2017;19(1):38. DOI: 10.1186/s12968-017-0350-x.
- Bohnen S., Radunski U.K., Lund G.K., Kandolf R., Stehning C., Schnackenburg B. et al. Performance of t1 and t2 mapping cardiovascular magnetic resonance to detect active myocarditis in patients with recent- onset heart failure. Circ. Cardiovasc. Imaging. 2015;8(6):e003073. DOI: 10.1161/CIRCIMAGING.114.003073.
- Мершина Е.А., Синицын В.Е., Ларина О.М. Магнитно-резонансная томография сердца в диагностике гипертрофической кардиомиопатии и стратификации риска внезапной сердечной смерти. Клин. И эксперимент. хир. Журн. им. акад. Б.В. Петровского. 2019;7(3):70–78. [Mershina E.A., Sinitsyn V.E., Larina O.M. Cardiac magnetic resonance in diagnosis of hypertrophic cardiomyopathy and sudden cardiac death risk stratification. Clin. Experiment. Surg. Petrovsky J. 2019;7(3):70–78. (In Russ.)]. DOI: 10.24411/2308-1198-2019-13008.
- Баев М.С., Рыжков А.В., Гаврилова Е.А., Труфанов Г.Е. Клиническое применение Т1-картирования миокарда: обзор литературы и первый опыт клинического применения. Сибирский журнал клинической и экспериментальной медицины. 2022;37(1):17–26. [Baev M.S., Ryzhkov A.V., Gavrilova E.A., Trufanov G.E. Clinical application of T1-myocardial mapping: Review of literature and first experience of clinical application. The Siberian Journal of Clinical and Experimental Medicine. 2022;37(1):17–26. (In Russ.)]. DOI: 10.29001/2073-8552-2022-37-1-17-26.
- Małek Ł.A., Werys K., Kłopotowski M., S ́piewak M., Miłosz-Wieczorek B., Mazurkiewicz Ł. et al. Native T1-mapping for non-contrast assessment of myocardial fi brosis in patients with hypertrophic cardiomyopathy – comparison with late enhancement quantifi cation. Magn. Reson. Imaging. 2015;33(6):718–724. DOI: 10.1016/j.mri.2015.04.001.
- Huang L., Ran L., Zhao P., Tang D., Han R., Ai T. et al. MRI native T1 and T2 mapping of myocardial segments in hypertrophic cardiomyopathy: tissue remodeling manifested prior to structure changes. Br. J. Radiol. 2019;92(1104):20190634. DOI: 10.1259/bjr.20190634.
- Baig M., Galazka P., Dakwar O., Syed S.A., Sawlani R., Shahir K. et al. Prevalence of myocardial edema with T2-mapping in hypertrophic cardiomyopathy. J. Am. Coll. Cardiol. 2021;77(18 Suppl. 1):1303. DOI: 10.1016/s0735-1097(21)02661-9.
- Ridouani F., Damy T., Tacher V., Derbel H., Legou F., Sifaoui I. et al. Myocardial native T2 measurement to diff erentiate light-chain and transthyretin cardiac amyloidosis and assess prognosis. J. Cardiovasc. Magn. Reson. 2018;20(1):58. DOI: 10.1186/s12968-018-0478-3.
- Pan J.A., Kerwin M.J., Salerno M. Native T1 mapping, extracellular volume mapping, and late gadolinium enhancement in cardiac amyloidosis: a meta-analysis. JACC Cardiovasc. Imaging. 2020;13(6):1299–1310. DOI: 10.1016/j.jcmg.2020.03.010.
- Banypersad S.M. The evolving role of cardiovascular magnetic reso-nance imaging in the evaluation of systemic amyloidosis. Magn. Reson. Insights. 2019;12:1178623X19843519. DOI: 10.1177/1178623X19843519.
- Slivnick J.A., Tong M.S., Nagaraja H.N., Elamin M.B., Wallner A., O’Brien A. et al. Novel cardiovascular magnetic resonance model to distinguish immunoglobulin light chain from transthyretin cardiac amyloidosis. JACC Cardiovasc. Imaging. 2021;14(1):302–304. DOI: 10.1016/j.jcmg.2020.07.030.
- Kotecha T., Martinez-Naharro A., Treibel T.A, Francis R., Nordin S., Abdel-Gadir A. et al. Myocardial edema and prognosis in amyloidosis. J. Am. Coll. Cardiol. 2018;71(25):2919–2931. DOI: 10.1016/j.jacc.2018.03.536.
- Kampmann C., Linhart A., Baehner F., Palecek T., Wiethoff C.M., Miebach E. et al. Onset and progression of the Anderson-Fabry disease related cardiomyopathy. Int. J. Cardiol. 2008;130(3):367–373. DOI: 10.1016/j.ijcard.2008.03.007.
- Krä mer J., Niemann M., Stö rk S., Frantz S., Beer M., Ertl G. et al. Relation of burden of myocardial fi brosis to malignant ventricular arrhythmias and outcomes in Fabry disease. Am. J. Cardiol. 2014;114(6):895–900. DOI: 10.1016/j.amjcard.2014.06.019.
- Patel V., O’Mahony C., Hughes D., Rahman M.S., Coats C., Murphy E. et al. Clinical and genetic predictors of major cardiac events in patients with Anderson-Fabry disease. Heart. 2015;101(12):961–966. DOI: 10.1136/heartjnl-2014-306782.
- Germain D.P., Charrow J., Desnick R.J., Guff on N., Kempf J., Lachmann R.H. et al. Ten-year outcome of enzyme replacement therapy with agalsidase beta in patients with Fabry disease. J. Med. Genet. 2015;52(5):353–358. DOI: 10.1136/jmedgenet-2014-102797.
- Motwani M., Banypersad S., Woolfson P., Waldek S. Enzyme replacement therapy improves cardiac features and severity of Fabry disease. Mol. Genet. Metab. 2012;107(1–2):197–202. DOI: 10.1016/j.ymgme.2012.05.011.
- Beck M., Hughes D., Kampmann C., Larroque S., Mehta A., Pintos-Morell G., et al.; Fabry Outcome Survey Study Group. Long-term eff ectiveness of agalsidase alfa enzyme replacement in Fabry disease: A Fabry Outcome Survey analysis. Mol. Genet. Metab. Rep. 2015;3:21–27. DOI: 10.1016/j.ymgmr.2015.02.002.
- Moon J.C., Sachdev B., Elkington A.G., McKenna W.J., Mehta A., Pennell D.J. et al. Gadolinium enhanced cardiovascular magnetic resonance in Anderson-Fabry disease. Evidence for a disease specifi c abnormalityof the myocardial interstitium. Eur. Heart J. 2003;24(23):2151–2155. DOI: 10.1016/j.ehj.2003.09.017.
- Militaru S., Ginghina C., Popescu B.A., Saftoiu A., Linhart A., Jurcut R. Multimodality imaging in Fabry cardiomyopathy: from early diagnosis to therapeutic targets. Eur. Heart J. Cardiovasc. Imaging. 2018;19(12):1313–1322. DOI: 10.1093/ehjci/jey132.
- Nordin S., Kozor R., Bulluck H., Castelletti S., Rosmini S., Abdel-Gadir A. et al. Cardiac fabry disease with late gadolinium enhancement is a chronic infl ammatory cardiomyopathy. J. Am. Coll. Cardiol. 2016;68(15):1707–1708. DOI: 10.1016/j.jacc.2016.07.741.
- Messroghli D.R., Moon J.C., Ferreira V.M., Grosse-Wortmann L., He T., Kellman P. et al. Clinical recommendations for cardiovascular magnetic resonance mapping of T1, T2, T2* and extracellular volume: a consensus statement by the Society for Cardiovascular Magnetic Resonance (SCMR) endorsed by the European Association for Cardiovascular Imaging (EACVI). J. Cardiovasc. Magn. Reson. 2017;19(1):75. DOI: 10.1186/s12968-017-0389-8.
- Sado D.M., Maestrini V., Piechnik S.K., Banypersad S.M., White S.K., Flett A.S. et al. Noncontrast myocardial T1 mapping using cardiovascular magnetic resonance for iron overload. J. Magn. Reson. Imaging. 2015;41(6):1505–1511. DOI: 10.1002/jmri.24727.
- Torlasco C., Cassinerio E., Roghi A., Faini A., Capecchi M., Abdel- Gadir A. et al. Role of T1 mapping as a complementary tool to T2* for non-invasive cardiac iron overload assessment. PLoS One. 2018;13(2):e0192890. DOI: 10.1371/journal.pone.0192890.
- 60 Krittayaphong R., Zhang S., Saiviroonporn P., Viprakasit V., Tanapibunpon P., Komoltri C. et al. Detection of cardiac iron overload with native magnetic resonance T1 and T2 mapping in patients with thalassemia. Int. J. Cardiol. 2017;248:421–426. DOI: 10.1016/j.ijcard.2017.06.100.


