Научно-методические основы итерационного прогноза риска и вреда здоровью человека при воздействии химических факторов среды обитания: от белковых мишеней до системных метаболических нарушений
Автор: Зайцева Н.В., Землянова М.А., Кольдибекова Ю.В., Пескова Е.В.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Профилактическая медицина: актуальные аспекты анализа риска здоровью
Статья в выпуске: 2 (46), 2024 года.
Бесплатный доступ
Повышение предиктивного потенциала ранней диагностики и коррекции негативных последствий воздействия факторов среды обитания приобретает особую актуальность для предупреждения и снижения персонализированных и популяционных рисков потерь здоровья населения. Осуществлена разработка научно-методических основ итерационного численного прогноза риска и вреда здоровью человека при воздействии химических факторов среды обитания. Дизайн исследования основан на алгоритме системного анализа развития негативных эффектов при воздействии химического фактора среды обитания. Углубленно обследовано более 1 млн человек, подвергающихся длительной аэрогенной комбинированной экспозиции в концентрациях до 5-10 RfC. Оценено порядка 350 цифровых многофакторных моделей (5500 параметров). Построены структурные биоинформационные матрицы для распознавания на молекулярно-клеточном уровне последовательности ответных событий, инициированных трансформацией белково-пептидного профиля плазмы крови человека, определяющие метаболом. Уточнены элементы вовлечения 20 белков-мишеней в патогенез нарушений, связанных с гипертензией, дислипидемией, ожирением, когнитивной дисфункцией, ассоциированных с химической комбинированной экспозицией. Обоснованы критерии безопасного содержания 10 контаминантов с учетом их комбинаций в биологических средах. Подтверждены прогнозные оценки патогенетических путей фактами их реализации на клеточно-тканевом, органном и организменном уровнях в виде метаболических нарушений и состоявшихся заболеваний со стороны сердечно-сосудистой, нервной систем, обмена липопротеидов и др., доказанно связанных с аэрогенным воздействием загрязняющих веществ. Расширены существующие методические подходы к оценке комбинированного действия веществ с учетом параметризированных причинно-следственных связей биомаркеров экспозиции и эффектов, количественной оценки дополнительных случаев реализации риска. Оценка разработанных цифровых моделей показала, что комбинированное действие химических веществ проявляется преимущественно синергизмом и эмерджентностью (до 70 % случаев). Разработаны концептуальные основы и архитектура итерационного прогноза риска и развития риск-ассоциированных заболеваний, в том числе в виде причинения реального вреда здоровью, при усилении экспрессии белковых мишеней. Таким образом, оцифрованная версия прогноза (цифровая платформа) как многоуровневая каскадная модель является инструментарием научного анализа гигиенической ситуации с параметризацией ожидаемых негативных исходов, определяет способы их коррекции и профилактики, что повышает надежность гигиенических оценок и обоснованность управленческих решений.
Риск здоровью, причиненный вред, факторы среды обитания, белки-мишени, негативный эффект, каскадная модель, причинно-следственные связи, прогноз, цифровая платформа
Короткий адрес: https://sciup.org/142241686
IDR: 142241686 | УДК: 57.044, | DOI: 10.21668/health.risk/2024.2.02
Текст научной статьи Научно-методические основы итерационного прогноза риска и вреда здоровью человека при воздействии химических факторов среды обитания: от белковых мишеней до системных метаболических нарушений
Важнейшим приоритетом государственной политики развития РФ является сохранение населения, укрепление здоровья и повышение благополучия людей (Указ Президента РФ от 07.05.2024 № 309 «О национальных целях развития Российской Федерации до 2036 года»)1.
Сохраняющиеся большие вызовы, обозначенные Стратегией научно-технологического развития РФ2, создают существенные риски для общества, экономики и системы государственного регулирования. Наиболее значимыми из них являются: демографический переход, обусловленный снижением рождаемости, увеличением продолжительности жизни, и связанное с этим старение населения; возрастание антропогенных нагрузок на окружающую среду до масштабов, угрожающих воспроизводству природных ресурсов, и связанный с этим рост рисков для жизни и здоровья граждан. В условиях больших вызовов требуется научное обоснование мер, которые необходимо принять для противодействия возможным угрозам и реагирования на новые вызовы. Решению этой проблемы посвящено достаточно большое количество исследований, и на принципах преемственности создано эффективное информационно-методическое обеспечение, включающее более 50 разработок. Они развивают научные подходы к аналитическим оценкам индивидуального, группового, популяционного уровня, основанные ведущими российскими учеными в области профилактической медицины [1–5].
В целях предупреждения и снижения персонализированных и популяционных рисков потерь здоровья населения «Прогнозом научно-технологического развития России до 2030 года»3 в средне- и долгосрочной перспективе определена необходимость всестороннего развития наукоемких исследований патогенетических аспектов развития негативных эффектов, обусловленных в том числе воздействием факторов среды обитания. В контексте изучения развития патологического процесса для разработки адекватных мер профилактики особый интерес представляет исследование молекулярногенетической компоненты внутриклеточных сигнальных путей, нарушения структуры и функции отдельных клеток и тканей с выявлением потенциальных молекулярных и клеточных мишеней повреждающего действия факторов риска среды обитания, в том числе при комбинированном поступлении [6–15]. Широкий спектр химических факторов высоких уровней опасности, формирующих экспозицию, обладает политропностью негативного воздействия4. Последнее обусловливает высокие риски множественности ответов со стороны здоровья населения. Для митигации рисков необходимо эффективное регулирование качества объектов среды обитания, в том числе в рамках государственного контроля, включающего социально-гигиенический мониторинг (СГМ) и контрольно-надзорную деятельность (КНД) [16, 17]. Вместе с тем в условиях моратория контрольно-надзорной деятельности перечень контролируемых веществ может быть минимизирован без качественных и информационных потерь.
В связи с этим молекулярное профилирование и исследование клеточно-молекулярных, метаболических, органно-системных механизмов модифицирующего действия химических факторов среды обитания и разработка на этой основе научно-методического инструментария численного прогноза ответа организма человека на воздействие является одной из актуальных проблем гигиены. Оптимизация перечня веществ, подлежащего первоочередному контролю, имеет существенное значение для практики регулирования.
Цель исследования – разработка научно-методических основ итерационного численного прогноза риска и вреда здоровью человека при воздействии химических факторов среды обитания.
Материалы и методы. Для достижения поставленной цели дизайн исследования базировался на последовательной реализации алгоритма системного анализа развития негативных эффектов при воздействии химического фактора среды обитания – от молекулярного до организменного уровня. Углубленным обследованием охвачено более 1 млн человек (порядка 800 тыс. детей в возрасте 4–7 лет и 500 тыс. взрослых 22–48 лет), подвергающихся реальной длительной аэрогенной комбинированной экспозиции на уровне до 5–10 референтных концентраций для условий хронического воздействия ( RfC )5.
Исследования на молекулярном уровне выполнены технологией протеомного профилирования плазмы крови экспонированных детей (порядка 300 протеомных профилей, 180 квантифицированных и идентифицированных экспрессированных белков). Исследование и количественная оценка контаминации биосред (крови, мочи) выполнена химикоаналитическими методами, закрепленными в реестре Росаккредитации (18 веществ, в том числе алюминий, медь, марганец, никель, хром, ванадий, кобальт, молибден, мышьяк, ртуть, фтор-ион, бенз(а)пирен, фенол, бензол, толуол, ксилол, этилбензол, акролеин)6. Результаты протеомного профилирования, полученные в натурных условиях, верифицированы в эксперименте на животных, подвергающихся экспозиции, эквивалентной реальной. Экспериментальные исследования выполнены на 300 крысах линии Wistar при моделировании ингаляционной изолированной и комбинированной экспозиции. Для прогноза негативных событий, инициированных трансформацией белково-пептидного профиля плазмы крови, с помощью ресурсов UniProt, Tissue expression DB, DisGeNET построено 25 биоинформационных матриц.
На клеточном уровне исследования выполнены методами растровой электронной микроскопии, трехмерной реконструкции клеток, технологией анализа изображений. Изучение морфологических изменений тканей выполнено гистологическими методами. Особенности клеточной реакции определены при воздействии семи металлов в нано- и микродиапазоне частиц сравнительно (Al, Mn, Ni, Cr, Сu, Ca, Mg, Co, Mo).
Изменения на органно-системном уровне изучали методами биохимических, иммунологических, гематологических исследований (порядка 100 показателей). Реализацию ответа на организменном уровне оценивали на основе установленных фактических заболеваний у экспонированных детей и взрослых при углубленном обследовании (порядка 1500 диагнозов в соответствии с МКБ-10). Оценка потерь ожидаемой продолжительности жизни (ОПЖ), инициированных усиленной экспрессией белков-мишеней, выполнена на основе эволюционного моделирования нарастания риска здоровью.
Моделирование причинно-следственных связей при реализации каскадной модели «экспозиция – биомаркер экспозиции – экспрессированный белок – биомаркер негативного эффекта – ответ (фактиче- ское риск-ассоциированное заболевание)» с учетом комбинированного действия факторов экспозиции выполнено методами регрессионного анализа с построением множественных логистических моделей. Общий вид модели, описывающей зависимость:
y = 1 / (1 + exp ( - ( b 0 + ∑b i · x i + ∑∑b ij · x ij ))).
Оценка достоверности и адекватности результатов моделирования осуществлена по F -критерию Фишера, коэффициенту детерминации ( R 2) и t -критерию Стьюдента ( р ≤ 0,05). Построено более 450 параметризированных моделей зависимости (порядка 5000 коэффициентов)7. Обоснование перечня веществ, подлежащих первоочередному регулированию, выполнено на основе решения обратной задачи с применением методов минимаксного оценивания и факторного анализа при фиксированных профилях факторов воздействия на исследуемых территориях8. Тесноту связи между веществами оценивали по R 2.
Конкретные примеры результатов реализации алгоритма системного анализа представлены преимущественно на модели натурной аэрогенной длительной экспозиции, формируемой компонентами выбросов в атмосферный воздух от источников промышленного производства – оксидом алюминия (Al2O3) и фторидом водорода (HF) на уровне 0,0006– 0,003 мг/кг · сут. (0,1–2,2 RfC ); бенз(а)пиреном (B[а]P) – 0,000003 мг/кг · сут. (2,1 RfC ). Выбор веществ обусловлен их высокой степенью опасности для здоровья человека (1–2-й класс) и одновременным присутствием в составе компонентов выбросов в атмосферный воздух от источников 13 крупных производств первичного алюминия и глинозема, размещенных в регионах РФ. Анализ пространственного распределения полученных результатов выполнен с применением ГИС-технологий9.
Результаты и их обсуждение. При реализации алгоритма исследований риск-ассоциированных ответов организма на различных уровнях их инициации у экспонированных лиц разных возрастных групп относительно неэкспонированных на молекулярном уровне выявлена трансформация белково-пептидного профиля плазмы крови. Определены белковые мишени воздействия распространенных маркеров экспозиции (Mn, Al, Cu, Ni, Cr, фтор, бенз(а)пирен). Установлены специфичные ткани, в которых экспрессируют идентифицированные белки. К ним относятся ткани печени, головного мозга, сердца, тонкого кишечника, легких. Напри- мер, у детей в возрасте 4–7 лет усиление экспрессии шести белков из 23 идентифицированных доказанно связано с воздействием повышенной контаминации биосред (в 1,5–1,8 раза от референтной или фоновой концентрации в крови / моче) в результате комбинированной экспозиции Al2O3, HF, B[а]P. При этом только два белка верифицированы в эксперименте на крысах при изолированной и комбинированной экспозиции и определены как мишени воздействия. Это аполипопротеин А1 (ген, кодирующий белок, – АРОА1), являющийся стимулятором обратного транспорта холестерина из сосудов, антиоксидант, и белок транстиретин (ген TTR) – транспортер тироксина, фактор репарации поврежденных молекул [18–20]. Экспрессия данных белков наблюдается преимущественно в гепатоцитах, энтероцитах и нейронах.
На основе результатов протеомного профилирования впервые обоснованы критерии безопасного содержания 10 контаминантов в биологических средах человека (в крови, моче). Для условий комбинированных экспозиций эти уровни существенно ниже, чем референтные значения. Например, максимальная недействующая концентрация по критерию изменения интенсивности экспрессии аполипопротеина А1 для алюминия в моче составляет 0,001 мг/дм3 (RFL – 0,0065 мг/дм3)10, фтор-иона в моче – 0,06 мг/дм3 (RFL – 0,2 мг/дм3)11, бенз(а)-пирена – 0,0 мг/дм3.
Прогнозные структурные-биоинформационные матрицы, построенные для распознавания изменений молекулярно-клеточных событий и их последовательности, связанных с усиленной экспрессией 25 идентифицированных белков, иерархически отразили первичные сигнально-транспортерные связи и пути, протекающие на 5–12-м уровнях, установочные ячейки их локализации (40–100), реакции клеточной популяции (10–15 видов), определяющие в последующем метаболом. Это позволило уточнить элементы вовлечения экспрессированных белков в патогенез метаболических нарушений, негативным исходом которых могут являться гипертензия, ожирение, гепатоз, когнитивная дисфункция, полиневропатия, бронхиальная астма и др. В конкретном примере при активации экспрессии аполипопротеина А1 и транстиретина молекулярные взаимодействия протекают на 7–10-м уровнях внутриклеточных сигнальных путей. Процесс обмена липопротеинов, пролиферативная реакция эпителия и эндотелия затрагиваются, начиная с 3-го уровня. За счет ли-ганд-рецепторного взаимодействия осуществляется патогенетически специфическое расщепление аполипопротеина А1. Процесс обусловлен активацией окисления и протеолитическими свойствами транстиретина. Как результат, активность обратного пе- реноса стеролов, в том числе холестерина, снижается. Провоспалительные и антиоксидантные свойства аполипопротеина А1 заменяются на воспалительные и окислительные. Прогнозируются метаболические нарушения, биохимические механизмы которых реализуются в виде дисбаланса липопротеинов, нейротрансмиттеров, снижения активности нейрогенеза [21, 22].
Детализация основных путей сигнальной трансдукции молекулярных событий позволила установить возможные направления патогенеза негативных событий. Показано, что изменение передачи сигнала дисрегулирует клеточную коммуникацию разнообразными способами. Пусковым является стимуляция экспрессии белка, вызывающая изменение восприятия сигнала. Возникает цепная реакция комбинаторных сигнальных событий и, как следствие, дискоординация клеточного гомеостаза. Конкретный пример основных путей сигнальной трансдукции молекулярных событий при повышенной экспрессии аполипопротеина А1, обусловленной одновременным воздействием Al 2 O 3, HF, B[а]P, представлен на рис. 1. В результате окислительной активности аполипопротеина А1 нарушается восприятие сигнала к синтезу липопротеинов высокой плотности. Замедляется лизосомальный эндоцитоз липопротеидов низкой плотности. Усиливается секреция липопротеина А. Повышается синтез билирубина как антиоксиданта в ответ на повышение окислительной активности [23, 24]. Последнее связано с прямым окислительным действием токсикантов и активным расщеплением аполипопротеина А1.
Следствием является усиление синтеза холестерина, что может повышать риск развития раннего атеросклероза, заболеваний периферических сосудов, ишемической болезни сердца и др., являющихся одной из ведущих причин снижения качества активного долголетия.
Предложенный подход повышает точность прогноза и обеспечивает раннюю диагностику метаболических нарушений, обусловленных трансформацией протеомного профиля в условиях химической экспозиции, в том числе комбинированной. Определяет способы коррекции и профилактики.
На клеточно-тканевом уровне в эксперименте на животных подтвержден прогноз патогенетических путей. Фактически доказано усиление экспрессии идентифицированных белков в прогнозируемых клетках. Установлено, что общим механизмом является развитие воспалительного процесса в клеточной популяции с особенностями по типу неиммунного и иммуноопосредованного повреждения. Дополнительно выявлена зависимость типа воспалительной реакции (нейтрофильный или эозинофильный) от размера и удельной площади
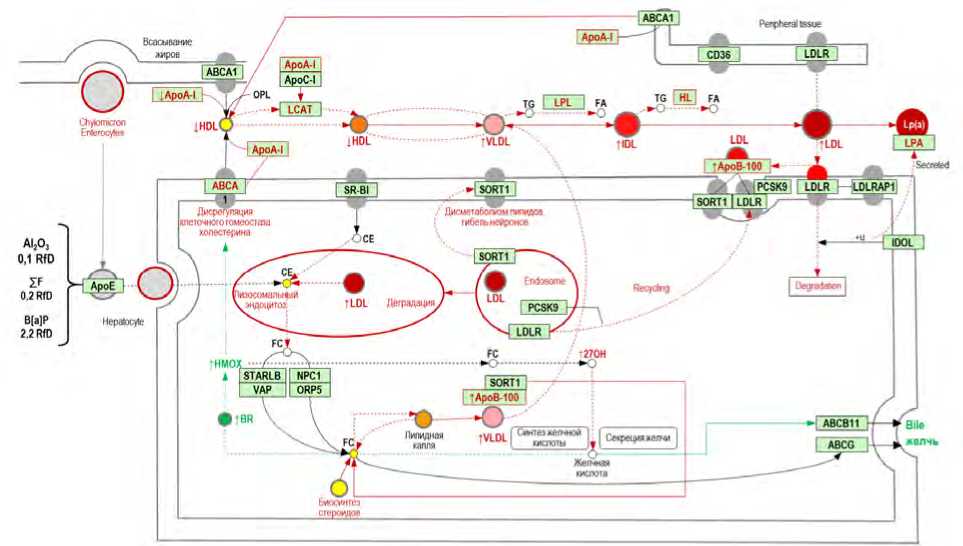
Рис. 1. Схема основных путей сигнальной трансдукции молекулярных событий при повышенной экспрессии аполипопротеина А1, обусловленной воздействием Al2O3, HF, B[а]P (красным цветом выделена дисрегуляция клеточной коммуникации)
поверхности воздействующих частиц. Установлено, что чем меньше размер и больше удельная площадь частиц, тем менее благоприятен прогноз. Так, при интратрахеальном воздействии наноразмер-ных частиц Al 2 O 3 (13–20 нм) в дозе 0,01 мг/кг · сут, эквивалентной реальной (0,1 RfC с учетом экстраполяции), установлена преимущественно эозинофильная реакция клеточной популяции в бронхоальвеолярном лаваже (БАЛЖ). Количество эозинофилов в 21–62 раза ( р = 0,0001) превышает показатель контроля и группы сравнения, подвергающейся экспозиции микроразмерным аналогом (20–30 мкм). При интратрахеальном воздействии последнего отмечена преимущественно нейтрофильная реакция. Количество лейкоцитов в БАЛЖ в 2–16 раза ( р = 0,0001) выше контрольных данных и показателя в группе сравнения.
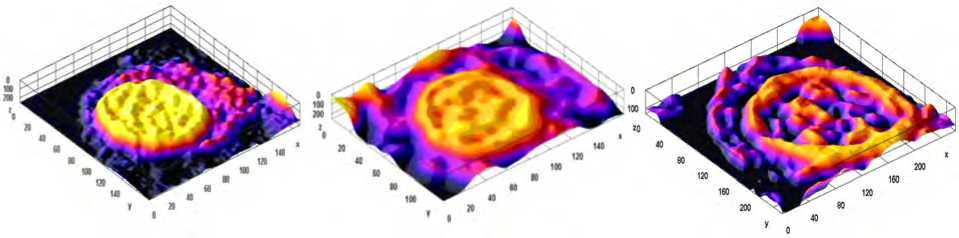
Цифровая трехмерная реконструкция поверхности фиксированных клеток бронхоальвеолярной жидкости представлена на рис. 2.
Электронной микроскопией определено нарушение структуры и формы поверхности альвеолярного макрофага в виде «пенистости», нарастающей с уменьшением размера частиц действующего вещества. Выявленные изменения свидетельствуют о повреждении клеточной мембраны. Доля альвеолярных макрофагов с нарушенной структурой поверхности и формой при экспозиции наноразмер-ными частицами Al 2 O 3 составила 18 %, что в 2,5 раза больше, чем при воздействии микрочастиц ( р = 0,02). Технологией анализа изображений подтверждено и расширено представление о зависимости степени повреждения клетки от морфометрического состава воздействующих веществ.
а б в
Рис. 2. Трехмерная реконструкция морфологических параметров альвеолярных макрофагов БАЛЖ крыс линии Wistar при интратрахеальном воздействии Al2O3 в дозе 0,01 мг/кг · сут, эквивалентной реальной (0,1 RfС ): а – контроль; б – группа в условиях экспозиции микроразмерными частицами; в – группа в условиях экспозиции наноразмерными частицами
а
б
в
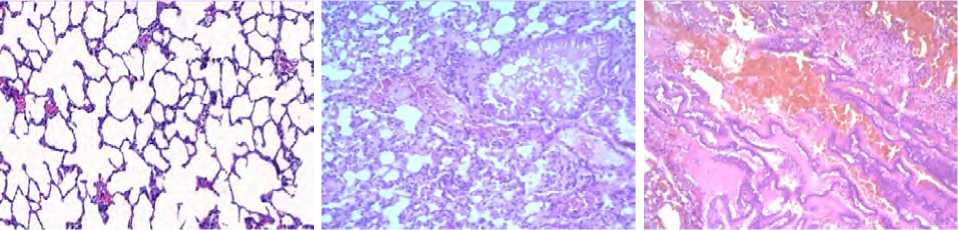
Рис. 3. Морфологические изменения ткани легкого крыс линии Wistar при ингаляционной экспозиции оксидом алюминия, × 1000: а – контроль, б – экспозиция микроразмерными частицами; в – экспозиция наноразмерными частицами
Глубина повреждения ткани подтверждена гистологически (рис. 3).
Показано, что при экспозиции наноразмерны-ми частицами изучаемого вещества морфологические изменения ткани легкого, по сравнению с контрольными данными, проявляются выраженной гиперплазией лимфоидной ткани, наличием эозинофильных инфильтратов и геморрагических очагов. При экспозиции микроразмерными частицами выраженность гиперплазии и инфильтратов умеренная, геморрагические очаги отсутствуют, т.е. установлена меньшая степень повреждения, что отличает от воздействия наночастиц.
Характеризуя органный уровень реализации ответа необходимо отметить, что в реальных условиях у экспонированных лиц подтверждены факты метаболических нарушений, характеризующихся изменением органоспецифических показателей, патогенетически связанных с факторами экспозиции, обусловливающих повышенную контаминацию биосред (от 1,5 до 3,5 RfL ). Об этом свидетельствует снижение содержания аполипопотеина А1, липопротеидов высокой плотности, повышено соотношение аполипопротеинов В100 и А1, билирубина до 1,5 раз относительно показателей сравнения ( р = 0,0001–0,001). Снижение активности нейрогенеза и дисбаланс нейромедиаторов реализуются за счет гипосинтеза нейротропина-3, повышения глутаминовой кислоты, нейронспецифической энолазы и серотонина в 1,3–2,0 раза относительно контрольных данных ( р = 0,001–0,03). Дисбаланс тиреотропных гормонов (ТТГ и Т 4 свободного) и достоверное увеличение активности специфических ферментов, например, глутаматдегидрогеназы (в 1,3 раза, р = 0,002), ассоциированные с повышенной контаминацией биосред, подтверждают цитотоксическое действие на гепатоциты и тиреоциты. В континууме прогнозируется отложение амилоидных бляшек в нейрональных клетках и холестериновых бляшек – в эндотелии сосудов. С этим могут быть связаны атеросклеротические и нейродегенеративные изменения, жировое перерождение гепатоцитов.
Показано, что степень выраженности экспрессии белков и метаболически связанных с этим изменений биохимических показателей негативных эф- фектов зависят от особенностей действия комбинации веществ. Разработано 25 цифровых моделей зависимости биомаркеров негативных эффектов от биомаркеров экспозиции (150 коэффициентов) для оценки комбинированного действия веществ, в том числе оксидов алюминия, меди, никеля, хрома, фторида водорода, бенз(а)пирена. Получено 60 показателей дополнительных случаев реализации риска, превышающих приемлемый уровень от 2 до 45 раз, развития негативных эффектов со стороны иммунной, костно-мышечной, нервной систем, органов дыхания, пищеварения. Подтверждение необходимости учета комбинированного действия в практике регулирования показано на конкретном примере интенсивности экспрессии фактора элонгации гамма (ген EF1G) при изолированной и комбинированной экспозиции. При хронической экспозиции одновременно бенз(а)пиреном, алюминия оксидом и фторидом водорода установлено, что комбинированное действие проявляется не просто суммацией эффектов, а преимущественно синергизмом, превышающим эффект аддитивности в 1,5 раза (рис. 4). Формируется дополнительно к изолированному действию риск развития негативных эффектов со стороны иммунной системы, органов дыхания. Величина дополнительного риска превышает приемлемый уровень до 30 раз.
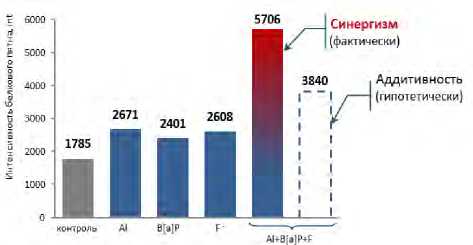
Рис. 4. Интенсивность экспрессии фактора элонгации гамма (ген EF1G ) в плазме крови крыс линии Wistar при изолированной и комбинированной экспозиции
С учетом особенностей комбинированного действия на органно-системном уровне определены профили предикторных показателей для ранней ди- агностики реализации формализованного риска в виде причинения вреда здоровью в условиях конкретной экспозиции. Профиль включает белки-мишени и патогенетически связанные с ними биомаркеры негативных эффектов, изменение которых повышает вероятность возникновения конкретного заболевания (рис. 5).
Например, для детей в возрасте 4–7 лет, экспонированных компонентами выбросов крупного алюминиевого производства, определены диагностические профили, позволяющие прогнозировать развитие заболеваний со стороны нервной системы и обмена веществ. Для раннего выявления и предупреждения избыточности питания (МКБ-10: Е67.8), ассоциированной с воздействием экспозиции, профиль предикторных показателей включает белок аполипопротеин А1 и связанный с ним комплекс биомаркеров дисбаланса липопротеинов (повышенный относительно физиологической нормы уровень общего холестерина и холестерина ЛПВП, сниженный уровень холестерина ЛПНП) и окислительноантиоксидантной активности (повышенный уровень малонового диальдегида и сниженный уровень антиоксидантной активности). Параметры многофакторной модели, описывающей зависимость развития заболевания от изменения биомаркеров эффектов: b 0 = -2,27, b 1 = -0,303–0,053 ( R 2=0,41–0,50, р = 0,0001–0,002). Расстройство вегетативной нервной системы (МКБ-10: G90.8) ассоциировано с экспрессией транстиретина и со связанным с ним повышенным уровнем нейромедиаторов (дофамина, глутамата), дисбалансом окислительно-восстановительного статуса клеток (повышенный уровень малонового диальдегида, общей антиоксидантной активности, глутатионпероксидазы). Параметры модели зависимости: b 0 = -1,93, b 1 = -0,16, b 2 = -0,16–0,07 ( R 2 = 0,52, р = 0,0001). Это позволило сформировать группы риска для последующих медико-профилактических мероприятий.
Прогнозные оценки в результате реализации каскадной модели полностью подтверждены выявлением на организменном уровне фактически состоявшихся заболеваний, доказанно связанных с аэрогенным воздействием химических факторов. Особенности структуры дополнительной заболеваемости определяются территориальной спецификой загрязнений. Например, в зоне экспозиции Al 2 O 3, HF, B[a]P структура дополнительных случаев фактических заболеваний у детей в возрасте 4–7 лет, установленных по результатам углубленных исследований, представлена в основном заболеваниями верхних дыхательных путей в виде аллергического и хронического ринита, аденоидита, синусита (J30.4, J32, J35.9) (23,0 % от общего количества заболеваний), расстройствами вегетативной и центральной нервной системы (G90.8), в том числе в виде нарушения активности и внимания (F90.0) (21,9 %), билиарной дисфункции (К82.8) (18,6 %), гиперлипидемии и избыточности питания (Е67.8, Е78.5) (13,3 %). У взрослых фертильного возраста (22–48 лет) наиболее значимыми в структуре дополнительных случаев заболеваний являются ожирение (24,8 %), заболевания верхних и нижних дыхательных путей (J32, J37, J42) в виде хронического ринита, синусита, ларингита, бронхита (23,0 % от общего количества заболеваний). Приоритеты, выделенные на индивидуальном уровне, формируют в целом профиль популяционных потерь здоровья.
Совокупность полученных результатов позволила разработать концептуальные основы и архитектуру итерационного прогноза риска и вреда здоровью: от белковых мишеней до риск-реализованных заболеваний. Упрощенная схема представлена на рис. 6.
Показано, что протеомная сигнатура, дисрегу-ляция внутриклеточных сигнальных путей, прямая и опосредованная цитотоксичность, окислительная активность токсикантов определяют ключевые
б
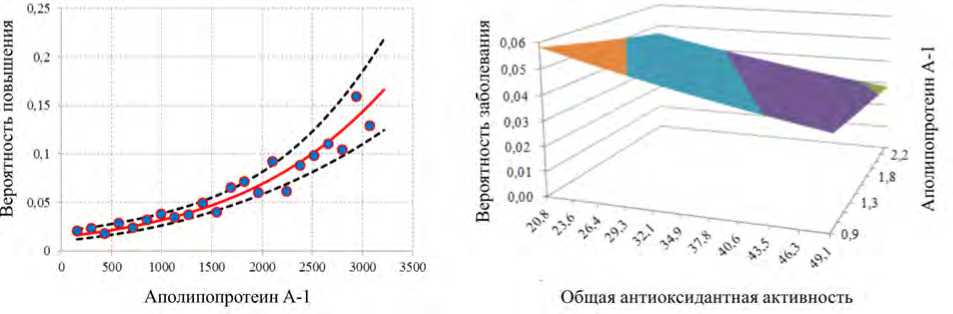
Рис. 5. Вероятность развития избыточного питания у детей при комбинированной аэрогенной экспозиции Al2O3, HF, B[а]P: а – вероятность повышения малонового диальдегида при экспрессии аполипопротеина А1; б – вероятность развития избыточного питания при повышении аполипопротеина А1 и снижении общей антиоксидантной активности
Изолированная и комбинированная экспозиция
Усиление экспрессии белок-кодирующих генов
Молекулярноклеточные события
Экспрессия в тканях
Метаболические нарушения
Негативный исход
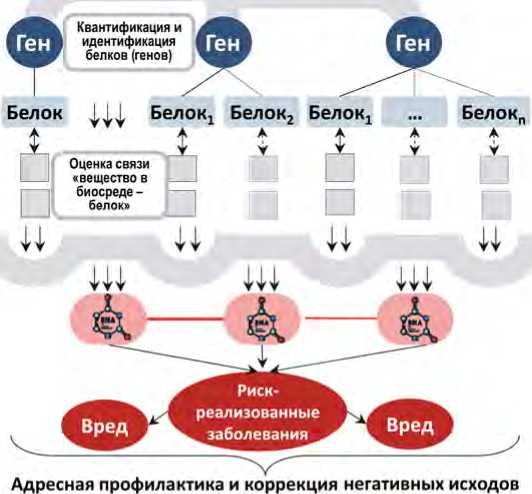
Рис. 6. Концептуальные основы и архитектура итерационного прогноза риска и вреда здоровью: от белковых мишеней до риск-реализованных заболеваний звенья патогенетических механизмов модифицирующего действия. Оцифрованная версия по существу является многоуровневой каскадной моделью и алгоритмом научного анализа гигиенической ситуации с параметризацией ожидаемых негативных исходов.
Практическое использование предложенных концептуальных подходов позволяет также перейти к оценке потерь ожидаемой продолжительности жизни на основе эволюционного моделирования нарастания риска. Показано, что при повышении экспрессии только двух белков и связанных с этим метаболических нарушений прогнозируется сокращение ожидаемой продолжительности жизни почти на два месяца. При этом интегральные потери здоровья являются этиопатогенетически значимыми и представлены в виде гипертонической болезни, ожирения, полиневропатии, жирового гепатоза.
На основе исследованных механизмов и установленных фактов формирования персонализированных рисков здоровью разработано 54 медицинских технологии профилактики клеточно-молекулярных и органно-системных риск-ассоциированных негативных эффектов, востребованность которых составляет более 45 % от численности населения в зоне экспозиции. Медико-профилактические технологии разработаны в отношении конкретных риск-реализованных заболеваний по восьми классам болезней, в том числе органов дыхания, сердечно-сосудистой, нервной, эндокринной систем и др. Персонализированные меры дополняют существующие стандарты оказания медицинской помощи на период до достижения приемле- мых рисков развития заболеваний и не осуществляются в системе практического здравоохранения. Содержание мероприятий предусматривает этиотропный и патогенетический блок. Этиотропный блок направлен на снижение химической контаминации в организме, и его наполнение зависит от уровня содержания веществ в биосредах. Патогенетический блок является целевым и предусматривает комплекс корректирующих и профилактических мер, дифференцированных по направлениям профилактики с учетом степени выраженности патологического процесса и акцентом на коррекцию возможных клеточно-молекулярных изменений.
Опыт реализации специализированной адресной медико-профилактической помощи экспонированному населению в регионах РФ (охвачено порядка 800 тыс. детей и взрослых) свидетельствует о ее эффективности (рис. 7). Подтверждена эффективность профилактических мер в виде снижения содержания от 1,5 до 30 раз токсичных компонентов (бенз(а)пирен, алюминий, фтор-ион, бензол, ксилол, фенол и др.) в биосредах через один год после лечения. Частота обострений и длительности заболеваний, например, вегетососудистой дистонии, билиарной дисфункции, у детей снизились от 2,3 до 3,2 раза.
Частота ОРВИ как сопутствующего заболевания снизилась до 2,7 раза. Экономическая эффективность составила порядка 6,5 руб. на 1 руб. затрат на одного пролеченного человека при амбулаторной форме реализации мероприятий, 1,8 руб. на 1 руб. – при стационарной форме.
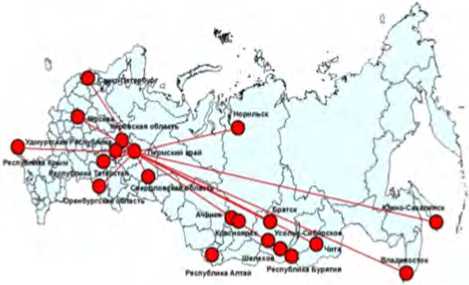
Рис. 7. Регионы РФ, в которых детское и взрослое население из зон экспозиции охвачено специализированной адресной медико-профилактической помощью
На основе накопленных результатов исследований создан и систематически пополняется электронный регистр оцифрованных сопряженных данных по каждому обследованному индивиду, подвергающемуся реальной химической экспозиции (рис. 8). Логическая структура регистра содержит данные качества среды обитания, параметры индивида, контаминации биосред, протеомного профиля, лабораторно-функциональных показателей, диагноз заболевания, адресные медико-профилактические мероприятия, их эффективность. К настоящему времени введено порядка 3 млн единиц информации, формирующих базу данных и знаний.
Обработка оцифрованных данных по содержанию контаминантов в биосредах обследованных лиц, проживающих в различных регионах России, позволила визуализировать пространственное распределение информации по биомаркерам аэрогенной экспозиции.
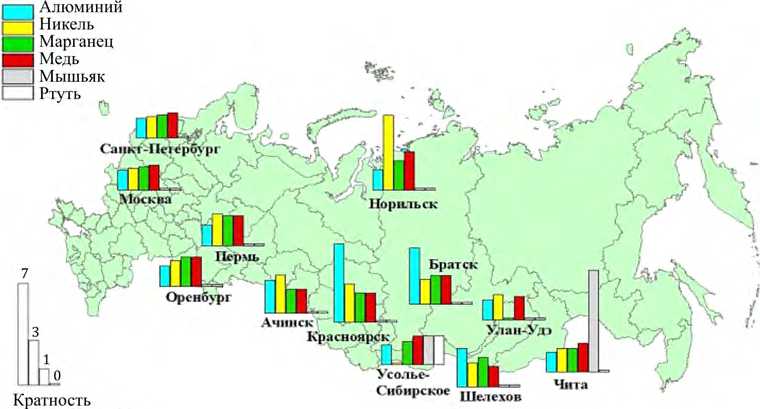
На основе анализа полученных результатов подтверждены факты хронических экспозиций насе- ления высокотоксичными веществами (1-й и 2-й классы опасности), в том числе на уровне до 10 RfC. В биосредах концентрации металлов, адекватных факторам экспозиции (оксидам алюминия, марганца, хрома, никеля, меди, свинца и др.), определяются на уровне до 8 RfL, органических соединений (бензола, толуола, ксилола, этилбензола, фенола бенз(а)пирена, формальдегида и др.) – до 10 Ф (рис. 9, 10). Выявлено, что масштабно распространены из них порядка 10 веществ, обоснованных в качестве биомаркеров экспозиции. Формируются локальные зоны экспонированных с контаминацией биосред высокотоксичными соединениями (мышьяк, ртуть, фтор и др.).
В целом с учетом неравномерного распределения по регионам России под экспозицией находятся 71,3 млн человек, в том числе 14,3 млн детей.
В результате реализации научно обоснованного подхода к выделению высокоопасных веществ, подлежащих первоочередному контролю в зоне экспозиции (на примере зоны, сформированной выбросами от источников производства алюминия), установлено, что приоритетный минимально достаточный перечень веществ включает три вещества из 45 компонентов, поступающих в атмосферный воздух. Это алюминия оксид, фторид водорода и фториды твердые и бенз(а)пирен. При нарушении гигиенических нормативов по данным компонентам программа наблюдений может быть расширена за счет наиболее тесно связанных с ними 13 веществ, поступающих в атмосферный воздух (подтверждено статистически). Так, при превышении содержания бенз(а)пирена в точках контроля программа наблюдений расширяется за счет включения двух веществ – смолистых веществ и масла нефтяного минерального. Перечень веществ, подлежащих контролю в атмосферном воздухе и дифференцированных по его очередности, представлен в таблице.
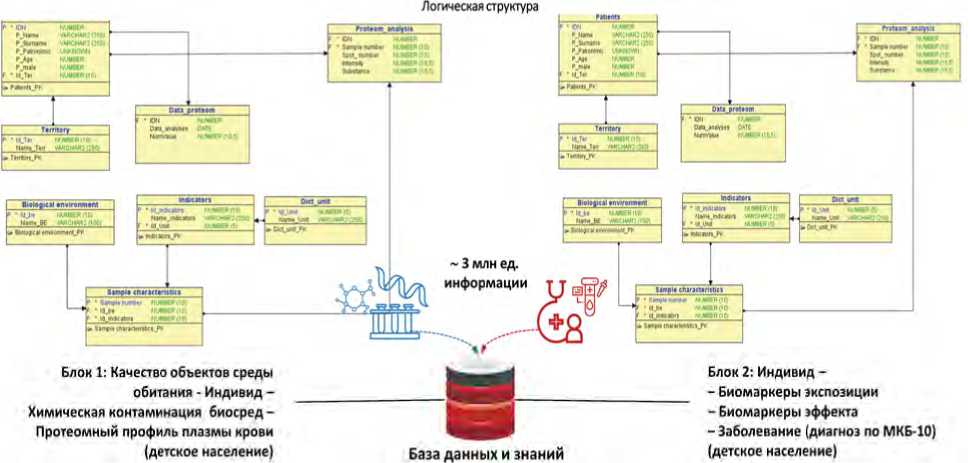
Рис. 8. Схематическое представление составных блоков электронного регистра оцифрованных аутентичных данных, сопряженных в системе «среда – здоровье»
превышения Rfl
Рис. 9. Содержание металлов в биосредах экспонированных лиц в регионах РФ
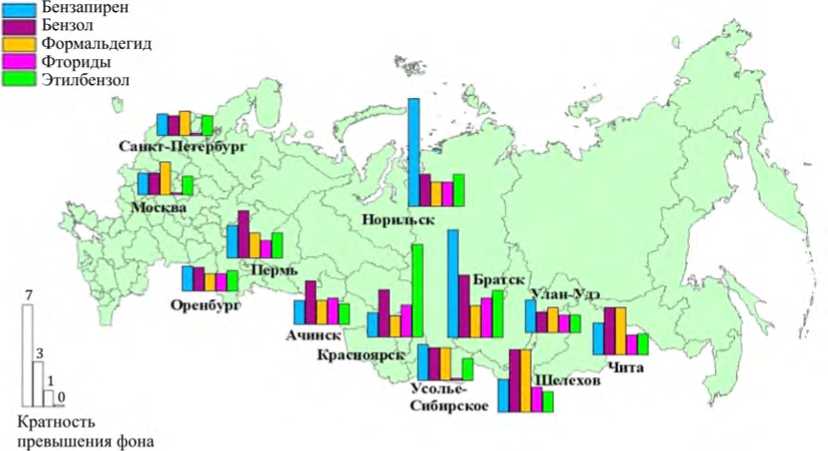
Рис. 10. Содержание органических соединений в биосредах экспонированных лиц в регионах РФ
Перечень веществ, подлежащих контролю в атмосферном воздухе в зоне экспозиции от источников алюминиевого производства
|
Приоритетные вещества, подлежащие первоочередному контролю в атмосферном воздухе |
|||||
|
Алюминия оксид |
Водорода фторид и фториды твердые |
Бенз(а)пирен |
|||
|
Вещества, рекомендуемые для расширения программы наблюдения |
|||||
|
Взвешенные вещества |
0,96* |
Азота оксид |
0,82 |
Смолистые вещества |
0,76 |
|
Свинец и его соед. |
0,96 |
Диметилсульфид |
0,76 |
Масло минеральное нефтяное |
0,74 |
|
Марганец оксид |
0,90 |
Водород цианистый |
0,75 |
||
|
Пыль неорг. SiO2 |
0,89 |
Гидрохлорид |
0,74 |
||
|
Медь оксид |
0,84 |
||||
|
Мазутная зола ТЭС (Va) |
0,77 |
||||
|
Железа оксид |
0,59 |
||||
П р и м е ч а н и е: * – коэффициент детерминации ( R 2).
Репрезентативность выбора приоритетных веществ, подлежащих первоочередному контролю, подтверждена установленными фактическими случаями ассоциированной болезненности у взрослого трудоспособного и детского населения (суммарно до 490 сл./1000).
Таким образом, представленные результаты научных наработок целиком и полностью посвящены расширению возможностей обеспечения успешных практик управления рисками причинения вреда (ущерба) в интересах защиты охраняемых законом ценностей – жизни и здоровья граждан и направлены на достижение ключевых национальных целей развития РФ. Оцифрованная версия прогноза (цифровая платформа) как многоуровневая каскадная модель является инструментарием научного анализа гигиенической ситуации с параметризацией ожидаемых негативных исходов, определяет способы их коррекции и профилактики, что повышает надежность гигиенических оценок и обоснованность управленческих решений.
Выводы. Разработана, апробирована научнометодическая основа и создана цифровая платформа прогноза риск-ассоциированных негативных эффектов на различных уровнях организации живого: от молекулярного до популяционного.
Многоуровневая архитектура биоинформаци-онного распознавания ответа обеспечивает переход от контактного исследования к численному эксперименту и количественному прогнозированию без информационных потерь.
Результаты исследования патогенетических механизмов модифицирующего действия химических контаминантов на белково-генетические и органно-системные компоненты ответа повышают надежность гигиенических оценок и эффективность социально-гигиенического мониторинга и контрольно-надзорной деятельности по достижению социально-значимых результатов.
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Научно-методические основы итерационного прогноза риска и вреда здоровью человека при воздействии химических факторов среды обитания: от белковых мишеней до системных метаболических нарушений
- Онищенко Г.Г. Актуальные проблемы и перспективы развития методологии анализа риска в условиях современных вызовов безопасности для здоровья населения Российской Федерации // Анализ риска здоровью. - 2023. -№ 4. - С. 4-18. DOI: 10.21668/health.risk/2023.4.01
- Потери лет жизни вследствие смертности от заболеваний мочевыделительной системы в промышленном регионе Казахстана с загрязнением атмосферного воздуха / Ш.С. Бибитова, Ж.Ж. Галиакпарова, М.А. Жаксылык, И.В. Лопуха, Р.Н. Оралова, А.К. Сандыбаева, Ж.У. Хашимов, Н.К. Дюсембаева [и др.] // Гигиена и санитария. - 2024. -Т. 103, № 2. - С. 120-129. DOI: 10.47470/0016-9900-2024-103-2-120-129
- Анализ отдельных перспективных направлений развития оценки риска для здоровья населения в Российской Федерации (обзор литературы) / М.Ю. Мозганов, Н.И. Николаева, А.С. Филин, В.В. Малышек, Г.Г. Онищенко // Гигиена и санитария. - 2024. - Т. 103, № 1. - С. 76-80. DOI: 10.47470/0016-9900-2024-103-1-76-80
- Современные вызовы и пути совершенствования оценки и управления рисками здоровью населения / В.Н. Ра-китский, С.В. Кузьмин, С.Л. Авалиани, Т.А. Шашина, Н.С. Додина, В.А. Кислицин // Анализ риска здоровью. - 2020. -№ 3. - С. 23-29. DOI: 10.21668/health.risk/2020.3.03
- Методические подходы к оценке и прогнозированию индивидуального риска здоровью при воздействии комплекса разнородных факторов для задач персонализированной профилактики / М.А. Землянова, Н.В. Зайцева, Д.А. Кирьянов, О.Ю. Устинова // Гигиена и санитария. - 2018. - Т. 97, № 1. - C. 34-43. DOI: 10.18821/0016-9900-2018-97-1-34-43
- Методический подход к организации мониторинга общественного здоровья Российской Федерации / Т.П. Васильева, А.В. Ларионов, С.В. Русских, А.Б. Зудин, Р.В. Горенков, М.Д. Васильев, А.А. Костров, А.А. Хапалов // Здоровье населения и среда обитания - ЗНиСО. - 2022. - № 7. - С. 7-17. DOI: 10.35627/2219-5238/2022-30-7-7-17
- Методический подход к составлению классификатора вызовов общественному здоровью / Т.П. Васильева, А.В. Ларионов, С.В. Русских, А.Б. Зудин, А.Е. Васюнина, М.Д. Васильев, В.М. Ротов // Здоровье населения и среда обитания - ЗНиСО. - 2024. - Т. 32, № 2. - С. 7-17. DOI: 10.35627/2219-5238/2024-32-2-7-17
- Модифицирующее влияние факторов среды обитания на течение эпидемического процесса COVID-19 / Н.В. Зайцева, А.Ю. Попова, С.В. Клейн, А.Н. Летюшев, Д.А. Кирьянов, В.М. Чигвинцев, М.В. Глухих // Гигиена и санитария. - 2022. - Т. 101, № 11. - С. 1274-1282. DOI: 10.47470/0016-9900-2022-101-11-1274-1282
- Прогноз научно-технологического развития России: 2030. Медицина и здравоохранение / под ред. Л.М. Гох-берга, Л.М. Огородовой. - М.: Министерство образования и науки Российской Федерации, Национальный исследовательский университет «Высшая школа экономики», 2014. - 48 с.
- Skinner M.K. Environmental epigenomics and disease susceptibility // EMBO Rep. - 2011. - Vol. 12, № 7. - P. 620-622. DOI: 10.1038/embor.2011.125
- Rappaport S.M. Discovering environmental causes of disease // J. Epidemiol. Community Health. - 2012. - Vol. 66, № 2. - P. 99-102. DOI: 10.1136/jech-2011-200726
- Зайцева Н.В., Землянова М.А., Долгих О.В. Геномные, транскриптомные и протеомные технологии как современный инструмент диагностики нарушений здоровья, ассоциированных с воздействием факторов окружающей среды // Гигиена и санитария. - 2020. - Т. 99, № 1. - С. 6-12. DOI: 10.47470/0016-9900-2020-99-1-6-12
- Anderson N.L., Anderson N.G. The human plasma proteome: history, character, and diagnostic prospects // Mol. Cell. Proteomics. - 2002. - Vol. 1, № 11. - P. 845-867. DOI: 10.1074/mcp.r200007-mcp200
- Statistical analysis of variation in the human plasma proteome / T.H. Corzett, I.K. Fodor, M.W. Choi, V.L. Walsworth, K.W. Turteltaub, S.L. McCutchen-Maloney, B.A. Chromy // J. Biomed. Biotechnol. - 2010. - Vol. 2010. - P. 258494. DOI: 10.1155/2010/258494
- Ahmad A., Imran M., Ahsan H. Biomarkers as Biomedical Bioindicators: Approaches and Techniques for the Detection, Analysis, and Validation of Novel Biomarkers of Diseases // Pharmaceutics. - 2023. - Vol. 15, № 6. - P. 1630. DOI: 10.3390/pharmaceutics15061630
- Социально-гигиенический мониторинг на современном этапе: состояние и перспективы развития в сопряжении с риск-ориентированным надзором / Н.В. Зайцева, И.В. Май, Д.А. Кирьянов, Д.В. Горяев, С.В. Клейн // Анализ риска здоровью. - 2016. - № 4. - С. 4-16. DOI: 10.21668/health.risk/2016.4.01
- Агамагомедова С.А. Риск-ориентированный подход при осуществлении контрольно-надзорной деятельности: теоретическое обоснование и проблемы применения // Сибирское юридическое обозрение. - 2021. - Т. 18, № 4. - C. 460-470. DOI: 10.19073/2658-7602-2021-18-4-460-470
- A thumbwheel mechanism for APOA1 activation of LCAT activity in HDL / A.L. Cooke, J. Morris, J.T. Melchior, S.E. Street, W.G. Jerome, R. Huang, A.B. Herr, L.E. Smith [et al.] // J. Lipid Res. - 2018. - Vol. 59, № 7. - P. 1244-1255. DOI: 10.1194/jlr.M085332
- Guo Q., Zhang C., Wang Y. Overexpression of apolipoprotein A-I alleviates endoplasmic reticulum stress in hepato-cytes // Lipids Health Dis. - 2017. - Vol. 16, № 1. - P. 105. DOI: 10.1186/s12944-017-0497-3
- Endogenous Human Proteins Interfering with Amyloid Formation / A.L. Gharibyan, S. Wasana Jayaweera, M. Lehmann, I. Anan, A. Olofsson // Biomolecules. - 2022. - Vol. 12, № 3. - P. 446. DOI: 10.3390/biom12030446
- ApoA-I cleaved by transthyretin has reduced ability to promote cholesterol efflux and increased amyloidogenicity / M.A. Liz, C.M. Gomes, M.J. Saraiva, M.M. Sousa // J. Lipid Res. - 2007. - Vol. 48, № 11. - P. 2385-2395. DOI: 10.1194/jlr.m700158-jlr200
- Magalhaes J., Eira J., Liz M.A. The role of transthyretin in cell biology: impact on human pathophysiology // Cell. Mol. Life Sci. - 2021. - Vol. 78, № 17-18. - P. 6105-6117. DOI: 10.1007/s00018-021-03899-3
- Kim S.Y., Park S.C. Physiological antioxidative network of the bilirubin system in aging and age-related diseases // Front. Pharmacol. - 2012. - Vol. 3. - P. 45. DOI: 10.3389/fphar.2012.00045
- Bilirubin Decreases Macrophage Cholesterol Efflux and ATP-Binding Cassette Transporter A1 Protein Expression / D. Wang, A. Tosevska, E.H. Heiß, A. Ladurner, C. Mölzer, M. Wallner, A. Bulmer, K.-H. Wagner [et al.] // J. Am. Heart Assoc. - 2017. - Vol. 6, № 5. - P. e005520. DOI: 10.1161/JAHA.117.005520


