Научное и теоретическое обоснование возможности разработки и создания персонифицированного противоопухолевого клеточного препарата на базе технологий клинической онкопротеомики
Автор: Брюховецкий Игорь Степанович, Брюховецкий Андрей Степанович
Журнал: Клиническая практика @clinpractice
Рубрика: Гипотезы
Статья в выпуске: 1 (17), 2014 года.
Бесплатный доступ
В статье представлен анализ существующих конвенциональных методологических и технологических подходов к современной противоопухолевой терапии рака и ряда злокачественных неоплазий. На основании ревизии существующих представлений клинической онкологии авторами предпринята попытка научного и теоретического обоснования инновационных подходов к созданию новаторских технологий протеомоснованной регуляторной терапии опухолей. Сформулирована оригинальная точка зрения авторов на проблему разработки и создания препаратов для персонифицированной терапии онкологических заболеваний. Предложена новая методология и альтернативный стратегический подход к лечению злокачественных опухолей, при котором основными мишенями и целями противоопухолевой терапии может стать опухолевая стволовая клетка. Показано, что протеом опухолевой стволовой клетки - наиболее устойчивая информационная структура клетки и может рассматриваться как основная мишень таргетной терапии опухолей человека.
Раковые стволовые клетки, инновационные терапии злокачественных новообразований, персонифицированная терапия рака, клиническая онкопротеомика
Короткий адрес: https://sciup.org/14338482
IDR: 14338482
Текст научной статьи Научное и теоретическое обоснование возможности разработки и создания персонифицированного противоопухолевого клеточного препарата на базе технологий клинической онкопротеомики
Проблема лечения онкологических заболеваний до настоящего времени остается крайне трудной и практически нерешаемой задачей, поэтому поиск и разработка новых противоопухолевых препаратов является очень актуальной медицинской, важной социально-значимой и экономической проблемой. Рак и другие злокачественные опухоли стоят на втором месте среди причин смертности населения земного шара, уступая первенство только сердечно-сосудистым заболеваниям. Эффективного лечения рака и злокачественных опухолей пока не найдено. Несмотря на все значительные достижения современной онкологии, выживаемость больных со злокачественными опухолями по-прежнему остается крайне низкой. По статистике, общая пятилетняя выживаемость онкологических больных составляет во Франции 57,9% [1], в США – 62% среди мужчин и 63,5% – среди женщин [2]. В России она не достигает и 43%. Медиана выживаемости онкологических пациентов с возвратными и рефрактерными злокачественными опухолями зависит от степени пролиферативности неопластического процесса и находится на уровне 1,5 - 3-х лет. Лишь при небольшом количестве отдельных возвратных форм рака выживаемость составляет более 5 лет [3].
Крайне низкие показатели эффективности терапии опухолей в России связаны с запоздалой диагностикой и лечением устаревшими противоопухолевыми препаратами. Между тем, снижение на треть смертности от онкозаболеваний в США и Европе за последние 20 лет было достигнуто именно благодаря применению инновационных препаратов, использование которых в России пока весьма ограничено [4-6]. При этом рынок противоопухолевых препаратов достаточно насыщен различными лекарственными противоопухолевыми средствами и составляет 19 млрд. долларов США. В стоимостном выражении преобладающая доля продаж (более 90%) принадлежит препаратам из стран Западной Европы. Россия занимает лишь 2% от всего объема продаж. На сегодняшний день на отечественном фармацевтическом рынке противоопухолевых средств вообще не представлены персонифицированные противораковые и антиметастатические клеточные препараты и их создание должно стать приоритетным направлением отечественных научных исследований и разработок.
Как создать инновационный противоопухо- левый персонифицированный препарат? Идти тем же путем фармакогеномики, что идут все зарубежные фармацевтические компании или попытаться найти альтернативу действующей методологии разработки и создания противоопухолевых средств? И действительно ли это должен быть фармацевтический продукт, фармако-геномный или генно-инженерный продукт?
Мы попытались сформулировать основные возможные направления работы в целях создания инновационного противоопухолевого препарата:
-
• необходимо провести фундаментальную ревизию старых, существующих и самых новых взглядов и концепций на канцерогенез опухолей и понять, как можно использовать эти знания в разработке новой терапии рака;
-
• необходимо критически оценить все известные стратегии терапии опухолей и найти их системообразующие недостатки;
-
• необходимо понять основные методологические причины неудач и ошибок в разработке современных противоопухолевых препаратов;
-
• необходимо предложить принципиально новую, инновационную, эффективную и безопасную парадигму терапии рака и других злокачественных опухолей;
-
• необходимо использовать для разработки критические технологии: геномные и постгеномные технологии создания лекарственных средств, клеточные технологии, биоинженерные технологии, нанотехнологии и т.д.;
-
• необходимо использовать в новой разработке основные достижения инновационных направлений современной медицины: молекулярной медицины, регенеративной медицины и персонифицированной медицины;
Итак, давайте попробуем, опираясь на предложенную ревизионную тактику, новые достижения многомерной биологии, постгеномные методологические подходы к живым системам, сформулировать альтернативную стратегию лечения злокачественных опухолей и посмотрим, что она может дать нам для разработки и создания биотехнологий инновационного персонифицированного противоопухолевого препарата.
Начнем свой ревизионный подход с критической оценки современных концепций канцерогенеза опухолей. Допустим apriore, что во всех существующих в настоящее время концепциях канцерогенеза рака имеется определенное рациональное зерно и почти все они в определенной мере были современны, правомерны и отражали состояние науки своего времени, существовавшего уровня знаний и промышленных технологий. Как же могло так получиться, что все теории практически ничего не дали для разработки эффективного противоопухолевого средства? Почему они, увеличивая объем знаний о раке, не взаимодополня-ют, а исключают и отрицают друг друга ? Ответ достаточно тривиален. Во-первых, это связано с тем, что в основу их был положен системный подход к исследованию, как методология науки 20 века [7].
Системный подход к анализу результатов в онкологии не позволяет структурировать и «уложить» весь информационный континуум знаний о раке в линейные и нелинейные системообразующие логические графы системного подхода, так как это многопараметрический процесс в который вовлечены все информационные уровни живой системы: межорганизменный, организменный, органный, тканевой, клеточный, субклеточный, белковый, молекулярный, атомарный, уровень элементарных частиц и резонансно-волновой уровень. Поэтому оценка системы с позиций одного или двух информационных уровней не позволяла дать максимальную объективность происходящих глубинных информационных процессов и корректировать их. Например, мутационная теория рассматривает проблему рака только на уровне нарушений ДНК, т.е. на молекулярном и атомарном уровне, а теория анеуплоидий оценивает все происходящее в раковой клетке с позиций клеточного и субклеточного уровня, сводя все онкоспецифические признаки к неопластическим изменениям в хромосомах и, соответственно, специфическим изменения кариотипа опухолевых клеток (ОК). Все изменения и нарушения сигналинга, описываемые большинством исследователей рака, соответствуют молекулярному уровню, а появление и динамика возникновения дефектных онкобелков лежит на другом – белковом уровне и они абсолютно не соотносятся друг с другом и т.д.
Во-вторых, рак – это эндогенный прогредиентный процесс нарушения мультилинейных информационных взаимоотношений, в который вовлекаются не отдельные клеточные компоненты, а формируются сбои межсистемных отношений основных структурных элементов различных информационных уровней, а не только отношения функционирования опреде- ленной патологической клеточной системы. С этих позиций, получается, что никаких противоречий в существующих концепциях возникновения и развития рака нет. Все исследователи видели и описывали определенные экспериментальные научные факты и закономерности только на разных информационных уровнях живой системы и наша ближайшая задача – сложить эту мозаику из разрозненных научных фактов в определенную информационную структуру возникновения и развития онкологического заболевания, опираясь на основные законы и достижения современной информа-циологии. Поэтому окончательная концепция возникновения и развития рака будет создана не путем умозаключений или установленных уникальных научных фактов отдельных гениальных или очень талантливых ученых, а путем систематизации и интеграции уже накопленных знаний, путем соединения и интеграции их с использованием технологий современной биоинформатики. Но для нас уже сейчас должно быть, очевидно, что нельзя отрицать или взаимоисключать любые научные факты и закономерности, описанные в большинстве теорий о канцерогенезе, а надо пытаться искать взаимоотношения и взаимосвязи между ними с позиций информационного подхода.
Следующий аспект проблемы – неэффективность терапии опухолей – также требует ревизии и анализа. Эволюционные и революционные стратегии терапии опухолей в современной онкологии используют самые разнообразные методологические походы, начиная от эмпирической медицины (травы, кровопускания, яды и т.д.) до применения самых современных высокотехнологичных инновационных методик лечения рака.
В настоящее время выделяется ряд научнообоснованных лечебных стратегий современной противоопухолевой терапии:
-
1) ампутационная стратегия (удаление части или всего органа или органокомплекса, пораженного опухолью),
-
2) гомеопатическая стратегия (лечение подобного подобным),
-
3) фармакологическая химиотерапевтическая стратегия (противоопухолевые антибиотики и химиопрепараты, противогрибковая терапия),
-
4) иммунотерапевтическая стратегия (иммуносупрессия и иммунокоррекция),
-
5) вакцинационная стратегия (создание противоопухолевых вакцин),
-
6) трансплантационная стратегия (пересадка органа и ткани взамен патологического, создание и имплантация искусственных органов и тканей, трансплантация костного мозга),
-
7) реконструктивно-восстановительная стратегия (заместительная пластическая микрохирургия, эндовидео- и рентгенохирургия, тканевая инженерия, имплантируемые биополимеры и биокомпозиты),
-
8) фармакологическая молекулярная стратегия (генная, белковая и пептидная инженерия, терапия ткане-специфическими белками и моноклональными антителами, факторами роста и нейротрофинами),
-
9) индукционная стратегия (волновая терапия, биорезонансная терапия, гипертермия, наномедицина, рентгенотерапия, фотодинамика, бор-нейтрон-захватная терапия, радиотерапия и радиохирургия, электростимуляция и магнитостимуляция),
-
10) таргетная стратегия и направленный транспорт лекарственных веществ (воздействие на цели и мишени в патологической клетке молекулами сигнальных белков, РНК, ДНК, иРНК, антителами, генно-инженерными конструкциями, индуцированными плюрипотентными стволовыми клетками и внутриклеточный трансфер фармакологических препаратов) и другие.
Общим, объединяющим и системообразующим началом и сущностью всех этих ранее известных конвенциональных и ультрасовременных методов и стратегий терапии опухолей является настойчивое стремление врачей любым путем уничтожить в организме пациента все опухолевые клетки: отравить их (цитотоксические методы), разрушить компартаменты ОК и приостановить их рост и развитие (цитостатические методы), удалить ОК путем хирургической резекции клеточной массы опухоли (циторедукционные методы). Однако пока все инновационные терапевтические и хирургические подходы, направленные на уничтожение ОК, не смогли обеспечить нужную эффективность лечения и достаточную выживаемость большинства онкологических пациентов. Несмотря на постоянный поиск и обнаружение новых мишеней и целей для уничтожения ОК путем противоопухолевого лечения, все еще не получено убедительных результатов от таргетной (целенаправленной) терапии, на которую возлагались большие надежды в онкологии начала этого века. Мы полагаем, что это связано с тем, что в ОК нет постоянных или универсальных целей и мишеней для терапии. Все мишени динамичные, транзиторные и связаны со временем, локализацией и функциональным состояние возникших нарушений в живой системе. Различные этиопатогенетичес-кие факторы и агрессивные факторы среды трансформируют ее компартменты и их функции очень индивидуально и разнообразно. В ОК формируются уникальные механизмы повреждения и мутаций ДНК, которые создают специфические морфофункциональные комбинации эпигенетических и генетических изменений внутриклеточных и мембранных белков. Даже при всей внешней схожести клинических проявлений, одинаковой топической локализации процесса в органе и однородности гистоморфологических изменений в клетках, диагностируемых визуально-микроскопически, сегодня очевидно, что на уровне белковой инфраструктуры клетки (генома, тран-скриптома, протеома, метаболома и секретома) эти клетки значительно отличаются друг от друга, и возможности их регуляции полностью зависят от этих эпигенетических и собственно генетических внутриклеточных трансформаций и метаморфоза молекулярной мимикрии их генома и протеома. Соответственно, терапевтическая коррекция и регуляция поврежденных клеток требует строго индивидуального и персонифицированного подхода с учетом всего спектра возникших многоуровневых белковых нарушений. К сожалению, даже современная таргетная терапия всегда будет «запаздывать» за адаптационными процессами внутриклеточных молекулярных перестроек белков, т.к. она направлена на постоянно изменяющиеся во времени и месте цели и мишени в ОК, которые модифицируются на каждом новом этапе приспособления клетки к изменяющимся агрессивным условиям среды, микроокружения и лечения. Это эволюционное адаптационное преимущество соматической клетки крайне необходимо для ее выживания и оно будет реализовано соматической клеткой даже при наличии необратимых мутаций ее генома, извращения протеома и необратимого нарушения секретома и метаболома. Низкая эффективность терапии рака и опухолей путем уничтожения ОК является закономерным и эволюционно детерминированным исходом данного методологического подхода к лечению. Следовательно, крайне низкая эффективность тера- пии опухолей не является негативным качеством опухолевой ткани, а свидетельствует только о том, что в организме эукариот имеется высокоэффективный, надежный и закономерный способ выживания соматических клеток в неблагоприятных условиях и стрессе. Это великое эволюционное приобретение и завоевание биологии развития человека и животных. Поэтому, несмотря на все наши знания молекулярной внутриклеточной машинерии и наше старание исправить эти нарушения, мы со своей целенаправленной терапией по мишеням и целям всегда будем опаздывать в соревновании с природой в постоянной борьбе с ее прогрессивными эволюционными системными механизмами. Поэтому парадигма противоопухолевого лечения, направленного только на уничтожение ОК не состоятельна и нуждается в замене. И альтернатива данной парадигме уже существует, и мы попытаемся ее изложить в свете новой концепции происхождения рака.
Конвенциональная теория канцерогенеза , основанная на происхождении рака (опухоли) из одной трансформированной дифференцированной клетки и дальнейшего опухолевого роста в результате ее клональной селекции, оказалась несостоятельной [8-10]. На смену ей пришла инновационная теория канцерогенеза как формы видообразования [11]. Но, помимо инновационной теории, еще нужен новый технологический подход для ее реализации. Нужна была не только принципиально новая теоретическая платформа, но и соответствующий инструментарий, основанный на другой методологической платформе возникновения и развития рака. Мы считаем, что этим теоретическим обоснованием могут стать современные научные представления о стволовой клетке (СК) человека вообще и концепции раковой СК (РСК).
В последние годы знания о природе СК бурно развивались, благодаря накоплению большого количества новых знаний о биологии эмбриональных СК и соматических, или регионарных взрослых СК. Фундаментальное представление о канцерогенезе рака и других опухолей в онкологии начала 2-го десятилетия 21 века кардинально изменилось именно с появлением новых научных фактов о роли СК млекопитающих в эмбриогенезе и онтогенезе человека. Сегодня взрослые регионарные СК обнаружены во всех органах человека. Рак и злокачественные опухоли различной локализации рассматриваются учеными как генети- ческое заболевание ядра взрослой соматической стволовой клетки.
Сформулирована и общепризнана на мировом уровне концепция раковых стволовых клеток [12], согласно которой в основе молекулярных событий и клеточных процессов, определяющих инициацию и развитие рака и опухолей, лежат явления, связанные с возникновением и существованием раковых стволовых клеток (РСК). Рак (злокачественная опухоль) развивается из РСК, которые в ней постоянно присутствуют. Возникают РСК в результате накопления мутаций во взрослых соматических СК [13].
Концепция РСК сразу же стала основой инновационной стратегии уничтожения РСК в опухоли и уже даже отмечены первые успехи в этом новом направлении противоопухолевой терапии (табл.1). Демонстрируя возможности уничтожения РСК, ученые пришли к печальному выводу, что РСК способна выжить даже в самых тяжелых и крайне неблагоприятных условиях. На каждую новую агрессию РСК и ОК реагируют формированием лекарственной резистентности. Под этим термином понимается очень высокая устойчивость ОК и РСК к ее уничтожению лекарственными химиопрепара-тами[14].
На самом деле, степень лекарственной резистентности РСК и ОК демонстрирует лишь уровень эволюционной приспособляемости соматической клетки к выживанию и степени адаптируемости ОК и РСК в условиях стресса и неблагоприятных воздействий.
Возникает резонный вопрос: а действительно ли нужно уничтожать все ОК и РСК в организме онкологического пациента и не повредим ли мы, уничтожая РСК, нормальные клетки и здоровые СК организма пациента? Весь опыт современной онкологии свидетельствует о том, что методологический подход, направленный на уничтожение клеток, пока еще не принес ожидаемых результатов. По-видимому, не возможно, да и не нужно уничтожать все ОК и РСК! ОК и РСК имеют огромный адаптационный потенциал и уникальные ресурсы для приспособляемости, как и любая соматическая клетка организма эукариот. Следует учитывать, что СК вообще, и по-видимому, и РСК в частности, – это универсальная форма выживания соматических клеточных систем у млекопитающих, аналогичная «споре» растений, и они способны выжить даже в самых экстре-
Таблица
Противоопухолевые фармакологические средства, уничтожающие раковые стволовые клетки опухоли
Поэтому химиотерапия и лучевая терапия на СК и РСК практически не действуют, но при этом они могут и приводят к повреждению и необратимым мутациям нормальных регионарных СК здоровых дифференцированных клеток у онкологического пациента.
У здорового человека в норме существует до 500 тысяч раковых клеток (10 5 ), у больного с предраком их число доходит до 1 миллиарда
(<10 9 ), а у больного раком их больше 1 миллиарда [15]. Поэтому даже у здорового человека «по определению» и в ограниченном количестве есть РСК, но они находятся под жестким регуляторным контролем естественных противоопухолевых систем организма человека. Проблема рака, в этом аспекте, представляется отчасти как проблема потери контроля над физиологической популяцией раковых клеток, их неуправляемого роста и неконтролируемого увеличения количества РСК и их потомков ОК, способных к неограниченной пролиферации. При этом, неуправляемыми ОК и РСК становятся только для обычных рост-регули-рующих механизмов организма, но остаются чувствительными к сверхсильным регуляторным воздействиям [16].
Быть может, не стоит в результате противоопухолевого лечения пытаться уничтожать все ОК и РСК, а необходимо попытаться направить все усилия на регуляцию и обеспечение контроля роста и количества ОК и РСК в организме, а также – на управление их эффекторными функциями. Быть может человек способен жить с определенным количеством РСК и ОК (до 1 или 1.5 триллиона клеток), если их специфичное функционирование, пролиферативный потенциал и эффекторные функции будут жестко регламентированы и контролированы современными регуляторными терапевтическими средствами. Если да, то как это скажется на качестве жизни и выживаемости пациентов с раком? По-видимому, если мы научимся управлять пролиферативным потенциалом и количеством ОК и РСК, то мы сможем перевести онкологическое заболевание из острого и фатального в курабельное и хроническое и значительно увеличим выживаемость этого контингента пациентов.
Можно ли, непосредственно воздействуя на ОК или РСК, управлять ими? Скорее всего, обычными фармакологическими способами и терапевтическими методами это невозможно, так как это генетически измененные, мутировавшие соматические клетки и они практически не реагируют на стандартные сигналы межклеточного взаимодействия. Они малочувствительны к индукции апоптоза, обладают не ограниченной способностью к пролиферации и способностью индуцировать ангиогенез [17]. Но поскольку абсолютно точно установлено, что ОК и РСК способны ответить на сверхсильные направленные сигнальные межклеточные воздействия, значит есть шанс их регуляции здоровыми и хорошо управляемыми клеточными системами и системами прогениторных и СК [18-22]. Этот известный научный факт открывает реальные возможности для активной биорегуляции и адекватного контроля этих патологических клеток in vivo в условиях злокачественного онкологического процесса.
Нужна принципиально новая парадигма терапии рака и злокачественных опухолей!!! И она была нами предложена как циторегуля-торная терапия (ЦРТ) опухолей.
В предыдущих публикациях в русско-язычной научной литературе, посвященных ЦРТ опухолей, мы подробно изложили ее содержание, а здесь только объясним ее суть. Остановимся на том, что она дает клиницисту-онкологу и какие основные принципы положены в новую парадигму терапии опухолей [23].
Современная парадигма лечения рака и злокачественных опухолей, применяемая в клинике, предполагает уничтожение клеток опухоли и РСК любым путем для полного излечения и выздоровления онкологического пациента.
Новая парадигма лечения рака и злокачественных опухолей может звучать следующим образом: контроль допустимого количества, регуляция и компенсация функционального состояния опухолевых клеток (ОК) и РСК в организме с целью перевода острого смертельного онкопроцесса в хронический и не смертельный, повышения выживаемости, продолжительности и качества жизни онкологических пациентов.
Принципы, положенные нами в основу ци-торегуляторной терапии:
-
• Принцип сохранения времени и жизни: необходимо перевести острый, скоротечный, неуправляемый и смертельный онкологический процесс у пациента в хроническое, длительное, не смертельное и контролируемое врачами заболевание.
-
• Принцип реставрации: нельзя уничтожать ткань опухоли и близлежащие с ней ткани в пораженном органе, а необходимо ее реставрировать клеточными системами и биополимерными матриксами, разрушая информационную структуру опухолевой ткани.
-
• Принцип корректности управления: управлять нужно не направленным транспортом лекарств или мутантными раковыми клетками и РСК, а только биологическими объектами,
поддающимися управлению, т.е. здоровыми стволовыми и прогениторными клетками пациента.
-
• Принцип персонификации – индивидуализация лечения должна осуществляться с учетом транскриптомно-протеомных характеристик РСК опухолей и здоровых СК этого пациента.
-
• Принцип компенсации: необходимо компенсировать нарушения метаболизма РСК и неустойчивость генома опухолевых клеток за счет декомпенсации информационной структуры протеома здоровых СК пациента направленным воздействием на ключевые белки их протеома. При здоровом геноме терапевтическая СК будет восстанавливать равновесие своего гомеостаза (делиться, выбрасывать излишние белки, «вытягивать» белки из клеток микроокружения), т.е. компенсироваться и оказывать требуемое таргетное терапевтическое регуляторное воздействие на РСК и опухолевые клетки.
Целью циторегуляторной терапии является осуществление управляющего эпигенетического регуляторного воздействия на протеом РСК для формирования декомпенсации устойчивости ее генома и транскриптома и запуска её саногенетических управляющих механизмов. Есть и другой путь: наоборот, достичь компенсации и устойчивости измененного мутантного генома ОК различной степени дифференцировки.
Существует, соответственно, два пути регуляторного воздействия на РСК и ОК. Первое – это мощное сверхсильное управляющее воздействие на протеом данной клетки, обеспечивающее информационное воздействие на геном ОК или РКС через изменение их метаболизма и внутриклеточного сигналинга РСК. Второй путь – поиск «ахиллесовой пяты» или «слабого места» в информационной структуре ОК или РСК, воздействие на которое позволит обычным сигнальным путем добиться стабилизации метаболизма и компенсации устойчивости генома ОК или декомпенсации устойчивости его генома в РСК.
Почему мы заговорили о таких клинических понятиях как «компенсация» и «декомпенсация» применительно к биологическому понятию «геном». Ну, наверное, потому, что для врача-клинициста наличие органического дефекта в живой системе не является прямым подтверждением его функциональной несостоятельности. Мы склонны проводить аналогии между функционированием живых систем и делать определенные выводы. Полагаем, что закономерности функционирования такой живой системы как «эукариотическая клетка» и живой системы «организм эукариот», состоящей из огромного числа подобных клеток, имеют много общего, и общие принципы регуляции, используемые в одной системе, могут вполне сработать и быть правомерными в другой живой системе. Для врачей-клиницистов существует очень ёмкое клиническое понятие динамических сдвигов функционального состояния живой системы: компенсация и декомпенсация. Это всего лишь иллюстрация уровня компенсации функций в этой живой системе, несмотря на ее структурно-морфологическую изменённость. Урегулирование причины декомпенсации в живой системе ведет к восстановлению её функции, хотя морфологический дефект никуда не ушел. Примером подобной живой системы может служить любой пожилой человек с тяжелым стенозирующим атеросклерозом сосудов, сердца и головного мозга поступающий в стационар для лечения острого нарушения мозгового кровообращения. Очевидно, что в результате самого современного лечения мы не способны устранить морфогенетический дефект сосудов и тканей в виде атеросклеротических бляшек и рубцовых изменений, возникщих в них в результате ишемии или гипоксии сосудистого генеза. При различных нарушениях кровообращения (транзитор-ных ишемических атаках, церебро-кардиаль-ных кризах, инсультах, инфарктах ит.д.) возникших после стресса, волнений, физических и положительных эмоциональных нагрузок у данного человека развиваются различные дисциркуляторные явления в различных органах (дисциркуляторная энцефалопатия, стенокардия, дисциркуляторный ангиоспазм сосудов или тромбоз брызжейки и кишки, преходящее нарушение мозгового кровообращения, инсульты и другие). Небольшая сосудистая терапия, направленная на расширение сосудов и борьбу с ангиоспазмом, введение поляризующей смеси из электролитов и препаратов, повышающих энергетику ткани/органа (АТФ, кокарбоксилаза, церебролизи, ноотропы ит.д.) обеспечивает стабилизацию региональной гемодинамики, восстановление циркулирующего объема крови, восстановление электролитного баланса крови, позволяет скомпенсировать состояние пациента, справиться с грубей- шими нарушениями гемодинамики и выписать его в удовлетворительном состоянии из стационара домой, где больной будет себя еще долго и хорошо чувствовать. Если этого не сделать, декомпенсация гемодинамики приведет к летальному исходу [24].
Но ведь справедливости ради надо признать, что мы не излечили больного от его недуга, не устранили у него органический дефект, не удалили его атеросклеротические бляшки, а добились всего лишь клинического, а точнее – функционального восстановления его общего состояния путем расширения сосудов в месте ангиоспазма, улучшения питания и уменьшения гипоксии пострадавшего органа в зоне дис-циркуляции и восстановления метаболизма пострадавших клеток. Нашей главной целью было не вылечить пациента, а не дать болезни (дисциркуляции) распространиться на весь организм и запустить неуправляемые процессы сердечно-сосудистой недостаточности в других органах и системах, развития дыхательной, по-лиорганной недостаточности, полигландуляр-ной недостаточности и т.д. Аналогично мы рассматриваем циторегуляторный подход в мутантной РКС и ОК – мы не собираемся устранять органические дефекты мутаций в ДНК, РНК и белках в РСК: они уже есть и их нельзя убрать «по определению», так как клетка подверглась мутациям и анеуплоидиям вследствие воздействия на её геном различных канцерогенов. Соматической неопластической РСК и ОК нужна помощь, и мы ставим задачу компенсировать геном ОК или декомпенсировать метаболизм и устойчивость генома РСК путем направленного воздействия на её транскриптом или воздействие на экспрессию ее генов.
На самом деле, на уровне клеточной биологии при терапии рака и опухолей мы столкнулись с задачей регуляции и управления клеточных систем, которую пока не знаем как решить. Для технической управленческой задачи подобного уровня уже давно были бы найдены оптимальные решения. Так, в вычислительной математике, при решении подобной задачи опираются на теорию управления систем, в технике – на теорию колебаний и теорию динамических систем, в кораблестроении – на теорию устойчивости, в транспортных задачах – это теория авторулевого [25]. Главный постулат для всех этих управляющих подходов изложен в междисциплинарной научной математической теории управления систем и формули- руется следующим образом: управляющим во взаимоотношениях различных систем является самая медленная фаза одного из процессов этих взаимодействующих систем [26].
Для наглядности процесса взаимодействия различных систем математики и технологи любят иллюстрировать такую систему управления на примере колонны машин, в которой двигается наиболее быстроходная гоночная машина, несколько грузовиков, автобус и трактор. Именно скорость самого медленно движущегося транспортного средства – трактора – является управляющей (системообразующей) для того, что бы все эти средства передвижения были в единой системной организации – движущейся колонне. Как видите, достаточно сложные системные взаимоотношения управляются по понятному математическому принципу.
Если экстраполировать известные достижения точных наук на онкологическую задачу по одному параметру управления – самой медленной управляющей фазе, то в случае злокачественной опухоли (рака) мы также имеем три клеточные системы, непосредственно взаимодействующие между собой (рис. 1) в организме онкологического пациента. Во-первых, это иммунная система пациента, все клетки которой берут начало от гемопоэтической СК (ГСК), и все потомки ГСК, специализированные дифференцированные клетки выполняют основные функции иммунитета организма и системной противомикробной и противоопухолевой защиты (Т-киллеры, Т-супрессоры, Т-хелперы, В-лейкоциты и т.д.). Второй противоопухолевой клеточной системой является система региональных взрослых СК органа, пораженного опухолью, которая также выполняет функции местной (локальной) противоопухолевой защиты. Компоненты этой системы, орган-специфи-ческие клетки различной степени дифференцировки, берущие свое начало от регионарной СК (нейральной, мезенхимальной, овальной печеночной клетки и т.д.). Третья клеточная система – это собственно сама система клеток опухоли, берущих свое начало от РСК, и все клеточные популяции опухоли различной степени дифференцированности являются потомками этой РСК. Взаимоотношения между этими тремя системами и определяют клеточное равновесие в ткани в норме и при патологии [27].
В условиях здоровья ткани, системное клеточное равновесие в ней, на уровне всего организма, обеспечивается нормальными ГСК, так
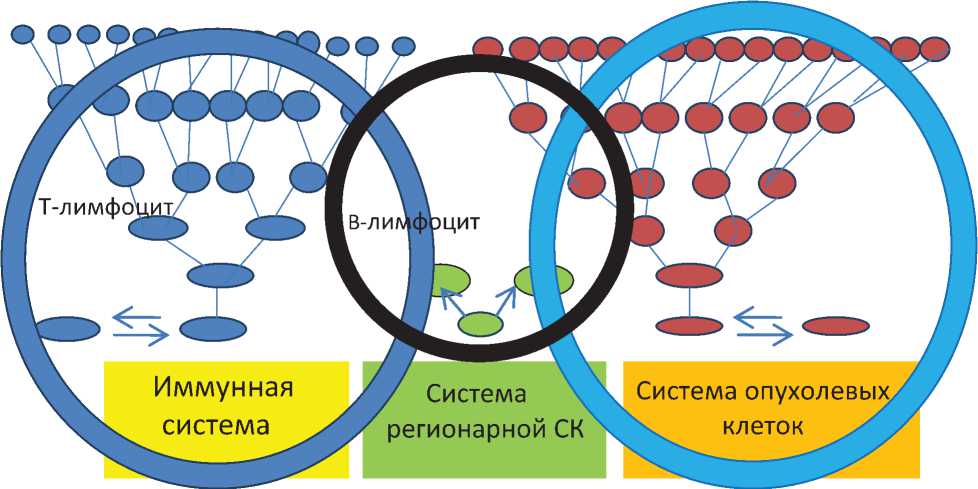
Рис. 1. Системный подход к анализу пациента с онкологическим заболеванием (объяснения в тексте).
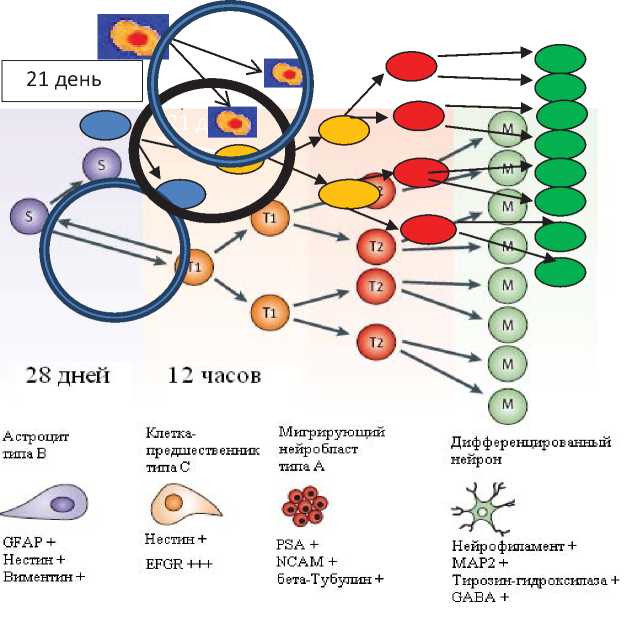
как они обладают самым медленным темпом пролиферации среди всех здоровых клеток организма. Математическое моделирование оценило скорость деления гемопоэтических стволовых клеток, как одно деление за 1-2 года, а в промежутке между делениями ГСК пребывают в состоянии пролиферативного покоя [28]. В своей аналитической работе о роли РСК в опухоли Н.Н. Белушкина и Ю.Н. Хомяков обобщили разные научные данные и показали, что в экспериментальных условиях с использованием бромдиоксиуридина длительность клеточного цикла ГСК мелких грызунов примерно 30 дней [29]. Ежедневно пролиферирует только 8 % клеточной популяции. Исследование популяционной кинетики ГСК у кошек показало, что ГСК вступают в пролиферацию 1 раз в 10 недель. У высших приматов частота пула стволовых клеток оценивается примерно 1 раз в год. При этом первая фаза пролиферации от ГСК до 1-го предшественника составляет 21 день. Поэтому в здоровом организме ГСК являются управляющими клеточными системами и их потомки выполняют фундаментальные регуляторные функции (регуляторные клетки иммунной системы). Аналогичное время (2021 день) формирования первого предшественника у взрослых нейральных стволовых клеток в системе нейральных СК [30]. А время формирования первого предшественника, например при глиобластоме, от начала пролиферации
РСК составляет 28 дней (рис. 2). И хотя общее время популяционной кинетики глиобластом-ной опухоли значительно меньше (60 дней), чем у ГСК, очевидно, что РСК глиомной опухоли доминируют в новых системных информационных межклеточных отношениях.
Поэтому, экстраполируя результаты математической теории систем с системными отношениями между иммунной системой, системой глиомных клеток злокачественной опухоли и системой нейральных СК на примере злокачественной опухоли мозга становится очевидным универсальный принцип – управляющим становится опухолевый процесс, а все другие клеточные системы становятся к нему в зависимые, управляемые им подсистемы. Это универсальный системный механизм доминирования опухолевых клеток над клетками других систем организма. Этим объясняют «элитарность» и «особенность» ОК среди всех 220 типов клеток организма, уже давно подмеченную онкологами, а также и то, что все другие клетки способствуют развитию опухоли и ее метастазированию [31]. Например известно, что при метастазировании опухоли собственные фибробласты пациента прокладывают дорогу ОК и РСК в неповрежденных тканях органов к новым зонам метастазирования. Однако выражаясь языком математики, при наличии злокачественной опухоли у пациента РСК и ее потомки «по определению» не могут быть уничтоже-
PSA +
21 день
28 дней
Астроцит типа В
GFAP +
Нестин +
Виментин +
Нестин +
Клетка- пр е дше с те: енник типа С
Диф ф еренцир о в анный нейрон
Нейро филамент +
МАР2 +
Тир озин- гидр оксипаз а +
GABA +
12 часов
Мигрирующий нейробласт типа А
NCAM + б ета-Т убупин +

Гемопоэтическая стволовая клетка
Раковая стволовая клетка
Предшественники 1-го поколения


Предшественники
2 поколения
Дифференцированные клетки иммунной системы
Нейральная СК
Рис. 2. Системные взаимоотношения иммунной системы крысы с системой опухолевых клеток глиомы С6 и системой нейральных стволовых и прогенеторных клеток ( объяснения в тексте).
ны имеющимися у него традиционными и стандартными системными и локальными механизмами противоопухолевой защиты организма пациента. Все эти противоопухолевые системы при наличии злокачественной опухоли, в соответствии с теорией управления систем, просто перестают работать и находятся в прямой зависимости от управляющего онкологического процесса. Более того, собственные стволовые клетки, зачастую, сами способствуют прогрессированию онкологического процесса. Этот факт уже давно нашел свое экспериментальное подтверждения в целом ряде научных публикаций. Поэтому применение собственных регионарных СК и ГСК недостаточно эффективно при регуляции количества и функций ОК и РСК, хотя они и способны оказывать ингибирующее воздействие на рост и пролиферацию злокачественной опухоли. По-видимому, в ряде случаев у ГСК, МСК или НСК иногда имеется определенный информационный канал (так называемая «ахиллесова пята») для минимального воздействия на РСК и ОК, и его надо идентифицировать и использовать в терапевтических регуляторных стратегиях в полном объеме.
Почему стала возможна такая реорганизация системных взаимоотношений в организме человека и млекопитающих с появлением злокачественной опухоли? Ведь опухоль уничтожает организм человека и животных. По-види-мому, онкологические заболевания – это классический эволюционный инструмент естественного отбора. Эти процессы становятся возможными в связи с тем, что развитие опухоли является многостадийным процессом, связанным с появлением и длительным накоплением генетических изменений (мутаций) в долгоживущих СК, приводящих к трансформации нормальной СК в РСК. Опухолевая модификация генома СК приводит к изменению экспрессии его генов, нестабильности генома и нарушению внутриклеточного и межклеточного сигналин-га РСК и ее потомков ОК и, соответственно, к фиксации в генетической памяти хромосом клетки этих мутаций. С позиций эволюции такой организм не может и не должен иметь много шансов для продолжения жизни в экстремальных природных условиях, в которых долгие годы находился человек и животные, пытаясь выжить. Однако, с позиций современной медицины и современного общества, человеку не нужно постоянно находиться в условиях природного экстрима и недостатка воды и питания. Поэтому наличие мутаций в его генах, приводящее к физическим дефектам и недостаткам, уже не является критическим и витальным параметром для его выживания и существования. Современное общество готово взять на себя заботу об этих людях, гарантировать их выживание и улучшить качество их жизни. Дело осталось за малым – понять, как это сделать. Поэтому мы предлагаем рассмотреть несколько путей преодоления этих противоречий с учетом самых последних достижений современной научной мысли и инновационного программно-аппаратурного обеспечения.
По-видимому, первый путь решения этой проблемы учеными уже в основном намечен. Это искусственное перепрограммирование соматических клеток, обеспечивающее восстановление естественных и функциональных системных отношений между всеми клеточными системами организма онкологического пациента. Как утверждают Н.Н. Белушкина, в подобном биохимическом процессе ключевую роль могут играть ингибиторы и активаторы КЦ и дифференцировки [29].
С позиций теории управления систем целью перепрограммирования собственных СК должно быть строго индивидуальное (персонифицированное) переформатирование в СК КЦ (в сторону увеличения) сроков образования их первых и вторых предшественников. Это теоретически возможно за счет целенаправленного персонифицированного биохимического воздействия и (или) направленных биофизических воздействий на геном здоровой СК. Персонифицированное перепрограммирование СК должно быть проведено с учетом ряда важных клеточных параметров: а) времени формирования первых и вторых предшественников ГСК в норме, в региональных СК пораженного опухолью органа и конкретной опухоли или опухолей при наличии 2-х и более новообразований, б) скорости пролиферативных процессов во всех трех взаимодействующих клеточных системах, в) изменение экспрессии генов СК при перепрограмировании должно быть в пределах физиологической нормы и оно не должно сопровождаться модифицикацией или трансформацией генома этих клеток. Моделирование взаимоотношений этих параметров позволит оценить эффективность проведенного перепрограммирования.
На современном уровне развития науки, искусственное перепрограммирование или, точнее, перепрограммирование генома соматических клеток может быть осуществлено только тремя известными принципиальными путями:
-
• Эпигенетическое перепрограммирование генома соматической клетки транскрипционными факторами цитоплазмы ооцита: перепрограммирование соматической дифференцированной клетки осуществляется путем перевода генома клетки на путь эмбрионального развития. Механизм репрограммирования: трансфер ядра соматической клетки в донорский ооцит без ядра (яйцеклетку). Факторы цитоплазмы и органел ооцита репрограммируют весь геном в направлении эмбриогенеза. Цель перепрограммирования: получение большого количества аутологичных эмбриональных стволовых клеток [32-34].
-
• Эндогенетическое перепрограммирование путем встраивания новых генов: перепрограммирование генома дифференцированных соматических клеток в плюрипотентные стволовые клетки с целью их последующей дифференцировки в клетки с необхомой функцией. Механизм перепрограммирования: доставка в клетку (трансфекция, электропорация и т.д.) генноинженерной конструкции, состоящей из генов 2-4 транскрипционных факторов и вектора (плазмиды, вируса, невирусной биоконструкции и др.). Репрограммированию подвергается не весь геном, а отдельные хромосомы. Цель данного репрограммирования – создание большого количества клеток со специализированными свойствами [35-37].
-
• Эндогенетическое и эпигенетическое перепрограммирование путем создания клеточных гибридов: перепрограммирование генома осуществляется слиянием эмбриональных СК (ЭСК) с коммитированным или дифференцированными клетками. Механизм перепрограммирования: создание клеточных гибридов, хи-меризация и слияние ЭСК с дифференцированными клетками и создание эмбриональных гибридных клеток. Репрограммированию под-вергатся как весь геном ЭСК, так и индивидуальные хромосомы, благодаря сегрегации (потере) хромосом соматического партнера. Цель перепрограммирования: создание большого количества эмбриональных гибридных стволовых клеток [38, 39].
Однако все известные в настоящий момент технологии перепрограммирования генома со- матических клеток описаны и имеют один большой недостаток, который перечеркивает все их достоинства. Во всех разработанных технологиях перепрограммирования необратимо модифицируется геном соматической клетки и поэтому имеется высокий риск появления новых ранее неизвестных генетических болезней, возможность неконтролируемого изменения генофонда населения высокоразвитых индустриальных стран, что может привести к необратимым нарушениям витальных функций пациентов. По-видимому, еще очень долго эти технологии перепрограммирования генома соматических клеток не найдут своей реализации в клинической практике [40].
Если провести аналогии существующих методологических подходов к клеточному перепрограммированию в молекулярной биологии с современными техническими подходами в информатике, то очевидно, что эти действия (существующие пути перепрограммирования генома) крайне грубы, несоразмерны и неадекватны степени повреждения и причинному фактору. Если у Вас «сбоит» и не работает персональный компьютер, то это не значит, что сразу же нужно взять паяльник и начать перепаивать материнскую плату или припаивать дополнительные микросхемы, даже если вы знаете, что они могут быть очень полезны. Есть очень высокий риск нарушения системности работы компьютера и нарушения архитектуры обработки информации. Любой программист или просто интересующийся компьютерами человек вам скажет, что быть может проблема сбоя в работе компьютера не в аппаратной части, а в нарушениях и сбоях в системном программном обеспечении или работе локальной подпрограммы. Иногда бывает достаточно перезагрузить компьютер, переформатировать флэш-карту или переустановить программное обеспечение и неполадки устраняются сами собой. По-видимому, и при перепрограммировании соматической клетки так же, как в технике, не нужно пытаться сразу решать проблему так радикально и категорично, пытаясь осуществить ее путем частичной или полной замены генов или встраиванием генно-инженерных конструкций в существующий геном соматической клетки. Не имея полного и четкого представления о реальном функционировании генома, протеома, секретома и метаболома СК, мы можем необратимо нарушить эволюционное равновесие и сбалансированность функци- ональных элементов в клетке, что приведет к неустойчивости ее генома и возникновению неизвестных ранее заболеваний. Целесообразно попытаться манипулировать уже известными и четко описанными программами клеточного цикла (КЦ) с их хорошо прогнозируемыми эффекторными функциями, программами клеточного сигналинга и эпигенетической регуляции, не допуская любых модификаций генома в перепрограммируемой соматической клетке. Необходимо жестко ограничить объем манипуляций с перепрограммируемой клеткой до уровня изменения экспрессии генов в пределах их физиологических концентраций экспрессирующих специфичных белков. То есть необходимо попытаться научиться управлять клеточными программами на эпигенетическом уровне, не допуская любой, даже самой незначительной трансформации генома СК и декомпенсации и неустойчивости его функционирования в норме.
Второй, уже известный подход к изменению функционального и морфологического состояния соматической клетки (в том числе и стволовой) – это эпигенетическое ремоделирование фенотипа соматических клеток путем химической индукции. К примеру, ремодедирова-ние стромальных клеток костного мозга осуществляется путем культивирования их в специальных условиях для получения нейральных клеток, хондроцитов, остеобластов и т.д. Цель ремоделирования: путем химической индукции осуществить пептидную противоопухолевую реставрацию клеточного фенотипа соматической клетки без модификации ее генома.
Иллюстрацией практической реализации подобного подхода к эпигенетическому ремоделированию стволовых клеток эукариот могут быть работы исследовательской группы S.Yamaguchi et al., которые показали, что путем специфичной химической обработки, направленной в сторону нейральной дифференцировки in vitro в стромальных стволовых клетках костного мозга, им удалось существенно изменить профиль генной экспрессии СК с увеличением экспрессии 5-ти нейрон-ассоциирован-ных генов, значительно снизить экспрессию генов, связанных с формированием мезенхимальных клеток, что было подтверждено на уровне микроматричного анализа и ПЦР-РВ. Более того, микроматричный анализ и ПЦР-РВ показал, что СККМ экспрессируют белки определенных факторов роста, включая NGF-b и BDNF, указывая их терапевтическую роль в защите повреждений центральной нервной системы [41]. Полученные результаты позволили предположить авторам, что, по крайней мере СККМ обладают мультипотентностью и потенциалом к изменению профиля генной экспрессии в ответ на окружающую среду, способны выделять (секретировать) нейротрофические и нейропротекторные факторы (рис. 3).
Таким образом, японские исследователи показали, что химическое индукционное воздействие на профиль экспрессии генов мультипо-тентной СК реально и позволяет обеспечить не только изменение протеома соматической клетки, но и сформировать необходимый регуляторный нейросекретом СК или прогенетор-ной клетки. Они трактовали полученные факты изменения профиля экспрессии СККМ как способность этих клеточных систем к нейральной дифференцировке. Это верно только отчасти. На самом деле, анализируя их результаты с позиций теории систем, очевидно, что они продемонстрировали новую технологию направленного изменения или перепрограммирования экспрессии генов и получения индуцированных мультипотентных клеточных систем с заданным протеомом и требуемыми свойствами. Программный алгоритм этих новых клеточных свойств заложен в изменении профиля экспрессии генов, без генно-ин- женерных модификаций их генома.
Таким образом, на представленном примере японские исследователи продемонстрировали реальные возможности и механизм ремоделирования пептидной структуры и таргетного изменения экспрессии генов здоровой соматической клетки путем химической индукции их фенотипа. То есть, существует реальная практическая возможность, не изменяя морфологической структуры генома здоровой соматической клетки, направленно изменить её транскриптом и протеом, что позволяет получить нужный фенотип и секретом клетки. Поэтому, используя технологию эпигенетического ремоделирования профиля экспрессии генов соматических клеток путем химической индукции, можно получить клеточные системы с необходимым протеомом, обеспечивающим требуемый противоопухолевый секретом. Этот инструментарий можно попытаться использовать для разработки и создания новых клеточных препаратов для персонифицированной терапии опухолей.
На первый взгляд кажется, что верный путь к созданию принципиально нового, персонифицированного противоопухолевого препарата уже найден, и достаточно прост – изменяя транскриптом здоровой стволовой клетки химическим путем, с учетом особенностей экспрессии генов опухолевой клетки или РСК вы-
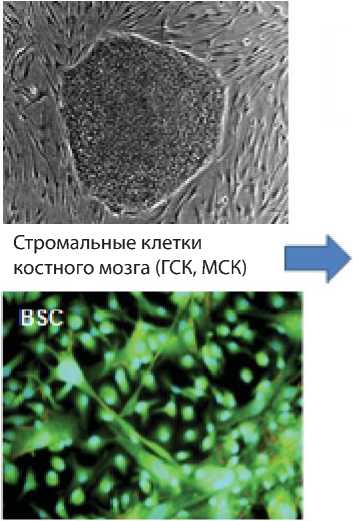
Рис. 3. Технологическая схема ремоделирования фенотипа стромальных СК костного мозга в нейральные СК путем химической индукции (S.Yamaguchi, S.Kuroda, H. Kobayashi et al., 2006).
Нейральноподобные стволовые клетки (НПСК)
Химическая индукция нейральной дифференцировки, 5-6 дней
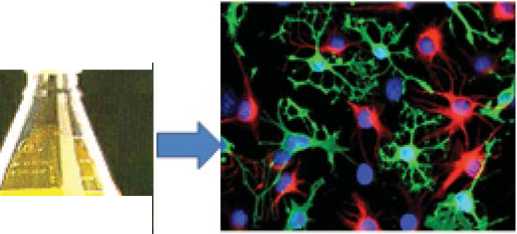
56 % клеток экспрессируют
Ретиноевая кислота
ДМСО
Фактор роста фибробластов - b нейрональный маркер nestin, 18%-положительны kTuj'-1, иммунореактивность против NF-М не выявлена
деленной из опухоли, можно получить персонифицированный клеточный препарат.
Но то, что кажется простым и очевидным, на самом деле совсем не просто и не однозначно. Это связано с тем, что геном опухолевой клетки очень нестабилен и ориентиры на постоянство транскриптомного профиля трансдукции этого генома не является надежным и постоянным критерием для получения надежной информации. Если в норме в соматической клетке именно геном и его транскриптомный профиль является оплотом стабильности и постоянства (они определяют стабильность и постоянство путей сигнальной трасндукции), а нестабильным, колеблющимся и динамичным является протеом, который зависит от процессов метилирования, модификации гистонов и процессов, происходящих с иРНК, то в опухолевой клетке и в РСК именно протеом является самым устойчивым, стабильным компонентом клеточной структуры [42 - 44] .
Как мы уже указывали ранее, он практически перестает реагировать на любые регуляторные сигналы и способен ответить только на сверхсильное управляющее воздействие. По протеому мы способны идентифицировать неопластический кариотип и злокачественный или доброкачественный фенотип опухолевой клетки и показать его гистологическую и им-мунохимическую специфичность. С другой стороны, динамичность протеома здоровой соматической клетки очень конкретна и отражает основные этапы ее судьбы. Временные изменения профиля протеома здоровой соматической клетки характеризуют фазу ее клеточного цикла, стадию дифференцировки, функционального состояния и динамических эффекторных тенденций (пролиферация, апотоз, миграция, ангиогенез и т.д.) и главное – он отражает текущее состояние белков в даннный момент времени, которое полностью коррелирует с ее транскриптомом. Другими словами, «протеом» здоровой соматической клетки очень жестко привязан к ее морфологии и функциональному состоянию и имеет специфичное профилирование на уровне «транс-криптома». У каждого протеомного профиля здоровой соматической клетки имеется запрограммированный в геноме транскриптом, возникающий в процессе запрограммированной экспрессии генов и формирования внутриклеточного сигналинга. То есть определенные изменения протеома здоровой клетки сопровож- даются очень стабильными и генетически детерминированными белковыми профилями экспрессирующих генов (траснкриптомным профилированием). Эта особенность принципиального отличия генома, транскриптома и протеома РСК и опухолевой клетки от подобных информационных показателей здоровой клетки и не позволяет опираться на транскриптом ОК и РСК при разработке персонифицированной противоопухолевой терапии. Каждый раз при исследовании транскриптома ОК и РСК результаты микроматричного анализа будут существенно различаться.
Таким образом, обобщая вышеизложенное можно утверждать, что наиболее стабильным информационным параметром здоровой соматической клетки является геном и его «транскриптом», манифестирующий профилем нормализованной сигнальной интенсивности белков, характеризующих экспрессию генов, полученный при микроматричном анализе или ПЦР – РВ РНК или ДНК ядра соматической клетки, а при неопластической опухолевой патологии наиболее стабильным информационным параметром соматической клетки является «проте-ом» регистрируемый в виде нормализованной сигнальной интенсивности (НСИ) всех структурных белков (ядра, цитоплазмы, органелл, мембраны, цитосклета и т.д.) клеток, полученных масс-спектрометрическим анализом лизатов всей клеточной массы изучаемых объектов.
Известно, что в ядре соматической клетки только в 1,5 % генома отвечают за формирование всей белковой структуры клетки, а остальные участки генома являются «программным» регуляторным обеспечением и так называемой «мусорной ДНК», роль которой пока еще не определена. Поэтому конкретный вариант генетического исследования клетки объективно отражает состояние этих 1,5% генома и состояние программного обеспечения или «ДНК-софта» оставшейся части ядра. В здоровой соматической клетке определенные протеомные профили жестко коррелируют с конкретными белковыми профилями экспрессии генов. Поэтому мы предлагаем единым информационным параметром здоровой (дифференцированной клетки и СК) и патологической (ОК и РСК) клетки считать совокупный протеомный профиль нормализованной сигнальной интенсивности клеточных белков, т.е. ее протеом. Для большей информативности и точности измерений клеточного протеома, из общего протеом- ного профиля НСИ белков дифференцированной клетки или здоровой СК можно попытаться математически (аппаратными методами) «удалить» малофункциональные белки, экспрессируемые генами этих клеток, выявлены-ми при микроматричном анализе и ПЦР-РВ. Аналогичные математические действия целесообразно проводить и с НСИ белков протео-мов и транскриптомов ОК и РСК. Эти несложные сопоставления НСИ и, при необходимости, составление матрицы их отличий позволят объективно исключить из общего профиля сравниваемых белков временные динамические сдвиги и изменения, характеризующие состояние сигнальной трансдукции соматической клетки, выявляемые при микроматричном анализе и характеризующие временной функциональный (патофункциональный) «срез» информационного состояния сигнальных путей. То есть, эти простые математические манипуляции с НСИ позволяют из протеомных информационных сетей исключить временные динамические информационнные параметры сигнальной трансдукции, имееющие транзи-торное (преходящее) значение в формировании окончательной протеомной структуры клетки. Мы бы даже обозначили их как информационные «шумы» сигнальных путей в заданном временном интервале. Несомненно, что для повышения информативности белковой клеточной структуры из общего протеомного профиля клетки, кроме белков динамического состояния (белки сигнальной трасндукции), целесообразно исключать белки морфологической структуры – белки цитоскелета, так как их роль в нарушениях регуляции и онкопатологии незначительная, но и недооценивать этот фактор нельзя.
Таким образом, для получения и систематизации потока информации, исходящего от всех белковых путей, которые взаимно соединяют внеклеточное микроокружение с контролем генной транскрипции исследуемых клеточных систем, наилучшим инструментом, по нашему мнению, является установление совокупного протеомного профиля исследуемой клетки. Но, как мы отметили выше, роль анализа и оценки транскриптомного профиля этих же клеток нисколько не уменьшается, а наоборот – возрастает. Транскриптом мы можем сопоставить с общей протеомной информацией, исключить «временные информационные транскрипты» сигнальных путей этой клетки, которые очень важны в диагностике, но в значительной мере мешают попытке анализа клеточной регуляции. В этой связи отметим еще раз, что попытка поиска «мишеней» для терапии на путях сигнальной трансдукции методологически не верна, так как «транскриптом» соматической клекти – это динамический информационный срез определенных белковых сдвигов (компенсаторных или декомпенсирующих) в общем информационном массиве. Удаление информационных «шумов» транскриптома из общего информационного массива белковых сетей клетки значительно повышает возможности регуляции и управления белковыми сетями этих клеточных систем.
В заключении мы должны отметить очень важное положение, к которому мы закономерно пришли в результате своих изысканий и рассуждений, и которое, надеемся, вытекает из нашего исследования и предшествующего изложения. «Протеом – это глобальная информационная структура клетки, материализованная в форме нормализованной сигнальной ин-тенсивоности (НСИ) ее белков и включающая все информационные составляющие ее ком-партментов, а также специализированных и эффекторных функций». Поэтому для разработки и создания персонифицированного противоопухолевого препарата нами был выбран уникальный информационный материал – «протеом» соматической клетки.
Список литературы Научное и теоретическое обоснование возможности разработки и создания персонифицированного противоопухолевого клеточного препарата на базе технологий клинической онкопротеомики
- Hill C. The frequency of cancer in France. Rev Prat. 2013; 63(8):1106-10.
- Guerin S., Hill C. Cancer epidemiology in France in 2010, comparison with the USA. Bull Cancer. 2010; 97(1):47-54.
- Давыдов М.И., Голанов А.В., Канаев С.В., и др. Анализ состояния и концепция модернизации радиационной онкологии и медицинской физики в России. Вопросы онкологии 2013; 59(5):529-38.
- Harding C.F., Pompei F., Wilson R. Differences in breast cancer survival by race. JAMA 2013; 310(22): 2456-7.
- Waite C.L., Roth C.M. Nanoscale drug delivery systems for enhanced drug penetration into solid tumors: current progress and opportunities. Crit Rev Biomed Eng. 2012; 40(1): 21-41.
- Kwong L.N., Heffernan T.P., Chin L. A systems biology approach to personalizing therapeutic combinations. Cancer Discov. 2013; 3(12):1339-44.
- Новиков А.М., Новиков Д.А. Методология научного исследования. М.: Либроком. 280 с.
- Rosenfeld S. Are the Somatic Mutation and Tissue Organization Field Theories of Carcinogenesis Incompatible? Cancer Inform. 2013; 12: 221-29.
- Sonnenschein C., Soto A.M. Somatic mutation theory of carcinogenesis: why it should be dropped and replaced. Mol Carcinog. 2000; 29(4):205-11.
- Soto A.M., Sonnenschein C. The tissue organization field theory of cancer: a testable replacement for the somatic mutation theory. Bioessays. 2011; 33(5):332-40.
- Duesberg P., Mandrioli D., McCormack A. et al. Is carcinogenesis a form of speciation? Cell Cycle. 2011; 10(13):2100-14.
- Reya T., Morrison S.J., Clarke M.F. et al. Stem cells, cancer, and cancer stem cells. Nature. 2001; 414(6859):105-11.
- Sperka T., Wang J., Rudolph K.L. DNA damage checkpoints in stem cells, ageing and cancer. Nat Rev Mol Cell Biol. 2012; 13(9):579-90.
- Huang Z., Cheng L., Gurianova O.A. et al. Cancer stem cells in glioblastoma molecular signaling and therapeutic targeting. Protein and cell 2010; 1(7): 638-55.
- Арчаков А.И. Биоинформатика, геномика и протеомика -науки о жизни XXI столетия. Вопросы медицинской химии 2000; 1: 4-7.
- Ahmed AU, Auffinger B, Lesniak MS. Understanding glioma stem cells: rationale, clinical relevance and therapeutic strategies. Expert Rev Neurother. 2013; 13(5):545-55.
- Брюховецкий И.С., Брюховецкий А.С., Кумейко В.В. и др. Стволовые клетки в канцерогенезе мультиформной глиобластомы. Клеточная трансплантология и тканевая инженерия 2013; VIII (2):13-19.
- Morrison SJ. Cancer stem cells. Clin Adv Hematol Oncol. 2005; 3(3):171-2.
- Li Q.,Bohin N., Wen T. et al. Oncogenic Nras has bimodal effects on stem cells that sustainably increase competitiveness. Nature. 2013; 504 (7478): 143-7.
- Meacham CE, Morrison SJ. Tumour heterogeneity and cancer cell plasticity. Nature. 2013; 501(7467):328-37.
- Signer R.A., Morrison S.J. Mechanisms that regulate stem cell aging and life span. Cell Stem Cell. 2013; 12(2):152-65.
- Magee J.A., Piskounova E., Morrison S.J. Cancer stem cells: impact, heterogeneity, and uncertainty. Cancer Cell. 2012; 21(3):283-96.
- Брюховецкий А.С. Клеточные технологии в нейроонкологии: циторегуляторная терапия глиальных опухолей головного мозга. М.: Издательская группа РОНЦ; 2011.
- Bivard A., Lin L., Parsonsb M.W. Review of Stroke Thrombolytics. J Stroke. 2013; 15(2):90-98.
- Фомин С.В., Беркинблит М.Б. Математические проблемы в биологии. М.: Наука; 1973.
- Неймарк Ю.И., Коган Р.Я., Савельев В.П. Динамические модели теории управления. М.: Наука; 1985.
- Пальцев М.А., Иванов А.А., Северин С.Е. Межклеточное взаимодействие. М.: Медицина, 2003.
- Vickers M, Brown G.C., Cologne G.B. et al. Modelling haemopoietic stem cell division by analysis of mutant red cells. Br J Haematol. 2000; 110(1):54-62.
- Белушкина Н.Н., Хомякова Т.Н., Хомяков Ю.Н. Заболевания, связанные с нарушением регуляции программируемой клеточной гибели. Молекулярная медицина 2012; 2: 3-10.
- Викторов И.В. Стволовые клетки мозга млекопитающих:биология стволовых клеток in vivo и in vitro. Известия РАН. Серия биологическая 2001; 6: 646-55.
- Давыдов М.И. Научная школа: молекулярно биологические признаки злокачественных новообразований и их маркеры. Технологии живых систем 2013; 10(2):003-004.
- Teperek M., Miyamoto K. Nuclear reprogramming of sperm and somatic nuclei in eggs and oocytes. Reprod Med Biol. 2013; 12:133-149.
- Torres-Padilla M.E. Generating different epigenotypes. Reprod Biomed Online. 2013; 27(6): 624-8.
- Xiong X.R., Wang L.J., Zi X.D. Epigenetic reprogramming of Yak iSCNT embryos after donor cell pretreatment with oocyte extracts. Anim Reprod Sci. 2012; 133(34):229-36.
- Wallenstein E.J., Barminko J., Schloss R.S. et al. Transient gene delivery for functional enrichment of differentiating embryonic stem cells. Biotechnol Bioeng. 2008; 101(5):859-72
- Porada C.D., Tran N.D., AlmeidaPorada G. et al. Transduction of longtermengrafting human hematopoietic stem cells by retroviral vectors. Hum Gene Ther. 2002; 13(7):867-79.
- Romero Z., Toscano M.G., Unciti J.D. et al. Safer vectors for gene therapy of primary immunodeficiencies. Curr Gene Ther. 2009; 9(4):291-305.
- D'Hulst C., Parvanova I., Tomoiaga D., et al. Fast Quantitative RealTime PCRBased Screening for Common Chromosomal Aneuploidies in Mouse Embryonic Stem Cells. Stem Cell Reports. 2013; 1(4):350-9.
- Clawson G.A. Cancer. Fusion for moving. Science. 2013; 342(6159):699-700.
- Репин В.С., Сухих Г.Т. Медицинская клеточная биология М.: РАМН БЭБиМ, 1998
- Yamaguchi S., Kuroda S., Kobayashi H. et al. The effects of neuronal induction on gene expression profile in bone marrow stromal cells (BMSC)a preliminary study using microarray analysis. Brain Res. 2006; 1087(1):15-27.
- Trimarchi M.P., Mouangsavanh M., Huang T.H. Cancer epigenetics: a perspective on the role of DNA methylation in acquired endocrine resistance. Chin J Cancer. 2011; 30(11):749-56.
- Connolly R., Stearns V. Epigenetics as a therapeutic target in breast cancer. J Mammary Gland Biol Neoplasia. 2012; 17(34):191-204.
- Bonneville R., Jin V.X. A hidden Markov model to identify combinatorial epigenetic regulation patterns for estrogen receptor α target genes. Bioinformatics 2013; 29(1):22-8.


