NCR-пептиды - растительные эффекторы, контролирующие терминальную дифференцировку клубеньковых бактерий в симбиотическую форму
Автор: Клюкова М.С., Жуков В.А., Тихонович И.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Агросистемы будущего
Статья в выпуске: 5 т.52, 2017 года.
Бесплатный доступ
Извлечение минеральных веществ из почвы - одна из главных проблем выживания растений. В частности, доступность таких макроэлементов, как азот и фосфор, лимитирует рост и развитие растений. Представители семейства Бобовые ( Fabaceae ) преодолевают это ограничение, устанавливая симбиотические взаимоотношения с азотфиксирующими почвенными бактериями (ризобиями). Проникновение бактерий в корни растения-хозяина индуцирует формирование специализированных органов - клубеньков. Внутри клеток симбиотического клубенька свободноживущие бактерии дифференцируются в симбиотическую форму (бактероиды) и превращаются в органеллоподобные структуры, которые фиксируют азот и снабжают им растение в обмен на питательные вещества (B.J. Ferguson с соавт., 2010). В клубеньках ряда бобовых растений бактероиды подвергаются терминальной (необратимой) дифференцировке, теряя возможность вернуться к индивидуальному существованию. Терминальная дифференцировка бактероидов начинается вскоре после проникновения ризобий в клетки клубенька и приводит к морфологическим, физиологическим и генетическим изменениям бактериальных клеток. Показано, что ключевую регуляторную роль в этом процессе играет обширное семейство антимикробных пептидов растений, представители которого носят название клубенек-специфичные цистеин-богатые пептиды (Nodule-specific Cysteine Rich, NCR-пептиды) (P. Mergaert с соавт., 2003). По своей структуре и способам действия они сходны с факторами врожденного иммунитета растений - дефензинами, однако образуются только в клубеньках. На сегодняшний день в геноме модельного бобового объекта люцерны слабоусеченной ( Medicago truncatula Gaertn.) идентифицировано порядка 700 генов, кодирующих NCR-пептиды, вариабельные по аминокислотной последовательности. В консервативных положениях они всегда несут цистеиновый мотив, вероятно, необходимый для принятия ими правильной конформации. Внутриклеточной мишенью NCR-пептидов служат симбиосомы (клеточные компартменты, содержащие бактероиды), к которым NCR-пептиды доставляются через секреторный путь и в которых они запускают процесс дифференцировки, взаимодействуя с компонентами бактериальной мембраны, а также различными внутриклеточными мишенями (D. Wang с соавт., 2010). Наиболее изученный представитель этого семейства у M. truncatula - MtNCR247. Он представляет собой катионный пептид с четырьмя цистеиновыми остатками, формирующими две дисульфидные связи в окисленной форме. MtNCR247 влияет на процессы транскрипции, трансляции и клеточного деления Sinorhizobium meliloti при низких концентрациях, а также проявляет антимикробную активность при более высоком содержании (A. Farkas с соавт., 2014). На сегодняшний день NCR-пептиды идентифицированы только у бобовых растений группы IRLC (Inverted Repeat-lacking Clade), для которых характерна терминальная дифференцировка бактерий в бактероиды. Вероятно, приобретение в процессе эволюции вариабельного семейства генов, кодирующих NCR-пептиды, было селективным преимуществом растений этой группы.
Бобово-ризобиальный симбиоз, азотфиксирующие клубеньки, дифференцировка бактероидов, ncr-пептиды, регуляция развития симбиоза
Короткий адрес: https://sciup.org/142214084
IDR: 142214084 | УДК: 633.31/.37:631.461.52:577.21 | DOI: 10.15389/agrobiology.2017.5.869rus
Текст обзорной статьи NCR-пептиды - растительные эффекторы, контролирующие терминальную дифференцировку клубеньковых бактерий в симбиотическую форму
При установлении азотфиксирующего симбиоза ризобии избирательно проникают в корни бобовых растений, что приводит к развитию особых корневых структур, называемых клубеньками (4). Онтогенез клу-
Работа поддержана Российским научным фондом (грант ¹ 14-24-00135), работа В.А. Жукова поддержана Российским фондом фундаментальных исследований (грант ¹ 14-04-01442-а).
беньков представляет собой четко организованный процесс, основанный на скоординированной экспрессии специализированных растительных и бактериальных генов (5). Значительная часть сложной системы генов растения, управляющих развитием клубенька, необходима для контроля микросимбионта растением-хозяином.
Внутри клубенька бактерии дифференцируются в бактероиды и осуществляют симбиотическую азотфиксацию, то есть восстановление молекулярного азота до иона аммония с использованием ферментного комплекса нитрогеназы (6, 7). В клубеньках бобовых, принадлежащих к группе IRLC (Inverted Repeat-Lacking Clade), превращение клубеньковых бактерий в бактероиды необратимо (терминальная дифференцировка), у других растений это обратимый процесс (8-10). Если штамм ризобий способен к образованию клубеньков на корнях широкого круга растений, то степень дифференцировки бактерий в бактероиды и ее обратимость строго соответствуют виду растения-хозяина, из чего следует, что процесс дифференцировки индуцируется растительными сигналами (11-13).
У модельного бобового растения Medicago truncatula в качестве таких факторов могут выступать по меньшей мере 800 клубенек-специфичных симбиотических пептидов (Symbiotic Peptide, symPEP), подавляющее большинство которых (более 700) относятся к группе клубенек-специфичных цистеин-богатых пептидов (Nodule-specific Cysteine Rich, NCR) (14-17). NCR-пептиды также описаны для других бобовых, относящихся к той же кладе IRLC, — бобов ( Vicia faba ) (18), белого клевера ( Trifolium repens ) (19), козлятника восточного ( Galega orientalis ) (20), гороха посевного ( Pisum sativum L.) (21-23). NCR-пептиды были выявлены в экспериментах по идентификации клубенек-специфичных белковых молекул (нодулинов) (21), однако далеко не все нодулины относятся к NCR-пептидам.
Целью представленной статьи стало обобщение и структурирование информации, накопленной за последнее десятилетие, в отношении регуляции дифференцировки симбиотических бактерий при установлении азот-фиксирующего симбиоза. Впервые дана полная характеристика многочисленного белкового семейства NCR-пептидов. Детально рассмотрены вопросы их структуры, функций, мишеней, способов действия, а также предполагаемого пути эволюции.
Гены NCR-пептидов принадлежат к обширной группе дефензин-подобных генов, различные представители которой встречаются в геномах позвоночных (кодируют белки, участвующие в приобретенном иммунитете), беспозвоночных (например, кодируют компонент токсина скорпиона), и растений (14, 24, 25). В свою очередь дефензины относятся к группе антимикробных пептидов (Antimicrobial Peptide, AMP), которые продуцируются почти всеми живыми организмами и играют ключевую роль во врожденном иммунитете (26-28). Общий способ действия антимикробных пептидов — нарушение микробных мембран и (или) индуцирование формирования пор, что приводит к лизису бактериальных клеток, а также делает возможным взаимодействие пептидов с внутриклеточными мишенями (ДНК, РНК, различными белками) (29-31).
По аминокислотному составу NCR-пептиды вместе с растительными дефензинами относят к обширному семейству белков CCP (Сysteine Сluster Protein), содержащих консервативный цистеиновый кластер — 4, 6, 8 или 10 цистеиновых остатков в консервативных положениях (32-34). Клубенек-специфичные CCP, они же NCR-пептиды, представляют одну из 10 подгрупп CCP (34, 35). Подобно генам дефензинов, гены NCR-пептидов коди-870
руют короткие (30-60 аминокислотных остатков) секретируемые полипептиды с высокой вариабельностью аминокислотной последовательности, что определяет их специфичность и различные механизмы действия (14, 36, 37). В отличие от дефензинов, ключевая функция которых — участие в защитных процессах и негативное влияние на бактерии, NCR-пептиды играют позитивную регуляторную роль в клубеньках бобовых растений, управляя дифференцировкой клубеньковых бактерий в азотфиксирующие бактероиды (11, 38, 39). При этом антимикробная активность NCR-пептидов выражается в том, что дифференцировка в бактероиды под их действием необратима. Кроме того, бактерии утрачивают способность к размножению.
Экспрессия генов, кодирующих NCR-пептиды, специфична для клубеньков. При этом определенные группы генов активируются совместно, что выражается в виде нескольких последовательных «волн» их экспрессии на различных стадиях развития клубенька (40). Только что синтезированные NCR-пептиды содержат N-концевую сигнальную последовательность, определяющую их транспортировку в эндоплазматический ретикулум (11, 14). В транспортировке NCR-пептидов ключевую роль играет сигнальная пептидаза, отрезающая сигнальную последовательность от зрелого пептида при сортировке белков на эндоплазматической сети (41). У мутантов M. truncatula по гену MtDNF1 , кодирующему клубенек-специфичную субъединицу сигнальной пептидазы, NCR-пептиды сохраняют сигнальные последовательности и накапливаются в эндоплазматической сети, не попадая в симбиосомы, в результате чего дифференцировка бактероидов не происходит (11, 16, 41). В случае нормального развития симбиоза по мере экспрессии генов различные наборы NCR-пептидов доставляются к эндосимбионту и опосредуют последующие события его дифференцировки (16).
Для некоторых NCR-пептидов (например, MtNCR247 и MtNCR335) показана способность к взаимодействию с мембраной бактериальных клеток, что в условиях in vitro приводит к гибели как клубеньковых бактерий, так и патогенов человека и растений (11, 42). Однако в естественных условиях (в клетках клубенька) симбиотические пептиды не нарушают проницаемость бактериальной мембраны настолько, чтобы это приводило к лизису клетки (31). Вероятно, увеличение проницаемости мембраны способствует проникновению NCR-пептидов внутрь бактериальных клеток.
Из бактероидов, присутствующих в клетках клубеньков M. truncatu-la , можно выделить около 140 различных NCR-пептидов, что свидетельствует о возможности их проникновения в бактериальную клетку, а также об их высокой стабильности и потенциальном взаимодействии с внутриклеточными мишенями (43). Одна из мишеней MtNCR247 — бактериальный белок FtsZ, играющий важную роль при формировании клеточной перегородки в процессе деления клеток (44-46). Другой партнер MtNCR247 — шаперон GroEL, необходимый для полной активации генов клубенькообра-зования и сборки нитрогеназного комплекса (47). Воздействие MtNCR247 также изменяет экспрессию некоторых регуляторных генов, критичных для прохождения клеточного цикла ( ctrA , gcrA , dnaA ), что может быть связано с остановкой пролиферации бактерий в клетках растения (45).
У клубеньковых бактерий существуют защитные механизмы, позволяющие противостоять действию растительных NCR-пептидов (48). В частности, определенную защиту от NCR-пептидов обеспечивает ген BacA, кодирующий белок семейства ABC-транспортеров (49-51). Так, мутант S. meliloti по гену bacA проявляет гиперчувствительность по отношению к MtNCR247 in vitro и in vivo (бактерии подвергаются деградации вскоре после высвобождения в клетки клубенька люцерны, в то время как штам- мы бактерий дикого типа остаются жизнеспособными и дифференцируют- ся в бактероиды) (52-54). Помимо этого, описан ген металлопептидазы HrrP (host range restriction peptidase), кодирующий фермент, способный разрезать NCR-пептиды (55, 56). У некоторых штаммов Bradyrhizobium для успешного азотфиксирующего симбиоза необходимо наличие в мембране стирол-подобных липидов (гопаноидов), вероятно, усиливающих ее прочность и обеспечивающих защиту от NCR-пептидов (57, 58).
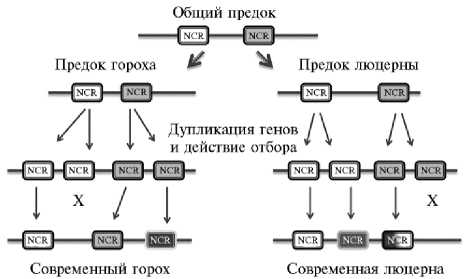
Схема предполагаемой эволюции генов NCR-пептидов у Medicago truncatula и Pisum sativum. Гены NCR-пептидов возникли приблизительно 25 млн лет назад у общего предка группы IRLC (Inverted Repeat-lacking Clade). Впоследствии дупликация, диверсификация, а также отбор в пользу наибольшей функциональности привели к появлению значительного числа генов, кодирующих антимикробные пептиды с низкой консервативностью последовательностей, которая стала основой разнообразия их активности и физиологических функций. Некоторые из NCR-пептидов приобретали уникальные функции, отличающие их от основной группы и незаменимые для успешного симбиоза; часть последовательностей становилась псевдогенами и утрачивала биологическую функцию. Цветом отмечена степень различий в вариативности нуклеотидных последовательностей генов NCR-пептидов и их изменениях в эволюции (мутации, рекомбинацию). Х означает, что ген, кодировавший NCR-пептид, вследствие мутации превратился в псевдоген и утратил первоначальную функцию.
Важная отличительная особенность генного семейства NCR-пептидов — их кластерная организация в пределах генома. Кластеры генов, кодирующих NCR-пептиды, равномерно распределены на восьми хромосомах у M. truncatula и, по-видимому, возникли при неоднократной дупликации и последующей диверсификации последовательностей (59). Поскольку промотор-ные области генов, кодирующих NCR-пептиды, тоже сходны, их экспрессия вы-сокосогласована. Секвенирование образцов РНК из зон клубенька, вырезанных из препарата при помощи лазерной микродиссекции, показало, что гены NCR-пептидов можно разделить на несколько групп, основываясь на их пространственно-временном профиле экспрессии (16). Очевид- но, экспрессия определенных групп генов NCR-пептидов необходима лишь на конкретной стадии развития клубенька (40).
Несмотря на ранее описанную взаимозаменяемость антимикробных молекул (14), появляются данные об уникальных по своим свойствам и функциям NCR-пептидах, отсутствие которых прерывает установление азотфиксирующего симбиоза. Так, MtNCR211, токсичный для S. me-liloti в условиях in vitro, необходим для выживания бактероидов in planta, поскольку мутация в его гене приводит к гибели бактероидов в клетках клубенька (60). Аналогично для поддержания бактероидов необходим MtNCR169, в отсутствие которого их дифференцировка практически не происходит и, как результат, не фиксируется азот (61). Оба эти NCR-пептида характеризуются сходной локализацией in planta (60, 61). Мутанты M. truncatula по генам MtDNF4 (=MtNCR211) и MtDNF7 (=MtNCR169) имеют похожие транскриптомные профили (62). Несмотря на это, роль каждого из указанных пептидов уникальна, поскольку у мутанта по гену MtNCR211 происходит лизис бактероидов после дифференцировки, а у мутанта по гену MtNCR169 лизису подвергаются недифференцированные бактерии (63). Последовательности генов NCR-пептидов весьма вариативны даже в пределах одного вида бобовых растений. Найденные гомологичные последовательности у разных представителей группы IRLC имеют очень низкий процент сходства, так что определение ортологичных пар становится невозможным (64). Вероятно, эти растения дивергировали от общего предка, уже имевшего гены NCR-пептидов, достаточно давно (рис.). Впоследствии в геноме каждого из них происходила дупликация генов NCR-пептидов, которые затем независимо эволюционировали под действием позитивного (движущего) отбора (59). У разных видов некоторые гены вследствие накопления мутаций могли превратиться в псевдогены и элиминироваться, поэтому одну и ту же биологическую функцию начинали выполнять неортологичные гены. Наконец, сходство отдельных участков последовательностей генов NCR-пептидов указывает на возможность повышения их вариабельности вследствие незаконной рекомбинации. Результатом эволюции этого генного семейства стало широкое разнообразие NCR-пептидов, наблюдаемое у современных представителей группы IRLC.
Согласно исследованиям эффективности симбиотической азотфик-сации, доведение дифференцировки бактероидов до терминальной фазы приносит растению (и симбиотической системе в целом) значительную выгоду (65). Вероятно, по этой причине приобретение в процессе эволюции семейства генов NCR-пептидов оказалось селективным преимуществом растений группы IRLC. Кроме того, NCR-пептиды участвуют в фоновом иммунном ответе клубеньков, активность которого не зависит от того, присутствуют ли в них нежелательные (патогенные) микроорганизмы (63). Активность в симбиотических органах растений генов NCR-пептидов, относящихся к системе растительного иммунитета и быстро эволюционирующих в направлении разнообразия, вместе с наличием у ризобий систем, позволяющих противостоять летальному воздействию NCR-пептидов, служит прекрасной иллюстрацией коэволюции партнеров в случае азотфик-сирующего симбиоза.
Таким образом, на сегодняшний день у ограниченной группы бобовых растений обнаружено большое генное семейство, которое обладает органо-специфичной экспрессией. Его представители выполняют функцию терминальной, то есть необратимой, дифференцировки симбионтов внутри клубенька. Предполагается, что гены NCR-пептидов возникли от родственных им генов растительных дефензинов в процессе стремительной дупликации и диверсификации последовательностей. Многие из NCR-пептидов взаимозаменяемы вследствие сходства структур, но некоторые приобрели новые, более специализированные функции. Роли, мишени и способы действия NCR-пептидов описаны лишь для нескольких представителей этого семейства, а значит, дальнейшие исследования могут привести к неожиданным и ценным открытиям.
Список литературы NCR-пептиды - растительные эффекторы, контролирующие терминальную дифференцировку клубеньковых бактерий в симбиотическую форму
- Ferguson B.J., Indrasumunar A., Hayashi S., Lin M.H, Lin Y.H., Reid D.E., Gresshoff P.M. Molecular analysis of legume nodule development and autoregulation. Journal of Integrative Plant Biol., 2010, 52(1): 61-76 ( ) DOI: 10.1111/j.1744-7909.2010.00899.x
- Chen W.-M., Moulin L., Bontemps C., Vandamme P., Bena G., Boivin-Masson C. Legume symbiotic nitrogen fixation by β-proteobacteria is widespread in nature. J. Bacteriol., 2003, 185(24): 7266-7272 ( ) DOI: 10.1128/JB.185.24.7266-7272.2003
- MacLean A.M., Finan T.M., Sadowsky M.J. Genomes of the symbiotic nitrogen-fixing bacteria of legumes. J. Plant Physiol., 2007, 144(2): 615-622 ( ) DOI: 10.1104/pp.107.101634
- Oldroyd G.E., Downie J.A. Coordinating nodule morphogenesis with rhizobial infection in legumes. Annu. Rev. Plant Biol., 2008, 59: 519-546 (doi: 10.1146/annurev.arplant.59.032607.092839).
- Oldroyd G.E. Speak, friend, and enter: signaling systems that promote beneficial symbiotic associations in plant. Nat. Rev. Microbiol., 2013, 11(4): 252-263 ( ) DOI: 10.1038/nrmicro2990
- Mylona P., Pawlowski K., Bisseling T. Symbiotic nitrogen fixation. The Plant Cell, 1995, 7: 869-885.
- Mus F., Crook M.B., Garcia K., Garcia Costas A., Geddes B.A., Kouri E.D., Paramasivan P., Ryu M.-H., Oldroyd G.E.D., Poole P.S., Udvardi M.K., Voigt C.A., Ané J.-M., Peters J.W. Symbiotic nitrogen fixation and the challenges to its extension to nonlegumes. Appl. Environ. Microbiol., 2016, 82(13): 3698-710 ( ) DOI: 10.1128/AEM.01055-16
- Rolfe B.G., Gresshoff P.M. Genetic analysis of legume nodule initiation. Annu. Rev. Plant Physiol. Plant Mol. Biol., 1988, 39: 297-319 ( ) DOI: 10.1146/annurev.pp.39.060188.001501
- Rhizobiaceae: Молекулярная биология бактерий, взаимодействующих с растениями/Под pед. Г. Спайнк; pус. пер. под ред. И.А. Тихоновича, Н.А. Проворова. СПб, 2002.
- Mergaert P., Uchiumi T., Alunni B., Evanno G., Cheron A., Catrice O., Mausset A.E., Barloy-Hubler F., Galibert F., Kondorosi A., Kondorosi E. Eukaryotic control on bacterial cell cycle and differentiation in the Rhizobium-legume symbiosis. PNAS USA, 2006, 103(13): 5230-5235 ( ) DOI: 10.1073/pnas.0600912103
- Van de Velde W., Zehirov G., Szatmari A., Debreczeny M., Ishihara H., Kevei Z., Farkas A., Mikulass K., Nagy A., Tiricz H., Satiat-Jeunemaître B., Alunni B., Bourge M., Kucho K., Abe M., Kereszt A., Maroti G., Uchiumi T., Kondorosi E., Mergaert P. Plant peptides govern terminal differentiation of bacteria in symbiosis. Science, 2010, 327(5969): 1122-1126 ( ) DOI: 10.1126/science.1184057
- Sen D., Weaver R.W. A basis for different rates of N2-fixation by the same strains of Rhizobium in peanut and cowpea root nodules. Plant Sci., 1984, 34(3): 239-246 ( ) DOI: 10.1016/S0304-4211(84)80002-4
- Bonaldi K., Gargani D., Prin Y., Fardoux J., Gully D., Nouwen N., Goormachtig S., Giraud E. Nodulation of Aeschynomene afraspera and A. indica by photosynthetic Bradyrhizobium sp. strain ORS285: the nod-dependent versus the nod-independent symbiotic interaction. Mol. Plant-Microbe Interact., 2011, 24(11): 1359-1371 ( ) DOI: 10.1094/MPMI-04-11-0093
- Mergaert P., Nikovics K., Kelemen Z., Munoury N., Vaubert D., Kondorosi A., Kondorosi E. A novel family in Medicago truncatula consisting of more than 300 nodule-specific genes coding for small, secreted polypeptides with conserved cysteine motifs. Plant Physiol., 2003, 132(1): 161-173 ( ) DOI: 10.1104/pp.102.018192
- Nallu S., Silverstein, K.A., Zhou P., Young N.D., VandenBosch K.A. Patterns of divergence of a large family of nodule cysteine-rich peptides in accessions of Medicago truncatula. The Plant Journal, 2014, 78(4): 697-705 ( ) DOI: 10.1111/tpj.12506
- Maroti G., Downie J.A., Kondorosi E. Plant cysteine-rich peptides that inhibit pathogen growth and control rhizobial differentiation in legume nodules. Curr. Opin. Plant Biol., 2015, 26: 57-63 ( ) DOI: 10.1016/j.pbi.2015.05.031
- Shabab M., Arnold M.F., Penterman J., Wommack A.J., Bocker H.T., Price P.A., Griffitts J.S., Nolan E.M., Walker G.C. Disulfide cross-linking influences symbiotic activities of nodule peptide NCR247. PNAS USA, 2016, 113(36): 10157-10162 ( ) DOI: 10.1073/pnas.1610724113
- Fruhling M., Albus, U., Hohnjec N., Geise G., Pühler A., Perlick A.M. A small famiy of broad bean codes for late nodulins containing conserved cysteine clusters. Plant Sci., 2000, 152(1): 67-77 ( ) DOI: 10.1016/S0168-9452(99)00219-8
- Crockard A., Bjourson J., Dazzo B., Cooper J.E. A white clover nodulin gene, dd23b, encoding a cysteine cluster protein, is expressed in roots during the very early stages of interaction with Rhizobium leguminosarum biovar trifolii and after treatment with chitolipooligosaccharide Nod factors. J. Plant Res., 2002, 115(6): 439-447 ( ) DOI: 10.1007/s10265-002-0053-7
- Kaijalainen S., Schroda M., Lindstrom K. Cloning of nodule-specific cDNAs of Galega orientalis. Plant Physiol., 2002, 114(4): 588-593 ( ) DOI: 10.1034/j.1399-3054.2002.1140412.x
- Scheres B., van Engelen F., van der Knaap E., van de Wiel C., van Kammen A., Bisseling T. Sequential induction of nodulin gene expression in the developing pea nodule. Plant Cell, 1990, 2(8): 687-700 ( ) DOI: 10.1105/tpc.2.8.687
- Kardailsky I., Yang W-C., Zalensky A., van Kammen A., Bisseling T. The pea late nodulin gene PsNOD6 is homologous to the early nodulin genes PsENOD3/14 and is expressed after the leghaemoglobin genes. Plant Mol. Biol., 1993, 23(5): 1029-1037 ( ) DOI: 10.1007/BF00021817
- Kato T., Kawashima K., Miwa M., Mimura Y., Tamaoki M., Kouchi H., Suganuma N. Expression of genes encoding late nodulins characterized by a putative signal peptide and conserved cysteine residues is reduced in ineffective pea nodules. Mol. Plant-Microbe Interact., 2002, 15(2): 129-137 ( ) DOI: 10.1094/MPMI.2002.15.2.129
- Silverstein K.A., Graham M.A., Paape T.D., VandenBosch K.A. Genome organization of more than 300 defensin-like genes in Arabidopsis. Plant Physiol., 2005, 138(2): 600-610 ( ) DOI: 10.1104/pp.105.060079
- Aerts A.M., Francois I.E., Cammue B.P., Thevissen K. The mode of antifungal action of plant, insect and human defensins. Cell. Mol. Life Sci., 2008, 65(13): 2069-2079 ( ) DOI: 10.1007/s00018-008-8035-0
- Vaara M., Vaara T. Polycations as outer membrane-disorganizing agents. Antimicrobial Agents and Chemotherapy, 1983, 24(1): 114-122.
- Boman H.G. Peptide antibiotics and their role in innate immunity. Annu. Rev. Immunol., 1995, 13: 61-92 ( ) DOI: 10.1146/annurev.iy.13.040195.000425
- Huang H.W. Molecular mechanism of antimicrobial peptides: The origin of cooperativity. BBA, 2006, 1758(9): 1292-1302 ( ) DOI: 10.1016/j.bbamem.2006.02.001
- Brogden K.A. Antimicrobial peptides: Pore formers or metabolic inhibitors in bacteria? Nat. Rev. Microbiol., 2005, 3(3): 238-250 ( ) DOI: 10.1038/nrmicro1098
- Sochacki K.A., Barns K.J., Bucki R., Weisshaar C. Real-time attack on single Escherichia coli cells by the human antimicrobial peptide LL-37. PNAS USA, 2011, 108(16): 77-81 ( ) DOI: 10.1073/pnas.1101130108
- Teixeira V., Feio M.J., Bastos M. Role of lipids in the interaction of antimicrobial peptides with membranes. Prog. Lipid Res., 2012, 51(2): 149-177 ( ) DOI: 10.1016/j.plipres.2011.12.005
- Van der Weerden N.L., Bleackley M.R., Anderson M.A. Properties and mechanisms of action of naturally occurring antifungal peptides. Cell. Mol. Life Sci., 2013, 70(19): 3545-3570 ( ) DOI: 10.1007/s00018-013-1260-1
- Epand R.M., Vogel H.J. Diversity of antimicrobial peptides and their mode of action. Biochimica et Biophysica Acta Journal, 1999, 1462(1-2): 11-28.
- Graham M.A., Silverstein K.A., Cannon S.B., VandenBosch K.A. Computational identification and characterization of novel genes from legumes. Plant Physiol., 2004, 135(3): 1179-1197 ( ) DOI: 10.1104/pp.104.037531
- Silverstein K.A., Graham M.A., VandenBosch K.A. Novel paralogous gene families with potential function in legume nodules and seeds. Curr. Opin. Plant Biol., 2006, 9(2): 142-146 ( ) DOI: 10.1016/j.pbi.2006.01.002
- Ganz T. Defensins: antimicrobial peptides of innate immunity. Nat. Rev. Immunol., 2003, 3(9): 710-720 ( ) DOI: 10.1038/nri1180
- Vriens K., Cammue B.P., Thevissen K. Antifungal plant defensins: mechanisms of action and production. Molecules, 2014, 19(8): 12280-12303 ( ) DOI: 10.3390/molecules190812280
- Nagy K., Mikulass K.R., Vegh A.G., Kereszt A., Kondorosi E., Varo G., Szegletes Z. Interaction of cysteine-rich cationic antimicrobial peptides with intact bacteria and model membranes. Gen. Physiol. Biophys., 2015, 34(2): 135-144 ( ) DOI: 10.4149/gpb_2015002
- Nicolas P. Multifunctional host defense peptides: Intracellular-targeting antimicrobial peptides. FEBS Journal, 2009, 276(22): 6483-6496 ( ) DOI: 10.1111/j.1742-4658.2009.07359.x
- Guefrachi I., Nagymihaly M., Pislariu C.I., Van de Velde W., Ratet P., Mars M., Udvardi M.K., Kondorosi E., Mergaert P., Alunni B. Extreme specificity of NCR gene expression in Medicago truncatula. BMC Genomics, 2014, 15(1): 1-16 ( ) DOI: 10.1186/1471-2164-15-712
- Wang D., Griffitts J., Starker C., Fedorova E., Limpens E., Ivanov S., Bisseling T., Long S. A nodule-specific protein secretory pathway required for nitrogen-fixing symbiosis. Science, 2010, 327(5969): 1126-1129 ( ) DOI: 10.1126/science.1184096
- Tiricz H., Szucs A., Farkas A., Pap B., Lima R.M., Maroti G., Kondorosi E., Kereszt A. Antimicrobial nodule-specific cysteine-rich peptides induce membrane depolarization-associated changes in the transcriptome of Sinorhizobium meliloti. Appl. Environ. Microbiol., 2013, 79(21): 6737-6746 ( ) DOI: 10.1128/AEM.01791-13
- Durgo H., Klement E., Hunyadi-Gulyas E., Szucs A., Kereszt A., Medzihradszky K.F., Kondorosi E. Identification of nodule-specific cysteine-rich plant peptides in endosymbiotic bacteria. Proteomics, 2015, 15(13): 2291-2295 ( ) DOI: 10.1002/pmic.201400385
- Handler A.A., Lim J.E., Losick R. Peptide inhibitor of cytokinesis during sporulation in Bacillus subtilis. Mol. Microbiol., 2008, 68(3): 588-599 ( ) DOI: 10.1111/j.1365-2958.2008.06173.x
- Penterman J., Abo R.P., De Nisco N.J., Arnold M.F.F., Longhi R., Zanda M., Walker G.C. Host plant peptides elicit a transcriptional response to control the Sinorhizobium meliloti cell cycle during symbiosis. PNAS USA, 2014, 111(9): 3561-3566 ( ) DOI: 10.1073/pnas.1400450111
- Maroti G., Kondorosi E. Nitrogen-fixing Rhizobium-legume symbiosis: are polyploidy and host peptide-governed symbiont differentiation general principles of endosymbiosis? Front. Microbiol., 2014, 5: 1-6 ( ) DOI: 10.3389/fmicb.2014.00326
- Farkas A., Maroti G., Durgo H., Gyorgypal Z., Lima R.M., Medzihradszky K.F., Kereszt A., Mergaert P., Kondorosi E. Medicago truncatula symbiotic peptide NCR247 contributes to bacteroid differentiation through multiple mechanisms. PNAS USA, 2014, 111(14): 5183-5188 ( ) DOI: 10.1073/pnas.1404169111
- Haag A.F., Baloban M., Sani M., Kerscher B., Pierre O., Farkas A., Longhi R., Boncompagni E., Hérouart D., Dall'Angelo S., Kondorosi E., Zanda M., Mergaert P., Ferguson G.P. Protection of Sinorhizobium against host cysteine-rich antimicrobial peptides is critical for symbiosis. PLoS Biology, 2011, 9(10): e1001169 ( ) DOI: 10.1371/journal.pbio.1001169
- Glazebrook J., Ichige A., Walker G.C. A Rhizobium meliloti homolog of the Escherichia coli peptide-antibiotic transport protein SbmA is essential for bacteroid development. Genes and Development, 1993, 7(8): 1485-1497.
- Ichige A., Walker G.C. Genetic analysis of the Rhizobium meliloti bacA gene: functional interchangeability with the Escherichia coli sbmA gene and phenotypes of mutants. J. Bacteriol., 1997, 179(1): 209-216.
- Ferguson G.P., Jansen A., Marlow V.L., Walker G.C. BacA-mediated bleomycin sensitivity in Sinorhizobium meliloti is independent of the unusual lipid A modification. J. Bacteriol., 2006, 188(8): 3143-3148 ( ) DOI: 10.1128/JB.188.8.3143-3148.2006
- Marlow V.L., Haag A.F., Kobayashi H., Fletcher V., Scocchi M., Walker G.C., Ferguson G.P. Essential role for the BacA protein in the uptake of a truncated eukaryotic peptide in Sinorhizobium meliloti. J. Bacteriol., 2009, 191(5): 1519-1527 ( ) DOI: 10.1128/JB.01661-08
- Karunakaran R., Haag A.F., East A.K., Ramachandran V.K., Prell J., James E.K., Scocchi M., Ferguson G.P., Poole P.S. BacA is essential for bacteroid development in nodules of galegoid, but not phaseoloid, legumes. J. Bacteriol., 2010, 192(11): 2920-2928 ( ) DOI: 10.1128/JB.00020-10
- Wehmeier S., Arnold M.F, Marlow V.L., Aouida M., Myka K.K., Fletcher V., Benincasa M., Scocchi M., Ramotar D., Ferguson G.P. Internalization of a thiazole-modified peptide in Sinorhizobium meliloti occurs by BacA-dependent and -independent mechanisms. Microbiology, 2010, 156: 2702-2713 ( ) DOI: 10.1099/mic.0.039909-0
- Crook M.B., Lindsay D.P., Biggs M.B., Bentley J.S., Price J.C., Clement S.C., Clement M.J., Long S.R., Griffitts J.S. Rhizobial plasmids that cause impaired symbiotic nitrogen fixation and enhanced host invasion. Mol. Plant-Microbe Interact., 2012, 25(8): 1026-1033 ( ) DOI: 10.1094/MPMI-02-12-0052-R
- Price P.A., Tanner H.R., Dillon B.A., Shabab M., Walker G.C., Griffitts J.S. Rhizobial peptidase HrrP cleaves host-encoded signaling peptides and mediates symbiotic compatibility. PNAS USA, 2015, 112(49): 15244-15249 ( ) DOI: 10.1073/pnas.1417797112
- Silipo A., Vitiello G., Gully D., Sturiale L., Chaintreuil C., Fardoux J., Gargani D., Lee H.-I., Kulkarni G., Busset N., Marchetti R., Palmigiano A., Moll H., Engel R., Lanzetta R., Paduano L., Parrilli M., Chang W.-S., Holst O., Newman D.K., Garozzo D., D'Errico G., Giraud E., Molinaro A. Covalently linked hopanoid-lipid A improves outer-membrane resistance of a Bradyrhizobium symbiont of legumes. Nat. Commun., 2014, 5: 5106 ( ) DOI: 10.1038/ncomms6106
- Kulkarni G., Busset N., Molinaro A., Gargani D., Chaintreuil C., Silipo A., Giraud E., Newman D.K. Specific hopanoid classes differentially affect free-living and symbiotic states of Bradyrhizobium diazoefficiens. MBio Jounal, 2015, 6(5): e01251-15 ( ) DOI: 10.1128/mBio.01251-15
- Alunni B., Kevei Z., Redondo-Nieto M., Kondorosi A., Mergaert P., Kondorosi E. Genomic organization and evolutionary insights on GRP and NCR genes, two large nodule-specific gene families in Medicago truncatula. Mol. Plant-Microbe Interact., 2007, 20(9): 1138-1148 ( ) DOI: 10.1094/MPMI-20-9-1138
- Kim M., Chen Y., Xi J., Waters C., Chen R., Wang D. An antimicrobial peptide essential for bacterial survival in the nitrogen-fixing symbiosis. PNAS USA, 2015, 112(49): 15238-15243 ( ) DOI: 10.1073/pnas.1500123112
- Horváth B., Domonkos Á., Kereszt A., Szűcs A., Ábrahám E., Ayaydin F., Bóka K., Chen Y., Chen R., Murray J.D., Udvardi M.K., Kondorosi É., Kaló P. Loss of the nodule-specific cysteine rich peptide, NCR169, abolishes symbiotic nitrogen fixation in the Medicago truncatula dnf7 mutant. PNAS USA, 2015, 112(49): 15232-15237 ( ) DOI: 10.1073/pnas.1500777112
- Lang C., Long S.R. Transcriptomic analysis of Sinorhizobium meliloti and Medicago truncatula symbiosis using nitrogen fixation-deficient nodules. Molecular Plant-Microbe Interactions, 2015, 28(8): 856-868 ( ) DOI: 10.1094/MPMI-12-14-0407-R
- Alunni B., Gourion B. Terminal bacteroid differentiation in the legume-rhizobium symbiosis: nodule-specific cysteine-rich peptides and beyond. New Phytologist, 2016, 211(2): 411-417 ( ) DOI: 10.1111/nph.14025
- Клюкова М.С. Характеристика семейства генов, кодирующих NCR-пептиды, у гороха посевного (Pisum sativum L.). Маг. дис. СПб, 2016.
- Oono R., Denison R.F. Comparing symbiotic efficiency between swollen versus nonswollen rhizobial bacteroids. Plant Physiol., 2010, 154(3): 1541-1548 ( ) DOI: 10.1104/pp.110.163436


