Нефропатия при морбидном ожирении, распространенность и клинико-функциональная характеристика
Автор: Муркамилов И.Т., Айтбаев К.А., Юсупов Ф.А., Райимжанов З.Р., Юсупова З.Ф., Юсупова Т.Ф., Хакимов Ш.Ш., Солижонов Ж.И., Боймуродов Й.Р.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 3 т.11, 2025 года.
Бесплатный доступ
Морбидное ожирение определяется как индекс массы тела (ИМТ) ≥ 40 кг/м² или ИМТ ≥ 35 кг/м² в сочетании с серьезными осложнениями, связанными с ожирением. Это состояние характеризуется крайне высоким риском развития сопутствующих заболеваний. По данным мировой статистики, распространенность морбидного ожирения составляет 4-8%. Представлен клинический случай поражения почек у пациента с морбидным ожирением и сахарным диабетом 2-го типа.
Морбидное ожирение, масса тела, распространенность, почки, протеинурия, скорость клубочковой фильтрации, прогноз
Короткий адрес: https://sciup.org/14132501
IDR: 14132501 | УДК: 616.01/-099.616-06 | DOI: 10.33619/2414-2948/112/24
Текст научной статьи Нефропатия при морбидном ожирении, распространенность и клинико-функциональная характеристика
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.01/-099.616-06
Морбидное ожирение — это хроническое прогрессирующее заболевание многофакторной природы, характеризующееся избыточным накоплением жировой ткани. Согласно рекомендациям Всемирной организации здравоохранения (ВОЗ), индекс массы тела (ИМТ) >40 кг/м² классифицируется как морбидное ожирение. В то же время российские исследователи относят к морбидному ожирению состояние с ИМТ ≥40 кг/м² или ≥35 кг/м² при наличии серьезных осложнений, связанных с ожирением [1]. Общепризнано, что у пациентов с морбидным ожирением наличие сахарного диабета (СД) 2-го типа и/или артериальной гипертензии (АГ) значительно ухудшает прогноз всех инвазивных процедур, включая нефротрансплантацию [2–4].
Частота СД 2-го типа и АГ среди таких пациентов крайне высока, достигая 47% и 81% соответственно [5].
Кроме того, средний возраст пациентов с морбидным ожирением чаще всего составляет около 40 лет [6].
Медицинские, социальные и экономические аспекты морбидного ожирения связаны с системным поражением внутренних органов, нарушением функций опорно-двигательной и репродуктивной систем, развитием хронической тревоги и депрессии, а также увеличением частоты злокачественных новообразований. Средняя продолжительность жизни при морбидном ожирении сокращается на 5–20 лет в зависимости от региона проживания, этнической и расовой принадлежности, а также пола [7].
Согласно данным исследований, смертность при морбидном ожирении значительно выше среди лиц молодого возраста (18–44 лет), тогда как в возрасте 45–59 лет (средний возраст) заболевание чаще встречается у женщин [8].
Поражения почек являются одним из наиболее частых и серьезных осложнений морбидного ожирения, занимая лидирующие позиции среди причин инвалидизации и смертности [9, 10].
Спектр патофизиологических и клинических проявлений поражения почек при морбидном ожирении варьирует от малосимптомного течения, включая мочекислый диатез, протеинурию и нефротический синдром, до хронической почечной недостаточности [9, 10]. Кроме того, морбидное ожирение является значимым фактором риска развития СД 2-го типа [1, 11] и онкологических заболеваний [12, 13].
СД 2-го типа и атеросклероз, в свою очередь, являются следствием прогрессирования метаболических нарушений. В этой связи особую значимость приобретают ранняя диагностика, в том числе дифференциальная, и своевременная нефропротективная терапия.
Цель исследования: продемонстрировать клинический случай нефропатии у 42-летнего мужчины с морбидным ожирением и СД 2-го типа, а также систематизировать имеющуюся информацию по данному заболеванию.
Эпидемиологическая характеристика морбидного ожирения. По данным Е. В. Ершовой и соавторов, около 4% взрослого населения России страдает морбидным ожирением [14].
В США, по данным исследователей, распространенность морбидного ожирения превышает 8% среди взрослого населения [5].
В странах Европы каждый пятый взрослый человек имеет ИМТ > 40 кг/м². Зарубежные авторы сообщают, что среди 773 госпитализированных пациентов распространенность морбидного ожирения составила 8% [15].
Развитие морбидного ожирения обусловлено сочетанным влиянием генетических и эпигенетических факторов, особенностей образа жизни и факторов окружающей среды. Исследование А. А. Ивановой и соавторов выявило, что гетерозиготные генотипы rs9939609 гена FTO (АТ) и rs17782313 гена MC4R (ТС) являются генотипами риска, в то время как гомозиготный генотип ТТ этих вариантов условно защищает женщин от развития морбидного ожирения [8].
Следует отметить, что генетический полиморфизм морбидного ожирения влияет на развитие сопутствующих заболеваний, ассоциированных с ожирением. Ассоциации различных генетических вариантов подробно представлены в ряде исследований [16, 17].
Почки при морбидном ожирении. Разнообразие этиологических факторов и сложность механизмов заболеваний почек при морбидном ожирении создают значительные трудности в диагностике и лечении данной патологии. Установлено, что частота госпитальной смертности у пациентов с морбидным ожирением выше, чем у лиц с нормальной массой тела [15].
Нефрологи и эндокринологи чаще всего сталкиваются с метаболическими заболеваниями почек у данной категории пациентов. У лиц с ИМТ >40 кг/м² нередко наблюдаются снижение pH мочи, повышенная экскреция оксалатов и мочевой кислоты. Эти изменения, в сочетании с ограничением физической активности, приводят к накоплению жировой ткани в почечных синусах. Данный процесс активирует локальную гиперактивность симпатоадреналовой системы, а также ренин-ангиотензин-альдостероновой системы, что в конечном итоге способствует развитию альбуминурии.
Описание клинического случая. Пациент Н., 45 лет, проживающий в сельской местности, обратился в клиническую базу кафедры факультетской терапии КГМА им. И. К. Ахунбаева (г. Бишкек) 8.01.2025 г. с жалобами на изменение цвета мочи. Физикальные данные: пациент Н., 45 лет, повышенного питания (Рисунок 1), рост 187 см, вес 175 кг, индекс массы тела 50 кг/м2. Артериальное давление (АД) 140/80 мм рт. ст., частота сердечных сокращений (ЧСС) 88 уд/мин. Сатурация кислорода в покое на атмосферном воздухе 95%. Как показано на Рисунке 1 и 2, у пациента прослеживаются неравномерное избыточное развитие жировой ткани, гинекомастия, увеличение объема живота за счет толщины подкожно-жировой клетчатки. Из анамнеза также известно, что пациент в течение двух лет состоит на диспансерном учете по поводу СД 2-го типа, принимает пероральные сахароснижающие препараты.
Данные инструментальных исследований. По результатам ЭКГ у пациента выявлено экстрасистолическая аритмия (Рисунок 3).
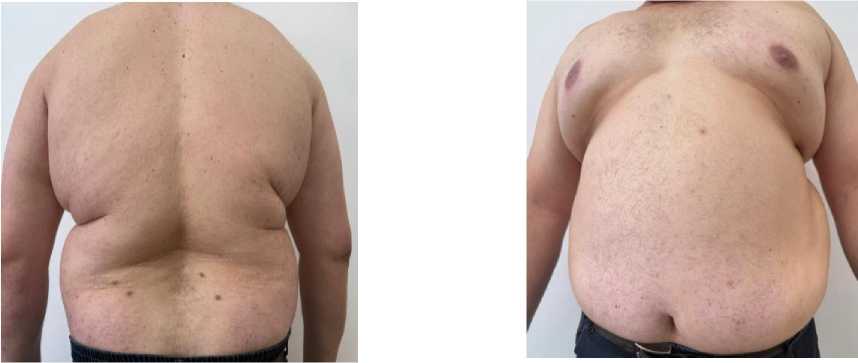
Рисунок 1. Внешний вид пациента Н., 45 лет: вид спереди, сзади
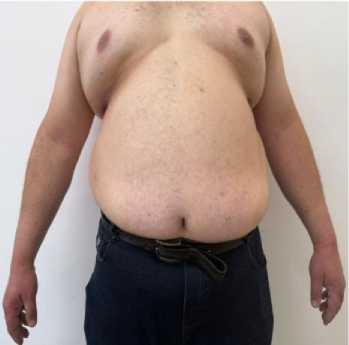
Рисунок 2. Внешний вид пациента Н., 45 лет: вид спереди и сбоку (справа)
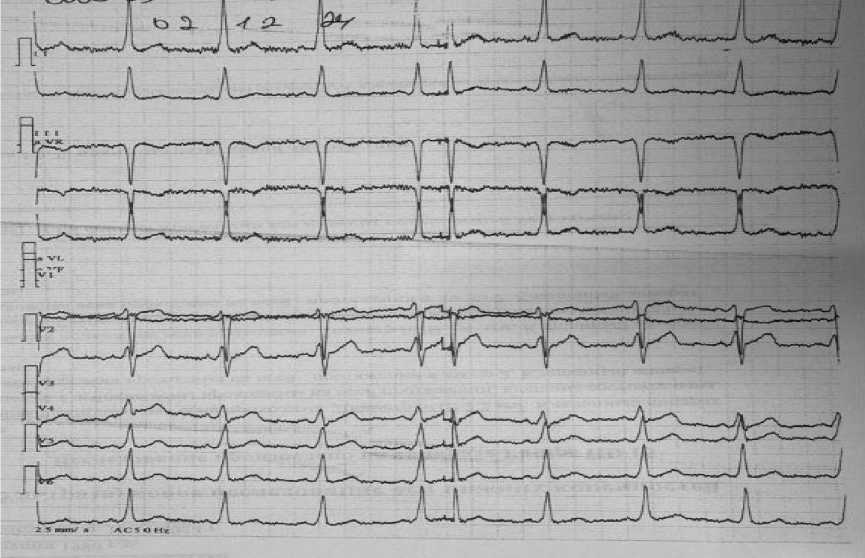
Рисунок 3. Электрокардиография пациента Н., 45 лет
Результаты ультразвукового исследования внутренних органов. Правая почка: неполное удвоение, визуализация удовлетворительная, топография не изменена, физиологическая подвижность не нарушена (Рисунок 4). Капсула прослеживается на всем протяжении. Контуры четкие, ровные. Размеры 152×75 мм, толщина паренхимы 24 мм. Эхогенность паренхимы обычной акустической плотности, эхоструктура однородная, кортико-медуллярная дифференциация сохранена, уплотнена. Чашечно-лоханочная система не дилатирована, дополнительные интра- и параренальные включения не определяются. При допплероангиографии сосудистый рисунок не изменен и прослеживается до капсулы. Мочеточник в верхней трети не визуализируется. Левая почка: визуализация удовлетворительная, топография не изменена, физиологическая подвижность не нарушена (Рисунок 4). Капсула прослеживается на всем протяжении, контуры четкие, ровные. Размеры 145×75 мм, толщина паренхимы 22 мм. Эхогенность паренхимы обычной акустической плотности, эхоструктура однородная, кортико-медуллярная дифференциация сохранена, уплотнена. Чашечно-лоханочная система не дилатирована, дополнительные интра- и параренальные образования и конкременты не выявлены. При допплероангиографии сосудистый рисунок не изменен, прослеживается до капсулы (Рисунок 5 и 6). Мочеточник в верхней трети не визуализируется. В брюшной полости, а также в синусах плевры с обеих сторон свободная жидкость не выявлена.

Рисунок 4. Показатели УЗИ почек пациента Н., 45 лет
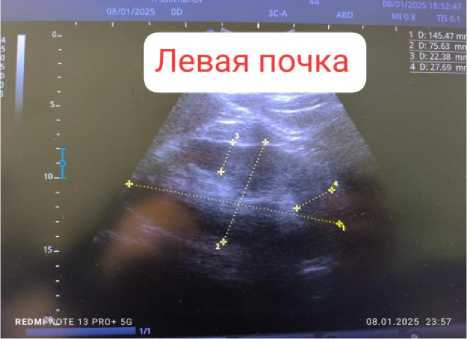
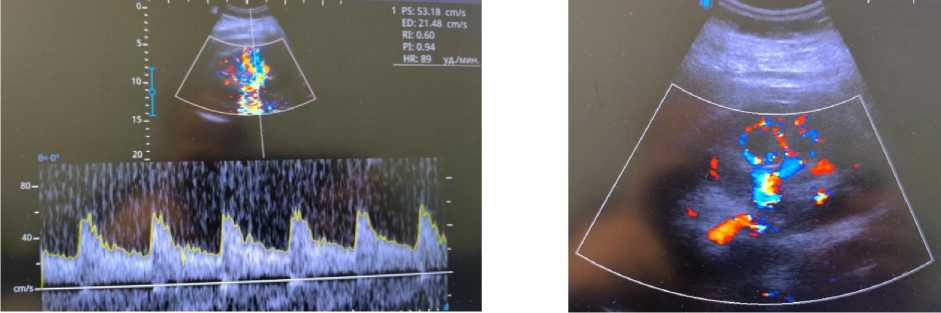
Рисунок 5. Показатели допплерографии сосудов почек пациента Н., 45 лет
Печень: визуализация удовлетворительная, расположение органа типичное. Капсула в визуализируемых участках уплотнена. Размеры долей печени увеличены. Передне-задний размер правой доли составляет 122 мм, кранио-каудальный – 163 мм, косой вертикальный –
181 мм. Передне-задний размер левой доли – 79 мм, хвостатой доли – 26 мм. Паренхима печени повышенной эхогенности, мелкозернистая, с однородной, диффузно уплотненной эхоструктурой. Звукопроводимость паренхимы ослаблена. Внутрипеченочные сосуды и желчные протоки не расширены, их стенки без признаков уплотнения. Диаметр воротной вены – 9,6 мм. Желчный пузырь: Визуализация удовлетворительная, расположение типичное. Размеры жёлчного пузыря составляют 80×33 мм. Форма обычная, контуры ровные и четкие. Стенки неравномерно утолщены до 4,7 мм и уплотнены. Содержимое гомогенное. Внепеченочные желчные протоки без признаков расширения, их стенки не изменены. Диаметр общего желчного протока – 4,0 мм.
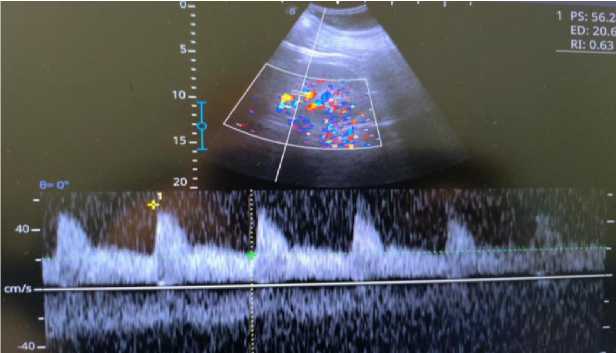
Рисунок 6. Показатели допплерографии сосудов почек пациента Н., 45 лет
Поджелудочная железа: визуализация удовлетворительная. Размеры органа: головка – 22 мм, тело – 11 мм, хвост – 20 мм. Контуры неровные, но четкие, сохранены. Эхогенность паренхимы обычная, эхоструктура однородная, без признаков очаговых изменений. Визуализируемые фрагменты вирсунгова протока не расширены, его стенки без патологических изменений. Селезёнка: визуализация удовлетворительная, топография органа не изменена. Размеры составляют 107×50 мм. Контуры ровные, четкие, сохранены. Структура органа хорошо дифференцируется, визуализируемые участки капсулы без изменений. Паренхима гомогенная, без признаков очаговых и диффузных изменений. Визуализируемые фрагменты паренхиматозных сосудов и сосудов ножки без патологических особенностей. Организованных включений в паралиенальном пространстве не выявлено.
Предстательная железа (трансабдоминальный доступ): визуализация удовлетворительная. Железа симметричная, обычной формы, без увеличения в размерах. Контуры ровные, четкие. Зональная дифференциация снижена. Размеры составляют 34×28×48 мм, объем – 24 см³. Эхогенность железы неравномерно повышена, эхоструктура неоднородная за счет чередования зон повышенной и пониженной эхогенности. Переходные зоны и периуретральные железы не гиперплазированы, уплотнены. Уретра имеет обычный ход. Мочевой пузырь: расположен типично, форма обычная. Дифференциация слоев стенки нарушена, слизистая ровная. Стенки не утолщены (3,6 мм), контуры ровные и четкие. Содержимое анэхогенное, гомогенное. Объем мочевого пузыря составляет 201 мл. Признаков конкрементов и объемных образований не выявлено. Интрамуральные отделы и устья мочеточников без изменений. Поступление мочи из правого и левого мочеточников визуализируется. Семенные пузырьки: не увеличены, продолговатой формы, контуры ровные и четкие, без признаков расширения.
Заключение: сонографические данные свидетельствуют о гепатомегалии, стеатогепатозе, признаках хронического холецистита, липоматозе поджелудочной железы, неполном удвоении правой почки, увеличении размеров почек, а также о диффузных изменениях предстательной железы по типу хронического простатита.
Щитовидная железа: визуализация удовлетворительная. Железа расположена типично, обычной формы, подвижна при глотании, асимметричная. Контуры ровные и четкие. Перешеек толщиной 3,8 мм. Узловых образований не выявлено. Правая доля: размеры 20×16×47 мм (объем – 8,5 см³). Паренхима однородная, мелкозернистой эхоструктуры, обычной эхогенности. Васкуляризация при триплексном сканировании не усилена. Узловых образований не выявлено. Левая доля: размеры 20×15×49 мм (объем – 8,4 см³). Паренхима однородная, мелкозернистой эхоструктуры, обычной эхогенности. Васкуляризация при цветовом триплексном сканировании не усилена. Узловых образований не выявлено. Суммарный объем железы составляет 16,9 см³, что не превышает возрастную норму по данным ВОЗ. Патологически измененные или увеличенные шейные лимфатические узлы не визуализируются. Заключение: эхоструктурная патология щитовидной железы не выявлена.
Общеизвестно, что морбидное ожирение значительно увеличивает риск развития бронхолегочных заболеваний, включая хроническую обструктивную болезнь легких (ХОБЛ). Учитывая этот факт, пациенту было проведено исследование воздушного потока для оценки функции внешнего дыхания (ФВД). Как показано на Рисунке 7, по данным ФВД нарушений бронхиальной проходимости не выявлено. Показатель форсированной жизненной емкости легких (ФЖЕЛ) находился в пределах нормы, а соотношение объема форсированного выдоха за 1 секунду (ОФВ1) к ФЖЕЛ составило 83%. Реакция на введение 400 мкг сальбутамола оказалась отрицательной: коэффициент бронходилатации (КБД) для ОФВ1 составил 4% (абсолютное значение — 160 мл), для ФЖЕЛ — 3% (абсолютное значение — 140 мл).
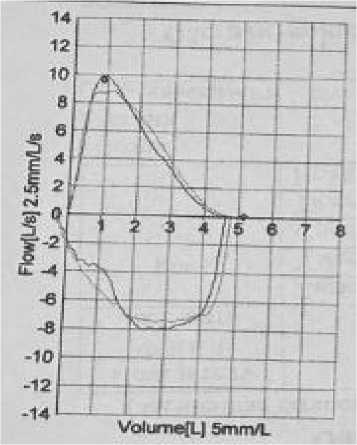
Рисунок 7. Показатели ФВД пациента Н., 45 лет
Эхокардиография: аорта уплотнена, конечный систолический размер левого желудочка 3,2 см, конечный диастолический размер левого желудочка 5,0 см, толщина задней стенки левого желудочка 1,0 см, толщина межжелудочковой перегородки 1,1 см. Продольный размер правого желудочка 2,5 см, систолический уровень легочного артериального давления 24 мм рт. ст., правое предсердие не расширено. Сократительная функция левого желудочка оценивается как удовлетворительная. Зон гипо- и акинеза желудочков не выявлены. При допплерографии сосудов нижних конечностей нарушений кровотока и признаков тромбоза и/или эмболии не обнаружено. При допплерографическом исследовании сосудов нижних конечностей кровоток не нарушен. Признаков тромбоза или эмболии не обнаружено.
Лабораторные исследования. Клинический анализ крови: гемоглобин 176 г/л, эритроциты 6,20×10¹²/л, цветной показатель 0,93, гематокрит 53,8%, тромбоциты 276×10⁹/л, лейкоциты 7,07×10⁹/л, лимфоциты: 44,1%, СОЭ 4 мм/час. Коагулограмма: протромбиновое время 9,4 сек, тромбиновое время 16,9 сек, протромбиновый индекс 153,4%, МНО 0,81, фибриноген 2,54 г/л, АЧТВ 25,9 сек, D-димер 1,22 мгFEU/л, антитромбин III 72,4%. Биохимический анализ крови: глюкоза венозной крови натощак 6,4 ммоль/л, общий билирубин 14,50 мкмоль/л, АЛТ 24,56 ед/л, АСТ 20,64 ед/л, щелочная фосфатаза 72 ед/л, ГГТ 29 ед/л, общий белок 68,7 г/л, альбумин: 42,5 г/л, мочевая кислота 310,61 мкмоль/л. Липидный профиль: общий холестерин 5,09 ммоль/л, холестерин ЛПВП 0,94 ммоль/л, холестерин ЛПНП 3,34 ммоль/л, триглицериды 1,82 ммоль/л. Гормональный статус: витамин D 16,40 нг/мл (норма: 30-100), паратгормон 79,6 пг/мл (норма: 9,7-75), ТТГ 0,46 мкМЕ/мл, Т4 свободный 19,12 пмоль/л, Т3 общий 1,48 пмоль/л, антитела к тиреопероксидазе 2,44 мМЕ/л (норма: до 30). Иммунологические и инфекционные тесты: антитела к ВИЧ – отрицательные, антитела к вирусу гепатита В и С не выявлены, реакция Вассермана отрицательная, Human Leukocyte Antigens-B 27 – не выявлены, ревматоидный фактор отрицательный. Цитокиновый статус: интерлейкин-6 10,9 пг/мл (норма: до 10), интерлейкин-10: 2,0 пг/мл (норма: до 10), ФНО-α 1,30 пг/мл (норма: до 6), VEGF 245,29 пг/мл (норма: 10-700). Функция почек: креатинин 59,35 мкмоль/л, мочевина 5,03 ммоль/л, остаточный азот 13,58 ммоль/л, СКФ (по CKD-EPI, Chronic Kidney Disease Epidemiology Collaboration) 105 мл/мин, суточная протеинурия 9,99 г, анти-PLA2R (Antibodies to the phospholipase A2 receptor / antibodies to the phospholipase A2 receptor) отрицательные. Простатический специфический антиген (ПСА): общая фракция 0,237 нг/мл, свободная фракция 0,063 нг/мл.
На основании клинических, анамнестических, инструментальных и лабораторных данных пациенту поставлен клинический диагноз: Неполный нефротический синдром с сохранной азотовыделительной функцией почек. Морбидное ожирение. Сахарный диабет 2го типа, целевой уровень гликированного гемоглобина <7,5%. Начато проведение нефропротективной терапии: ингибиторы натрийзависимого переносчика глюкозы 2 типа, ингибиторы ангиотензинпревращающего фермента, антагонисты минералокортикоидных рецепторов, статины, антиагреганты, диуретики и антикоагулянты.
Обсуждение
Согласно «Практическому руководству по выявлению, оценке и лечению избыточного веса и ожирения у взрослых», разработанному Национальным институтом здоровья США и Североамериканской ассоциацией по изучению ожирения, морбидное ожирение определяется как ИМТ≥40 кг/м² или ИМТ≥35 кг/м² в сочетании с серьёзными сопутствующими заболеваниями [19]. При этом морбидное ожирение сопровождается увеличением концентрации свободных жирных кислот и продукцией воспалительных цитокинов, что запускает развитие инсулинорезистентности. В результате каждый второй пациент с этим видом ожирения имеет СД 2-го типа [20]. Данный факт подтверждается и в нашем клиническом случае: пациент Н., 45 лет, с морбидным ожирением имеет СД 2-го типа, АГ и нефропатию. Как уже упоминалось, с ростом распространённости морбидного ожирения увеличивается и частота нефропатий в общей популяции. В структуре вторичных нефропатий поражение почек при морбидном ожирении занимает ведущее место [10, 11].
В нефрологической практике хроническая почечная недостаточность (ХПН) у пациентов с морбидным ожирением часто диагностируется на поздних стадиях. Ранние исследования показали, что у таких пациентов нефробиопсия выявляет гломеруломегалию в сочетании с фокально-сегментарным гломерулосклерозом (ФСГС/FSGS, focal segmental glomerulosclerosis) [21]. У большинства из них отмечается утолщение гломерулярной базальной мембраны и снижение количества фильтрационных пор из-за утолщения ножек подоцитов. В одном из исследований выявлена взаимосвязь между площадью поверхности клубочка и массой тела (r = 0,462, p = 0,05), а также между толщиной базальной мембраны и уровнями гликированного гемоглобина, холестерина и триглицеридов (r = 0,60, p = 0,05; r = 0,789, p = 0,004; r = 0,70, p = 0,016 соответственно) [21]. Позднее был изучен гистологический спектр изменений при нефробиопсии у пациентов с морбидным ожирением [5]. Так, среди 3263 биоптатов нативной почки, проанализированных в Колумбийском университете, 248 принадлежали пациентам с морбидным ожирением. Средний возраст пациентов составил 53 года, а средний ИМТ – 44,0 кг/м². Расчётная скорость клубочковой фильтрации (СКФ) составляла 30 мл/мин/1,73 м², и у большинства пациентов наблюдалась протеинурия нефротического уровня. Гломеруломегалия была зафиксирована у 73 пациентов, а у 167 диагностированы такие состояния, как диабетическая нефропатия, острый канальцевый некроз, гипертонический нефросклероз, иммуноглобулин А-нефропатия, мембранозная нефропатия и волчаночный нефрит [5].
Важно отметить, что практически у каждого второго пациента результаты нефробиопсии приводили к пересмотру и коррекции терапевтической стратегии. Большинство исследований свидетельствуют об увеличении частоты нефропатий при морбидном ожирении. На ранних стадиях диабетической нефропатии поражения почек характеризуются гломеруломегалией и альбуминурией. В случае нашего пациента Н. лабораторные признаки нефропатии могли ускориться вследствие наложения СД 2-го типа. Однако, по техническим причинам и из-за отказа пациента от проведения диагностической процедуры, нефробиопсия не была выполнена.
В публикации B. L. Erstad и D. E. Nix (2021) обсуждались клинические проблемы оценки фильтрационной функции почек у лиц с морбидным ожирением [22]. Практика показывает, что пациенты с морбидным ожирением часто страдают от суставных болей, хронических запоров и вентральных грыж. В работе российских исследователей [23] проанализирована частота морбидного ожирения среди пациентов с вентральной грыжей, где в 72% случаев выявлено ожирение, а в 31% – метаболический синдром, обусловленный морбидным ожирением. Изменение физико-химических свойств желчи и хронический запор у таких пациентов являются ключевыми факторами в патогенезе формирования вентральных грыж наряду с повышением внутрибрюшного давления. Увеличение времени операции и интраоперационной кровопотери у пациентов с морбидным ожирением становится всё более актуальной проблемой в клинической практике [24].
Хирургические вмешательства у этой категории пациентов требуют повышенных доз анестетиков, что увеличивает риск постоперационных осложнений [25]. На фоне морбидного ожирения чаще наблюдаются острое повреждение почек и дыхательная недостаточность [26]. Также особое внимание следует уделять риску тромбоза глубоких вен и тромбоэмболии легочной артерии. У пациента Н., 45 лет, были выявлены высокий уровень D-димера и эритроцитоз, свидетельствующие о повышенном риске тромботических осложнений, однако данные инструментальных исследований признаков тромбоза не показали.
Заключение
Комплексная клинико-инструментальная и лабораторная диагностика позволила выявить у пациента Н., 45 лет, нефротическую протеинурию, развившуюся на фоне морбидного ожирения и СД 2-го типа. Эти данные подчеркивают необходимость раннего выявления и мониторинга состояния почек у пациентов с морбидным ожирением. Тканевая биопсия остаётся «золотым стандартом» диагностики, позволяя уточнить клиникогистологический диагноз и оптимизировать ренопротективную терапию. Однако её применение ограничено техническими и организационными трудностями, особенно в отдалённых регионах. В связи с этим перспективным направлением становится использование жидкостной биопсии, обладающей высоким диагностическим и прогностическим потенциалом. Удлинение додиализного периода у пациентов с морбидным ожирением требует командного подхода с участием нефролога, эндокринолога, диетолога, психотерапевта и специалиста по метаболической хирургии. В условиях отсутствия доступа к тканевой биопсии важное значение приобретают меры профилактики системных тромбоэмболических осложнений, особенно у пациентов с высоким риском тромбозов. Эффективное управление данной патологией требует интеграции современных диагностических технологий, адекватной медикаментозной терапии и индивидуализированного подхода к каждому пациенту, что позволит не только улучшить прогноз, но и повысить качество жизни этой группы пациентов.
Информированное согласие. От пациента было получено письменное добровольное информированное согласие на публикацию описания клинического случая, результатов его обследования и лечения, а также его изображений в медицинском журнале, включая его электронную версию (дата подписания 9.01.2025г.).
Прозрачность исследования. Исследование не имело спонсорской поддержки. Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать.
Декларация о финансовых и других взаимоотношениях. Все авторы принимали участие в разработке концепции статьи и в написании рукописи. Окончательная версия рукописи была одобрена всеми авторами. Авторы не получали гонорар за статью.


