Нейроэндокринная опухоль тонкой кишки и карциноидный синдром: трудности диагностики (клиническое наблюдение)
Автор: Родионов Е.О., Столярова В.А., Миллер С.В., Подолько Д.В., Тузиков С.А., Безгодова Н.В., Мох А.А., Маркович В.А., Миллер Д.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.21, 2022 года.
Бесплатный доступ
Актуальность. Нейроэндокринные опухоли (НЭО) тонкой кишки являются редкими и медленно растущими опухолями, которые возникают из нейроэндокринных клеток желудочно-кишечного тракта, синтезирующих серотонин и другие вазоактивные молекулы. Диагностика является сложной задачей, и зачастую диагноз устанавливается на поздней стадии заболевания, поскольку опухоль длительное время может быть бессимптомной или сопровождаться неспецифическими жалобами со стороны желудочно-кишечного тракта. Примерно у 40 % пациентов в результате гормональной активности нейроэндокринных опухолей тонкой кишки развивается карциноидный синдром. Хирургическое лечение является единственным методом лечения локализованных НЭО тонкой кишки. Пятилетняя выживаемость пациентов составляет около 85 %, с медианой 9,3 года. Описание клинического случая. Больную длительное время беспокоили жалобы на сухие «приливы», представляющие собой выраженное покраснение кожи лица и в меньшей степени кожи туловища, сопровождающиеся чувством жара, выраженной головой болью и слезотечением, общей слабостью, ощущением истощения. Пациентка на протяжении 14 лет безуспешно проходила симптоматическое лечение у разных специалистов (гинеколога, терапевта, психиатра, эндокринолога и др.). В результате длительного и комплексного обследования был установлен диагноз нейроэндокринной опухоли подвздошной кишки. Пациентка была радикально прооперирована (pt2N1m0. Ст. iiiB, g2), но с учетом факторов неблагоприятного прогноза (метастаз в лимфатический узел брыжейки, наличие карциноидного синдрома, повышенные биохимические маркеры, уровень Ki67 6 %, наличие рецепторов соматостатина 2-го и 5-го типа в 60 % опухолевых клеток) в дальнейшем пациентке показано лечение аналогами соматостатина. Заключение. При подозрении на НЭО тонкой кишки, особенно при наличии карциноидного синдрома, следует приложить все усилия для подтверждения диагноза с помощью комбинации анатомической и функциональной визуализации опухоли с биохимическими маркерами. Правильная трактовка клинической картины позволила бы направить пациентку на такие исследования, как соматостатин-рецепторная сцинтиграфия и/или 68ga-ПЭТ/КТ с исследованием биохимических маркеров в крови и моче и, соответственно, диагностировать НЭО тонкой кишки в более ранние сроки и на ранней стадии.
Нейроэндокринная опухоль, нейроэндокринные биомаркеры, нейроэндокринная опухоль тонкой кишки, карциноидный синдром, карциноидное сердце
Короткий адрес: https://sciup.org/140295074
IDR: 140295074 | УДК: 616.341-006.4+616-006.86]-07-08 | DOI: 10.21294/1814-4861-2022-21-3-160-167
Текст научной статьи Нейроэндокринная опухоль тонкой кишки и карциноидный синдром: трудности диагностики (клиническое наблюдение)
Нейроэндокринные опухоли (НЭО) тонкой кишки являются редкими и медленно растущими опухолями, которые возникают из нейроэндокринных клеток желудочно-кишечного тракта, синтезирующих серотонин и другие вазоактивные молекулы [1]. Частота встречаемости составляет менее 0,8 на 100 000 человек в год [2], при этом НЭО составляют до 40 % всех новообразований тонкой кишки [3, 4].
Диагностика НЭО тонкой кишки является сложной задачей, и зачастую диагноз устанавливается на поздней стадии заболевания, поскольку опухоль длительное время может быть бессимптомной или сопровождаться неспецифическими жалобами со стороны желудочно-кишечного тракта [4]. В редких случаях заболевание может манифестировать такими осложнениями, как кишечная непроходимость, перфорация кишки или кровотечение [5]. НЭО тонкой кишки имеют высокую склонность к метастазированию в лимфатические узлы корня брыжейки и в печень [1]. Примерно у 40 % па- циентов в результате гормональной активности нейроэндокринных опухолей тонкой кишки с гиперпродукцией вазоактивных веществ, главным образом серотонина, развивается карциноидный синдром. Клинические проявления варьируют от классической триады (покраснение кожи, диарея и бронхоспазм) до нервно-психических симптомов, пеллагры и развития локального или отдаленного фиброза [6]. При подозрении на НЭО тонкой кишки используются такие методы визуализации, как КТ и МРТ органов брюшной полости, 68Ga-ПЭТ/КТ в комбинации с показателями биохимических маркеров – хромогранин А, серотонин и 5-ГИУК [7].
Хирургическое лечение является единственным методом лечения локализованных НЭО тонкой кишки. Эффект применения лекарственной терапии зависит как от функциональной активности опухоли, так и от ее биологического потенциала (степени дифференцировки опухоли, наличия сосудистой и периневральной инвазии, количества некрозов, высокой митотической и пролиферативной активности клеток опухоли) [7].
Примерно 80 % пациентов умирают от печеночной недостаточности вследствие метастатического поражения, а 16 % – от кишечной непроходимости [1]. Пятилетняя выживаемость пациентов с нейроэндокринными опухолями тонкой кишки составляет около 85 %, с медианой 9,3 года [3].
Представляем клинический случай , показывающий трудности диагностики пациентки с НЭО тонкой кишки.
Пациентка Ш., 1974 г. р., считает себя больной с 2005 г., когда стала отмечать сухие «приливы» в виде выраженного покраснения кожи лица и в меньшей степени кожи туловища, сопровождающиеся чувством жара, выраженной головной болью и слезотечением, общей слабостью, ощущением истощения (рис. 1). Данные приливы возникали несколько раз в день, после приема пищи и при любых стрессовых состояниях, купировались самостоятельно. Также предъявляла жалобы на неустойчивый стул с эпизодами диареи.
Из анамнеза: наблюдалась у гинеколога с 1998 г. с диагнозом: эндометриоз тела матки, брюшины малого таза, яичников; дважды выполнялась диагностическая лапароскопия с биопсией. В 2005 г. установлена внутриматочная терапевтическая система «Мирена», после чего появились указанные жалобы. Проходила неоднократно лечение в терапевтическом стационаре с диагнозом вегето-сосудистая дистония по смешанному типу с абортивными симпато-адреналовыми кризами. Наблюдается у эндокринолога с диагнозом хронический аутоиммунный тиреоидит, гипотиреоз, принимает L-тироксин. В 2013 г. пролечена по поводу описторхоза. Несмотря на проводимую терапию, приливы сохранялись, неоднократно (2009, 2013 гг.) проводилось обследование, включая УЗИ щитовидной железы, УЗИ и МРТ органов брюшной полости малого таза – без выраженной патологии. Дважды выполнялось МРТ головного мозга (в 2009 и 2015 гг.), патологии не выявлено. Проходила лечение у психиатра по поводу сохраняющихся жалоб, без особого эффекта.
К 2019 г. частота и интенсивность приливов усилилась, вновь обратилась к эндокринологу, впервые заподозрен карциноидный синдром, назначено обследование. По данным МРТ органов брюшной полости (14.03.19): солидное образование в нижнем этаже брюшной полости, размерами 44×37 мм однородной структуры, накапливающее контраст. При видеоколоноскопии (2.04.19) признаки экстраорганной компрессии сигмовидной кишки без признаков прорастания стенки кишки извне. Онкомаркеры от марта 2019 г. (СА 19–9, СА 125, РЭА) в пределах референсных значений, повышены хромогранин А – 219 мкг/л (референсные значения <100) и суточная экскреция кортизола в моче – 501,7 нмоль/сут (референсные значения <485,6). Исследование уровня гормонов (инсулин, ФСГ, тестостерон, пролактин, ГСПГ) – показатели в пределах нормы. СКТ органов брюшной полости и малого таза (1.04.19) (пересмотр в НИИ онкологии ТНИМЦ) на уровне Th5 в брыжейке тонкой кишки – объемное образование овальной формы с четкими контурами, размерами 44×36×65 мм, неоднородной структуры, часть сосудов брыжейки тонкой кишки тесно прилежит к образованию. Кроме того, обнаружено образование, располагающееся ниже в стенке одной из петель тонкой кишки, до 28 мм в диаметре, суживающее просвет кишки, но без признаков декомпенсации (рис. 2).
Хирургическое лечение в плановом порядке проведено 7.05.2019. При лапаротомии выявлено, что в забрюшинном пространстве в проекции корня брыжейки подвздошной кишки определялась опухоль, практически не смещаемая, размером 75×55×50 мм; в проекции забрюшинной опухоли
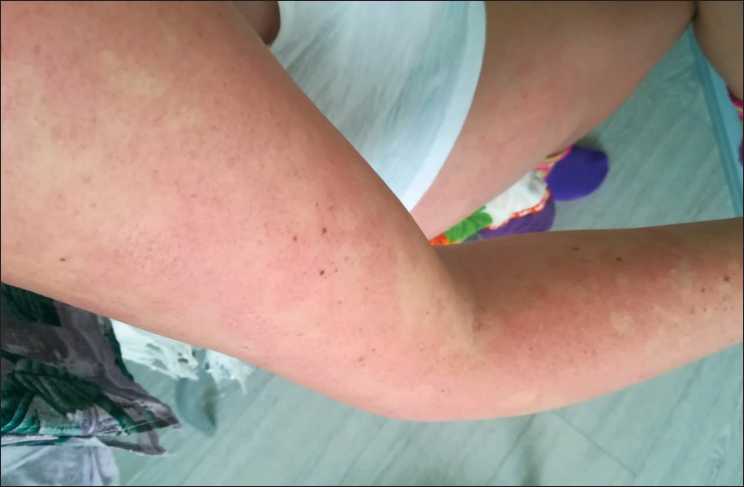
Рис. 1. Фотография пациентки во время эпизода прилива, который проявлялся множественными асимметричными пятнами пурпурно-красного цвета на коже верхних конечностей
Fig. 1. The photo of the patient during an episode of a hot flash; asymmetric multiple spots of purple-red color with localization on the upper limbs
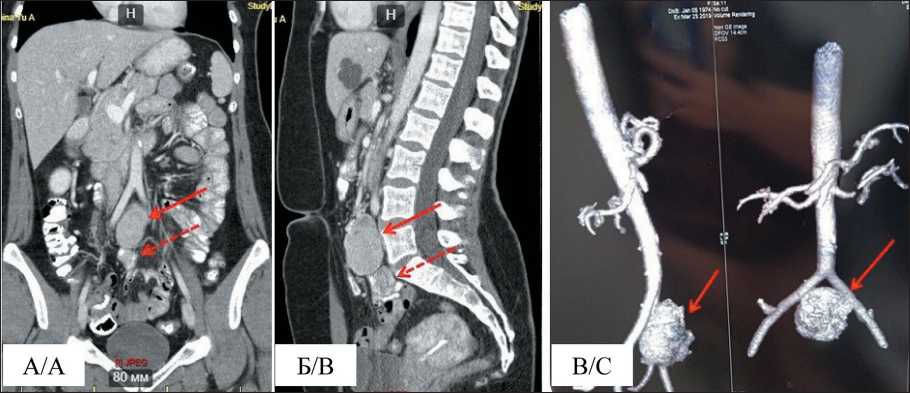
Рис. 2. КТ органов брюшной полости. На уровне Th5 в брыжейке тонкой кишки объемное образование овальной формы с четкими контурами, размерами 44×36×65 мм, неоднородной структуры, часть сосудов брыжейки тонкой кишки тесно прилежит к образованию; образование, располагающееся ниже в стенке одной из петель тонкой кишки, в диаметре размерами до 28 мм, суживает просвет кишки. Примечание: А – фронтальная проекция; Б – сагиттальная проекция; В – 3D-реконструкция. Сплошная стрелочка – метастатический узел, пунктирная – опухолевая ткань
Fig. 2. CT image. At the level of the Th5 vertebra in the mesentery of the small intestine, there is an oval large lesion with clear contours, dimensions: 44×36×65 mm, heterogeneous structure, part of the vessels of the mesentery of the small intestine is closely adjacent to the lesion. A lesion located lower in the wall of one of the loops of the small intestine up to 28 mm in diameter, narrowing the intestinal lumen. Note: A – frontal projection; B – sagittal projection; C – 3D-reconstruction. Solid arrow – metastatic node, dotted arrow – tumor tissue
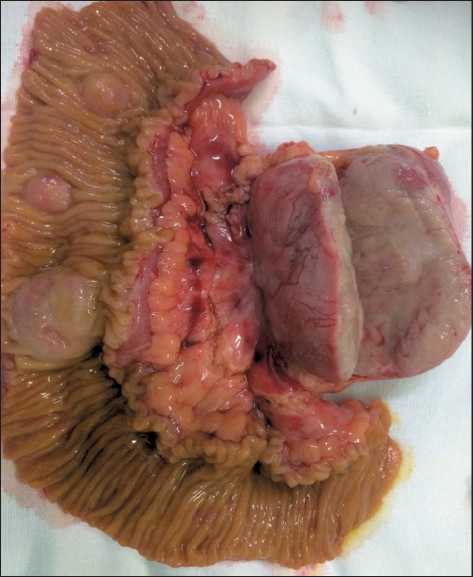
Рис. 3. Операционный препарат. Фрагмент резецированной тонкой кишки с метастатическим лимфоузлом. На поверхности слизистой оболочки кишки имеются 3 плотных округлых образования размерами до 28 мм, серо-розового цвета, деформирующих стенку. Метастатический лимфатический узел в брыжейке кишки, размером 75×55×50 мм
Fig. 3. A fragment of the removed intestine with metastatic lymph node is presented. On the surface of the mucous membrane there are 3 dense rounded lesions up to 28 mm in size, gray-pink in color, deforming the intestinal wall. The mesenteric metastatic lymph node, 75×55×50 mm is size
петля подвздошной кишки имела 3 внутристеночных плотных округлых образования, деформирующих стенку кишки. Выполнена операция в объеме комбинированной резекции неорганной забрюшинной опухоли с резекцией петель подвздошной кишки, аппендэктомией (рис. 3).
Гистологическое иссдледования от мая 2019 г.: множественная НЭО тонкой кишки с метастазом в лимфатический узел брыжейки тонкой кишки (тотальное замещение лимфатического узла опухолью), G2. По линиям резекции опухолевой ткани не обнаружено. В червеобразном отростке признаки хронического аппендицита. В клетках опухоли определяется диффузная экспрессия Syn-aptophysin, Chromogranin, Cytokeratin AE1/AE3. Пролифертивная активность высокая – Ki67 экспрессируется ~6 % опухолевых клеток (рис. 4). Дополнительно проведено ИГХ-исследование в ФГБУ «Российский научный центр радиологии и хирургических технологий им. академика А.М. Гранова» Минздрава России: позитивная реакция в опухоли на рецепторы к соматостатину 2-го и 5-го типа (60 % клеток).
На основе полученных данных установлен диагноз: нейроэндокринная опухоль подвздошной кишки, pT2N1M0. Ст. IIIB. С учетом стадии процесса, гистологического заключения, повышенного содержания в крови маркеров нейроэндокринной опухоли пациентке показано проведение адъювантного лечения в виде назначения аналогов соматостатина (Соматулин-Аутожель (ланреотид) 120 мг п/к 1 раз в 28 дней; первая инъекция от 20.06.19.). Пациентка регулярно проходила контрольное обследование: ПЭТ/КТ с 68Ga-DOTA-TATЕ и с
68Ga-DOTA-NOC, КТ ОБП и ОМТ, исследование маркеров 5-ГИУК, серотонин и хромогранин А. При очередном плановом проведении контрольного обследования ПЭТ/КТ с 68Ga-DOTA- TATE от II/2021 (в Санкт-Петербурге): признаков прогрессирования злокачественного процесса не выявлено. ПЭТ/КТ с 68Ga-DOTA-NOC от II/2021: появился сомнительный очаг в петле тонкой кишки на уровне L5 размерами 9 мм с SUV=3,2, рекомендовано наблюдение в динамике. Сохраняется высокий уровень серотонина в крови (от 1,5 до 2,5 выше нормы), уровни хромогранина А в крови и метаболитов катехоламинов и серотонина в моче (ВМК, ГВК, 5-ГИУК) в пределах нормы. По данным МРТ органов брюшной полости и малого таза от января 2022 г. явных признаков прогрессирования опухолевого процесса нет.
Пациентка продолжает биотерапию аналогами соматостатина по настоящее время. В процессе терапии регулярно выполнялось ЭХОКГ – патологических изменений не выявлено. Переносит лечение в целом удовлетворительно, с явлениями холестатического гепатита, синдрома мальабсорбции и мальдигестии, проводится коррекция лечения.
Обсуждение
Карциноидный синдром возникает в результате синергетического взаимодействия опухолевых факторов (серотонин, кинины, калликреин, простагландины и др.), попадающих в общий кровоток [5, 8]. При опухолях, ограниченных тонкой кишкой и регионарными лимфатическими узлами, большинство этих медиаторов поступает в печень и инактивируется там, следовательно, классический карциноидный синдром редко наблюдается при отсутствии отдаленного метастазирования [9, 10].
Высокий уровень циркулирующего серотонина может вызвать такое грозное осложнение, как карциноидная болезнь сердца, которая поражает до 20 % пациентов с карциноидным синдромом и характеризуется фиброзом клапанов правых отделов сердца. Клапанный фиброз в конечном итоге приводит к сердечной недостаточности и
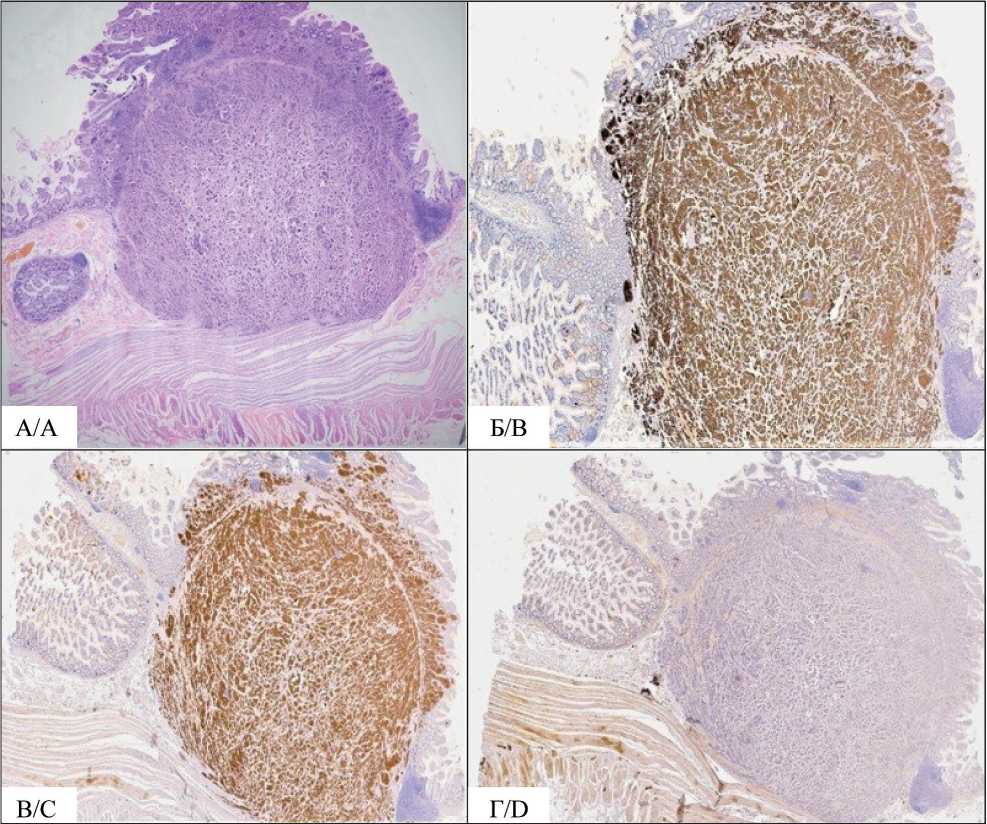
Рис. 4. Микрофото. Гистологические и иммуногистохимическое исследование, ×10:
А – в стенке тонкой кишки рост инвазивной опухоли гнездного строения, представленной крупными относительно мономорфными клетками, с хорошо заметными ядрышками и типичной конфигурацией хроматина по типу «соль с перцем», немногочисленными митозами, 4 ×10 HPF (2 мм2), окраска гематоксилином и эозином; Б – ИГХ, в опухолевых клетках выявлена диффузная экспрессия хромогранина А; В – ИГХ, диффузная экспрессия синаптофизина; Г – ИГХ, экспрессия CD56 отсутствует (ядра клеток докрашены гематоксилином Майера)
Fig. 4. Microphoto. Histological and immunohistochemical images , ×10:
A – invasive nested growth in the wall of the small intestine, represented by large relatively monomorphic cells, with clearly visible nucleoli and a typical salt and pepper chromatin configuration, few mitoses, 4 × 10 HPF (2 mm2), stained with hematoxylin and eosin; B – immunohistochemistry, diffuse expression of chromogranin A was detected in tumor cells; C – immunohistochemistry, diffuse expression of synaptophysin; D – immunohistochemistry, no expression of CD56 (cell nuclei stained with Mayer’s hematoxylin)
связан со значительно худшим прогнозом [11, 12]. Проявление карциноидной болезни сердца может быть незаметным, и его наиболее надежно выявляют с помощью эхокардиографии, хотя N-концевой натрийуретический пептид типа pro-b (NT-proBNP) является сывороточным маркером с высокой отрицательной прогностической ценностью [11, 12].
НЭО тонкой кишки, несмотря на малые размеры, имеют тенденцию вызывать выраженную фиброзную реакцию в брыжейке и часто сопровождаются метастатическим поражением регионарных лимфоузлов, в связи с чем практически у 50 % пациентов наблюдаются симптомы обструкции кишечника [13].
Карциноидный синдром в описанном клиническом случае явился первым и единственным проявлением опухолевого процесса, при этом НЭО тонкой кишки длительное время не определялась по данным инструментальных методов обследования. Несмотря на «стаж» карциноидного синдрома и высокий уровень серотонина в крови, у пациентки отсутствуют признаки фиброза клапанов и дисфункции сердца по данным ЭХОКГ. Из-за связи карциноидной болезни сердца с повышенным уровнем серотонина пациентке рекомендован препарат телотристат, который применяется у пациентов как с карциноидной болезнью сердца, так и с высоким уровнем серотонина [12].
Мультиспиральная компьютерная томография брюшной полости может служить начальным диагностическим методом, в то время как МРТ может обнаруживать метастазы в печени с более высокой точностью по сравнению с компьютерной томографией. Однако, учитывая, что большинство опухолей имеют рецепторы соматостатина, функциональные методы визуализации, такие как ПЭТ/ КТ с аналогами соматостатина, меченными галлием-68, значительно улучшили диагностическую чувствительность [14]. По данным четырех метаанализов, средняя чувствительность 68Ga-ПЭТ/ КТ для НЭО любой локализации составляет от 88 до 93 % [15]. Кроме того, использование таких биомаркеров, как хромогранин А и 5-гидроксин-долуксусная кислота (5-ГИУК) в суточной моче, широко распространено в качестве комплексной диагностики НЭО.
По данным литературы, из-за относительно редкой встречаемости нейроэндокринных опухолей, недостаточной осведомленности врачей
Список литературы Нейроэндокринная опухоль тонкой кишки и карциноидный синдром: трудности диагностики (клиническое наблюдение)
- Farley H.A., Pommier R.F. Surgical Treatment of Small Bowel Neuroendocrine Tumors. Hematol Oncol Clin North Am. 2016; 30(1): 49-61. doi: l0.l0l6/j.hoc.20l5.09.00l.
- LeeM.R., Harris C., BaegK.J., AronsonA., Wisnivesky J.P., Kim M.K. Incidence Trends of Gastroenteropancreatic Neuroendocrine Tumors in the United States. Clin Gastroenterol Hepatol. 2019; 17(11): 2212-7. doi: l0.l0l6/j.cgh.20l8.l2.0l7.
- Barsouk A., Rawla P., Barsouk A., Thandra K.C. Epidemiology of Cancers of the Small Intestine: Trends, Risk Factors, and Prevention. Med Sci (Basel). 2019; 7(3): 46. doi: 10.3390/ medsci7030046.
- Kalligeros M., Diamantopoulos L., Toumpanakis C. Bio-markers in Small Intestine NETs and Carcinoid Heart Disease: A Comprehensive Review. Biology (Basel). 2021; 10(10): 950. doi: l0.3390/biologyl0l00950.
- Modlin I.M., KiddM., Latich I., ZikusokaM.N., ShapiroM.D. Current status of gastrointestinal carcinoids. Gastroenterology. 2005; 128(6): 1717-51. doi: l0.l053/j.gastro.2005.03.038.
- Clement D., Ramage J., Srirajaskanthan R. Update on Pathophysiology, Treatment, and Complications of Carcinoid Syndrome. J Oncol. 2020. doi: 10.1155/2020/8341426.
- ОрелН.Ф., AртамоноваE.B., ГорбуноваB.A., Делектор-ская B.B., Емельянова Г.С., Любимова H.B., Маркович A.A., Орлова К.В., Орлова Р.В., Трифанов В.С. Практические рекомендации по лекарственному лечению нейроэндокринных неоплазий желудочно-кишечного тракта, поджелудочной железы и других локализаций. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2. 2021; 11: 499-512 [Orel N.F., Artamonova E. V., Gorbunova VA., Delektorskaya V.V., Emelyanova G.S., Lyubimova N.V., Markovich A.A., Orlova K.V., Orlova R.V., Trifanov V.S. Practical recommendations for drug treatment of neuroendocrine neoplasms of the gastrointestinal tract, pancreas and other localizations. Malignant tumors. Practical advice from RUSSCO. #3s2. 2021; 11: 499-512. (in Russian)].
- Granberg D. Biochemical Testing in Patients with Neuroendocrine Tumors. Front Horm Res. 2015; 44: 24-39. doi: 10.1159/000381981.
- Singh S., Asa S.L., Dey C., KenneckeH., LaidleyD., Law C., Asmis T., Chan D., Ezzat S., Goodwin R., Mete O., Pasieka J., Rivera J., Wong R., Segelov E., Rayson D. Diagnosis and management of gastrointestinal neuroendocrine tumors: An evidence-based Canadian consensus. Cancer Treat Rev. 2016; 47: 32-45. doi: 10.1016/j.ctrv.2016.05.003.
- ScottA.T., Howe J.R. Management of Small Bowel Neuroendocrine Tumors. J Oncol Pract. 2018; 14(8): 471-82. doi: 10.1200/J0P. 18.00135.
- Luis S.A., Pellikka P.A. Carcinoid heart disease: Diagnosis and management. Best Pract Res Clin Endocrinol Metab. 2016; 30(1): 149-58. doi: 10.1016/j.beem.2015.09.005.
- Strosberg J.R., Halfdanarson T.R., BellizziA.M., Chan J.A., Dillon J.S., Heaney A.P., Kunz P.L., O'Dorisio T.M., Salem R., Segelov E., Howe J.R., Pommier R.F., Brendtro K., Bashir M.A., Singh S., SoulenM.C., TangL., Zacks J.S., Yao J.C., BergslandE.K. The North American Neuroendocrine Tumor Society Consensus Guidelines for Surveillance and Medical Management of Midgut Neuroendocrine Tumors. Pancreas. 2017; 46(6): 707-14. doi: 10.1097/MPA.0000000000000850.
- Howe J.R., CardonaK., FrakerD.L., KebebewE., UntchB.R., Wang Y.Z., Law C.H., Liu E.H., Kim M.K., Menda Y., Morse B.G., BergslandE.K., Strosberg J.R., NakakuraE.K., PommierR.F. The Surgical Management of Small Bowel Neuroendocrine Tumors: Consensus Guidelines of the North American Neuroendocrine Tumor Society. Pancreas. 2017; 46(6): 715-31. doi: 10.1097/ MPA.0000000000000846.
- Maxwell J.E., Howe J.R. Imaging in neuroendocrine tumors: an update for the clinician. Int J Endocr Oncol. 2015; 2(2): 159-68. doi: 10.2217/ije.14.40.
- Sundin A., ArnoldR., BaudinE., Cwikla J.B., ErikssonB., Fanti S., Fazio N., Giammarile F., Hicks R.J., Kjaer A., Kren-ning E., Kwekkeboom D., Lombard-Bohas C., O'Connor J.M., O'Toole D., RockallA., Wiedenmann B., Valle J.W., Vullierme M.P.; Antibes Consensus Conference participants. ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: Radiological, Nuclear Medicine & Hybrid Imaging. Neuroendo-crinology. 2017; 105(3): 212-44. doi: 10.1159/000471879.


