Некоторые аспекты ревизионного эндопротезирования тазобедренного сустава. Пластика костных дефектов губчатыми аллоплантами
Автор: Мухаметов Урал Фаритович, Мухаметов Фарит Фагимович, Сулейманов Ямиль Нуриманович, Нагаев Ринат Явдатович, Нигматуллин Рафик Талгатович, Шангина Ольга Ратмировна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Цель. Провести сравнительную оценку частоты развития расшатывания эндопротезов тазобедренного сустава с цементной и бесцементной фиксацией, разработать рекомендации для удаления костного цемента из бедренного канала, оценить эффективность применения спейсеров и предлагаемого метода восполнения костного дефекта компонентов вертлужной впадины. Материалы и методы. Представлен анализ показаний для проведения операций репротезирования тазобедренного сустава и сравнительная частота его выполнения после использования эндопротезов с бесцементной и цементной фиксацией. Из 33 пациентов с нестабильностью имплантата 28 (84,8 %) больных имели эндопротезы с цементной фиксацией. Отмечена необходимость щадящего удаления имеющегося первичного эндопротеза, предложен метод удаления костного цемента из бедренного канала с сохранением проксимального отдела бедренной кости. Для пластики костных дефектов предложено использовать губчатые аллогенные костные трансплантаты, изготовленные в ФГБУ «Всероссийский центр глазной и пластической хирургии»» Минздрава России (г. Уфа) из утилизированных головок бедренных костей. Результаты. Из 33 пациентов в сроки наблюдения от 3 до 8 лет получены хорошие результаты с функциональным состоянием оперированного сустава от 80 до 100 баллов по W.H. Harris у 23 пациентов, удовлетворительные - у 4. У 2 пациентов в течение года после операции возникло проседание ножки эндопротеза, потребовавшее повторной ее замены с хорошим результатом в сроки наблюдения 5 и 7 лет. Заключение. Представленные особенности проведения реэндопротезирования тазобедренного сустава могут быть использованы в практической ортопедии.
Эндопротез, нестабильность, тазобедренный сустав, доступы, ножки эндопротеза, ревизионное эндопротезирование, костная пластика, цементная фиксация, бесцементная фиксация
Короткий адрес: https://sciup.org/142121923
IDR: 142121923 | УДК: 616.728.2-089.227.843-77-08-039.34 | DOI: 10.18019/1028-4427-2016-4-29-35
Текст научной статьи Некоторые аспекты ревизионного эндопротезирования тазобедренного сустава. Пластика костных дефектов губчатыми аллоплантами
Рост количества операций и вовлечение широкого круга хирургов – ортопедов в выполнение операций первичного эндопротезирования сустава привело к росту количества осложнений, требующих повторного (ревизионного) эндопротезирования. По данным Эндрю-Майкла и Скотт Спорер (2014), число ревизионных эндопротезирований достигает до 10,7 % [2] от общего количества операций эндопротезирования тазобедренного сустава.
Наиболее частым показанием к повторному вмешательству служит возникшее расшатывание компонентов эндопротезов, чаще развивающееся в результате развития глубокой перипротезной инфекции [3]. Считается, что частота возникающей нестабильности при цементном и бесцементном эндопротезировании тазобедренного сустава не отличается [1].
Успех ревизионного эндопротезирования во многом зависит от решения проблем, связанных со щадящим удалением компонентов первичного эндопротеза, ликвидацией инфекционного процесса, восполнения дефектов костной ткани [4], достижения надежной фиксации и реинтеграции нового эндопротеза сустава. Технические сложности представляет удаление из бедренного канала остатков костного цемента без дополнительного разрушения стенок бедренного канала, в связи с чем предлагаются различные методы трансфеморального доступа к ножке эндопротеза и костной мантии [5]. Большое значение имеет правильно выполненное предоперационное планирование.
На выбор метода репротезирования тазобедренного сустава влияют различные факторы. При развитии
асептического расшатывания методом выбора является одноэтапная замена имплантата. При развитии глубокой инфекции большинство ортопедов предпочитают двух- и более этапную замену сустава с использованием спейсеров [6].
Целью исследования было сравнение частоты раз- вития расшатывания эндопротезов тазобедренного сустава с цементной и бесцементной фиксацией, разработка рекомендаций для удаления костного цемента из бедренного канала, оценка эффективности применения спейсеров и предлагаемого метода восполнения костного дефекта компонентов вертлужной впадины.
МАТЕРИАЛЫ И МЕТОДЫ
С 2007 по 2013 год под нашим наблюдением находилось 33 пациента в возрасте от 28 до 82 лет, которым было выполнено повторное хирургическое вмешательство по поводу нестабильности имплантатов после проведенного эндопротезирования тазобедренного сустава. Мужчин было 19, женщин – 14.
Асептическая нестабильность эндопротеза была выявлена у 19 пациентов. У 14 пациентов нестабильность эндопротеза развилась на фоне глубокой инфекции (у 2 пациентов глубокая инфекция развилась в результате перипротезного перелома бедра).
У больных с нестабильностью эндопротеза причинами первичного эндопротезирования тазобедренного сустава были первичный (идиопатический) кок-сартроз – 22 (66,6 %), ревматоидный полиартрит – 4 (12,1 %), посттравматический коксартроз – 3 (9,1 %), перелом шейки бедра 2 (6,1 %), диспластический кок- сартроз – 1 (3,05 %), асептический некроз головки бедра – 1 (3,05 %).
В таблице 1 представлен характер развившейся нестабильности эндопротеза и типы эндопротезов, использованных при первичном эндопротезировании тазобедренного сустава.
Как видно из приведенной таблицы 1, наибольшее количество пациентов было после эндопротезирования с использованием цементной фиксации – 28 (84,8 %). У всех этих больных использовался костный цемент без добавления какого-либо антибиотика.
Нестабильность только вертлужного компонента наблюдалась у 10 пациентов, только бедренного компонента – у 13 пациентов и обоих компонентов – у 10 пациентов.
Сроки развития нестабильности эндопротеза тазобедренного сустава представлены в таблице 2.
Таблица 1
Характер развившейся нестабильности эндопротеза тазобедренного сустава. Типы эндопротезов, использованных при первичном эндопротезировании
|
Тип эндопротеза |
Характер нестабильности эндопротеза |
Общее число случаев нестабильности эндопротеза |
|||||
|
асептическая нестабильность |
нестабильность на фоне глубокой инфекции |
||||||
|
вертлужный компонент |
бедренный компонент |
оба компонента |
вертлужный компонент |
бедренный компонент |
оба компонента |
||
|
Эндопротез Мюллера с укрепляющим кольцом и цементной фиксацией |
1 |
3 |
2 |
2 |
2 |
5 |
15 |
|
Эндопротез с укрепляющим кольцом Мюллера с цементной фиксацией вкладыша и бесцементной ножкой Авенир |
1 |
1 |
|||||
|
Эндопротез Мюллера с цементной фиксацией и без укрепляющего кольца |
2 |
4 |
1 |
2 |
2 |
11 |
|
|
Эндопротез «Элит плюс» с цементной фиксацией |
1 |
1 |
|||||
|
Эндопротез «Компомед» с бесцементной фиксацией |
1 |
1 |
|||||
|
Эндопротез «Биомет» с бесцементной фиксацией |
1 |
1 |
|||||
|
Эндопротез с бесцементной фиса-цией с чашкой Вагнера и ножкой Споторно |
1 |
1 |
|||||
|
Однополюсной протез Яртез с бесцементной фиксацией ножки |
2 |
2 |
|||||
|
ВСЕГО |
5 |
11 |
3 |
5 |
2 |
7 |
33 |
Таблица 2
Сроки развития нестабильности эндопротеза тазобедренного сустава после первичного эндопротезирования
|
Тип эндопротеза |
Срок развития нестабильности эндопротеза после операции |
Общее число случаев нестабильности эндопротеза |
|||||
|
асептическая нестабильность |
нестабильность на фоне глубокой инфекции |
||||||
|
менее 5 лет |
через 5 лет |
через 10 лет |
менее 5 лет |
через 5 лет |
через 10 лет |
||
|
Эндопротезы с цементной фиксацией |
14 |
– |
– |
10 |
1 |
3 |
28 |
|
Эндопротезы с бесцементной фиксацией |
5 |
– |
– |
– |
– |
– |
5 |
|
ВСЕГО |
19 |
– |
– |
10 |
1 |
3 |
33 |
Согласно приведенным данным, нестабильность эндопротеза в первые 5 лет развилась у 29 пациентов, в последующие годы – лишь у 4 пациентов. Отсюда, причина нестабильности у указанной группы больных кроется в самой операции (нарушение техники выполнения или присоединение инфекции в этот период).
Обследование пациентов с нестабильностью эндопротеза включало клинические данные, рентгенологическое исследование, компьютерную томографию тазобедренного сустава и проксимального отдела бедра, бакпосев пунктатов или содержимого из раны.
После определения показаний к ревизионному эндопротезированию сустава необходимо провести предоперационное планирование. Предоперационная компьютерная томография и рентгенограмма в 2 проекциях помогали правильно определить тип и размер необходимого эндопротеза, выявить показания к костной пластике, не допустить дополнительного разрушения кости.
При дефекте стенок вертлужной впадины типа 2А и 2Б [10] с сохраненными контурами впадины предпочтение отдавали обычным чашкам для первичного эндопротезирования. При репротезировании вертлужного компонента с костными дефектами задней стенки впадины типа 3А или В применяли реконструктивные кольца Бурх-Шнейдора (рис. 1), а при дефектах крыши впадины типа 3А – укрепляющие кольца М. Мюллера с танталовым аугментом.
При расшатывании ножки эндопротеза тазобедренного сустава с дефектом костной ткани типа 1 по W.G. Paprosky (2004) на фоне сохраненной костной ткани возможно использование эндопротеза для первичного эндопртезирования. Однако это бывает редко. Из 26 пациентов лишь у 6 была возможность использования первичной ножки эндопротеза (рис. 2).
Нестабильная ножка первичного эндопротеза, как правило, вызывает образование неравномерного дефекта костной ткани на протяжении проксимального отдела бедра. В этих условиях, при наличии костного дефекта 2-4 типа, нами использовалась ревизионная ножка Вагнера с дистальной фиксацией. Обязательным было выполнение рентгенографии бедра в 2 проекциях. При этом необходимо было учитывать физиологическую кривизну бедра и правильно определить длину ножки эндопротеза, которая должна была обеспечивать протяженность контакта с костной тканью бедра и не выходить за пределы бедренного канала, не вызывать разрушение кортикального слоя, тем самым, исключая возможность возникновения в последующем перипротезного перелома бедра (рис. 3).
Для обеспечения стабильной установки ревизионной ножки эндопротеза необходимо было выполнить щадящее удаление первичной ножки.
Трансфеморальное удаление первичной ножки эндопротеза, при любом его варианте, вызывает разрушение проксимального отдела бедра, требующее в последующем дополнительной фиксации его фрагментов и использования более длинной ревизионной ножки. Целостность костной ткани бедра и опороспособности ноги восстанавливались в сроки от 4 до 6 месяцев (рис. 4).
Прямое удаление ножки первичного эндопротеза с сохранением проксимального отдела бедра с тщательной костной пластикой всех остаточных полостей бедренного канала губчатыми аллоимплантами позволяли восстановить костную ткань проксимального отдела бедра и ее опороспособность в более ранние сроки – к 3 месяцам со дня операции (рис. 5).
Прямое удаление ножки первичного эндопротеза удается при значительном расшатывании эндопротеза с бесцементной фиксацией. Но при цементной фиксации ножки первичного эндопротеза возникают сложности при тщательном удалении остатков костного цемента, хотя удаление самой ножки с цементной фиксацией трудностей не вызывает.
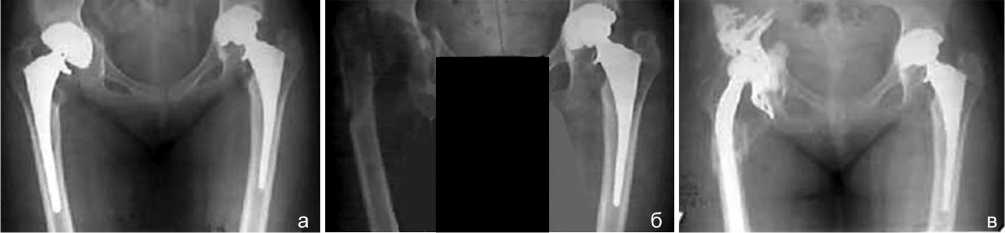
Рис. 1. Рентгенограммы таза в прямой проекции больной А., 27 лет. Диагноз: ревматоидный полиартрит, ризомиелическая форма, активность 2, НФС 3: а – состояние после тотального замещения обоих тазобедренных суставов эндопротезами «Компомед». Нестабильность обоих эндопротезов, более выраженная справа. Дефект вертлужной впадины типа 3В; б – после первого этапа – удаления эндопротеза правого тазобедренного сустава. Дефект вертлужной впадины типа 3В. Удаление ножки эндопротеза через трансфеморальный доступ. Спейсер не использован; в – через 2 года после ревизионного эндопротезирования
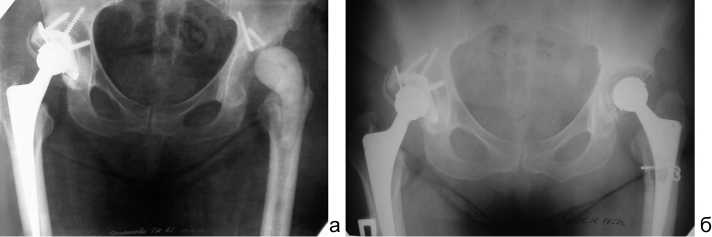
Рис. 2 Рентгенограммы таза в прямой проекции больного С., 62 года: а – после 1-го этапа: удаление эндопротеза с установкой цементного спейсера. Дефект вертлужной впадины типа 2А, костной ткани бедра типа 1; б – после 2-го этапа: ревизионное эндопротезирование с использованием первичного эндопротеза
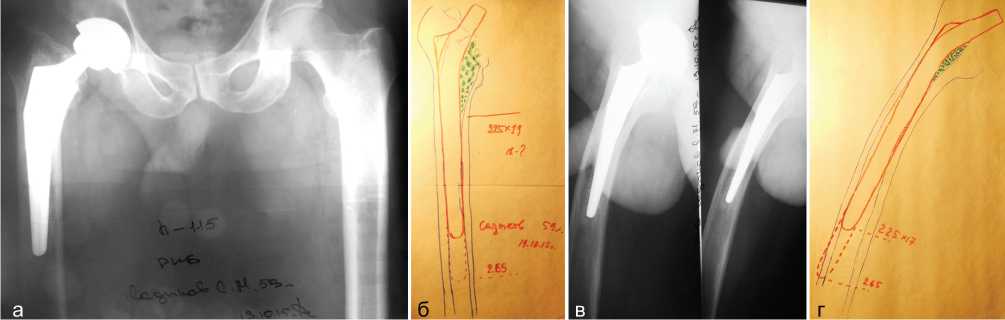
Рис. 3.: а – рентгенограмма таза в прямой проекции больного С., 59 лет. Диагноз: нестабильность бедренного компонента эндопротеза правого тазобедренного сустава с проседанием ножки на 1,5 см. Дефект костной ткани бедра типа 2; б – предоперационное планирование. Длина ножки, выделенная пунктиром, 265 мм. Зеленым цветом определена зона костной пластики; в – боковая рентгенограмма правого тазобедренного сустава; г – при планировании по боковой рентгенограмме видно, что ножка эндопротеза длиной 262 мм перфорирует кортикальный слой бедра. Произведена коррекция запланированной длины ножки
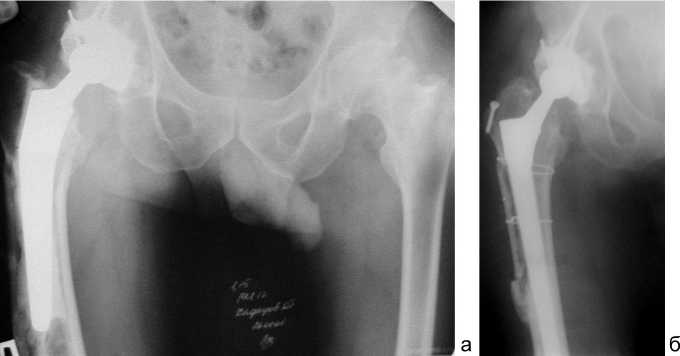
Рис. 4. Рентгенограммы тазобедренных суставов в прямой проекции больной Х., 26 лет: а – нестабильность бедренного компонента эндопротеза М. Мюллера с цементной фиксацией. Дефект костной ткани бедра типа 3А; б – после одноэтапной замены бедренного компонента бесцементной ножкой Вагнера. Доступ трансфеморальный. Произведен остеосинтез фрагментов бедра в зоне доступа
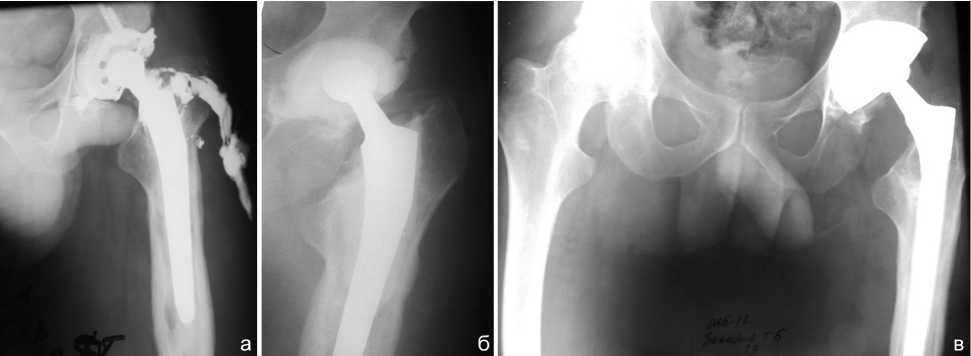
Рис. 5. Рентгенограммы тазобедренных суставов в прямой проекции больного З., 29 лет: а – нестабильность эндопротеза левого тазобедренного сустава на фоне глубокой перипротезной инфекции. Дефект вертлужной впадины типа 1. Дефект костной ткани бедра типа 3А; б – после 1-го этапа: прямое удаление эндопротеза с установкой артикулирующего спейсера. В проксимальном отделе бедра определяется костный дефект, заполненный костным цементом; в – через год после 2-го этапа: ревизионное эндопротезирование бесцементным эндопротезам. Стрелкой указана зона костной пластики губчатым аллоимплантом. Определяется заполнение медиального дефекта проксимального отдела бедра гомогенной костной тканью
Для полного удаления остатков костного цемента мы стали использовать окончатую остеотомию 2,5×1 см над дистальным концом ножки эндопротеза (рис. 6). Такая остеотомия позволяла сохранить целостность проксимального отдела бедра. Образовавшийся небольшой дефект кортикального слоя диафиза бедра и свет, проникающий через него, обеспечивали полный контроль бедренного канала на всем протяжении цементной мантии, а также позволяли более точно просверливать имевшуюся дистальную костную пробку.
Если имеющиеся в бедренном канале дефекты не обеспечивали контакт ножки эндопротеза с костной тканью на протяжении 9-10 см, то костные дефекты бедренного канала восполняли пластикой губчатыми аллогенными костными трансплантатами 10×10 мм.
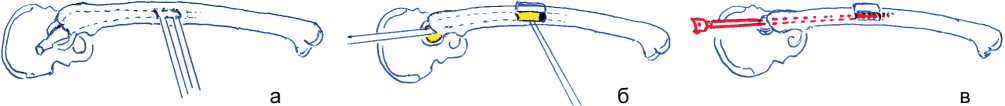
Рис. 6. Схема окончатой остеотомии проксимального отдела бедра: а – окончатая остеотомия бедра; б – удаление костного цемента с проксимального и дистального концов ножки эндопротеза; в – рассверливание бедренного канала и костной пробки под контролем зрения
Губчатые аллоимпланты размерами 10×10 мм изготовлялись в многопрофильном тканевом банке ФГБУ «Всероссийский центр глазной и пластической хирургии» МЗ РФ в г. Уфе из утилизированных головок бедренных костей, забранных при ранее проведенных нами операциях по эндопротезированию.
Переданные в костный банк костные структуры распиливались на фрагменты кубической формы со средним диаметром ребра около 10 мм. Затем трансплантаты подвергались последовательной физикохимической обработке с использованием детергентов по утвержденному лабораторному регламенту. На первом этапе после мембранолиза проводилась экстракция клеточных компонентов, что, как известно, снижает иммуногенность биоматериала. Деконтаминация трансплантатов достигалась ори- гинальной технологией селективной радиационной стерилизации [7, 8, 9]. Трансплантаты при этом сохраняли свои механические свойства и биологическую активность.
Использование данного губчатого аллоимпланта с прессованием импакторами его во все имеющиеся полости позволяло достичь на всем протяжении ножки эндопротеза жесткого плотного контакта с костной тканью. Обеспечивались первичная стабильность эндопротеза и благоприятные условия для развития вторичной стабильности [4]. Инфекционные осложнения или аллергическая реакция в послеоперационном периоде не наблюдались. Уже через год после операции на рентгенограммах на месте аллопланта определялась гомогенная костная ткань (см. рис. 5, в).
РЕЗУЛЬТАТЫ
При развившейся нестабильности эндопротеза тазобедренного сустава ревизионное эндопротезирование нами проводилось в один и более этапов.
Одноэтапное ревизионное эндопротезирование было выполнено у 14 пациентов с асептическим расшатыванием первичного эндопротеза. Двух- и более этапное эндопротезирование применено у 14 пациентов с развившейся глубокой инфекцией и у 5 пациентов с асептической нестабильностью эндопротеза (при технической невозможности выполнения одномоментной операции или сомнении избежать инфекционного процесса).
У 15 пациентов после удаления нестабильного эндопротеза был установлен спейсер. Артикулирующий спейсер по Фицеку был использован у 6 пациентов (рис. 5, б). Эти больные после операции могли ходить с нагрузкой на оперированную ногу. При операции репротезирования облегчался доступ к суставу. Спей-сер в виде свободного шара был применен у 7 и в виде шара с ножкой – у 2 пациентов.
После установки спейсера окончательное репротезирование проводили через 4 месяца или через год после ликвидации воспалительного процесса.
У 4 больных через 2 или 4 недели из-за продолженного воспаления спейсеры, установленные в виде шара, были вынуждены удалить.
При выполнении двух- и более этапного ревизионного эндопротезирования у 4 пациентов после удаления эндопротеза спейсеры не были использованы. У этих больных окончательная установка эндопротеза была выполнена в сроки от 3 до 4 месяцев после ликвидации воспалительного процесса с хорошим результатом в сроки наблюдения 5 лет.
При повторной артропластике замена только вертлужного компонента эндопротеза была выполнена у 6 пациентов. Замена только бедренного компонента – у
11 пациентов. У 16 пациентов были заменены оба компонента эндопротеза.
Для замены вертлужного компонента эндопротеза безцементные чашки первичного эндопро-тезирова-ния использовались у 7 пациентов, цементная чашка с укрепляющим кольцом М. Мюллера – у 6, цементная чашка с укрепляющим кольцом М. Мюллера и танталовым аугментом – у 1, комбинированная ревизионная танталовая чашка – у 5 и цементная чашка с реконструктивной клеткой Бурх-Шнейдора – у 10 пациентов.
При замене бедренного компонента были применены безцементная ножка Вагнера – у 21 пациента, цементная ножка М. Мюллера – у 5 и безцементная ножка Спаторно – у 1.
При удалении ножки первичного эндопротеза у 5 пациентов использовался трансфеморальный доступ (из них безцементная фиксация была у 1 пациента). У 22 пациентов произведено прямое удаление ножки, из них у 3 – с применением дополнительной окончатой остеотомии.
Дополнительная костная пластика губчатыми алло-имплантами применена у 7 пациентов.
Из 33 пациентов с ревизионным эндопротезированием тазобедренного сустава в сроки наблюдения от 3 до 8 лет получены хорошие результаты с функциональным состоянием оперированного сустава от 80 до 100 баллов по W.H. Harris [11] у 23 пациентов, удовлетворительные – у 4. У 2 пациентов в течение года после операции возникло проседание ножки эндопротеза, потребовавшее повторной ее замены с хорошим результатом в сроки наблюдения 5 и 7 лет.
У 4 пациентов после ревизионного эндопротезирования развились инфекционные осложнения. Перед операцией бактериологический посев пунктата из сустава у этих больных не проводился. Эндопротезы были удалены. Двум из них планируется репротезирование. У двух – оставлена «висячая нога».
ЗАКЛЮЧЕНИЕ
Под нашим наблюдением находилось 33 пациента в возрасте от 28 до 82 лет, которым было выполнено репротезирование по поводу нестабильности эндопротеза тазобедренного сустава. Из них 29 (87,9 %) больных были оперированы в первые 5 лет после первичного эндопротезирования сустава. На наш взгляд, основными причинами развития указанных осложнений были допущенные ошибки или инфицирование сустава при первичном протезировании.
Сравнительный анализ частоты развития нестабильности эндопротеза тазобедренного сустава, в том числе с развитием глубокой инфекции, показал, что у 28 (87,5 %) пациентов раннее расшатывание эндопротеза возникало после имплантации искусственных суставов с цементной фиксацией.
Повторное эндопротезирование тазобедренного сустава – сложное хирургическое вмешательство, требующее подготовки хирурга, оснащения специальным инструментарием и различного типа эндопротезами, позволяющими, в зависимости от ситуации, во время операции менять технику ее выполнения, а также наличие костного банка для восполнения имеющихся дефектов костной ткани. Отсутствие спейсера не является препятствием для двухэтапной ревизии.
Важным условием достижения раннего восстановления целостности костной ткани бедра было максимальное сохранение его при удалении первичного эндопротеза. Предложенная нами окончатая остеотомия бедра на уровне дистального отдела ножки эндопротеза позволяла при прямом удалении эндопротеза с цементной фиксацией полностью удалить цементную мантию и подготовить бедренный канал без повреждения проксимальных отделов бедренной кости.
У 8 пациентов для пластики дефектов костной ткани нами были применены губчатые аллогенные костные трансплантаты, изготовленные в ФГБУ «Всероссийский Центр глазной и пластической хирургии» МЗ РФ в г. Уфа, которые показали хорошие пластические свойства с перестройкой в ранние сроки и отсутствие инфекционных осложнений при их применении. Использование аллогенных трансплантатов из утилизированных при предыдущих операциях головок бедра позволило решить проблемы с донорством и трудностями в правовом регулировании постмортальной донации тканей.
Таким образом, отмеченные некоторые особенности проведения реэндопротезирования тазобедренного сустава могут быть учтены в практической ортопедии.
Список литературы Некоторые аспекты ревизионного эндопротезирования тазобедренного сустава. Пластика костных дефектов губчатыми аллоплантами
- Сравнительный анализ среднесрочных и отдаленных результатов первичного эндопротезирования тазобедренного сустава серийными эндопротезами бесцементной и цементной фиксации/В.М. Прохоренко, А.Б. Слободской, А.А. Мамедов, А.Г. Дунаев, И.В. Воронин, И.С. Бадак, А.Г. Лежнев//Вестн. травматологи и ортопедии им. Н.Н. Приорова. 2014. № 3. С. 21-26.
- Ревизионное эндопротезирование тазобедренного сустава: рук. для врачей/под ред. Д.Дж. Джакофски, Э.К. Хедли; пер. с англ. под ред. Н.В. Загороднего. М.: ГЭОТАР-Медиа, 2014. 323 с.
- Применение спейсоров для лечения глубокой перипротезной инфекции тазобедренного и коленного суставов/В.Ю. Мурылев, М.Ю. Холодаев, Я.А. Рукин, А.В. Лычагин, В.В. Карпов, Д.В. Римашевский, П.М. Елизаров//Вестн. травматологи и ортопедии им. Н.Н. Приорова. 2013. № 3. С. 18-24.
- Результаты применения костной пластики аллотрансплантатами при ревизионном эндопротезировании тазобедренного сустава/Н.В. Загородний, В.И. Нуждин, К.М. Бухтин, С.В. Каграманов//Вестн. травматологии и ортопедии им. Н.Н. Приорова. 2014. № 2. С. 33-39.
- Результаты применения трансфеморального доступа при ревизионном эндопротезировании тазобедренного сустава/Н.В. Загородний, В.И. Нуждин, И.А. Николаев, С.В. Каграманов//Вестн. травматологии и ортопедии им. Н.Н. Приорова. 2013. № 3. С. 11-17.
- Двухэтапное тотальное замещение тазобедренных суставов в условиях глубокой перипротезной инфекции/В.П. Волошин, А.В. Еремин, Г.А. Оноприенко, М.В. Лекишвили, М.Г. Васильев//Вестн. травматологии и ортопедии им. Н.Н. Приорова. 2012. № 4. С. 3-9.
- Шангина О.Р. Радиационная стерилизация соединительнотканных биоматериалов//Сборник тезисов «Биоимплантология на пороге ХХ1 века». Симпозиум по проблемам тканевых банков с международным участием. М., 2001. С. 30-31.
- Шангина О.Р. Сохранность структуры биоматериалов в зависимости от вида консервации и стерилизации: материалы докл. Всерос. науч. конф. «Реактивность и пластичность гистологических структур в нормальных, экспериментальных и патологических условиях»//Морфология. 2003. Т. 124, № 5. С. 82.
- Шангина О.Р., Нигматуллин Р.Т. Морфологические и биофизические критерии радиационной устойчивости аллостатических трансплантатов: тез. докл. VII конгр. Междунар. Ассоциации морфологов//Морфология. 2004. Т. 126, № 4. С. 138.
- Paprosky W.G., Lawrence J.M., Cameron H.U. Classification and treatment of the failed acetabulum: a systematic approach//Contemp. Orthop. 1991. Vol. 22. P. 121-129.
- Harris W.H. Traumatic arthritis of the hip after dislocation and acetabular fractures: treatment by mold arthroplasty. An end-result study using a new method of result evaluation//J. Bone Joint Surg. Am. 1969. Vol. 51, N 4. P. 737-755.


