Некоторые особенности танатогенеза и случай смерти пациента от осложненной травмы шейного отдела позвоночника, полученной на фоне анкилозирующего спондилоартрита (болезни Штрюмпеля — Бехтерева — Мари) (клинический случай)
Автор: Ульянов В.Ю., Бажанов С.П., Бахарев Р.М., Матвеева О.В., Гераськина И.О., Островский В.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Травматология и ортопедия
Статья в выпуске: 2 т.17, 2021 года.
Бесплатный доступ
Продемонстрированы результаты прижизненных и постмортальных морфологических исследований, вскрывающих некоторые особенности танатогенеза у пациентов с осложненной травмой шейного отдела позвоночника, полученной на фоне длительно существующего анкилозирующего спондилоартрита.
Позвоночник, шейный отдел позвоночника, анкилозирующий спондилоартрит, танатогенез
Короткий адрес: https://sciup.org/149135633
IDR: 149135633 | УДК: 616.721–002.77
Текст научной статьи Некоторые особенности танатогенеза и случай смерти пациента от осложненной травмы шейного отдела позвоночника, полученной на фоне анкилозирующего спондилоартрита (болезни Штрюмпеля — Бехтерева — Мари) (клинический случай)
тифакториальное заболевание, характеризующееся обязательным поражением крестцово-подвздошных суставов и/или позвоночника с потенциальным исходом их в анкилоз. Этиология заболевания в настоящее время неизвестна, однако в литературе приводятся сведения о роли наследственной пред- расположенности, обусловленной генетическими (порядка 40 аллелей гена гистосовместимости HLA) и средовыми факторами (травма, психоэмоциональный стресс, гипотермия). Идентифицированным геном предрасположенности к анкилозирующему спондилоартриту является HLA-В27 (вклад в наследуемость — 16-23%), который обнаруживается у подавляющего большинства пациентов с подтвержденным диагнозом и у ⅓ их родственников первой степени родства. Антиген HLA-В27 является либо рецептором для этиологического альтерирующего фактора, либо имеет сходные свойства в комплексе с другими молекулами, ошибочно распознаваемыми цитотоксическими Т-лимфоцитами, повреждающими клетки и ткани. Другими генами предрасположенности также являются гены кластера интерлейкина-1 (вклад в наследуемость — 4-6%), ERAP1 (вклад в наследуемость — 0,34%), IL23R (вклад в наследуемость — 0,31 %) и другие. Данные гены вырабатывают антигены I класса, последние относят к распространенным практически повсеместно на клетках мембранным гликопротеинам, в том числе на тромбоцитах и стволовых гемопоэтических клетках. Они принимают участие в патогенезе альтерации клеточных мембран, матрикса и соединительной ткани в целом. Патоморфологическая картина заболевания характеризуется инфильтрацией лимфоцитами и макрофагами органов-мишеней, активизацией фибропластических процессов с образованием фиброзных рубцовых тканей сухожилий, связок, капсул суставов, фасциальных листков и апоневрозов, которые подвергаются кальцификации и оссификации [1–4].
Распространенность данной патологии в мире составляет 0,5-2%, в Российской Федерации — 0,10,2%. Заболевание развивается преимущественно в возрасте 20–30 лет, соотношение мужчин и женщин 9:1 (в последние годы это соотношение приближается к 2:1–1:1), с ежегодным выявлением 4–6 тысяч новых случаев. Стойкая утрата трудоспособности вследствие функциональной недостаточности суставов осевого скелета при анкилозирующем спон-дилоартрите, по мировым данным, возникает через 20–40 лет после манифестации заболевания, по российским — через 15 лет (средний возраст получения инвалидности — 46,3 года), сопровождается резким ухудшением качества жизни и приводит к преждевременной смерти лиц трудоспособного возраста в 5% наблюдений, будучи связанной с осложнениями патологии шейного отдела позвоночника, сердца и почек [5, 6].
Самым серьезным осложнением, встречающимся в 6,4-11,3% случаев при анкилозирующем спонди-лоартрите, является перелом позвонков, в том числе шейных (до 53%), возникающий в результате нарушений осанки и походки (позитивный сагиттальный баланс) даже при незначительном механическом воздействии, например в случаях падения в быту с высоты собственного роста. У таких пациентов шейный отдел позвоночника, как и остальные, теряет свою эластичность вследствие ограничения подвижности суставов, напоминая по своей «новой» геометрии трубчатую кость, легко ломаясь между диском и замыкательной пластинкой и распространяясь на задние структуры позвоночного столба (трехколонные нестабильные повреждения) при разгибании, сгибании и переразгибании (низкоэнергетическая травма), а также часто сопровождаясь неврологическим дефицитом в 14,6% случаев [7, 8].
Типичными осложнениями переломов шейного отдела позвоночника в острый и ранний посттравматические периоды является восходящий отек спинного и головного мозга, а также острая дыхательная недостаточность, обусловленная бульбарными нарушениями, парезом диафрагмы. В случаях сочетания осложненной травмы шейного отдела позвоночника с анкилозирующим спондилоартритом острая дыхательная недостаточность обусловливается еще и существованием апикального фиброза легких, ограниченной подвижностью грудной клетки вследствие фиброзного и костного анкилоза сочленений головок ребер с грудными позвонками. Любое из этих осложнений может привести пациента к летальному исходу [9].
Описание комбинации осложненной травмы шейного отдела позвоночника и анкилозирующего спондилоартроза, сопровождающейся рядом осложнений и приведшей к смерти пациента, является весьма полезным примером для практикующих специалистов, позволившим проанализировать прижизненные и постмортальные особенности танатогенеза этой патологии.
Цель — продемонстрировать результаты прижизненных и постмортальных морфологических исследований, вскрывающих некоторые особенности танатогенеза у пациентов с осложненной травмой шейного отдела позвоночника, полученной на фоне длительно существующего анкилозирующего спон-дилоартрита (болезни Штрюмпеля — Бехтерева — Мари).
Учитывая наличие единичных литературных описаний летальных случаев осложненной травмы шейного отдела позвоночника, полученной пациентом на фоне длительно существующего в анамнезе анкилозирующего спондилоартрита, приводим собственное клиническое наблюдение танатогенеза этой сочетанной патологии, основанное на результатах прижизненных и постмортальных морфологических исследований.
Объектами судебно-медицинской экспертизы были труп пациента К., 37 лет, постановление (определение) о проведении судебно-медицинской экспертизы трупа, медицинская карта стационарного больного (форма 003/у), доставленные транспортом НИИТОН СГМУ в отдел судебно-медицинской экспертизы трупов Саратовского городского отделения судебно-медицинской экспертизы трупов ГУЗ «Бюро судебно-медицинской экспертизы Министерства здравоохранения Саратовской области», акт судебно-медицинского исследования трупа, заключение эксперта (экспертиза трупа).
Материалом для исследования явились протоколы прижизненных клинико-интраскопических исследований, выполненных в стационаре, а также постмортальные макро- и микропрепараты внутренних органов (кусочки головного и спинного мозга, легких, паравертебральных тканей), полученные при судебно-медицинской экспертизе трупа для дополнительных исследований, в том числе судебно-гистологического, а также заключение эксперта (экспертиза трупа). В работе использовали клинико-интраскопи-ческие и судебно-медицинские методы исследования, а также аналитического и описательного анализа.
Описание клинического случая. Больной К., 37 лет, поступил в нейрохирургическое отделение НИИТОН СГМУ через 10 дней с момента получения травмы в результате падения с высоты собственного роста и удара шеей о твердую поверхность. Пациент предъявлял жалобы на выраженную боль в шейном отделе позвоночника, слабость активных движений в верхних конечностях, отсутствие активных движений в нижних конечностях, нарушение функций тазовых органов по типу задержки.
В анамнезе в течение девяти лет страдал болезнью Штрюмпеля — Бехтерева — Мари (МКБ-10: М45 — анкилозирующий спондилит, аксиальный спондилоартрит) поздней стадии (достоверный са-кроилиит на рентгенограммах в проекции Фергюсона и синдесмофиты в позвоночнике) умеренной степени активности (2,0 по ASDAS (Ankylosing Spondylitis Disease Activity Score) С-РБ, 3,7 — по BASDAI (Bath Ankylosing Spondylitis Disease Activity Index)) II функционального класса (сохранены самообслуживание и профессиональная деятельность, ограничена непрофессиональная деятельность). В юношеском возрасте активно занимался спортом (плаванье, велоспорт, бег).
При неврологическом осмотре активные движения в конечностях отсутствовали — нижняя параплегия, грубый верхний парапарез до плегии в кистях (снижение мышечного тонуса до 0 баллов), сухожильные рефлексы с конечностей не вызывались, кожные брюшные рефлексы (верхние, средние и нижние) отсутствовали. Патологические рефлексы не вызывались. Нарушения поверхностной чувствительности фиксировали с уровня С5 позвоночно-двигательного сегмента.
На рентгенограммах шейного отдела позвоночника (ЭЭД 0,039 мЗв) были обнаружены перелом верхней трети тела С7-позвонка со смещением фрагментов, синдесмофиты по передней и боковой поверхностям тел позвонков, оссификация передней продольной связки, конкресценция задних структур С2–С7-позвонков, снижение высоты межпозвонковых дисков, отсутствие дифференцировки суставных щелей межпозвонковых суставов, положительный симптом «цилиндра», проявляющийся отсутствием смещений тел позвонков относительно друг друга (рис. 1).
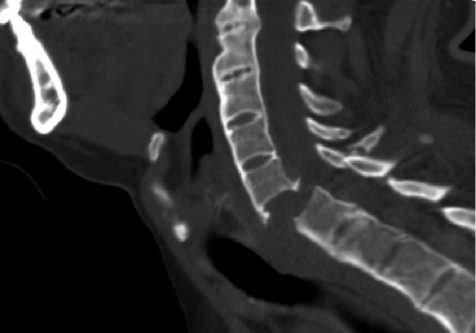
При проведении компьютерной томографии шейного отдела позвоночника (спиральный режим, шаг 0,5 мм, мультипланарная реконструкция, ЭЭД 1 мЗв) визуализировали усиление шейного лордоза, полную конкресценцию тел и задних структур С2– С7–Th3-позвонков, головок 1–3-го ребер, перелом верхней трети тела С7-позвонка со смещением фрагментов и снижением высоты вентрального отдела тела позвонка на 1/5, смещение кпереди и под углом фрагмента оссифицированной продольной связки, деформацию позвоночного канала до 2,1 мм, перелом дуги С7-позвонка со смещением фрагментов, перелом остистого отростка С6-позвонка, неровность замыкательных пластинок тел С3–С6-позвонков за счет мелких узелков Поммера, выраженные краевые остеофиты от замыкательных пластинок, ин-конгруэнтность суставных поверхностей, костные разрастания дугоотростчатых суставов, склерозирование и уплотнение замыкательных пластинок тел позвонков (рис. 2).
Наличие осложненного повреждения шейного отдела позвоночника послужило показанием для выполнения дискэктомии С6–С7-позвонков, передней декомпрессии спинного мозга на этом уровне, открытого вправления подвывиха С6-позвонка, переднего спондилодеза имплантатом «Mesh», фиксации вентральной пластиной «Medtronic» в условиях тоталь-
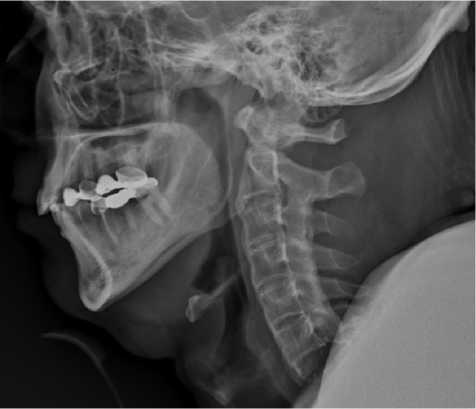
Рис. 1. Рентгенограмма шейного отдела позвоночника (в боковой проекции), выполненная до хирургического вмешательства
а
б
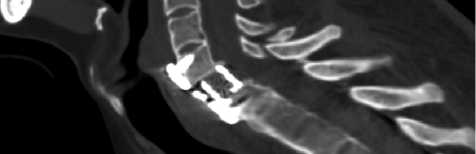
Рис. 2. КТ-сканы шейного отдела позвоночника: а — до хирургического вмешательства; б — после хирургического вмешательства ной внутривенной анестезии и искусственной вентиляции легких.
При контрольной компьютерной томографии (стандартный режим, ЭЭД 0,8 мЗв), выполненной в ранний послеоперационный период, фиксировали деформацию позвоночного канала до 3,1 мм, эндопротез располагался по средней линии, интимно прилежал к телам С6–Th1-позвонков, винты конструкции находились в толще костной ткани позвонков, деформации или сдавления трахеи металлической пластиной обнаружено не было (рис. 2).
На 2-е сутки после операции на фоне не купируемой нестероидными противовоспалительными пре- паратами боли в шейном отделе позвоночника и отсутствия положительной динамики неврологического дефицита у пациента было отмечено нарушение глотания, гиперсаливация, брадикардия до 52–56 ударов в минуту, гипертермия до 38,8°С, затруднение дыхания и невозможность откашливания мокроты. Назначены диуретические препараты, глюкокортикостероиды и физические методы гипотермии. При компьютерной томографии органов грудной клетки визуализировались признаки левостороннего плеврита, компрессионные ателектазы S9–S10 левого легкого, очаговая бронхопневмония S4–S6 левого легкого (рис. 3).
Пациенту проводили интенсивную терапию, включающую диуретики, глюкокортикостероиды, антибактериальные препараты, муколитики, вазопрессоры, прокинетики, макро- и микронутриенты. На 4-е сутки после операции на фоне прогрессирования бульбарных нарушений и острой дыхательной недостаточности на кардиомониторе была зафиксирована асистолия. Проводимые реанимационные мероприятия эффекта не имели, была констатирована биологическая смерть пациента, причиной которой стал восходящий отек спинного мозга, механизмом — асистолия.
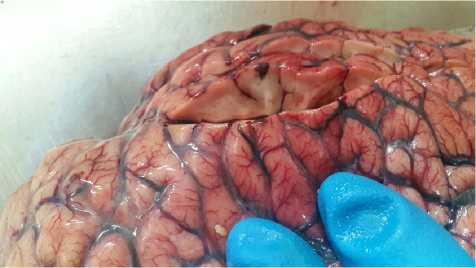
Труп пациента К. был направлен на судебно-медицинское исследование. При внутреннем исследовании тела были обнаружены резкая сглаженность рельефа извилин и борозд головного мозга, вещество мозга имело тестовато-эластическую консистенцию (рис. 4), на разрезе было влажным, блестящим с наличием кровяных точек и полос, легко снимаемых при поглаживании мозговым ножом.
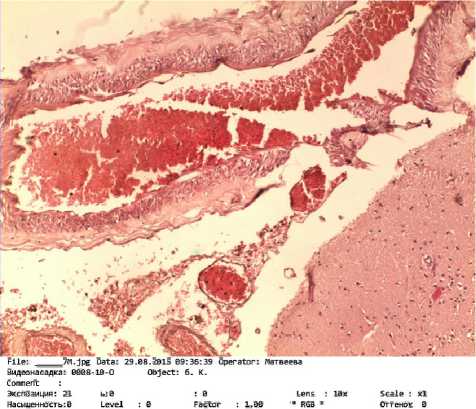
При судебно-гистологическом исследовании препаратов головного мозга отмечался выраженный периваскулярный и перицеллюлярный отеки, свежие кровоизлияния различных размеров, полнокровие мелких капилляров (рис. 4).
В шейном, грудном и поясничном отделах позвоночника отмечали сращение тел позвонков с задними фасетчатыми отростками, окостенение и обызвествление на уровне межпозвонковых дисков, которое в виде «скобок» окаймляло их. Наблюдалось сглаживание, местами исчезновение, вогнутого бокового контура тел позвонков с его неровностью, окостенение межостистых и желтых связок, сращение дуго-отростчатых суставов с окостенением и обызвествлением их капсул.
При судебно-гистологическом исследовании в препаратах костно-хрящевых блоков среди истонченных костных трабекул отмечали разрастание плотной малоклеточной фиброзной ткани с единичными тонкостенными сосудами, дегенеративно измененным коллагеновым хрящом (рис. 5).
На передней поверхности шейного отдела позвоночника в проекции C6–Th1 визуализировалась имплантированная металлическая конструкция, фиксированная к позвоночному столбу четырьмя шурупами. Выражено окостенение и обызвествление передней продольной связки позвоночника, на уровне С6–С7-позвонков металлический протез — межтеловой сетчатый эндокорректор. Обнаружены кровоизлияния под твердой и мягкой мозговыми оболочками спинного мозга на уровне кровоизлияния под твердой и мягкой мозговыми оболочками на уровне С5–Th1-позвонков, мягкие мозговые оболочки студенистые, вещество спинного мозга на уровне С7-позвонка бесструктурно, синюшного цвета с точечными и полосчатыми кровоизлияниями,
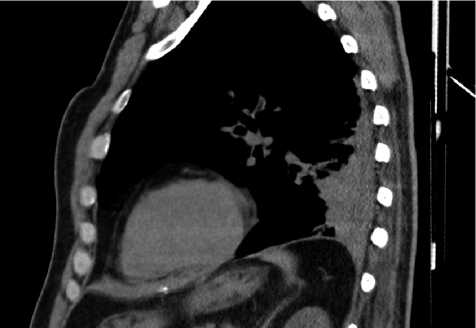
Рис. 3. КТ-скан органов грудной клетки на 2-е сутки после хирургического вмешательства
б
Рис. 4. Головной мозг с признаками отека: а — макропрепарат, фото; б — микропрепарат, фото (увеличение ×10)
не снимаемыми при поглаживании ножом; на прилежащих участках спинной мозг — плотноэластической консистенции, липнущий к ножу.
При судебно-гистологическом исследовании спинного мозга были обнаружены фрагменты периферических нервов, их эндо-, пери- и эпиневрий не дифференцировались. Мелкие нервные стволики были сохранены; в крупных — нервные волокна в по-
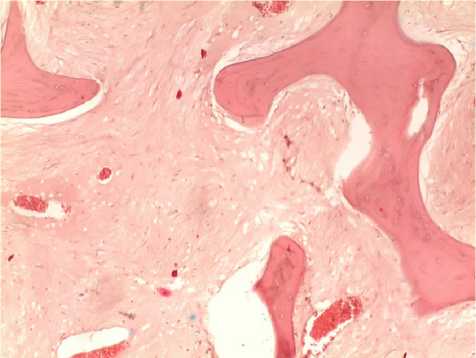
Рис. 5. Микропрепарат костно-хрящевого блока шейных позвонков. Фото (увеличение ×10)
перечном и продольном срезах присутствовали, однако местами в них обнаруживались очаги некрозов и единичные кальцинаты. Нервные волокна в основном были дегенеративно изменены, в единичных миелиновых волокнах прослеживался осевой цилиндр. Найдены также единичные регенераты, которые были подвержены обызвествлению. Во фрагментах спинномозгового узла большая часть нейронов находилась в поврежденном состоянии. Эти повреждения характеризовались исчезновением ядрышек, мелкодисперсной базофильной «пыли» в цитоплазме. Цитоплазма большинства нейронов была с интенсивным эозинофильным окрашиванием (потеря субстанции Ниссля). Выявлялся отек между нейронами и тонковолокнистой соединительнотканной оболочкой, окружающей нейроны. Фибробластические клетки этой оболочки имели признаки пролиферации. Место гибели единичных нейронов замещали пролиферирующие фибробласты.
Легочная плевра с обеих сторон была неравномерно утолщена, в области верхушек легких с обеих сторон уплотнена, с соединительнотканными тяжистыми прослойками белесовато-серого цвета, единичными спайками между листками слева. Ткань левого легкого была воздушно-тестоватой консистенции с уплотнением в области нижнего края, неравномерно серо-красного цвета на разрезе с белесоватыми прослойками. С поверхности разрезов при надавливании на края стекала темная жидкая кровь и умеренное количество серо-розовой жидкости, на поверхности разрезов выступали утолщенные стенки расширенных бронхов, местами из просветов бронхов выделялись слизисто-гнойные пробки, мутная желтовато-серая слизь (рис. 6).
Перикард цел, содержал около 20 мл желтоватой прозрачной жидкости. Эпикард гладкий, блестящий. Сердце массой 330 г, размеры 13×12×7 см, камеры сердца расширены, миокард на разрезе неравномерной тусклой красновато-коричневой окраски, дряблый. В полостях сердца и крупных сосудах жидкая кровь и кровяные свертки. Толщина левого желудочка 1,7 см, правого — 0,5 см, перегородки между ними — 1,9 см.
Таким образом, динамика танатогенеза включала в себя момент получения переломов шейного отдела позвоночника (первичное повреждение нервной ткани), появление висцеральных осложнений травматической болезни: в острый период — восходящего отека спинного мозга и каудальных отделов ствола головного мозга (вторичное повреждение нервной ткани), в ранний период — полиорганной недостаточности, в том числе легочной (центральные и пе-
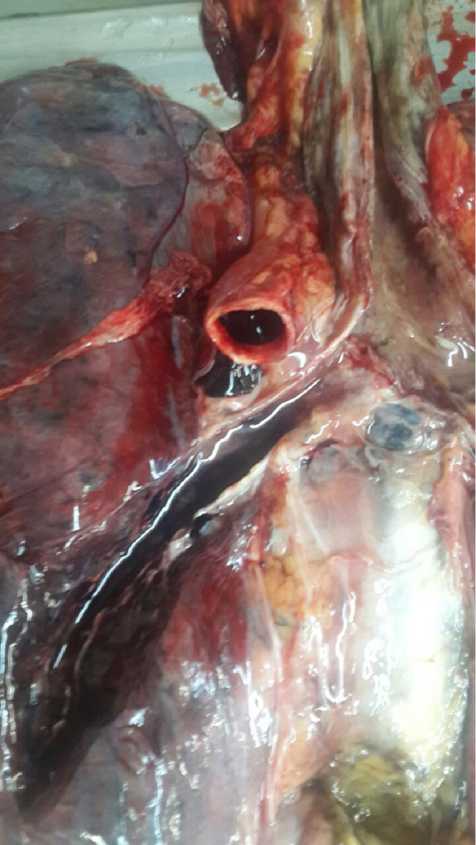
Рис. 6. Макропрепарат органокомплекса трахеи, бронхов, легких и плевры. Фото
риферические механизмы) и сердечно-сосудистой (бульбарные нарушения), а также присоединение инфекционно-воспалительного процесса, что было подтверждено результатами судебно-медицинской экспертизы трупа, сведениями медицинской документации, дополнительными сведениями с учетом информации об обстоятельствах смерти. Последняя наступила на фоне анкилозирующего спондилоарт-рита в результате резкого изменения положения тела при самопроизвольном падении от тупой травмы шейного отдела позвоночника с переломовывихом тела С6–С7-позвонков, ушиба спинного мозга на уровне С7-позвонка, кровоизлияния под твердую и мягкую оболочки спинного мозга на уровне С5– Th1-позвонков, осложнившихся восходящим деструктивным отеком спинного мозга, отеком головного мозга, левосторонней гнойной пневмонией с ателектазом нижней доли.
Обсуждение . Анкилозирующий спондилоартрит является наиболее распространенной причиной возникновения синдрома ригидного позвоночника, когда вследствие прогресса патологического процесса происходит продолженная оссификация задних продольных связок и капсул межпозвонковых суставов, приводя к восходящему снижению подвижности позвоночного столба. Это обусловлено тем, что слегка напряженные и менее упругие хрупкие компоненты соединительной ткани получают микротравмы, и в толще капсульно-связочного аппарата возникает ядро оссификации под действием активно пролиферирующих преостеобластов (стволовые клетки адвентиции). При полисегментарном остеоартрите действие компрессии и силы, направленной на позвоночный столб под углом, соответствует длинному плечу условного биомеханического рычага, вокруг которого формируется новое движение всей осевой структуры позвоночного столба. При обычной физической активности или в условиях нагрузок формируется дополнительный рычаг натяжения, приводя к значительному усилению воздействия на структуры ограниченно растяжимой соединительной ткани, кратно умножая количество очагов микротравм. Нарушение целостности капсульно-связочных структур сопровождается присоединением костных разрастаний, которые формируют протяженные «мостики», визуализируемые в виде непрерывных четкообразных структур, минимизируя содержание костного матрикса в телах позвонков, что диагностируется клиницистами как остеопороз [10, 11].
Аналогичные патологические процессы возникают и в грудной клетке, приводя к снижению подвижности позвоночника во время акта дыхания, которое связано с ограниченным размером капсулы суставов, даже незначительное натяжение которых способствует резкому увеличению внутрисуставного давления и сближению суставных поверхностей, их последующей фиксации и повреждению гиалинового хряща, внутри которого активизируются процессы неоваскулогенеза. Последние составляют патофизиологическую основу фиброзного, а затем и костного анкилоза с формированием рестриктивной дыхательной недостаточности. Главным триггером осложненной травмы шейного отдела позвоночника, полученной на фоне анкилозирующего спондилита, оказывается прямое или опосредованное механическое воздействие на шейные позвонки различной силы, в которых возникает патологический перелом, причиной которого является нарушение кровообращения и потеря костной массы [12, 13].
Первичный очаг травмы шейного отдела позвоночника и спинного мозга запускает целый каскад патофизиологических процессов за счет высвобождения в системный кровоток альтерированных клеточных элементов, медиаторов, цитокинов и других биологически активных веществ, составляющих основу полиорганной дисфункции/недостаточности и восходящего деструктивного отека спинного мозга и каудальных отделов ствола головного мозга, развивающихся в острый и ранний периоды травматической болезни спинного мозга. Последняя сопровождается присоединением инфекционно-воспалительного процесса, усиливая «цитокиновый шторм» и замыкая порочный круг патофизиологических процессов, приводящих к летальному исходу. Преобладающие механизмы танатогенеза в условиях осложненной позвоночно-спинномозговой травмы шейного отдела позвоночника, полученной на фоне анкилозирующего спондилоартрита, — сердечный вариант, клинически проявляющийся асистолией, а морфологически — дряблостью миокарда, расширением полостей сердца, а также мозговой вариант танатогенеза, клинически проявляющийся восходящим деструктивным отеком спинного мозга, а морфологически — кровоизлияниями в ткань мозга, дислокацией его структур, выраженным отеком и набуханием вещества мозга с резким нарушением ликворооттока. Комбинацию с описанными механизмами танатогенеза наиболее часто составляет легочный вариант, клинически проявляющийся прогрессированием острой дыхательной недостаточности, инфекционно-воспалительными осложнениями со стороны трахеобронхиального дерева, морфологическими эквивалентами которых являются пневмонические очаги, диффузный двусторонний эндобронхит [14–16].
Заключение . Механизмами танатогенеза у пациентов с осложненной травмой шейного отдела позвоночника, полученной на фоне длительно существующего анкилозирующего спондилоартрита, являются преимущественно сердечный или мозговой варианты, а также их комбинация с легочным вариантом танатогенеза.
Список литературы Некоторые особенности танатогенеза и случай смерти пациента от осложненной травмы шейного отдела позвоночника, полученной на фоне анкилозирующего спондилоартрита (болезни Штрюмпеля — Бехтерева — Мари) (клинический случай)
- Аллами M.A. Д, Емелин А. Л., Ахтямов И.Ф. и др. Исторические очерки по диагностике и лечению болезни Бехтерева. Практическая медицина 2019; 17 (6), ч. 2: 10-6.
- Бочкова А. Г., Дубинина Т. В., Закиров РХ. и др. Федеральные клинические рекомендации по диагностике и лечению анки-лозирующего спондилита (Болезнь Бехтерева). М.: Ассоциация ревматологов России, 2013; 21 с.
- Кулыгин Б. Б., Володин С. А., Чернышева А. И. Проблема анкилозирующего спондилоартрита в настоящее время. Научный альманах 2018; 3-2 (41): 144-7). DOI: 10.17117/па. 2018.03.02.144.
- Норкин И. А., Чехонацкий А. А., Нинель В. Г. и др. Лечение перелома шейного отдела позвоночника при болезни Бехтерева. Хирургия позвоночника 2007; (2): 23-5). DOI: 10.14531/SS2007.2.23-25.
- Колесов СВ., Сажнев М.Л., Кудряков С.А. и др. Оперативное лечение перелома шейного отдела позвоночника у пациента с болезнью Бехтерева. Хирургия позвоночника 2011; (2): 8-11). DOI: 10.14531/SS2011.2.8-11.
- Ардашев И. П., Гатин В. Р., Ардашева Е.И. и др. Хирургическое лечение переломов шейного отдела позвоночника при анкилозирующем спондилите. Хирургия позвоночника 2013; (1): 8-14). DOI: 10.14531/ss2013.1.8-14.
- Бадяев В. В., Бадяева Е.Е. Случай смерти от травмы грудного отдела позвоночника при болезни Бехтерева. Избранные вопросы судебно-медицинской экспертизы 2010; (11): 57-9.
- Полулях M.B., Герасименко С. И., Скляренко Е.Т и др. Анкилозирующий спондилит (Болезнь Бехтерева). М.: Медицинская книга, 2008; 144 с.
- Мацко Д. E. Нейрохирургическая патология. СПб.: Изд-во РНХИ им. проф. А.Л. Поленова, 2012; 408 с.
- Орел A. M. Концепция патогенеза анкилозирующего спондилита (биомеханические аспекты поражения). Международный неврологический журнал 2012; 7 (53): 13-22.
- Шерман Л.А., Бунак M.C., Бикти-миров Р. Г. Патологический перелом позвоночника у больного с анкилозирующим спондилоартритом: трудности лучевой диагностики. Альманах клинической медицины 2015; (43): 131-5). DOI: 10.18786/2072-0505-2015-43-131-135.
- Thumbikat Р, Hariharan RP, Ravichandran G,etal. Spinal cord injury in patients with ankylosing spondylitis: a 10-year review. Spine 2007; 32 (26): 2989-95. DOI: 10.1097/BRS. 0b013e31815cddfc.
- Han SW, Kim SH. Ankylosing spondylitis with cervical fracture, cardiac arrest, locked-in syndrome and death. BMJ Case Reports2012; (10): 1136. DOI: 10.1136/bcr. 01.2012.5522.
- Gelalis ID, Lykissas MG, Dimoi AA, et al. Fatal isolated cervical spine injury in a patient with ankylosing spondylitis: a case report. Global Spine J 2015; 5 (3): 253-6. DOI: 10.1055/S-0035-1549430.
- Wysham KD, Murray SG, Hills N, et al. Cervical spine fracture and other diagnoses associated with mortality in hospitalized ankylosing spondylitis patients. Arthritis Care Res (Hoboken) 2017; 69 (2): 271-7. DOI: 10.1002/acr. 22934.
- Westerveld LA, Verlaan JJ, Oner FC. Spinal fractures in patients with ankylosing spinal disorders: a systematic review of the literature on treatment, neurological status and complications. Eur Spine J 2009; 18 (2): 145-56. DOI: 10.1007/S00586-008-0764-0.


