Немалиновая миопатия редкой формы (случай из практики)
Автор: Мигалкин Николай Сергеевич, Филимонова Галина Николаевна, Прудникова Оксана Германовна, Мезенцев Игорь Николаевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Случай из практики
Статья в выпуске: 5 т.28, 2022 года.
Бесплатный доступ
Введение. Немалиновые миопатии - группа нейромышечных заболеваний, отличительной гистологической особенностью которых является наличие немалиновых тел в миосимпластах. Цель. Описательная морфология редкой формы первичной немалиновой миопатии, прогрессирующей в позднем возрасте. Материалы и методы. Исследован операционный материал паравертебральных мышц пациентки 51 года со сколиотической деформацией на уровне L4-S1, оперированной неоднократно с целью коррекции деформации позвоночника на фоне неврологических нарушений. Парафиновые срезы окрашивали гематоксилином и эозином, по Массону, методом Ptah, изучали посредством сканирующего микроскопа 3DHISTECH Pannoramic MIDI II BF для оцифровки препаратов по технологии Whole slide imaging в двух режимах: Single layer mode и Extended focus (3DHISTECH, Венгрия). Результаты. Во фрагментах измененной мышечной ткани в миосимпластах идентифицировались нитчатые структуры немалиновых тел, которые располагались диффузно-точечно по всей саркоплазме либо образовывали скопления различной конфигурации. Наблюдалась повышенная вариабельность диаметров мышечных волокон, внутренние ядра, контрактурно измененные миосимпласты и с признаками миофагий, картины постепенного замещения мышечных волокон адипоцитами, массовая жировая дегенерация волокон, фиброз интерстициального пространства. Внутримышечные нервные стволики имели признаки полной инволюции, сохранялся фиброзированный периневрий, единичные нервные волокна; нервно-мышечные веретена отличались увеличенной соединительнотканной капсулой. Сосуды артериального звена с признаками фиброза и облитерацией просвета, сосуды венозного русла извитые. Обсуждение. В связи с большим числом генов, ответственных за NM, генетический поиск может быть затруднен и бывает результативным лишь в 50 % случаев. Установлено, что немалиновые тела могут распределяться диффузно либо образовывать скопления неправильной формы, чаще субсарколеммально и характерны для мелких волокон. В представленном клиническом случае немалиновые тела наблюдались по всей площади волокон и были характерны для миосимпластов различных размеров. Заключение. Посредством патогистологического исследования паравертебральных мышц была установлена нейромышечная природа заболевания, определенного как немалиновая миопатия, прогрессирующая в позднем возрасте, не диагностированная ранее на предыдущих этапах лечения.
Немалиновая миопатия, паравертебральные мышцы, немалиновые образования, фиброз, жировая дегенерация, инволюция нервных проводников, облитерация сосудов
Короткий адрес: https://sciup.org/142236796
IDR: 142236796 | УДК: 616.741-009 | DOI: 10.18019/1028-4427-2022-28-5-715-719
Текст научной статьи Немалиновая миопатия редкой формы (случай из практики)
Немалиновые миопатии (Nemaline myopathy, NM) – группа прогрессирующих нейромышечных заболеваний, которые характеризуются наличием аномальных скрученных или палочковидных структур в мышеч- ных волокнах, выявляемых при гистопатологическом исследовании (NEMA – «нить»). Болезнь относится к наиболее распространенным миопатиям, частота встречаемости один на 50000 человек в равной степени
мужчины и женщины, обычно передается по наследству, в единичных случаях заболевание не наблюдается у других членов семьи [1, 2]. Клинические проявления NМ значительно варьируют как по возрасту манифестации, так и тяжести течения, в 90 % случаев миопатии проявляются при рождении или в раннем детстве, очень редко обнаруживаются у взрослых [3]. Отличительными чертами NМ являются гипотония, слабость скелетных мышц, деформации позвоночника, проблемы при кормлении [4].
Выделяют шесть клинических групп NM в зависимости от возраста манифестации и степени тяжести. Взаимосвязь между тяжестью заболевания и определенным геном, в котором произошла мутация, не установлена, необходимо регулярное наблюдение у кардиолога [4]: 1) тяжелая врожденная форма: сильная мышечная гипотония, нарушение функции внешнего дыхания; 2) немалиновая миопатия Амишей при рождении: гипотония мышц, контрактуры суставов, нарушения дыхания; 3) промежуточная врожденная форма: средняя степень тяжести, задержка моторного развития, утрата способности самостоятельной ходьбы; 4) типичная (мягкая) врожденная форма: гипотония, вялость в мышцах, расположенных ближе к туловищу; 5) миопатия, проявляющаяся в 8-15 лет: нормальное раннее моторное развитие, симметричная слабость мышц лодыжек; 6) миопатия, проявляющаяся во взрослом возрасте 20-50 лет: быстро прогрессирующая общая слабость мышц, боль в мышцах, деформации позвоночника. Механизмы, приводящие к формированию немалиновых миопатий, являются предметом продолжающихся исследований [1, 3, 5, 6].
Представляемый клинический случай интересен не только с точки зрения особенностей клинической картины заболевания (стертость манифестации неврологических проявлений), но и особенностей гистоструктуры мышечной ткани при патогистологическом анализе. В рамках клинической работы представлена краткая морфологическая характеристика и обсуждение данной проблемы [7].
Цель работы – описательная морфология редкой формы немалиновой миопатии, прогрессирующей в позднем возрасте.
МАТЕРИАЛЫ И МЕТОДЫ
Исследован операционный материал параспиналь-ных мышц пациентки 51 года со сколиотической деформацией позвоночника на уровне L4-S1. При поступлении была диагностирована неврологическая симптоматика в виде болезненных спазмов мышц лица, шеи, гипотонуса и гипотрофии мышц бедер, голеней, стоп, ограничений движений в конечностях. Прогрессирующий неврологический дефицит не укладывался в клинические проявления вторичной миопатии, после сбора анамнеза было принято решение о проведении гистопатологического исследования мышц спины с целью уточнения этиологии заболевания.
Мышечную ткань фиксировали в 10 % растворе нейтрального формалина, после гистологической про- водки заливали в парафин, срезы окрашивали гематоксилином и эозином, трихромным методом по Массону, методом PTAH. Изучали посредством сканирующего микроскопа 3DHISTECH Pannoramic MIDI II BF для получения цифровых микропрепаратов по технологии Whole slide imaging в двух режимах: Single layer mode и Extended focus (3DHISTECH, Венгрия).
Обследования пациентки проводились в соответствии с требованиями Хельсинской декларации 1975 года, пересмотренными в 2013 году; было подписано информированное добровольное согласие на осуществление диагностики и медицинского вмешательства с дальнейшим использованием данных в научных целях.
РЕЗУЛЬТАТЫ
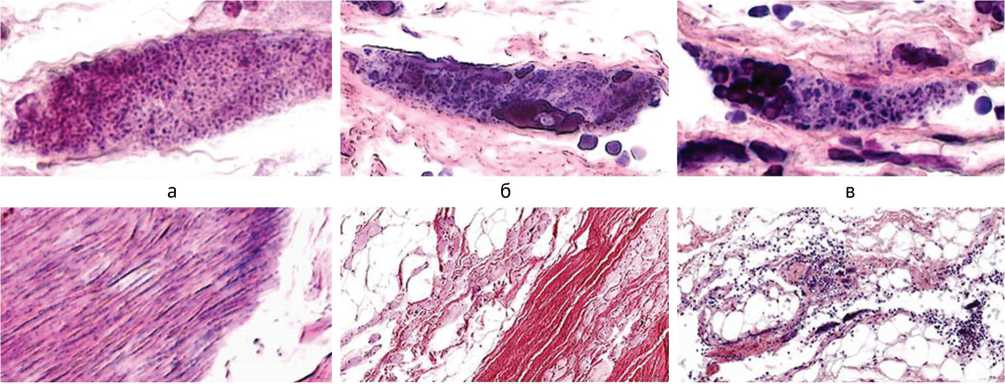
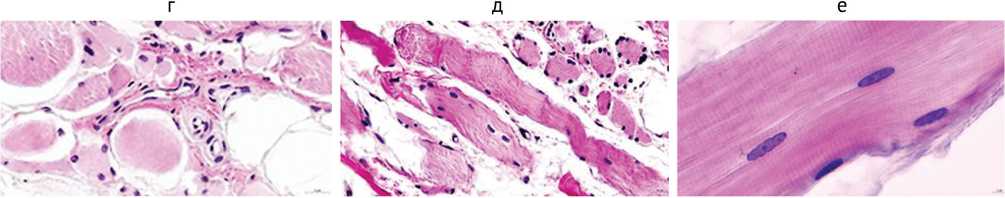
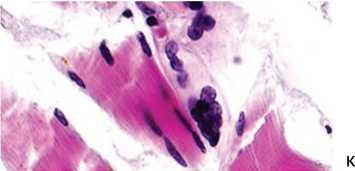
Проведенное патогистологическое исследование паравертебральных мышц пациентки, неоднократно оперированной с целью коррекции деформации позвоночника на фоне неврологических нарушений, позволило уточнить этиологию основного заболевания и дифференцировать его как генетически обусловленную немалиновую миопатию, прогрессирующую в позднем возрасте. Макроскопически наблюдались фрагменты мышечной ткани с выраженным фиброзом, атрофией, жировым замещением. При микроскопировании измененной мышечной ткани визуализировались миосимпласты, под сарколеммой которых идентифицировались немалиновые тела, окрашенные темно-синим по Рtah (рис. 1). Одни располагались диффузно в виде точечных вкраплений (рис. 1, а), другие группировались в кластеры разнообразной конфигурации (рис. 1, б, в). На продольных срезах немалиновые образования визуализировались в виде нитчатых структур (рис. 1, г). В операционном материале наблюдались поля адипоцитов, заместивших мышечные волокна, различные этапы преобразования миосимпластов в жировые клетки, остаточные мелкие миоциты погружа- лись в соединительнотканные конгломераты (рис. 1, д), нередко встречались геморрагии (рис. 1, е). Были характерны волокна разнообразных диаметров, визуализировались картины постепенного замещения миосимпластов жировыми клетками (рис. 1, ж), отмечались внутренние ядра и контрактурно измененные волокна (рис. 1, з). В симпластах с различимой поперечной исчерченностью идентифицировались вытянутые собственные ядра по периферии и в центре (рис. 1, и), наряду с сохранными фрагментами мышечной ткани наблюдались мышечные волокна с утраченной гистоструктурой (рис. 1, к).
Сосуды зачастую были погружены в конгломераты адипоцитов, просветы облитерированы, оболочки с признаками фиброза, гладкомышечные клетки (ГМК) t. media с нарушенной циркулярной ориентацией (рис. 2, а, б). Сосуды венозного русла тонкостенные, извитые (рис. 2, в). Нервно-мышечные веретена характеризовались увеличенной соединительнотканной капсулой (рис. 2, г), внутримышечные нервные проводники подвергались полной инволюции, сохранялся фиброзированный периневрий, единичные нервные волокна (рис. 2, д).
3 и
Рис. 1. Фрагменты парафиновых срезов параспинальных мышц при немалиновой миопатии: а – миоцит с диффузным распределением немалиновых стержней; б, в – гонгломераты немалиновых тел; в – слева группа клеток макрофагального ряда в миосимпласте с немалиновыми телами; г – темно-синие немалиновые нити; д – остаточные мышечные волокна погружены в поле адипоцитов, справа – волокна, заключенные в соединительнотканное разрастание; е – геморрагии; ж – различные этапы замещения мышечных волокон на адипоциты, волокна разнообразных диаметров; з – контрактурно измененные миосимпласты, внутренние ядра; и – сохранные мышечные волокна; к – миосимпласт с утраченной гистоструктурой (справа). Окраска: а–е – методом Pyah; ж–к – гематоксилином и эозином. Увеличение: а, б, в – 2300×; г – 3000×; д – 200×; е – 300×; ж – 700×; з – 500×; и – 1100×; к – 1600×
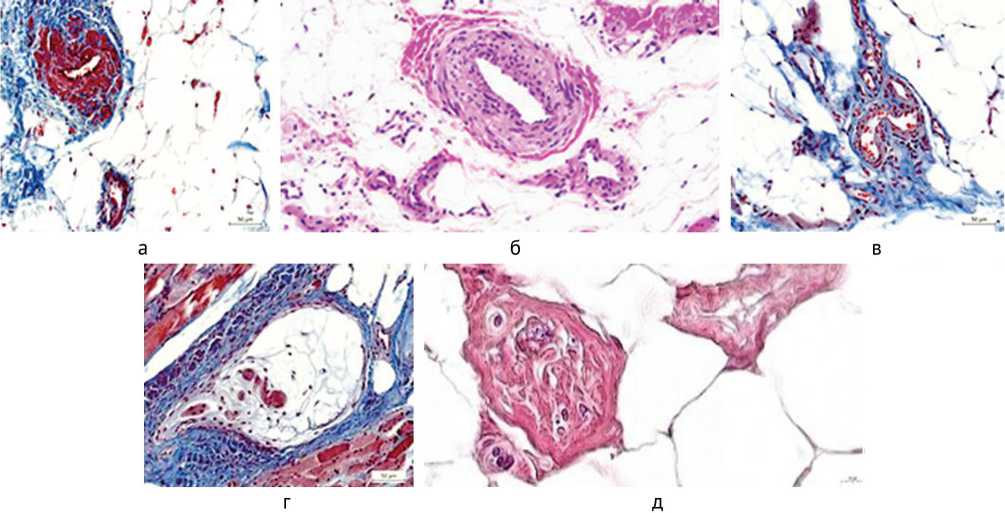
Рис. 2. Фрагменты парафиновых срезов паравертебральных мышц при немалиновой миопатии, особенности гистоструктуры сосудов, нервно-мышечных веретен и нервных проводников: а – сосуды погружены в скопления адипоцитов, окклюзия просвета; б – выраженный фиброз t. media, ГМК лишены циркулярной ориентации; в – извитые контуры венозного сосуда; г – увеличенная капсула нервно-мышечного веретена в соединительнотканном конгломерате; д – инволюция внутримышечного нервного стволика с массовой дегенерацией нервных волокон, сохранен фиброзированный периневрий. Окраска: а, в, г – по Массону, б – гематоксилином и эозином, д – методом Ptah. Увеличение: а, в, г – 500×; б – 270×; д – 1600×
ОБСУЖДЕНИЕ
В исследованном клиническом случае имеет место патология, проявившаяся в подростковом возрасте и неуклонно прогрессирующая во взрослом. По данным литературы, в связи с большим числом генов, ответственных за NM, генетический поиск может быть затруднен и бывает результативным лишь в 50 % случаев [1], необходимы дополнительные исследования, в частности, патогистологический анализ.
Фиброз стенок сосудов, обусловленный чрезмерным отложением белков внеклеточного матрикса, связывают с такими заболеваниями как атеросклероз, гипергликемия, дислипидемия, гипергомоцистеинемия; а также с ренин-ангиотензин-альдостероновой системой, окислительным стрессом, факторами роста и дисбалансом секреции цитокинов, полученных из эндотелия [8]. Дисбаланс коллагенов приводит к фиброзу стенки и, как следствие, к облитерации просвета; установлена роль коллагенов в обеспечении гемостаза, с акцентом на коллагены типов I–IV, VI, XV, XVIII [9]. Показана также роль ГМК в развитии жесткости стенок артерий, это второй важный компонент после белков внеклек-точного матрикса, который не только регулирует взаимодействия актомиозина при сокращении, но и опосредует механотрансдукцию в клетках и гемостаз белков внеклеточного матрикса. Жесткость артерий, обратная растяжимости, вовлечена в этиологию хронических сердечнососудистых заболеваний и является основной причиной заболеваемости и смертности во всем мире [10].
Данные, представленные в настоящей работе, находят отражение в других исследованиях. Известно, особенностями мышечной ткани при NM являются аномальная вариабельность размеров мышечных волокон, что обусловливает бимодальное распределение диметров на гистограмме; внутренние ядра, локальный некроз мышечных волокон, выраженный фиброз эндо- и перимизия [11]. Также установлено, что немалиновые тела могут распределяться диффузно либо образовывать скопления неправильной формы, чаще субсар-колеммально, и характерны для мелких волокон [12]. Последние 2 факта не подтверждены в представленной работе, немалиновые образования наблюдались не только под сарколеммой, но по всей площади волокон, и в равной степени были характерны для миосимпла-стов различных размеров.
Методом электронной микроскопии выявлено, что идентифицировать NM можно по наличию структур стержневидной или яйцевидной формы; немалиновые стержни имеют аналогичную Z-дискам решетчатую структуру, их форма у пациентов с мутациями в KLHL40 и LMOD3 различна и может быть полезна для диагностики [4].
Установлено, что нарушения сократительной способности и организации цитоскелета при NM вызывают такие дефекты ядра как разрушенная оболочка, измененное расположение хроматина, что, в свою очередь, учитывая важную роль ядра в регуляции экспрессии генов, а также цитоскелета в поддержании целостности миосимпластов, объясняет нарушение сократительной способности филаментов [12].
Тонкая нить актина – основная составляющая саркомера, именно на этом уровне сокращения возникает мышечная слабость у пациентов с NМ [3]. Десять из 12 известных генов при NM кодируют белки, которые являются компонентами тонкого филамента, либо способствуют стабильности и обновлению актина. Белки, кодирующиеся генами NEM2 и ACTA1 , участвуют в формировании мышечного тонуса и сокращении мышц. NEM2 – кодирует белок nebulin, мутации здесь являются основной причиной возникновения миопатии и обнаружены в 66,7 % случаев [5]. Показано как мыши с дефицитом nebulinа демонстрировали тяжелую мышечную атрофию и слабость in vivo, связанные с низким содержанием NEМ2 [13]. Посредством морфологического анализа мышц с мутацией в NEМ2 установлено, что количество волокон, занятых немалиновыми телами, обратно коррелируют с тяжестью болезни [14]. Аномальная укладка, измененная полимеризация и агрегация мутантных изоформ α -actinа являются общими свойствами мутантов при NM, некоторые из этих эффектов специфичны и, вероятно, приводят к вариациям в степени мышечной слабости [6].
Понимание вклада саркомерной дисфункции в мышечную слабость через задействованные гены поможет разработать целевые терапевтические стратегии [3]. Точная диагностика заболевания позволит определять тактику лечения и избегать неблагоприятных исходов применяемых хирургических методов [15, 16].
ЗАКЛЮЧЕНИЕ
Посредством патоморфологического исследования паравертебральных мышц была установлена нейромышечная природа заболевания, определенного как немалиновая миопатия, прогрессирующая в позднем возрасте, не диагностированная ранее на предыдущих этапах лечения. Для мышц характерны немалиновые тела двух типов, локализующиеся диффузно-точечно в саркоплазме либо образующие конгломераты различной формы, как под сарколеммой, так и по всей площади волокон; повышенная вариабельность диаметров миосимпластов, внутренние ядра, контрактурно из-
мененные волокна, картины миофагий. Наблюдались поля жировой дистрофии, инволюция нервных проводников с фиброзированным периневрием, фиброз интерстициального пространства и стенок сосудов, их облитерация.
При сложных деформациях позвоночника необходима оценка неврологического статуса и сбор анамнеза с использованием максимального спектра тестов, патогистологический анализ операционного материала является одним их объективных диагностических критериев.
Список литературы Немалиновая миопатия редкой формы (случай из практики)
- Malfatti E., Romero N.B. Nemaline myopathies: State of the art // Rev. Neurol. (Paris). 2016. Vol. 172, No 10. P. 614-619. DOI: 10.1016/j. neurol.2016.08.004.
- Nemaline myopathies / C. Wallgren-Pettersson, C.A. Sewry, K.J. Nowak, N.G. Laing // Semin. Pediatr. Neurol. 2011. Vol. 18, No 4. P. 230-238. DOI: 10.1016/j.spen.2011.10.004.
- De Winter J.M., Ottenheijm C.A.C. Sarcomere. Dysfunction in Nemaline Myopathy // J. Neuromuscul. Dis. 2017. Vol. 4, No 2. P. 99-113. DOI: 10.3233/JND-160200.
- Sewry С.А., Laitila J.M., Wallgren-Pettersson C. Nemaline myopathies: a current view // J. Muscle Res. Cell Motil. 2019. Vol. 40, No 2. P. 111-126. DOI: 0.1007/s10974-019-09519-9.
- Clinico-pathological features and mutational spectrum of 16 nemaline myopathy patients from a Chinese neuromuscular center / X. Yin, C. Pu, Z. Wang, K. Li, H. Wang // Acta Neurol. Belg. 2022. Vol. 122, No 3. P. 631-639. DOI: 10.1007/s13760-020-01542-9.
- Evidence for a dominant-negative effect in ACTA1 nemaline myopathy caused by abnormal folding, aggregation and altered polymerization of mutant actin isoforms / B. Ilkovski, K.J. Nowak, A. Domazetovska, A.L. Maxwell, S. Clement, K.E. Davies, N.G. Laing, K.N. North, S.T. Cooper // Hum. Mol. Genet. 2004. Vol. 13, No 16. P. 1727-1743. DOI: 10.1093/hmg/ddh185.
- Прогрессирующая немалиновая миопатия у пациентки, неоднократно оперированной на позвоночнике: клинический случай и обзор литературы / О.Г. Прудникова, А.О. Котельников, Н.С. Мигалкин, Г.Н. Филимонова // Хирургия позвоночника. 2022. T. 19, № 1. С. 15-21. DOI: 10.14531/ss2022.1.15-21.
- Lan T.H., Huang X.Q., Tan H.M. Vascular fibrosis in atherosclerosis // Cardiovasc. Pathol. 2013. Vol. 22, No 5. P. 401-407. DOI: 10.1016/j. carpath.2013.01.003.
- Manon-Jensen T., Kjeld N.G., Karsdal M.A. Collagen-mediated hemostasis // J. Thromb. Haemost. 2016. Vol. 14, No 3. P. 438-448. DOI: 10.1111/ jth.13249.
- Vascular Smooth Muscle Cells and Arterial Stiffening: Relevance in Development, Aging, and Disease / P. Lacolley, V. Regnault, P. Segers, S. Laurent // Physiol. Rev. 2017. Vol. 97, No 4. P. 1555-1617. DOI: 10.1152/physrev.00003.2017.
- Neuromuscular Disease Center. Washington University, St. Louis, MO USA. 2021. URL: http://neuromuscular.wustl.edu/index.html (дата обращения: 11.02.2022).
- Impairments in contractility and cytoskeletal organization cause nuclear defects in nemaline myopathy / J.A. Ross, Y. Levy, M. Ripolone, J.S. Kolb, M. Turmaine, M. Holt, J. Lindqvist, K.G. Claeys, J. Weis, M. Monforte, G. Tasca, M. Moggio, N. Figeac, P.S. Zammit, H. Jungbluth, C. Fiorillo, J. Vissing, N. Witting, H. Granzier, E. Zanoteli, E.C. Hardeman, C. Wallgren-Pettersson, J. Ochala // Acta Neuropathol. 2019. Vol. 138, No 3. P. 477495. DOI: 10.1007/s00401-019-02034-8.
- In vivo characterization of skeletal muscle function in nebulin-deficient mice / C. Gineste, A.C. Ogier, I. Varlet, Z. Hourani, M. Bernard, H. Granzier, D. Bendahan, J. Gondin // Muscle Nerve. 2020. Vol. 61, No 3. P. 416-424. DOI: 10.1002/mus.26798.
- Muscle histopathology in nebulin-related nemaline myopathy: ultrastructructural findings correlated to disease severity and genotype / E. Malfatti, V.L. Lehtokari, J. Böhm, J.M. de Winter, U. Schäffer, B. Estournet, S. Quijano-Roy, S. Monges, F. Lubieniecki, R. Bellance, M.T. Viou, A. Madelaine, B. Wu, A.L. Taratuto, B. Eymard, K. Pelin, M. Fardeau, C.A. Ottenheijm, C. Wallgren-Pettersson, J. Laporte, N.B. Romero // Acta Neuropathol. Commun. 2014. Vol. 2. P. 44. DOI: 10.1186/2051-5960-2-44.
- Бакланов А.Н., Колесов С.В., Шавырин И.А. Оперативное лечение нейромышечного сколиоза // Гений ортопедии. 2013. № 2. C. 72-77.
- Снижение периоперационного риска при вертебрологических операциях у пациентов с наследственными заболеваниями соединительной ткани / С.О. Рябых, В.Л. Шушарина, П.В. Очирова, А.Н. Третьякова, Т.В. Рябых // Гений ортопедии. 2015. № 4. C. 48-52. DOI: 10.18019/10284427-2015-4-48-52.


