Неоадъювантная химиотерапия в органосохранном лечении мышечно-инвазивного рака мочевого пузыря
Автор: Винтизенко С.И., Слонимская Елена Михайловна, Усынин Е.А., Юрмазов З.А., Хурсевич Н.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 (32), 2009 года.
Бесплатный доступ
Изучено влияние неоадъювантной полихимиотерапии по схеме MVAC (цисплатин, метотрексат, винбластин, доксору- бицин) на эффективность лечения инвазивных форм рака мочевого пузыря. Установлено, что проведение системной хи- миотерапии у больных мышечно-инвазивным раком мочевого пузыря в предоперационном режиме способствует снижению количества рецидивов опухоли, позволяет отодвинуть сроки их появления, соответственно, увеличить продолжительность жизни без признаков местного проявления опухолевого роста и уменьшить количество выполняемых органоуносящих операций.
Инвазивный рак мочевого пузыря, неоадъювантная химиотерапия, выживаемость, эффективность
Короткий адрес: https://sciup.org/14055129
IDR: 14055129 | УДК: 616.62-006.6+615.28
Текст научной статьи Неоадъювантная химиотерапия в органосохранном лечении мышечно-инвазивного рака мочевого пузыря
В структуре онкоурологической заболеваемости опухоли мочевого пузыря занимают первое место и составляют 70 % [3]. На долю инвазивного рака мочевого пузыря (РМП), который характеризуется исходно агрессивным течением и неблагоприятным прогнозом, приходится до 60 % новообразований этой локализации, лечение данной категории больных остается одной из наиболее сложных и нерешенных задач онкоурологии [5]. Это касается, прежде всего, выбора объема оперативного вмешательства.
Согласно рекомендациям Европейской ассоциации урологов (2007), стандартным методом лечения мышечно-инвазивного РМП считается радикальная цистэктомия с деривацией мочи в сегмент кишечного тракта. Несмотря на значительный объем оперативного вмешательства, в течение двух лет после радикальной цистэктомии у 50 % больных появляются отдаленные метастазы, а у 25 % местные рецидивы опухоли в полости малого таза [7]. В связи с этим в последнее время растет число сторонников орга- носохранного подхода в лечении инвазивного РМП с использованием химиолучевой терапии [2, 4, 6]. Считается, что органосохранное лечение может быть предложено пациентам с мышечноинвазивным раком, у которых отсутствуют регионарные и отдаленные метастазы, размер солитарной опухоли не более 5 см, нет проявлений гидронефроза, опухоль имеет папиллярное строение, предполагается «видимое» полное удаление новообразования с помощью трансуретральной резекции (ТУР), а также при полной регрессии опухоли после индукционной химиотерапии [4]. Для снижения риска развития местного рецидива опухоли и отдаленных метастазов, с целью увеличения выживаемости, в настоящее время применяют системную лекарственную терапию с использованием различных схем (CMV, MVAC, GC и др.) и режимов, как один из важнейших этапов комбинированного лечения [1].
На сегодняшний день хорошо изучена эффективность адъювантной химиотерапии, она позволяет снизить частоту развития рецидивов почти у трети больных РМП, отодвинуть сроки их появления и увеличить продолжительность жизни. Основным преимуществом этого вида лечения является то, что химиотерапия выполняется после морфологического исследования удаленного препарата. Следовательно, наиболее точно определяются распространенность процесса и прогноз заболевания. К серьезному недостатку послеоперационной химиотерапии следует отнести отсутствие контроля за ее эффективностью, поскольку опухоль, по реакции которой можно было бы судить о действенности лечения, уже удалена [1].
В настоящее время интенсивно изучается роль неоадъювантной химиотерапии (НАХТ) в органосохранном лечении инвазивных форм РМП. Предоперационная химиотерапия имеет ряд преимуществ, которые заключаются в возможности уменьшения размеров опухоли, снижении способности опухолевой ткани к реимплантации во время ее фрагментации при ТУР мочевого пузыря, оценки чувствительности опухоли на проводимое лечение (можно добиться полной регрессии новообразования или прекратить лечение ввиду нечувствительности) [2, 3]. Однако результаты НАХТ противоречивы. Некоторые авторы считают, что она улучшает показатели выживаемости на 10–15 % [3], другие полагают, что результаты НАХТ позволяют только выделять группы больных с хорошим (при полной регрессии опухоли) и плохим (при частичной регрессии и отсутствии эффекта) исходом заболевания и могут трактоваться лишь как дополнительный фактор прогноза [8]. Изучение литературных данных показывает, что единой точки зрения в отношении целесообразности проведения НАХТ у больных инвазивным РМП до сих пор нет.
Целью исследования явилось изучение влияния неоадъювантной полихимиотерапии на эффективность лечения мышечно-инвазивного РМП.
Материалы и методы
В исследование включено 60 больных мышечно-инвазивным РМП T2а-3bN0M0G1–3 без признаков регионального и отдаленного метастазирования, из них мужчин было 52 (87 %), женщин – 8 (13 %). Средний возраст составил 54,5 ± 0,5 года. У всех пациентов морфологи- чески установлен переходно-клеточный рак с разной степенью дифференцировки опухоли. В зависимости от варианта проведения химиотерапии больные были разделены на две группы. В первую (I) вошли 26 больных, которым проводилось 2 курса системной полихимиотерапии в неоадъювантном режиме по стандартной схеме MVAC (метотрексат – 30 мг/м2 в 1-й и 8-й дни, винбластин – 4 мг/м2 в 1-й и 8-й дни, цисплатин – 70 мг/м2 во 2-й день, доксорубицин 30 мг/м2 – во 2-й день), перерыв между курсами – 4–6 нед. В последующем этим пациентам выполнялась ТУР мочевого пузыря и проводились 2 курса адъювантной химиотерапии по вышеуказанной схеме. Во II (контрольную) группу были включены 34 пациента, у которых лечение начиналось с выполнения ТУР мочевого пузыря, а затем проводилось 2 курса системной полихимиотерапии в адъювантном режиме по схеме MVAC. Анализируемые группы пациентов были сопоставимы по возрасту, полу, стадии заболевания, характеру роста и степени дифференцировки опухоли.
Для оценки распространенности процесса выполнялась светооптическая цистоскопия с измерением двух максимальных размеров опухоли, учитывались количество новообразований, характер их роста, с последующим забором биопсийного материла. Дополнительно проводились УЗИ, компьютерная томография. Стадия заболевания определялась в соответствии с международной классификацией TNM 6-го пересмотра (2002). Исследование биопсийного и операционного материала включало определение гистотипа опухоли, степени ее дифференцировки и инвазии, оценку терапевтического патоморфоза после цитостатической терапии. Объективная оценка эффекта предоперационного лечения в I группе проводилась после 2 курсов химиотерапии по шкале RECIST и основывалась на данных УЗИ, компьютерной томографии и цистоскопии. Полученные данные были обработаны с использованием программы Statistica 6,0.
Результаты и обсуждение
Анализ непосредственной эффективности НАХТ у 26 больных I группы показал, что ни в одном наблюдении не было получено полной
Таблица 1
Эффективность НАХТ у больных мышечно-инвазивным раком мочевого пузыря в зависимости от степени дифференцировки опухоли, абс.ч. (%)
У всех пациентов, получавших НАХТ, при морфологическом исследовании операционного материала после выполнения ТУР в опухолевой ткани определялась степень выраженности лекарственного патоморфоза. Было отмечено, что из 13 больных, у которых эффект от проведенного лечения был оценен как стабилизация процесса, у 8 (61,5 %) повреждения злокачественных клеток были незначительными и соответствовали I степени патоморфоза, тогда как II степень патоморфоза достоверно чаще наблюдалась при явлениях частичной регрессии опухоли – у 7 (63,6 %) из 11 пациентов. Эти данные дают основание полагать, что при достижении частичной регрессии опухоли после 2 курсов химиотерапии целесообразно
Таблица 2
|
Группы |
Сроки выявления рецидивов |
||||||
|
0–3 мес |
3–6 мес |
6–9 мес |
9–12 мес |
12–18 мес |
18–24 мес |
Всего |
|
|
I группа (НАХТ) n=26 |
2 (7,8) |
3 (11,5) |
1 (3,8) |
4 (15,4) |
1 (3,8) |
3 (11,5) |
14 (53,8) |
|
10 (38,5) |
4 (15,3) |
||||||
|
II группа (АХТ) n=34 |
3 (8,8) |
5 (14,7) |
3 (8,8) |
5 (14,7) |
2 (5,9) |
3 (8,8) |
21 (61,7)* |
|
16 (47)* |
5 (14,7) |
||||||
Примечание: * – различия между группами статистически значимы (p<0,05).
Таблица 3
Характеристика рецидивов рака мочевого пузыря у больных исследуемых групп, абс.ч. (%)
|
Характеристика рецидивов |
I группа (НАХТ) |
II группа (АХТ) |
|
Всего рецидивов |
14 (53,8) |
21 (61,7) * |
|
Продолженный рост опухоли |
1 (7,1) |
2 (9,5) |
|
Единичный рецидив |
10 (71,4) |
14 (66,7) |
|
Множественный рецидив |
4 (28,6) |
7 (33,3) |
|
Поверхностный рецидив |
9 (64,3) |
13 (61,9) |
|
Инвазивный рецидив |
5 (35,7) |
8 (38,1) |
|
Среднее время появления рецидивов (мес) |
10,5 ± 0,5 |
7,8 ± 0,5 * |
Примечание: * – различия между группами статистически значимы (p<0,05).
Частота и сроки выявления рецидивов в исследуемых группах, абс.ч. (%)
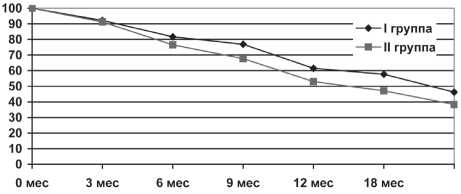
Рис. 1. Показатели 2-летней безрецидивной выживаемости у больных исследуемых группах продолжить лекарственное лечение, и в этом случае можно ожидать увеличение степени повреждения опухолевых клеток.
При анализе результатов лечения мышечноинвазивного РМП одним из наиболее значимых моментов является оценка частоты и сроков появления местных рецидивов опухоли. По нашим данным, за 2-летний период наблюдения рецидивы РМП возникли у 53,8 % пациентов, получавших химиотерапию в предоперационном режиме, в контрольной группе этот показатель был значимо выше и составил 61,7 % (p<0,05) (табл. 2).
В обеих группах пациентов, независимо от режима проведения химиотерапии, большая часть рецидивов опухоли определялась уже на первом году наблюдения. Тем не менее у больных, получивших НАХТ, местные рецидивы выявлялись реже по сравнению с пациентами, которым проводилась адъювантная химиотерапия (АХТ), – в 38,5 % и 47 % наблюдений соответственно (p<0,05). Среднее время появления рецидива в исследуемой группе составило 10,5 ± 0,5 мес, в контрольной группе – 7,8 ± 0,5 мес (p<0,05) (табл. 3). При изучении клинических особенностей роста рецидивных опухолей в зависимости от вида лечения каких-либо значимых различий отмечено не было. Так, у больных обеих групп преимущественно выявлялись единичные опухолевые узлы, которые характеризовались поверхностным характером роста новообразования.
Анализ отдаленных результатов показал, что 2-летняя безрецидивная выживаемость у больных с предоперационной химиотерапией составила 46,2 %, тогда как в группе с АХТ она была достоверно ниже – 38,3 % (p<0,05)
(рис. 1). Поскольку все пациенты после проведенного лечения были живы и ни в одном клиническом наблюдении не было выявлено отдаленных метастазов, показатели общей и безметастатической 2-летней выживаемости составили 100 %.
Больным с рецидивирующим течением заболевания проводились повторные ТУРы с последующими курсами внутрипузырной или системной (в зависимости от степени инвазии опухоли) химиотерапии. Однако у ряда пациентов в связи с частым возникновением повторных рецидивов и значительным укорочением сроков между их выявлением были определены показания к выполнению радикальной цистэктомии. В итоге органоуносящей операции подверглись 5 (14,7 %) больных II группы, что более чем в 2 раза превысило количество подобных операций в I группе – 2 (7,7 %) (р<0,05).
Заключение
Таким образом, проведение системной химиотерапии у больных мышечно-инвазивным раком мочевого пузыря в предоперационном режиме способствует снижению количества рецидивов опухоли, позволяет отодвинуть сроки их появления, соответственно, увеличить продолжительность жизни без признаков местного проявления опухолевого роста и уменьшить количество выполняемых органоуносящих операций.


